Расплавы, 2021, № 2, стр. 207-220
Электроосаждение субмикро- и микродисперсных порошков карбида молибдена из карбонатно-молибдатных расплавов
Х. Б. Кушхов a, *, Р. Х. Карацукова a, М. Н. Лигидова a, А. А. Хотов a, Ж. З. Али a, З. А. Жаникаева a, М. Х. Маржохова a
a ФБГОУ ВО “Кабардино-Балкаркский государственный университет им. Х.М. Бербекова”
Нальчик, Россия
* E-mail: hasbikushchov@yahoo.com
Поступила в редакцию 12.10.2020
После доработки 26.10.2020
Принята к публикации 11.11.2020
Аннотация
Установлены закономерности совместного электровыделения углерода и молибдена из карбонатно-молибдатных расплавов в диапазоне температур 1023–1123 К. Показано, что в карбонатно-молибдатном расплаве, содержащем слабополяризующие катионы (K+ и Na+), карбонат- и молибдат-ионы не участвуют в процессах катодного восстановления вплоть до потенциалов выделения щелочных металлов. В расплавленной системе K2CO3–Na2CO3–Li2CO3–Li2MoO4, содержащей катион Li+, за счет кислотно-основных взаимодействий и последующего образования катионизированных комплексов ${\text{L}}{{{\text{i}}}_{x}}{\text{MoO}}_{{\text{4}}}^{{(x - {\text{2}})}}$ и ${\text{L}}{{{\text{i}}}_{x}}{\text{CO}}_{{\text{3}}}^{{(x - {\text{2}})}}$ происходит их электровосстановление до металлического молибдена и углерода на катоде, а последующее их взаимодействие на атомарном уровне – к образованию карбида молибдена. Основываясь на результатах электрохимической диагностики методом вольтамперометрии, проведено электроосаждение карбида молибдена в широком интервале температур 1023–1073 К, плотности тока 0.5–3.0 А/см2, в зависимости от состава электролита. Установлено, что с повышением температуры содержание фаз примеси (MoC и C) уменьшается, и при 1173 К эти фазы в продукте не обнаруживаются. Исследован элементный и гранулометрический состав, морфология и микроструктура частиц порошка карбида молибдена. Результаты этих исследований свидетельствуют, что размер частиц порошка карбида молибдена, полученного методом электрохимического синтеза, находится в субмикро- и микродиапазоне.
ВВЕДЕНИЕ
Ранее в работах [1–5] были разработаны физико-химические основы высокотемпературного электрохимического синтеза высокодисперсных (нано-, субмикро-, микродисперсных) порошков карбида молибдена и вольфрама в хлоридно-оксидных расплавах под избыточным давлением диоксида углерода (в качестве источника углерода) и в кислородсодержащих (вольфраматно-молибдатно-карбонатных) расплавах. Вследствие низкой растворимости СО2 в хлоридно-оксидных, смешанных галогенидно-кислородсодержащих расплавах [6–8] данный способ позволяет осуществлять процесс синтеза при сравнительно низкой плотности тока (оптимальное значение 0.1 А/см2). Вольфраматно-молибдатно-карбонатные расплавы позволяют реализовать более чем на порядок высокие скорости процесса (до 3.0 А/см2). Однако эти расплавленные электролиты (N2WO4–Li2MoO4–Li2CO3) содержат до 85 мол. % дорогостоящего вольфрамата натрия, на фоне которого происходит совместное электровыделение молибдена и углерода на катоде, а также последующее взаимодействие на атомарном уровне с образованием высокодисперсных порошков карбида молибдена.
Электрохимические процессы в расплавах карбонатов щелочных металлов в атмосфере воздуха и диоксида углерода под избыточным давлением изучены нами в работе [9]. Эти исследования показали, что в эвтектическом расплаве К2СО3–Na2СО3 карбонат-ион устойчив и не проявляет электрохимическую активность в катодной области до потенциалов разряда катионов щелочных металлов. Добавление карбоната лития, содержащего катион с большей поляризующей силой в расплав К2СО3–Na2СО3 смещает кислотно-основное равновесие в сторону образования СО2 и влияет на электрохимическое поведение карбонатных расплавов, приводя к появлению катодной волны восстановления СО2 до элементарного углерода.
С целью упрощения и удешевления процесса электрохимического синтеза высокодисперсных порошков карбида молибдена нами в настоящей работе изучена возможность осуществления совместного электровосстановления молибдат- и карбонат-ионов на фоне эквимольного расплава смеси карбонатов калия и натрия, и реализация с использованием этих расплавленных систем процесса электрохимического синтеза высокодисперсных порошков карбида молибдена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для решения поставленных задач нами использованы метод циклической вольтамперометрии, гальвано- и потенциостатический электролиз. Вольтамперные исследования и электролиз проводили в трехэлектродной электрохимической ячейке из коррозионностойкой нержавеющей стали, которая позволяла проводить измерения при температурах до 1173 К. Измерения потенциалов проводили относительно кислородно-карбонатного электрода сравнения (золото). На этом электроде в воздушной атмосфере при температурах ниже температуры термической устойчивости карбонатного расплава устанавливается равновесие:
(1)
${1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{О}}}_{2}} + 2{{{\text{е}}}^{ - }} \leftrightarrow {{{\text{О}}}^{{2 - }}}.$При температурах выше термического разложения расплава смеси карбонатов щелочных металлов функция электрода может изменяться, и он работает как кислородно-карбонатный электрод.
(2)
${\text{С}}{{{\text{О}}}_{{\text{2}}}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{О}}}_{{\text{2}}}} + {\text{2}}{{{\text{е}}}^{ - }} \leftrightarrow {\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}.$Обратимость такого электрода в карбонатных расплавах обоснована в работах [10–12]. В качестве рабочих электродов использовали электроды из золота в виде проволоки диаметром 0.5 мм, глубина погружения в расплав – 10–15 мм. Анодом, и одновременно контейнером для расплава, служил стеклоуглеродный тигель объемом 30 см3. В качестве фонового электролита, с целью снижения температуры была выбрана эквимольная смесь К2СО3–Na2СО3. Для ее приготовления использовали химически чистые карбонаты калия и натрия. В работе также были использованы химически чистые карбонат лития, молибдаты натрия и лития. Соли перед проведением эксперимента сушили в вакуумном шкафу при температуре 473 К в течение 5 ч, а затем прокаливали в муфельной печи в течение 4 ч при температуре 673°С. Все реактивы хранили в сухом перчаточном боксе LabStar (Германия). Для поддержания необходимого режима рабочей температуры 973–1173 К применяли печь сопротивления шахтного типа, в качестве нагревательных элементов которой использовали силитовые стержни. Автоматическое регулирование температуры осуществлялось с помощью электронного терморегулятора ОВЕН-ТРМ-1, использовалась хромель-алюмелевая термопара (точность поддержание температуры ±1 К). Для получения вольтамперных зависимостей использовали электрохимический комплекс Autolab Nova 2013 (Голландия), согласованного с компьютерной системой управления. В качестве источника питания для проведения электролиза применяли источник тока БП-5А.
Для определения фазового, элементного, гранулометрического состава, микроструктуры катодных осадков использовали рентгеновские дифрактометры D2 Fhazer (Германия), XRD-7000 фирмы Shimadzu (Япония), рентгенофлюорисцентный спектрометр Спектроскон МАKS GV (Россия), лазерный анализатор размера частиц Fritsch Analisette-22 Nanо Tech plus (Германия), сканирующий электронный микроскоп Vega 3 LMN (Чехия) с системой для рентгеновского микроанализа Х-Max (Великобритания).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены циклические вольтамперограммы расплава эквимольной смеси К2CO3–Na2СО3, содержащей 3.0 мол. % Li2СО3 и 5.0 мол. % Li2MoO4, на золотом электроде относительно кислородного электрода сравнения при температуре 1023 К. На катодной ветви при потенциалах отрицательнее –1.5 В (до потенциалов выделения щелочных металлов) наблюдается растянутая по оси потенциалов волна восстановления А. Если поляризация катода проводилось до –2.0 В, то на анодной ветви при потенциалах положительнее –1.15 В наблюдается три волны окисления продукта катодного процесса. Если поляризацию катода проводить до –2.2 В и более, то в катодной ветви до потенциала выделения щелочного металла изменений в характере катодной ветви не наблюдается. Напротив, в этих условиях, все волны на анодной ветви практически сливаются в одну растянутую по оси потенциалов. При этом волна Б практически остается постоянной по высоте, волна В увеличивается по высоте, а волна Г уменьшается. При повышении концентрации молибдата лития до 10.0 мол. % на вольтамперной кривой в катодном цикле наблюдается тенденция к раздвоению катодной волны А, а на анодной ветви характер вольтамперной зависимости сохраняется с той лишь разницей, что все волны смещены на 150–200 мВ в положительную область потенциалов. Это смещение волн, по-видимому, вызвано увеличением концентрации молибдата в расплаве и изменением потенциала электрода сравнения с повышением концентрации молибдата натрия в расплаве.
Рис. 1.
Циклические вольтамперограммы эквимольного расплава K2СО3–Na2CO3, содержащего Li2MoO4 и Li2CO3. ${{{\text{С}}}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}}}}$ = 3.0 мол. %; ${{{\text{С}}}_{{{\text{L}}{{{\text{i}}}_{2}}{\text{Mo}}{{{\text{O}}}_{{\text{4}}}}}}},$ мол. %: 1.2–5.0; (3–7) – 10.0. Катод – Au. Электрод сравнения – кислородный. T = 1023 К. Потенциал возврата, В: –1.6 (5 кривая); –2.0 (1, 3 кривые); –2.1 (4 кривая); ‒2.2 (2, 5 кривые); –2.5 (6 кривая).
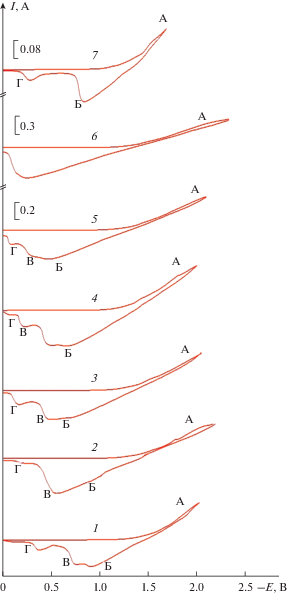
Рентгенофазовый анализ продукта потенциостатического электролиза при потенциалах –1.75…–2.2 В (область потенциалов волны А) показал, что катодный осадок состоит из фазы карбида молибдена Мо2С с примесями фазы свободного углерода.
Волны Б и В на анодной ветви мы связываем с растворением фазы карбида молибдена и образованием молибдат-иона соответственно по реакциям:
(3)
${\text{М}}{{{\text{о}}}_{{\text{2}}}}{\text{С}} - 8{{{\text{е}}}^{ - }} + 4{{{\text{О}}}^{{2 - }}} \to 2{\text{Мо}}{{{\text{О}}}_{2}} + {\text{С}},$(4)
${\text{Мо}}{{{\text{О}}}_{{\text{2}}}} - {\text{2}}{{{\text{е}}}^{ - }} + {\text{2}}{{{\text{О}}}^{{{\text{2}} - }}} \to {\text{МоО}}_{{\text{4}}}^{{{\text{2}} - }},$(5)
${\text{С}} - {\text{4}}{{{\text{е}}}^{ - }} + {\text{3}}{{{\text{О}}}^{{{\text{2}} - }}} \to {\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}.$(6)
${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }} + х{\text{L}}{{{\text{i}}}^{ + }} \leftrightarrow {\text{С}}{{{\text{О}}}_{{\text{2}}}} + {\text{L}}{{{\text{i}}}_{x}}{{{\text{O}}}^{{(x - {\text{2}})}}}.$При электролизе расплава смеси К2CO3–Na2СО3–Na2MoO4, не содержащем карбонат лития, при температуре 1023 К карбид молибдена на катоде не выделяется. Электроосаждение карбида молибдена в расплавленной смеси К2CO3–Na2СО3–Li2MoO4–Li2CO3 можно объяснить на основе принципа катионного (кислотно-основного) катализа, определяющего процессы электровосстановления жестких оксион-ионов в ионных расплавах [13, 14]. В расплавленной системе К2CO3–Na2СО3–Li2MoO4–Li2СO3 катион лития Li+, вступая в кислотно-основное взаимодействие с молибдат- и карбонат-ионом, образует катионизированные частицы ${\text{L}}{{{\text{i}}}_{х}}{\text{MoO}}_{{\text{4}}}^{{(x - {\text{2}})}}$ и ${\text{L}}{{{\text{i}}}_{х}}{\text{СO}}_{{\text{3}}}^{{(x - {\text{2}})}}$ с более низкими значениями энергетических барьеров восстановления по реакциям:
(7)
${\text{МоО}}_{{\text{4}}}^{{{\text{2}} - }} + х{\text{L}}{{{\text{i}}}^{ + }} \leftrightarrow {\text{L}}{{{\text{i}}}_{х}}{\text{M}}{{{\text{o}}}_{{\text{4}}}}{{{\text{O}}}^{{(x - {\text{2}})}}},$(8)
${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }} + х{\text{L}}{{{\text{i}}}^{ + }} \leftrightarrow {\text{L}}{{{\text{i}}}_{x}}{\text{СO}}_{{\text{3}}}^{{(x - {\text{2}})}}.$(9)
${\text{L}}{{{\text{i}}}_{х}}{\text{MoO}}_{{\text{4}}}^{{(x - {\text{2}})}} + {\text{6}}{{{\text{е}}}^{ - }} \to {\text{Мо}} + {\text{L}}{{{\text{i}}}_{x}}{{{\text{O}}}^{{(x - {\text{2}})}}} + {\text{3}}{{{\text{О}}}^{{{\text{2}} - }}},$(10)
${\text{L}}{{{\text{i}}}_{x}}{\text{СO}}_{{\text{3}}}^{{(x - {\text{2}})}} + {\text{4}}{{{\text{е}}}^{ - }} \to {\text{С}} + {\text{L}}{{{\text{i}}}_{x}}{{{\text{O}}}^{{(x - {\text{2}})}}} + {\text{2}}{{{\text{О}}}^{{{\text{2}} - }}},$Таким образом, в карбонатном расплаве, содержащем слабополяризующие катионы (K+ и Na+), карбонат- и молибдат-ионы в катодной области не проявляют электрохимическую активность до потенциалов выделения щелочных металлов. Поэтому в этих расплавленных системах электрохимический синтез карбида молибдена не удается реализовать при температуре 1023 К. В расплавленной системе K2СО3–Na2CO3–Li2MoO4 (5.0–10.0 мол. %)–Li2CO3 (30 мол. %), содержащей катион лития Li+ за счет кислотно-основных взаимодействий и образования катионизированных комплексов ${\text{L}}{{{\text{i}}}_{x}}{\text{MoO}}_{{\text{4}}}^{{(x - {\text{2)}}}}$ и ${\text{L}}{{{\text{i}}}_{x}}{\text{CO}}_{{\text{3}}}^{{(x - {\text{2}})}}$ происходит их электровосстановление с выделением металлического молибдена и углерода, при этом электросинтез карбида молибдена становится возможным.
Принимая во внимание результаты вольтамперометрических измерений, нами было проведено электроосаждение карбида молибдена в диапазоне температур 1023–1073 К в гальваностатическом режиме в широком интервале плотностей тока 0.5–3.0 А/см2. Для этой цели в качестве катода использовали никелевый пруток диаметром 3.0 мм, площадью 2.0–4.0 см2, а в качестве анода – графитовый тигель марки МПГ-7. Электролиз осуществляли в расплавленной эквимольной смеси К2СО3–Na2CO3, содержащей Li2MoO4 1.0–15.0 и Li2CO3 – 1.0–5.0 мол. %. Продолжительность электролиза 60 мин. В процессе электролиза катодный осадок осаждается на никелевом электроде в виде карбидно-солевой “груши” (рис. 2), его отмывали от электролита в кипящей дистиллированной воде, центрифугировали, высушивали в сушильном шкафу при температуре 423 К и взвешивали.
Рис. 2.
Внешний вид карбидно-солевой “груши”, полученной электролизом расплава 45K2СО3–45Na2CO3–1Li2CO3–9Li2MoO4 (мол. %). Т = 1023 К. Плотность тока – 2.0 А/см2.

В табл. 1 представлены состав электролизной ванны, условия проведения электролиза (плотность тока, температура), фазовый состав катодного продукта. На рентгенограммах катодных осадков (рис. 3–7) при различных температурах и плотностях тока, составе рабочего электролита присутствуют в основном характеристические линии фаз полукарбида молибдена Мо2С, следы фазы карбида молибдена МоС и графита.
Таблица 1.
Зависимость фазового состава катодного осадка и напряжения на ванне от состава электролита, плотности тока и температуры
| Состав электролита, мол. % | T, К | i, А/см2 | U, B | Фазовый состав катодного осадка | |
|---|---|---|---|---|---|
| 1. | К2СО3 – 45.0 | 1023 | 0.5 | 1.7–1.8 | Mo2С + следы С |
| Na2CO3 – 45.0 | 1.0 | 1.8–1.95 | Mo2С + следы MoС4 + С | ||
| Li2CO3 – 1.0 | 2.0 | 2.0–2.1 | Mo2С + следы MoС + С | ||
| Li2MoO4 – 9.0 | 3.0 | 2.2–2.4 | Mo2С + графит С | ||
| 2. | К2СО3 – 44.0 | 1023 | 0.5 | 1.6–1.7 | Mo2С + следы С |
| Na2CO3 – 44.0 | 1.0 | 1.9–2.0 | Mo2С + следы С | ||
| Li2CO3 – 2.2 | 2.0 | 2.2–2.4 | Mo2С + следы С | ||
| Li2MoO4 – 9.8 | 3.0 | 3.0–3.1 | Mo2С + следы MoС + С | ||
| 3. | К2СО3 – 44.0 | 1073 | 0.5 | 1.0–1.2 | Mo2С + следы MoС + С |
| Na2CO3 – 44.0 | 1.0 | 1.7–1.8 | Mo2С + следы MoС + С | ||
| Li2CO3 – 2.2 | 2.0 | 1.8–2.0 | Mo2С + следы MoС + С | ||
| Li2MoO4 – 9.8 | 3.0 | 2.1–2.3 | Mo2С + следы MoС + С | ||
| 4. | К2СО3 – 41.5 | 1073 | 0.5 | 1.0–1.0 | Mo2С + следы С |
| Na2CO3 – 41.5 | 1.0 | 1.3–1.4 | Mo2С + следы С | ||
| Li2CO3 – 2.0 | 2.0 | 1.5–1.7 | Mo2С + следы С | ||
| Li2MoO4 – 15.0 | 3.0 | 2.1–2.3 | Mo2С + следы MoС + С | ||
| 5. | К2СО3 – 43.0 | 1173 | 0.5 | 0.8–0.9 | Mo2С + следы С |
| Na2CO3 – 43.0 | 1.0 | 0.9–1.0 | Mo2С + следы С | ||
| Li2CO3 – 4.5 | 2.0 | 1.0–1.2 | Mo2С + следы С | ||
| Li2MoO4 – 9.5 | 3.0 | 1.3–1.5 | Mo2С + следы С |
Рис. 3
Рентгенограмма порошка карбида молибдена полученного, электролизом расплава 45K2СО3–45Na2CO3–1Li2CO3–9Li2MoO4 (мол. %). Т = 1023 К. Плотность тока, А/см2: черная линия – 0.5; красная линия – 1.0, синяя – 2.0; зеленая – 3.0.

Рис. 4.
Рентгенограмма порошка карбида молибдена полученного, электролизом расплава 45K2СО3–45Na2CO3–1Li2CO3–9Li2MoO4 (мол. %). Т = 1023 К. Плотность тока, А/см2: черная линия – 0.5; красная линия – 1.0, синяя – 2.0; зеленая – 3.0.

Рис. 5.
Рентгенограмма порошка карбида молибдена полученного, электролизом расплава 44K2СО3–44Na2CO3–2.2Li2CO3–9.8Li2MoO4 (мол. %). Т = 1073 К. Плотность тока, А/см2: черная линия – 0.5; красная линия – 1.0, синяя – 2.0; зеленая – 3.0.
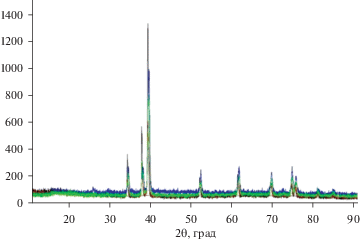
Рис. 6.
Рентгенограмма порошка карбида молибдена полученного, электролизом расплава 41.5K2СО3–41.5Na2CO3–2.0Li2CO3–15Li2MoO4 (мол. %). Т = 1073 К. Плотность тока, А/см2: черная линия – 0.5; остальные – 1.0.

Рис. 7.
Рентгенограмма порошка карбида молибдена полученного, электролизом расплава 43K2СО3–43Na2CO3–4.5Li2CO3–9.5Li2MoO4 (мол. %). Т = 1173 К. Плотность тока, А/см2: черная линия – 0.5; красная линия – 1.0.
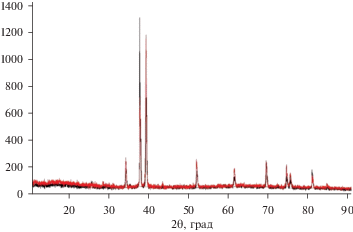
Из экспериментальных результатов, представленных в табл. 1 и на рис. 3–7, можно сделать заключение, что в широком интервале плотности тока (0.5–3.0) А/см2, температуры 1023–1173 К, составе электролизной ванны продукт электролиза представляет собой полукарбид молибдена Мо2С, содержащий следы фаз свободного углерода (графита) и фазы карбида молибдена МоС. При увеличении температуры электролиза от 1023 до 1173 К содержание фазы свободного углерода уменьшается и на рентгенограмме (рис. 7) характеристические линии свободного углерода отсутствуют. Фаза МоС при температуре 1173 К в катодном осадке также практически не обнаруживается.
После того, как были определены фазы, входящие в состав образцов, по полученным исходным дифрактограммам было проведено оценочное уточнение кристаллической структуры методом Ритвельда. В этом случае никакой другой предварительной обработки дифрактограмм, кроме определения фона, не производилось. Поиском по базе PDF-4+ обнаружена фаза Mo2C (PDF № 04-003-2258), орторомбическая решетка, пр. группа Pbcn. По результатам уточнения Ритвельда помимо параметров решетки были также получены оценочные значения размера кристаллитов и микронапряжений. Кроме того, размер кристаллитов был также оценен путем расчета по формуле Дебая–Шеррера, по одному рефлексу 69.46° (плоскость (321)), в качестве инструментальной полуширины была взята полуширина пика 69.13° стандарта Si (табл. 2).
Таблица 2.
Уточненные значения параметров решетки, а также значения R-факторов (факторов расходимости) уточнений
| Параметры решетки | Объем ячейки V, Å3 | Оценочный размер зерен, нм | Оценочный размер кристаллитов по формуле Дебая–Шеррера (рефлекс 69.46° (321)), нм | Оценочный размер микронапряжений, % | Rp | Rwp | Goodness- of-Fit | |||
|---|---|---|---|---|---|---|---|---|---|---|
| a, Å | b, Å | c, Å | α = β = γ | |||||||
| 4.736(2) | 6.029(9) | 5.208(2) | 90° | 148.73 | 84 | 90 | 0.036 | 7.62 | 10.59 | 17.69 |
Проведены также исследования гранулометрического состава синтезированных порошков карбида молибдена. Размер частиц порошка определяли с помощью лазерного анализатора Frisch Analyzette-22 Nanotech. Результаты представлены на рис. 8. Эти измерения показывают бимодальное распределение размера частиц в синтезированном порошке карбида молибдена. С увеличением плотности тока с 1.0 до 3.0 А/см2 доля частиц размером меньше 1.0 мкм в порошке карбида молибдена существенно возрастает.
Рис. 8.
Распредиление по размерам частиц порошка карбида молибдена, полученного электролизом расплава 44K2СО3–44Na2CO3–2.2Li2CO3–9.8Li2MoO4 (мол. %). Т = 1073 К. Плотность тока, А/см2: а – 1.0; б – 3.0.

Исследована морфология и микроструктура частиц порошка, проведен элементный анализ (рис. 9), получена цветная карта распределения элементов в образце карбида молибдена (рис. 10). Результаты этих измерений также подтверждают возможность получения электролизом расплавленной смеси K2CO3–Na2СО3–Li2MoO4–Li2CO3 субмикро- и микродисперсных порошков карбида молибдена.
ВЫВОДЫ
1. Установлены закономерности совместного электровыделения углерода и молибдена из карбонатно-молибдатных расплавов в диапазоне температур 1023–1123 К. Показано, что в расплавленной системе K2CO3–Na2CO3–Li2CO3–Li2MoO4, содержащей катион Li+, за счет кислотно-основных взаимодействий и последующего образования катионизированных комплексов ${\text{L}}{{{\text{i}}}_{x}}{\text{MoO}}_{{\text{4}}}^{{(x - {\text{2}})}}$ и ${\text{L}}{{{\text{i}}}_{x}}{\text{CO}}_{{\text{3}}}^{{(x - {\text{2}})}}$ происходит их электровосстановление до металлического молибдена и углерода на катоде, а дальнейшее их взаимодействие на атомарном уровне приводит к образованию высокодисперсных порошков карбида молибдена.
2. Проведено электроосаждение карбида молибдена в интервале температур 1023–1073 К, при плотностях тока 0.5–3.0 А/см2 и различном составе электролита. Установлено, что с повышением температуры содержание фаз примеси (MoC и C) уменьшается, и при 1173 К эти фазы в продукте не обнаруживаются.
3. Исследован элементный и гранулометрический состав, морфология и микроструктура частиц порошка карбида молибдена. Результаты этих исследований свидетельствуют, что размер частиц карбида молибдена, полученного методом электрохимического синтеза, находится в субмикро- и микродиапазоне.
Работа выполнена при финансовой поддержке РФФИ проект № 19-03-00606.
Список литературы
Малышев В.В., Кушхов Х.Б. Успехи высокотемпературного электрохимического синтеза в ионных расплавах // Журн. общей химии. 2004. 74. № 8. С. 1233–1240.
Шаповал В.И., Малышев В.В., Новоселова И.А., Кушхов Х.Б. Современные проблемы высокотемпературного электрохимического синтеза соединений переходных металлов IV–IV групп // Успехи химии.1995. 64. № 2. С. 133–140.
Новоселова И.А., Малышев В.В., Шаповал В.И., Кушхов Х.Б., Девяткин С.В., Теоретические основы технологий высокотемпературного электрохимического синтеза в ионных расплавах // Теоретические основы химической технологи. 1997. 31. № 3. С. 286–295.
Новоселова И.А., Малышев В.В., Шаповал В.И., Кушхов Х.Б., Высокотемпературный электрохимический синтез двух- и трехкомпонентных интерметаллических и тугоплавких соединений молибдена и вольфрама с кобальтом, никелем и углеродом // Журн. прикладной химии. 1997. 70. № 8. С. 1282–1288.
Malyshev V.V., Kushkhov Kh.B, Shapoval V.J. High-temperature electrochemical synthesis of carbides, silicides and borides of IV-group metals in ionic melts // J. Applied Electrochemistry. 2002. P. 573–279.
Кушхов Х.Б., Шаповал В.И, Новоселова И.А. Электрохимическое поведение углекислого газа под избыточным давлением в эквимольном расплаве хлоридов калия и натрия // Электрохимия. 1987. 23. № 7. С. 952–956.
Новожилов А.Л. Растворимость CO2 в расплавленных хлоридах щелочных металлов // Журн. неорганической химии. 1984. 20. № 11. С. 2971–2973.
Ивановский Л.Е., Некрасов В.Н. Газы и ионные расплавы. М.: Наука, 1979.
Кушхов Х.Б., Лигидова М.Н., Али Ж.З., Хотов А.А., Тленкопачев М.Р., Карацукова Р.Х. Электрохимические процессы в расплавах карбонатов щелочных металлов под избыточным давлением диоксида углерода // Расплавы. 2020. № 4. С. 1–18.
Chery D., Albun V., Melendez-Cobllos A., Loiz V., Cossira M. Mechanistic approach of the electrochemical reduction of CO2 into CO at a gold electrode in molten carbonates by cyclic voltammetry // Int. J. Hydrog. Energy. 2016. 41. № 41. P. 18 706–18 712.
Никитина Е.В., Кудяков В.Я., Малков В.Б., Плаксин С.В. Коррозионно-электрохимическое поведение никеля в расплаве карбонатов щелочных металлов в хлорсодержащей атмосфере // Расплавы. 2013. № 3. С. 44–50.
Кудяков В.Я., Жук В.И., Перин С.М., Малков В.Б. Коррозионное поведение сплава Х30Н45ЮТ и стали 20Х23Н18 в расплаве карбонатов лития и калия при анодной поляризации // Расплавы. 2011. № 5. С. 64–73.
Шаповал В.В., Кушхов Х.Б., Соловьев В.В. Катионный катализ электровосстановление карбонат-иона на фоне хлоридных расплавов // Укр. Хим. Журн. 1985. 51. № 12. С. 1263–1266.
Кушхов Х.Б., Малышев В.В., Шаповал В.И., Исследование электровосстановления молибдат-иона в расплаве вольфрамата натрия, содержащем катионы натрия, лития, бария, магния и алюминия // Электрохимия. 1990. 26. № 9. С. 1115–1119.
Дополнительные материалы отсутствуют.




