Расплавы, 2021, № 2, стр. 118-128
Электровосстановление смесей хлорида никеля(II) и хлорида кобальта(II) в термоактивируемом химическом источнике тока
О. В. Волкова a, *, В. В. Захаров a, Е. А. Ильина a, А. А. Панкратов a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: olga@ihte.uran.ru
Поступила в редакцию 30.04.2020
После доработки 18.05.2020
Принята к публикации 10.06.2020
Аннотация
Исследованы разрядные характеристики элементов термоактивируемого химического источника тока, содержащих в качестве положительного электрода смеси NiCl2–CoCl2. Установлено, что использование смесей вместо индивидуальных хлоридов никеля и кобальта позволяет понизить температуру разряда элемента ТХИТ. Минимальная температура фиксации устойчивого разрядного плато составляет 480°С. Максимальная емкость разрядного плато составляет 0.33 А ⋅ ч ⋅ г–1. Оптимальный состав катодной смеси содержит 20 мас. % CoCl2. Определены состав и морфология продуктов восстановления исследуемых катодных материалов. Установлено, что в процессе разряда элемента ТХИТ происходит восстановление исходных хлоридов никеля и кобальта до металлов. Процесс восстановления сопровождается диффузией галогенидов лития из сепаратора в катодное пространство. Восстановленные металлы (Ni, Co) образуют сеть разветвленных дендритов, покрытых солевой пленкой на основе хлорида лития. Плотность и морфология дендритного осадка определяется составом исходной катодной смеси. В состав солевой пленки входят твердые растворы и перитектики системы Li, Co, Ni || Cl, Br, F. Показано, что процесс восстановления Ме2+ (где Me – Ni, Co) до металла Ме0 протекает по расплавному механизму в режиме диффузионной кинетики.
ВВЕДЕНИЕ
Термоактивируемые химические источники тока (ТХИТ) позиционируются как генераторы электрической энергии с высокой удельной мощностью, способные работать в любых условиях окружающей среды [1–10]. Их время работы может варьироваться от нескольких минут до нескольких часов. Отдельные модификации батарей ТХИТ адаптированы к значительным механическим нагрузкам (линейное ускорение до 20 000 g, скорость вращения до 12 000 об./мин). Совокупность этих показателей определяет конструкционные особенности и выбор активных компонентов ТХИТ. Однако, учитывая специфику и область применения ТХИТ, общей чертой при их создании является стремление разработчиков снизить массагаборитные параметры изделия без потери мощностных характеристик батареи. Способствовать решению данной задачи могут такие факторы как увеличение емкости электродных компонентов и снижение рабочее температуры ТХИТ. В этом плане, особенно интересными представляются системы на основе электрохимической пары LiB–NiCl2. Литий–борный композит обладает высокой емкостью (до 2.5 А ⋅ ч ⋅ г–1) и не ограничивает мощностные показатели ТХИТ. Электрическая емкость хлорида никеля существенно ниже, и составляет 0.413 А ⋅ ч ⋅ г–1. Тем не менее, особенности восстановления NiCl2 позволяют использовать, в изготавливаемых батареях ТХИТ, до 80% от его теоретической емкости. Э. д. с. токообразующей реакции NiCl2 + 2Li = Ni + 2LiCl – 2.61 В. Данная система работоспособна при плотностях тока порядка 20 кА ⋅ м–2. Это позволяет разрабатывать высокомощные батареи ТХИТ с удельной энергоемкостью до 120 Вт ⋅ ч ⋅ кг–1. Для сравнения, удельная энергоемкость наиболее распространенных батарей ТХИТ выпускаемых на основе систем Li–Al/FeS2; Li–Si/FeS2, не превышает 30 Вт ⋅ ч ⋅ кг–1 при плотностях тока не выше 4 кА ⋅ м–2.
Для повышения мощности батареи ТХИТ на основе хлорида никеля(II), в катодный материал вводят значительное количество оксидных добавок (V2O3, MoO3) [11, 12], не участвующих в токообразующей реакции. Это ведет к снижению удельной электрической емкостью катода. Поэтому представляет интерес поиск катодных материалов, состоящих лишь из активных компонентов и позволяющих реализовать высокие электрические характеристики.
В данной работе проведено исследование разрядных характеристик и продуктов восстановления элементов ТХИТ на основе смесей хлорида никеля(II) и хлорида кобальта(II). Целью работы является поиск катодных материалов, обеспечивающих повышение электрической емкости ТХИТ, снижения рабочей температуры и определение механизма восстановления твердофазного катода.
МЕТОДИКА ЭКСПЕРИМЕНТА
При изготовлении элементов ТХИТ были использованы реактивы марки “ч. д. а.”. Исходные навески хлорида никеля(II) и хлорида кобальта(II) гомогенизировали в агатовой ступке и спрессовывали в таблетки. При формировании элемента ТХИТ использовали токоотводы чашечной конструкции, в которые помешались активные электродные компоненты. В качестве отрицательного электрода использовали литий – борный композит с содержанием бора 24 мас. % [13]. Анодный материал брали в избыточном количестве, что гарантировало лимитирующую роль катода в разрядных характеристиках элемента ТХИТ. В качестве сепаратора применяли низкоплавкую смесь галогенидов лития 22LiF–31LiCl–47LiBr (мол. %) с температурой плавления 430°С, загущенную γ–LiAlO2. Все операции по изготовлению элемента ТХИТ проводили в сухом аргоновом боксе.
Разряд электрохимических ячеек проводили в гальваностатическом режиме с помощью электрохимической рабочей станции “Zahner IM6”.
Электронно-микроскопический анализ продуктов восстановления катода проводили с помощью растрового электронного микроскопа (РЭМ) с безазотным энергодисперсионным детектором “X-Act ADD + JSM-5900LV” (Jeol, Япония), пространственное разрешение 3 нм (2.5 нм с катодом LaB6).
Рентгенофазовый анализ (РФА) образцов проводили при комнатной температуре на дифрактометре “Rigaku D/MAX-2200VL/PC” (Rigaku, Япония) с использованием CuKα излучения в диапазоне брегговских углов 2θ от 10° до 85° с шагом 0.02°.
Для синхронного термического анализа (СТА) использовали термический анализатор “STA 449 F1 Jupiter” (NETZSCH). Измерения проводили в графитовых тиглях в интервале температур 35–650°С, скорость нагрева/охлаждения – 10°С/мин. Измерительную ячейку с образцом продували аргоном со скоростью 50 мл/мин. Полученные данные были обработаны с помощью программного обеспечения “NETZSCH Proteus”.
Потенциодинамические кривые снимали на двухэлектродной ячейке при помощи потенциостата/гальваностат “Model 263A”. Площадь рабочего электрода составляла 0.07 см2. В качестве противоэлектрода использовали таблетку Li–B композита площадью 2.3 см2. Поляризация противоэлектрода не превышала 10 мВ. Малая величина поляризации противоэлектрода позволяет использовать его в качестве электрода сравнения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В рамках данной работы были исследованы разрядные характеристики твердофазных катодов на основе смесей NiCl2–CoCl2. Восстановление катодных материалов проводили в составе элементов ТХИТ с Li–B анодом, в температурном интервале 450–550°С. Нижняя граница рассматриваемого температурного интервала соответствует началу затвердевания низкоплавкой смеси галогенидов лития в сепараторе. В качестве верхнего температурного предела выбрана оптимальная температура разряда ТХИТ с чистым хлоридом никеля [12]. Плотность тока варьировалась от 0.25 до 0.5 А/см2. Из полученных данных следует, что минимальная температура, при которой фиксируется устойчивое разрядное плато, составляет 480°С (плотность тока 0.25 А/см2, рис. 1). Максимальная длительность разрядного плато реализуется при 500°С для ТХИТ с составом катодной смеси NiCl2–CoCl2 (20 мас. %) и составляет 0.33 А ⋅ ч ⋅ г–1 (рис. 2). Потеря емкости катода при более высоких температурах, связанна с частичным растворением CoCl2 в электролите. При температуре ниже 480°С возрастает активное сопротивление солевой фракции продуктов восстановления катода, что ведет к омическому характеру падения напряжения разряда.
Рис. 1.
Разрядные кривые элементов ТХИТ Li–B/NiCl2–CoCl2 (20 мас. %), снятые при различных температурах. Плотность тока разряда 0.25 A ⋅ см–2.

Рис. 2
Разрядные кривые элементов ТХИТ с различным составом катодной смеси NiCl2–CoCl2 (х мас. %), где х: 1 – 0; 2 – 10; 3 – 20; 4 – 40; 5 – 50; 6 – 100. Плотность тока разряда 0.5 A ⋅ см–2, Тразр = 500°С.

Морфологию и состав продуктов восстановления катодов определяли методом электронной микроскопии, РФА и энергодисперсионного анализа. На дифрактограммах всех образцов присутствуют линии LiCl, металлического Ni и Co (рис. 3). Также присутствуют пики исходных хлоридов NiCl2 и CoCl2. Следует отметить, что при восстановлении хлорида кобальта в составе элементов ТХИТ, образуются металлический кобальт двух модификаций (β-Co и α-Co). РЭМ исследования катодов с частичным отбором емкости показало, что при восстановлении смесей NiCl2–CoCl2, граница электрохимической реакции смещается от сепаратора вглубь катода (рис. 4, 5). Восстановленные металлы (Ni, Co) образуют сеть разветвленных дендритов, покрытых солевой пленкой на основе хлорида лития. Плотность и морфология дендритного осадка определяется составом исходной катодной смеси. При увеличении содержания в исходном катоде CoCl2, образуются более рыхлые и мелкозернистые дендриты. Энергодисперсионные спектры образцов содержат линии, принадлежащие анионам брома, что свидетельствует о наличии диффузии галогенидов лития (LiBr, LiF) из сепаратора в катодное пространство. Элементный состав не восстановленной части катода соответствует соотношению компонентов исходной катодной смеси.
Рис. 3.
Дифрактограммы продуктов восстановления катодных смеси NiCl2–CoCl2 (80 мас. %) при различном отборе емкости: 1 – $0.{\text{91}}{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{2}}}}};$ 2 – $0.{\text{44}}{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}.$
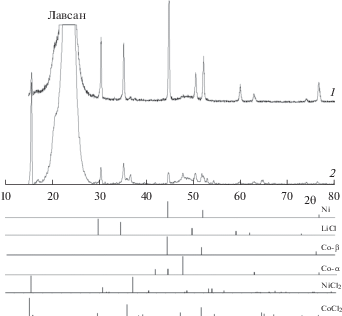
Рис. 4.
РЭМ поперечного скола катода после отбора емкости $0.{\text{44}}{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}.$ Плотностью тока 0.5 A ⋅ см–2, Тразр = 480°С.

Рис. 5.
РЭМ поперечного скола катода после отбора емкости $0.{\text{44}}{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}.$ Плотностью тока 0.5 A ⋅ см–2, Тразр = 480°С.

Результаты СТА продуктов восстановительной реакции элемента ТХИТ показали, что при максимальном отборе емкости, вид кривых ДСК не имеет выраженной зависимости от состава исходной катодной смеси (рис. 6, кривые 1, 2). Для всех образцов характерно наличие двух пиков с экстремумами в области 493 ± 3 и 592 ± 3°С. Мы считаем, что появление первого пика обусловлено присутствием в образцах галогенов Br и F. Для подтверждения этого предположения, мы провели СТА продуктов восстановления элементов ТХИТ, в которых в качестве сепаратора был использован твердый электролит, не содержащий галогенидов лития (рис. 6, кривая 3). Как видно из рисунка, при максимальном отборе емкости, кривые ДСК этих образцов содержат лишь один пик, соответствующий плавлению хлорида лития (610°С). Таким образом, мы подтвердили принадлежность низкотемпературного пика, к плавлению смеси галогенидов лития. Высокотемпературный пик на кривых ДСК образцов с максимальным отбором емкости, характеризует процесс плавления смеси хлорида лития с небольшим содержанием хлоридов переходных металлов. При частичном отборе емкости, вид кривых ДСК продуктов восстановления элементов ТХИТ зависит от состава исходной катодной смеси (рис. 7). Для смесей с большим содержанием CoCl2 более 80 мас. %, на кривых ДСК присутствуют два пика. Первый из них соответствует минимальной температуре плавления твердых растворов в системе LiCl–CoCl2 (512°С, 33 мол. % CoCl2), второй близок к температуре плавления перитектики в этой системе (522°С, 41 мол. % CoCl2) [14]. По мере увеличения концентрации NiCl2 в составе исходной катодной смеси, наблюдается смещение пиков в область более высоких температур. При этом происходит уменьшение интенсивности и уширение пика плавления твердых растворов. Очевидно, это обусловлено тем, что твердые растворы в системе LiCl–NiCl2 являются более тугоплавкими [15]. Присутствие в образцах Br и F, ведет к смещению пиков в область более низких температур (приблизительно на 10°). Таким образом, мы можем утверждать, что восстановление исследуемых катодных смесей протекает по расплавному механизму в системе Li, Co, Ni || Cl, Br, F.
Рис. 6.
ДСК кривые продуктов восстановления катодных смесей элементов ТХИТ при максимальном отборе емкости: 1 – LiB|LiF–LiCl–LiBr|NiCl2–CoCl2 (80 мас. %); 2 – LiB|LiF–LiCl–LiBr|NiCl2–CoCl2 (20 мас. %); 3 – LiB|Li4SiO4–Li3PO4|NiCl2–CoCl2 (20 мас. %).
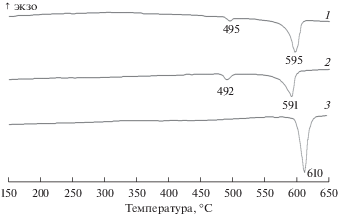
Рис. 7.
ДСК кривые продуктов восстановления катодных смесей элементов ТХИТ при частичном отборе емкости $(0.{\text{44}}{{{\text{С}}}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}){\text{:}}$ 1 – LiB|LiF–LiCl–LiBr|NiCl2–CoCl2 (80 мас. %); 2 – LiB|LiF–LiCl–LiBr|NiCl2–CoCl2 (50 мас. %); 3 – LiB|LiF–LiCl–LiBr|NiCl2–CoCl2 (20 мас. %); 4 – LiB|Li4SiO4–Li3PO4|NiCl2–CoCl2 (20 мас. %).

Для уточнения природы процессов, протекающих при восстановлении катодных смесей, был использован хроновольтамперометрический метод. Съемка потенциодинамических кривых проводилась при температуре 500°С, для ячеек с загущенным электролитом (LiF–LiCl–LiBr), и при 550°С, для ячеек с твердым электролитом (Li4SiO4–Li3PO4). Скорость развертки (υ) варьировалась от 5 до 100 мВ/с, смещение потенциала от НРЦ ±1В. В качестве рабочего электрода были использованы смеси NiCl2–CoCl2. Пять первых циклов служили для формирования поверхности рабочего электрода и исключались из дальнейшего анализа. Характерной чертой потенциодинамических кривых образцов с загущенным электролитом является наличие двух катодных пиков (рис. 8). Из литературных данных [16] известно, что при высоких температурах в хлоридных расплавах в присутствии металла одновременно могут существовать ионы нескольких валентностей. Согласно [17], при температурах ниже 650°С, доля Ni+ по отношению ко всему никелю в расплаве не превышает 3.2%. Так как концентрация Ni+ для рассматриваемых процессов пренебрежительно мала, логично предположить, что восстановление исследуемых катодных смесей протекает по двухэлектронному механизму (Me2+ + 2e– → Me0, где Me – Ni, Co) из солевого расплава LiCl–CoCl2–NiCl2. Однако, в этом случае, на потенциодинамических кривых должен фиксироваться лишь один катодный пик. Чтобы определить природу второго пика, мы провели съемку потенциодинамических кривых на ячейках с твердым электролитом (рис. 8, врезка б). Как видно из рисунка, в катодной области полученных зависимостей наблюдался лишь один пик. Его положение на оси абсцисс соответствует второму пику (от НРЦ) кривых, снятых на ячейках с загущенным электролитом. Очевидно, именно этот пик отвечает процессу восстановления переходных металлов из хлоридного расплава LiCl–CoCl2–NiCl2. Природа второго пика связан с присутствием в электролите ячейки аниона Br–. Диффундируя, в процессе работы ячейки, в солевую фракцию продуктов восстановления рабочего электрода, Br– образует комплексные соединения с переходными металлами [MeBrxCly]n–. Восстановление этих комплексов и дает первый (от НРЦ) пик на потенциодинамических кривых ячеек с загущенным электролитом. Наблюдаемое уширение катодных пиков, обусловлено увеличением дисперсности поверхности рабочего электрода в процессе роста дендритов металлического кобальта и никеля. Линейная зависимость тока пиков от корня квадратного из скорости развертки потенциала говорит о том, что электрохимическая реакция протекает в режиме диффузионной кинетики (рис. 8, врезка а).
Рис. 8.
Циклические вольтамперные кривые, снятые на электроде NiCl2–CoCl2 (20 мас. %) для ячеек с загущенным электролитом (LiF–LiCl–LiBr); врезки: а – зависимость плотности тока катодных пиков от скорости развертки потенциала; б – циклическая вольтамперная кривая, снятые на электроде NiCl2–CoCl2 (20 мас. %) для ячеек с твердым электролитом (Li4SiO4–Li3PO4) (скорость развертки 10 мВ/с).

ЗАКЛЮЧЕНИЕ
Исследованы разрядные характеристики элементов ТХИТ, содержащих в качестве положительного электрода смеси NiCl2–CoCl2. Установлено, что рассматриваемые катодные материалы позволяют снизить температуру разряда элементов ТХИТ до 480°С. Максимальная емкость разрядного плато 0.33 А ⋅ ч ⋅ г–1. В процессе разряда элементов ТХИТ наблюдается диффузия электролита в катодную область. Продукты восстановления исследуемых катодных материалов содержат дендритную губку из металлического никеля и кобальта, покрытую солевой пленкой на основе хлорида лития. Дисперсность и морфология дендритов (при прочих равных условиях разряда ТХИТ) определяется соотношением компонентов в исходной катодной смеси. По мере роста металлической губки, зона катодной реакции смещается вглубь положительного электрода. Солевая составляющая разряженного катода содержит смесь комплексных соединений [MeBrxCly]n– (Me – Ni, Co). Присутствие Br– снижает энергию связи лигандов с комплексообразователем, что ведет к уменьшению катодной поляризации и, как следствие, к увеличению разрядного напряжения элемента ТХИТ. Восстановление смеси NiCl2–CoCl2 протекает по двухэлектронному механизму в режиме диффузионной кинетики.
Исследования выполнены с использованием оборудования ЦКП “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Guidotti R.A., Masset P. // J. Power Sources. 2006. 161. P. 1443–1449. https://doi.org/10.1016/j.jpowsour.2006.06.013
Guidotti R., Reinhardt F.W., Dai J., Reisner D.E. // J. Power Sources. 2006. 160. P. 1456–1464. https://doi.org/10.1016/j.jpowsour.2006.02.025
Nelson P.A. // J. Power Sources. 1990. 29. P. 565–577. https://doi.org/10.1016/0378-7753(90)85026-9
Masset P.J., Guidotti R.A. // J. Power Sources. 2008. 177. P. 595–609. https://doi.org/10.1016/j.jpowsour.2007.11.017
Masset P.J., Guidotti R.A. // J. Power Sources. 2008. 178. P. 456–466. https://doi.org/10.1016/j.jpowsour.2007.11.073
Butler P., Wagner C., Guidotti R., Francis I. // J. Power Sources. 2004. 136. P. 240–245. https://doi.org/10.1016/j.jpowsour.2004.03.034
Au M. // J. Power Sources. 2003. 115. P. 360–366. https://doi.org/10.1016/S0378-7753(02)00627-4
Masset P.J. // Z. Naturforsch. 2008. 63a. P. 596–602. https://doi.org/10.1515/zna-2008-0911
Volkova O.V., Zakharov V.V., Reznitskikh O.G. Electroreduction of chromium(III) chloride in a thermal battery // Russian Metallurgy. 2017. № 8. P. 655–659.
Volkova O.V., Zakharov V.V. Electroreduction of chromium(III) chloride and molybdenum(VI) oxide mixtures in a thermally activated battery // Russian Metallurgy. 2018. № 2. P. 201–204.
Барнашов С.А., Елисеев А.И., Щеткин Н.М., Загайнов В.А., Королева И.В., Радецкая Е.В., Бондаренко А.И. и др. Тепловая батарея. Патент РФ № 2369944, 2007.
Волкова О.В., Захаров В.В., Вовкотруб Э.Г., Плаксин С.В., Першина С.В. Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI) в термоактивируемом химическом источнике тока // Расплавы. 2019. № 5. С. 411–422.
Захаров В.В. и др. Способ изготовления литий-борного композита и реактор. Патент РФ № 2 395 603, 2010.
Seifert H.-J. // Z. anorg. allg. Chemie. 1961. Bd. 307. P. 137–144. https://doi.org/10.1002/zaac.19613070305
Голубева М.С., Медведев Б.С. Тройная взаимная система из хлоридов и сульфатов лития и никеля // Журн. неорган. химии. 1962. 7. № 2. С. 2600–2603.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Ёлшин А.Н. Электрохимическое поведение катодов высокотемпературных химических источников тока на основе хлоридов переходных металлов: дис. канд. хим. наук: 02.00.05. Свердловск, 1990.
Дополнительные материалы отсутствуют.


