Расплавы, 2021, № 3, стр. 233-242
Расчет линий ликвидус в солевых смесях LiF–NaF, LiF–KF, NaF–KF, NaF–CsF и KF–CsF эвтектического типа на основе термодинамической теории возмущений
А. Г. Давыдов a, *, Н. К. Ткачев a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: A.Davydov@ihte.uran.ru
Поступила в редакцию 25.08.2020
После доработки 29.12.2020
Принята к публикации 04.01.2021
Аннотация
Представленная модель термодинамической теории возмущений для учета дополнительного заряд-дипольного вклада в свободную энергию расплавленных щелочно-галоидных систем применена при описании равновесий между расплавом и кристаллом в бинарных солевых смесях с общими анионами. Проведены расчеты линий ликвидус на диаграммах состояния бинарных систем LiF–NaF, LiF–KF, NaF–KF, NaF–CsF и KF–CsF эвтектического типа. Погрешность в описании линий ликвидус на фазовых диаграммах рассмотренных фторидных смесей при использовании табличных значений ионных радиусов и поляризуемостей составила не более 15% относительно имеющихся в литературе данных FactSage. Расхождения между расчетными и литературными данными становятся более заметными при переходе к системам, содержащим более крупные и поляризуемые катионы. Также наблюдается смещение положения точки эвтектического равновесия в сторону менее тугоплавкого компонента на величину до 5–10% и небольшое завышение температуры эвтектической точки по сравнению с экспериментом и данными FactSage.
ВВЕДЕНИЕ
Практический интерес к расплавленным галогенидам щелочных металлов (ГЩМ) обусловлен их широким применением в различных областях технологии получения легких металлов, электрорафинирования, переработки и т.д. [1–4]. Все большее внимание сосредоточено на использовании фторидных расплавов для проектирования жидкосолевых ядерных реакторов [3–5]. Активно разрабатываются и новые схемы переработки отработавшего ядерного топлива с помощью галогенидных расплавов [4, 6]. В последние десятилетия также достигнуты определенные успехи в развитии технологий солнечной энергетики [3, 4]. Вследствие значительной востребованности расплавов ГЩМ наблюдается закономерное развитие теоретических подходов к моделированию фазовых диаграмм многокомпонентных солевых смесей [4, 7].
Наиболее распространенным в этом направлении исследований является метод термодинамического моделирования, основанный на использовании феноменологической модели субрегулярных растворов и поиске параметров с помощью баз данных по термодинамическим свойствам и фазовым равновесиям простых систем для расчета фазовых равновесий в многокомпонентных смесях [8, 9]. Наиболее уязвимым местом данного метода является возрастание числа подгоночных параметров с увеличением сложности системы, в результате чего достоверность оценки фазовых равновесий снижается при описании более сложных систем.
Вследствие бурного роста вычислительных ресурсов стало возможным численное описание фазовых равновесий в солевых системах, основанное на определенном сочетании методов ab initio и молекулярной динамики [10, 11]. Была разработана модель поляризуемых ионов (PIM), в рамках которой распределение электронной плотности и поляризуемости ионов в расплаве вычисляются в зависимости от их окружения [11, 12].
В рамках статистической теории задачу описания фазовых равновесий в смесях ГЩМ при учете дополнительных межионных эффектов можно переадресовать термодинамической теории возмущений [13], которая позволяет учесть заряд-дипольную поправку второго порядка во взаимодействие ионов по квантово-механической теории как возмущение к парному потенциалу системы заряженных твердых сфер, определяющему структуру расплавов. Сложность рассмотрения заряд-дипольных взаимодействий в достаточно плотных ионных жидкостях связана с их многочастичным характером [14]. Однако данная проблема может быть сведена к рассмотрению парных взаимодействий путем введения кооперативного параметра – диэлектрической проницаемости [15]. Целями настоящей работы было: 1) применить модель термодинамической теории возмущений, предложенную в [16], для учета заряд-дипольной добавки в свободную энергию бинарных щелочно-галоидных расплавов с общими анионами; 2) провести сопоставление результатов расчетов с экспериментальными и FactSage данными при описании ликвидуса в системах LiF–NaF, LiF–KF, NaF–KF, NaF–CsF и KF–CsF.
Отметим, что в рамках данной работы рассматривается только наиболее существенный для галогенидов щелочных металлов тип эффектов второго порядка, связанный с взаимодействиями между зарядом первого иона и дипольным моментом второго. При этом пренебрегается еще более слабыми диполь-дипольными и заряд-квадрупольными межионными взаимодействиями, которые интересны для рассмотрения, например, в галогенидных расплавах d- и f-металлов.
ТЕОРИЯ
Рассмотрим систему из N = N1+ N2+ N3 свободных частиц, которая содержит N1 катионов ${\text{M}}_{1}^{ + }$ и N2 катионов ${\text{M}}_{2}^{ + }$ с электровалентностью z1 = z2 = +1, а также N3 анионов X– с z3 = –1 (где M+ = Li+, Na+, K+ или Cs+, а X– = F–). Долю ионов того или иного сорта в такой смеси определим как xi = Ni/N, а диаметры как di, соответственно. Поскольку структура солевых расплавов практически полностью определяется кулоновским взаимодействием [14], основной вклад в свободную энергию рассматриваемой системы описывается в рамках модели многосортной смеси заряженных твердых сфер (CHS). Тогда полную свободную энергию солевого расплава можно записать в виде:
(1)
${{F}_{{{\text{liq}}}}} = {{F}_{{{\text{id}}}}} + {{F}_{{{\text{hs}}}}} + {{F}_{{\text{c}}}} + {{F}_{{{\text{pol}}}}}.$Вклад смеси идеальных газов в свободную энергию имеет стандартную форму [17]:
(2)
${{F}_{{{\text{id}}}}} = N{{k}_{{\text{B}}}}T \cdot \mathop \sum \limits_i \left[ {{{x}_{i}}\ln {{x}_{i}}--{{x}_{i}}\ln \left( {\frac{1}{\rho } \cdot {{{\left( {\frac{{2\pi {{m}_{i}}{{k}_{{\text{B}}}}T}}{{{{h}^{2}}}}} \right)}}^{{\frac{3}{2}}}}} \right)} \right]--1{\text{\;}},$Вклад твердосферных взаимодействий в свободную энергию учитывается в работе на основе интерполяционной схемы Мансури–Карнагана–Старлинга–Леланда (MCSL) для многосортной смеси твердых сфер [18]:
(3)
${{F}_{{{\text{hs}}}}} = N{{k}_{{\text{B}}}}T \cdot \left[ {\frac{{3{{y}_{2}} + 2{{y}_{3}}}}{\Delta } + \frac{{3--3{{y}_{1}}--3{{y}_{2}}--{{y}_{3}}}}{{2{{\Delta }^{2}}}}--\frac{3}{2}\left( {1--{{y}_{1}} + {{y}_{2}} + {{y}_{3}}} \right) + \left( {{{y}_{3}}--1} \right) \cdot \ln \Delta } \right].$Кулоновский вклад в свободную энергию найден в работе Блюма и Розенфельда в рамках среднесферического приближения (MSA) для смеси заряженных твердых сфер произвольных диаметров и электровалентностей [19]:
(4)
${{F}_{{\text{c}}}} = --\frac{{N{{e}^{2}}}}{\varepsilon } \cdot \left( {\mathop \sum \limits_i \frac{{{{x}_{i}}z_{i}^{2}\Gamma }}{{1 + \Gamma {{d}_{i}}}} + \frac{{\pi P_{n}^{2}}}{{2\Delta }} \cdot \frac{\Omega }{\rho }} \right) + \frac{{N{{k}_{{\text{B}}}}T{{\Gamma }^{3}}}}{{3\pi \rho }}{\text{\;}},$Удобно теперь рассмотреть заряд-дипольный вклад в свободную энергию расплавленных солей с помощью термодинамической теории возмущений (TPT) [13], учитывая более слабые, но сложные взаимодействия на основе среднесферической модели, которая может быть решена аналитически в общем виде [20]. Отметим, что с математической точки зрения удобнее проводить расчеты возмущающей добавки в свободную энергию расплавов в пространстве Фурье-образов, оперируя парциальными структурными факторами. Аналитические выражения для радиальных функций распределения в [21] могут быть выражены только в виде Лаплас-образов, тогда как для прямых корреляционных функций Орнштейна–Цернике получаются значительно более простые выражения [22]. Поэтому дополнительный вклад заряд-дипольных взаимодействий в свободную энергию можно представить как:
(5)
${{F}_{{{\text{pol}}}}} = \frac{1}{{4{{\pi }^{2}}}} \cdot \mathop \sum \limits_{i,j} \sqrt {{{x}_{i}}{{x}_{j}}} \mathop \smallint \limits_0^\infty \phi _{{ij}}^{{{\text{pol}}}}\left( k \right) \cdot \left( {S_{{ij}}^{{{\text{chs}}}}\left( k \right) - {{\delta }_{{ij}}}} \right) \cdot {{k}^{2}}dk + \frac{\rho }{2} \cdot \mathop \sum \limits_{i,j} {{x}_{i}}{{x}_{j}}\phi _{{ij}}^{{{\text{pol}}}}\left( 0 \right)~,$Выражение интересующей нас добавки в парный потенциал взаимодействия в прямом пространстве $\phi _{{ij}}^{{{\text{pol}}}}(R)$ = $\frac{{{{E}_{{ij}}}}}{{2{{R}^{4}}}}$ [14] путем Фурье-преобразования можно привести к следующему виду:
(6)
$\phi _{{ij}}^{{{\text{pol}}}}\left( k \right) = \pi k{{E}_{{ij}}} \cdot \left( {\frac{{\sin k{{d}_{{ij}}}}}{{{{k}^{2}}d_{{ij}}^{2}}} + \frac{{\cos k{{d}_{{ij}}}}}{{k{{d}_{{ij}}}}} - {\text{Si}}\left( {k{{d}_{{ij}}}} \right)} \right){\text{\;}},$Свободная энергия ионных кристаллов вычислялась в работе в соответствие с уравнением Борна–Майера [24] при учете колебательного вклада по модели Дебая:
(8)
${{F}_{{{\text{sol}}}}} = \frac{{NA{{z}_{i}}{{z}_{j}}{{e}^{2}}}}{{2{{R}_{0}}}} \cdot \left( {1 - \frac{{{{\rho }_{e}}}}{{{{R}_{0}}}}} \right) + N{{k}_{{\text{B}}}}T \cdot \left[ {3\ln \left( {1 - {{e}^{{ - \frac{{{{\theta }_{d}}}}{T}}}}} \right) + \frac{9}{8} \cdot \frac{{{{\theta }_{d}}}}{T} - D\left( {\frac{{{{\theta }_{d}}}}{T}} \right)} \right].$Вычисление равновесий “расплав–кристалл” осуществлялось стандартно посредством приравнивания химических потенциалов компонентов в обеих фазах при заданном составе и давлении [25].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Модель учета заряд-дипольных взаимодействий в бинарных жидкосолевых смесях с общими анионами применена к расчетам линий ликвидус на диаграммах плавкости эвтектических систем LiF–NaF, LiF–KF, NaF–KF, NaF–CsF и KF–CsF. В данном разделе приводятся результаты расчетов кривых ликвидус в указанных системах при сопоставлении с зависимостями, представленными в базе данных FactSage [26], а также имеющимися в литературе экспериментальными данными о положениях точек эвтектического равновесия [27, 28]. При вычислениях свободной энергии расплавленных фторидов щелочных металлов использованы экспериментальные значения плотностей [29]. В качестве ионных радиусов для описания системы сравнения заряженных твердых сфер были выбраны общеизвестные радиусы Фуми–Тоси [30]. Значения диэлектрических постоянных были рассчитаны с помощью формулы Клаузиуса–Моссотти из справочных данных по ионным поляризуемостям Полинга [30]. Свободные энергии кристаллов вычислялись с использованием характеристических температур Дебая и параметров отталкивания Борна, взятых из [24]. Представленные на рисунках результаты расчетов кривых ликвидус обозначены сплошными линиями, пунктирными линиями изображены данные FactSage. Кроме того, на диаграммах нанесены расчетные значения температур плавления чистых солей, а также температура плавления и состав в эвтектической точке. В обсуждениях к рисункам проведено общее сопоставление положения точек эвтектического равновесия и с экспериментальными значениями различных авторов, и с данными FactSage Database.
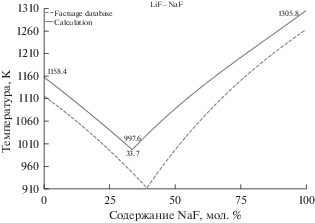
На рис. 1 представлены данные по кривым ликвидус на фазовой диаграмме бинарной системы LiF–NaF простого эвтектического типа. По данным различных авторов [27] положение эвтектической точки для смеси LiF–NaF находится в диапазоне температур 898–932 K и 39–40 мол. % NaF. Рассчитанное в нашей работе значение составляет 997.6 K и 33.7% содержания NaF. Из сопоставления расчетных и литературных данных видно, что вычисленное положение эвтектической точки смещено на 5–6 мол. % в сторону менее тугоплавкого компонента, а температура плавления завышена на 65–100 K.
Рис. 1.
Линии ликвидус на фазовой диаграмме эвтектической смеси LiF–NaF (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
На рис. 2 изображены расчетные линии ликвидус для смеси LiF–KF от состава в сопоставлении с данными FactSage. Положение точки эвтектического равновесия в системе LiF–KF по литературным данным [27] соответствует области температур 749–766 K и 49.5–53 мол. % содержания KF. Вычисленное нами положение эвтектического равновесия достигается в точке, соответствующей 853.1 K и 45.2% KF. Заметно слабое смещение эвтектической точки в сторону более легкоплавкого компонента примерно на 5 мол. %, а температура плавления смеси завышена не более чем на 100 K.
Рис. 2.
Линии ликвидус на фазовой диаграмме эвтектической смеси LiF–KF (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
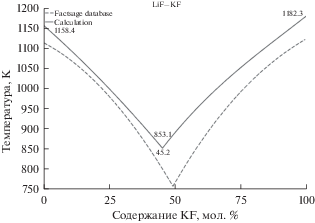
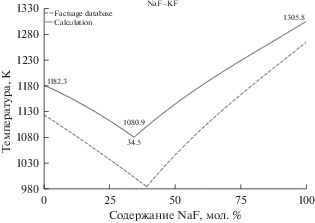
Рисунок 3 иллюстрирует кривые ликвидус на фазовой диаграмме смеси NaF–KF. Результаты различных авторов для системы NaF–KF [27] свидетельствуют о положении точки эвтектического равновесия в диапазоне температур 983–994 K при содержании NaF 40 мол. %. Полученное в данной работе положение эвтектического равновесия соответствует 1080.9 K и 34.5% содержания NaF. Рассчитанное значение состава в эвтектической точке также сдвинуто в сторону менее тугоплавкого компонента на 5.5% с аналогичным смещением вверх по температуре.
Рис. 3.
Линии ликвидус на фазовой диаграмме эвтектической смеси NaF–KF (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
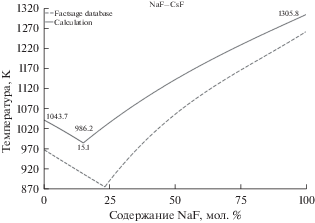
На рис. 4 показаны результаты расчетов линий ликвидус в системе NaF–CsF. В соответствие литературным данным для смеси NaF–CsF [28] положение точки эвтектического равновесия находится в диапазоне температур 883–888 K при содержании NaF 20–24 мол. %. Рассчитанное по модели положение эвтектического равновесия соответствует 986.2 К и 15.1% содержания NaF. Аналогично, рассчитанное значение состава в эвтектической точке смещено в сторону менее тугоплавкого компонента менее чем на 10%, а температура плавления смеси завышена примерно на 100 K.
Рис. 4.
Линии ликвидус на фазовой диаграмме эвтектической смеси NaF–CsF (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
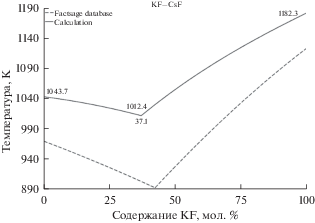
Наконец, на рис. 5 представлены рассчитанные кривые ликвидус для бинарной эвтектической смеси KF–CsF в зависимости от содержания KF. По данным авторов из [28] смесь KF–CsF в точке эвтектического состава 43 мол. % имеет температуру плавления 898–900 K. Вычисленное нами положение эвтектической точки составляет 37.1% при температуре 1012.4 K. Закономерно рассчитанное положение эвтектической точки смещение в сторону легкоплавкого компонента на 6% по оси состава и вверх по температуре на величину до 120 K.
Рис. 5.
Линии ликвидус на фазовой диаграмме эвтектической смеси KF–CsF (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
Сопоставление результатов расчетов кривых ликвидус с данными различных авторов [26–28] показывает разумной согласие для всех рассмотренных бинарных фторидных смесей даже при использовании табличных значений ионных радиусов и поляризуемостей. Погрешности в описании ликвидуса на фазовых диаграммах указанных фторидных систем не превышают 15%. Во всех рассмотренных случаях наблюдается некоторое завышение расчетных температур плавления вследствие недооцененной свободной энергии жидкосолевой фазы. Также заметна общая тенденция смещения положения эвтектического равновесия в сторону легкоплавкого компонента и некоторое завышение температуры эвтектической точки по сравнению с температурами плавления чистых солей. В целом же рассчитанные кривые ликвидус по своему характеру точно повторяют зависимости, представленные в FactSage Database.
Завышение температуры плавления проявляется более заметно с увеличением ионного радиуса катионов, то есть при переходе от систем, содержащих фторид лития, к смесям с фторидом цезия. Последнее связано с более значительной недооценкой свободной энергии в системах с большими поляризуемостями катионов вследствие повышения диэлектрической постоянной, поскольку зависимость Клаузиуса–Моссоти жестко привязывает эту величину к номинальным поляризуемостям ионов. В результате для солей с наиболее поляризуемыми катионами, такими как CsF, дополнительный вклад в свободную энергию даже немного понижается. Отметим, что в отсутствие вклада заряд-дипольных взаимодействий свободные энергии расплавов недооценены еще более существенно, что приводит и к более резкому завышению температур плавления [16].
Дальнейшее развитие предлагаемого подхода мы видим в направлении уточнения локальных диэлектрических свойств ионных расплавов. В частности, предполагается использовать вариационный принцип для нахождения диэлектрической постоянной посредством минимизации свободной энергии. Кроме того, планируется провести расчеты поверхности ликвидус на фазовых диаграммах тройных систем Li, Na, K || F и Na, K, Cs || F.
ВЫВОДЫ
1. Предложенная ранее модель термодинамической теории возмущений, учитывающая дополнительный заряд-дипольный вклад в свободную энергию расплавленных солей на базе системы сравнения заряженных твердых сфер, обобщена на случай бинарных жидкосолевых расплавов типа M1X–M2X с общими аниономи.
2. На этой основе проведены расчеты линий ликвидус на бинарных пограничных диаграммах плавкости, входящих в тройные системы Li, Na, K || F и Na, K, Cs || F.
3. Учет заряд-дипольных взаимодействий приводит к понижению свободной энергии жидкосолевой фазы и, как следствие, температур плавления фторидных солей щелочных металлов. Погрешности при расчетах линий равновесия “расплав–кристалл” в указанных бинарных системах не превышают 15%.
4. При описании ликвидуса на диаграммах плавкости бинарных солевых смесей LiF–NaF, LiF–KF, NaF–KF, NaF–CsF и KF–CsF наблюдается смещение положения точки эвтектического равновесия в сторону менее тугоплавкого компонента на величину порядка 5–10% по оси состава и вверх по температуре на величину до 120 K.
Исследование выполнено при финансовой поддержке РФФИ в рамках научных проектов № 19-33-90180 и № 18-03-00606.
Список литературы
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
Janz G.J. Molten Salts Handbook. Academic Press Inc., 1967.
Gaune-Escard M., Haarberg G.M. Molten Salts Chemistry and Technology. John Wiley & Sons, 2014.
Lantelme F., Groult H. Molten Salts Chemistry: From Lab to Applications. Elsevier Inc., 2013.
Блинкин В., Новиков В. Жидкосолевые ядерные реакторы. М.: Атомиздат, 1978.
Gaune-Escard M. Molten Salts: From Fundamentals to Applications. Springer Science & Business Media, 2002.
Braunstein J., Mamantov G., Smith G. Advances in Molten Salt Chemistry: Volume 3. Plenum Press, 1975.
Chang Y.A., Chen S., Zhang F., Yan X., Xie F., Schmid-Fetzer R., Oates W.A. // Progress in Materials Science. 2004. 49. P. 313–345. https://doi.org/10.1016/S0079-6425(03)00025-2
Kapała J., Bochyńska M., Broczkowska K., Rutkowska I. // J. Alloys and Compounds. 2008. 451. P. 679–681. https://doi.org/10.1016/j.jallcom.2007.04.085
Song J., Shi S., Li X., Yan L. // J. Molecular Liquids. 2017. 234. P. 279–286. https://doi.org/10.1016/j.molliq.2017.03.099
Beneš O., Zeller Ph., Salanne M., Konings R.J.M. // J. Chem. Phys. 2009. 130. P. 134716. https://doi.org/10.1063/1.3097550
Salanne M., Madden P.A. // Molecular Physics. 2011. 109. P. 2299–2315. https://doi.org/10.1080/00268976.2011.617523
Solana J.R. Perturbation Theories for the Thermodynamic Properties of Fluids and Solids. CRC Press: Taylor & Francis Group, 2013.
Stillinger F.H. Equilibrium Theory of Pure Fused Salts // Molten Salt Chemistry, 1964.
Kirkwood J.G. // Chemical Review. 1936. 19. P. 275–307. https://doi.org/10.1021/cr60064a007
Давыдов А.Г., Смолярчук Е.В., Ткачев Н.К. // Расплавы. 2019. № 6. С. 513–530. https://doi.org/10.1134/S0235010619060021
Ландау Л.Д., Лифшиц Е.М. Теоретическая физика. Статистическая физика. Часть 1. М.: Наука, 1976.
Mansoori G.A., Carnahan N.F., Starling K.E., Leland T.W. // J. Chemical Physics, 1971. 54. P. 1523–1525. https://doi.org/10.1063/1.1675048
Blum L., Rosenfeld Y. // J. Statistical Physics. 1991. 63. P. 1177–1190. https://doi.org/10.1007/BF01030005
Hiroike K. // Molecular Physics. 1977. 33. P. 1195–1198. https://doi.org/10.1080/0026897770010101136
Blum L. // Theoretical Chemistry: Advances and Perspectives. 1980. 5. P. 1–66. https://doi.org/10.1016/b978-0-12-681905-2.50007-4
Юхновский И.Р., Головко М.Ф. Статистическая теория классических равновесных систем. Киев: Наукова думка, 1980.
Давыдов А.Г., Ткачев Н.К. // Расплавы. 2020. № 5. С. 508–520. https://doi.org/10.31857/S0235010620050035
Sirdeshmukh D.B., Sirdeshmukh L., Subhadra K.G. Alkali Halides: A Handbook of Physical Properties. Springer-Verlag Berlin Heidelberg, 2001.
Prigogine I., Defay R. Chemical Thermodynamics. Longmans Green and Co, 1954.
FTsalt – FACT Salt Phase Diagrams. Available at: http://www.crct.polymtl.ca/fact/documentation/FTsalt/FTsalt_Figs.htm
Посыпайко В.И. и др. Диаграммы плавкости солевых систем. Часть 2. Двойные системы с общим анионом. М.: Металлургия, 1977.
Посыпайко В.И. и др. Диаграммы плавкости солевых систем. Часть 1. Двойные системы с общим анионом. М.: Металлургия, 1977.
Haynes W.M. CRC Handbook of Chemistry and Physics: 97th Edition. CRC Press: Taylor & Francis Group, 2017.
Batsanov S.S., Batsanov A.S. Introduction to Structural Chemistry. Springer Science + Business Media, Dordrecht, 2012.
Дополнительные материалы отсутствуют.


