Расплавы, 2021, № 3, стр. 223-232
Летучести компонентов насыщенных паров растворов UCl4 в расплавленной эквимольной смеси NaCl–KCl
А. Б. Салюлев a, *, В. Я. Кудяков a, Н. И. Москаленко a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: salyulev@ihte.uran.ru
Поступила в редакцию 02.09.2020
После доработки 19.09.2020
Принята к публикации 02.10.2020
Аннотация
Измерены методом потока летучести компонентов насыщенных паров расплавленных смесей UCl4–NaCl–KCl, содержащих 2.0, 5.0, 12.2, 25.1, 32.9 и 49.7 мол. % UCl4 в интервале температур 880–1200 K. Определен химический состав насыщенных паров. Сделан вывод о присутствии в паровой фазе двойных соединений наиболее вероятного состава NaUCl5 и KUCl5, вносящих заметный вклад в общее давление паров над расплавленными смесями. Найдено, что исследованные расплавленные смеси проявляют отрицательные отклонения от идеального поведения.
ВВЕДЕНИЕ
При организации процессов получения металлического урана высокотемпературными методами и регенерации отработанного ядерного топлива на его основе необходимо знать летучести компонентов насыщенных паров расплавленных солевых смесей, содержащих соединения урана, в частности, его тетрахлорид. Летучесть является одним из важных параметров, определяющих течение различных высокотемпературных процессов. С ней, в частности, связаны возможные потери ценных компонентов солевых расплавов в результате испарения. Однако сведений по летучести тетрахлорида урана из его бинарных, тройных или многокомпонентных высокотемпературных смесей с хлоридами щелочных металлов в доступной литературе практически нет, за исключением наших данных для расплавов UCl4–CsCl и UCl4–LiCl [1].
В настоящем сообщении приведены результаты экспериментальных исследований летучести компонентов и химического состава паров растворов UCl4 в расплавленной эквимольной смеси NaCl–KCl – одной из наиболее интересных солевых систем с практической точки зрения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали хлориды натрия и калия марки “х. ч.”. Их сушили при пониженном давлении (~1 Па) в течение 60–80 ч, постепенно повышая температуру до температуры плавления. Безводный тетрахлорид урана синтезировали хлорированием двуокиси урана тетрахлоридом углерода марки “ос. ч.” [2–5]. Полученный продукт многократно дистиллировали в вакууме и в токе инертного газа для отделения легколетучих (UCl5) и возможных труднолетучих примесей. По данным химического анализа атомное отношение Cl/U в полученном продукте составляло 3.95. Приготовленные таким образом соли брали в требуемых соотношениях и сплавляли в кварцевых пробирках в инертной атмосфере. Расплавы быстро охлаждали во избежание ликвации. Взвешивание и загрузку солей и их плавов в кварцевые приборы проводили в сухом боксе с P2O5 в атмосфере азота.
Для измерения летучестей компонентов насыщенных паров расплавленных смесей UCl4–NaCl–KCl нами был использован, как и ранее [1, 6, 7], надежный динамический тензиметрический метод – метод переноса [9]. Его сущность заключается в отборе определенного объема инертного газа-носителя, насыщенного при заданной температуре парами солей, с последующей их конденсацией в условиях практической неизменности состава жидкой солевой фазы.
Методика эксперимента и конструкция измерительного прибора, изготовленного из кварцевого стекла, были подробно описаны ранее [6–8]. Для опытов брали достаточно большие навески плавов солей (по 20–40 г), чтобы свести к минимуму (не более 0.15–0.20%) изменение их состава в результате частичного испарения компонентов. В качестве газа-носителя использовали гелий марки “ос. ч.”. Его очищали от примесей кислорода и влаги медленным пропусканием через две колонки с активированным углем, поддерживаемым при температуре кипения жидкого азота, через две емкости с расплавленным металлическим литием и через кварцевую пробирку, заполненную стружкой циркония, нагретой до температуры 1150 K. Скорость газового потока (2.5 · 10–7–7 · 10–7 м3/с) подбирали таким образом, чтобы обеспечить равновесие между расплавленной солевой и паровой фазами и свести к минимуму (не более 0.3–0.5%) вклад диффузионной составляющей в общий перенос паров из испарителя в конденсатор прибора [1, 6–8]. Для этого испаритель и конденсатор были соединены друг с другом кварцевым капилляром диаметром 1 мм и длиной около 20 мм. Количество пропущенного газа-носителя определяли по объему вытесненной воды из газосборника. Ячейки с солями нагревали в электропечи сопротивления, снабженной массивным металлическим блоком. Температуру расплава, фиксируемую Pt/Pt–Rh термопарой, поддерживали постоянной при заданных значениях в пределах ±1 K.
Пары солей конденсировались за капилляром в съемных кварцевых конденсаторах. Их взвешивали до и после опыта на аналитических весах типа АДВ-200М и определяли вес конденсата паров с точностью 0.2 мг. Собранный конденсат смывали бидистиллированной водой и анализировали на содержание урана, натрия и калия. Уран находили весовым или фотоколориметрическим методом с арсеназо III, щелочной металл – по атомно-абсорбционным спектрам на спектрофотометре фирмы Perkin-Elmer, США. Ошибки определения урана и щелочных металлов, в зависимости от их содержания в конденсатах паров и применявшегося метода анализа, составляли от 2 до 10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
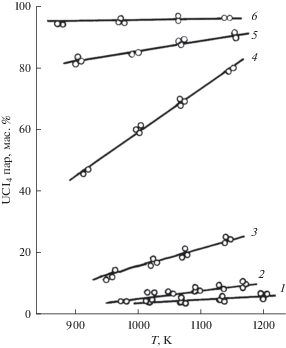
Найдено, что концентрация тетрахлорида урана в насыщенных парах его растворов в расплавленной эквимольной смеси NaCl–KCl возрастает с температурой для всех составов жидкой фазы за исключением расплава с 50 мол. % UCl4. Для последнего концентрация UCl4 в парах, в пределах погрешности аналитических определений, остается постоянной (рис. 1).
Рис. 1.
Температурная зависимость концентрации UCl4 в насыщенных парах над его растворами в расплавленной эквимольной смеси NaCl–KCl, содержащей: 1 – 2.0; 2 – 5.0; 3 – 12.2; 4 – 25.1; 5 – 32.9; 6 – 49.7 мол. % UCl4.
При неизменной температуре концентрация UCl4 в газовой фазе возрастает при увеличении его концентрации в расплаве (рис. 1, 2). На рис. 2 приведена также изотерма 4 (1073 K), построенная на основании литературных данных по давлению насыщенных паров над чистыми жидкими NaCl, KCl [10, 11] и UCl4 [4, 12] в предположении идеального смешения компонентов расплавов UCl4–NaCl–KCl. Можно видеть, что реальные расплавленные смеси UCl4–NaCl–KCl значительно отклоняются от идеального поведения в сторону меньших летучестей UCl4, причем тем в большей степени, чем ниже температура. Это свидетельствует о достаточно сильном взаимодействии компонентов в расплаве.
Рис. 2.
Изменение концентрации UCl4 в насыщенных парах в зависимости от состава его растворов в расплавленной эквимольной смеси NaCl–KCl при 973 (1), 1073 (2) и 1173 К (3); для идеального поведения смесей при 1073 К (4).
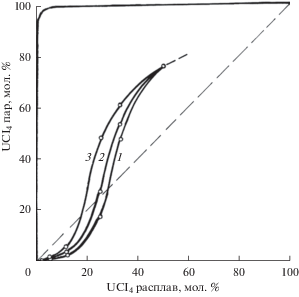
Рассматриваемые расплавленные смеси, содержащие менее 17–27 мол. % UCl4, в интервале температур 973–1173 K при длительной неизотермической выдержке будут обогащаться тетрахлоридом урана (рис. 2) несмотря на то, что последний является самым легколетучим индивидуальным компонентом. Напротив, более высококонценрированные растворы UCl4 будут при указанных условиях обедняться тетрахлоридом. Отмеченный факт очень важен с практической точки зрения.
Химический анализ конденсатов не позволяет однозначно судить о молекулярном составе насыщенных паров над расплавленными смесями. В парах реальных солевых систем могут присутствовать кроме мономерных и димерных (полимерных) молекул (NaCl, KCl, Na2Cl2, K2Cl2 [9–11, 13–15], UCl4 [4, 5, 12, 15, 16]) также смешанные соединения (NaKCl2 [9, 11, 13, 15, 17], NaUCl5, KUCl5 [14] и др.). Поэтому определение парциальных давлений различных молекулярных форм (которых может быть много) в парах над многокомпонентными расплавленными смесями представляет собой очень сложную задачу [9, 11, 14, 15, 18]. Однако, зная количества возгонов и их элементный состав, по известным соотношениям [6–9] легко можно рассчитать летучести компонентов в предположении, что в паровую фазу из солевых расплавов UCl4, NaCl и KCl переходят только в виде мономерных молекул:
(1)
${{f}_{i}} = {{{{n}_{i}} \cdot P} \mathord{\left/ {\vphantom {{{{n}_{i}} \cdot P} {(\sum {{n}_{i}} + N)}}} \right. \kern-0em} {(\sum {{n}_{i}} + N)}},$Летучести UCl4, NaCl, KCl меняются с температурой согласно эмпирическим уравнениям вида lg f = A – B/T. Значения постоянных A и B, определенных из экспериментальных данных методом наименьших квадратов, приведены в табл. 1. Здесь же дан среднеквадратичный разброс экспериментальных точек, Δ.
Таблица 1.
Коэффициенты уравнений температурной зависимости летучестей компонентов растворов UCl4 разных концентраций в расплавленной эквимольной смеси NaCl–KCl
| [UCl4], мол. % |
T, K | n * | lg f = A – B/T ± ∆, Па | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| UCl4 | NaCl | KCl | |||||||||
| A | B | ∆ | A | B | ∆ | A | B | ∆ | |||
| 2.0 | 1015–1200 | 12 | 9.9 | 10 900 | 0.02 | 10.5 | 9500 | 0.01 | 10.5 | 9500 | 0.01 |
| 5.0 | 970–1170 | 14 | 10.3 | 10 900 | 0.02 | 10.3 | 9200 | 0.02 | 10.2 | 9200 | 0.02 |
| 12.2 | 945–1160 | 12 | 10.6 | 10 900 | 0.02 | 10.1 | 9000 | 0.02 | 10.0 | 9000 | 0.02 |
| 25.1 | 915–1165 | 10 | 11.2 | 10 600 | 0.01 | 8.5 | 7500 | 0.04 | 8.5 | 7500 | 0.04 |
| 32.9 | 900–1160 | 10 | 11.1 | 9600 | 0.01 | 8.8 | 7500 | 0.01 | 8.7 | 7500 | 0.01 |
| 49.7 | 880–1150 | 9 | 10.4 | 7400 | 0.02 | 9.6 | 7400 | 0.02 | 9.4 | 7400 | 0.02 |
Рассчитанные таким образом летучести компонентов характеризуют суммарную способность каждого компонента раствора (расплавленных смесей) – хлоридов урана, натрия или калия, переходить в паровую фазу независимо от того, в каких молекулярных формах он испаряется и находится в газовой фазе. Такая характеристика особенно полезна на практике, где весьма часто важно количественно оценивать переход вещества из конденсированной фазы в газообразную и относительную улетучиваемость различных компонентов в случае сложных смесей.
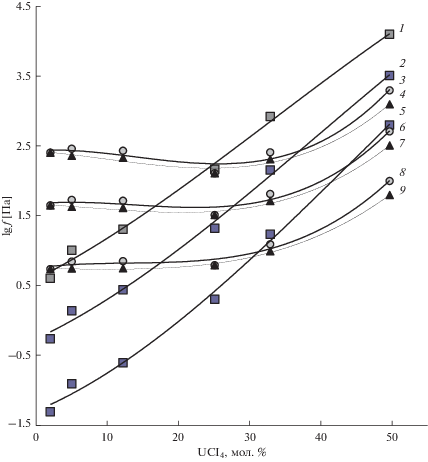
Летучесть всех компонентов расплавленных смесей UCl4–NaCl–KCl увеличивается с ростом температуры (рис. 3). У тетрахлорида урана она возрастает с повышением его содержания в жидкой фазе и при концентрациях свыше 25–31 мол. % начинает превышать летучесть хлоридов щелочных металлов. Летучесть же хлоридов натрия и калия сначала почти не меняется (или слабо уменьшается) с понижением их содержания в расплавах, а затем начинает возрастать. Наибольшая летучесть NaCl и KCl наблюдается из расплавленных смесей с минимальной концентрацией хлоридов щелочных металлов (рис. 3). Это однозначно свидетельствует о том, что из расплавленных смесей UCl4–NaCl–KCl хлориды щелочных металлов испаряются не только в виде мономеров, димеров MCl и M2Cl2 и смешанных димеров NaKCl2 [9–11, 13–15, 17], но и в виде их двойных соединений с более летучим компонентом – тетрахлоридом урана: MnUCl4 +n (M – щелочной металл), из которых, согласно литературным сведениям [14] и результатам наших исследований [1], преобладают комплексы типа MUCl5. Их вклад в летучесть хлоридов натрия и калия – наибольший у расплавленных смесей с максимальной концентрацией тетрахлорида урана.
Рис. 3.
Изотермы летучестей компонентов из растворов UCl4 в расплавленной эквимольной смеси NaCl–KCl: 1, 2, 5 – UCl4, 3, 6, 8 – NaCl, 4, 7, 9 – KCl; 1, 3, 4 – 1173 К, 2, 6, 7 – 1073 К, 5, 8, 9 – 973 К.
Действительно, для реакций равновесия в паровой фазе
можно записать уравненияПри повышении концентрации UCl4 в расплавленных смесях (и соответствующем понижении концентрации MCl) PMCl должно уменьшаться, а ${{P}_{{{\text{MUC}}{{{\text{l}}}_{{\text{5}}}}}}},$ согласно уравнению (3) – возрастать симбатно с ${{P}_{{{\text{UC}}{{{\text{l}}}_{{\text{4}}}}}}},$ внося все больший вклад в суммарный переход в пар, т.е. в летучесть (PMCl + ${{P}_{{{\text{MUC}}{{{\text{l}}}_{{\text{5}}}}}}}$) хлорида каждого щелочного металла, что и наблюдается экспериментально (рис. 3).
Приведенная упрощенная схема (в которой не учтено присутствие в парах частиц Na2Cl2, K2Cl2 и NaKCl2) тем не менее позволяет качественно объяснить основные причины “аномального” хода летучести хлорида щелочного металла с его концентрацией в расплавах. Отметим, что аналогичный тип концентрационного изменения летучести хлорида щелочного металла в результате его частичного соиспарения с летучими комплексами MUCl5 и MThCl5 был зафиксирован нами для расплавленных смесей UCl4–MCl (M = Cs, Li) [1] и ThCl4–MCl (M = Cs, Rb, K, Na, Li) [19].
У расплавленных смесей UCl4–NaCl–KCl менее летучий в индивидуальном состоянии (по сравнению с KCl) хлорид натрия [10, 11] становится более летучим (рис. 3). Различие в летучестях становится наибольшим у расплава с максимальной концентрацией тетрахлорида. Это также может быть следствием совместного испарения хлоридов натрия и калия с UCl4 в составе газообразных комплексов.
Имеющиеся в нашем распоряжении экспериментальные данные для расплавленных смесей UCl4–NaCl–KCl, UCl4–CsCl и UCl4–LiCl [1] позволяют проследить тенденции в изменении летучести тетрахлорида урана в зависимости от температуры, концентрации и природы соли-растворителя (табл. 2).
Таблица 2.
Летучесть тетрахлорида урана (в Па) в насыщенных парах над растворами UCl4 в расплавленной эквимольной смеси NaCl–KCl
| T, K | Концентрация UCl4 в расплаве, мол. % | |||||
|---|---|---|---|---|---|---|
| 2.0 | 50.0 | 2.0 | 50.0 | 2.0 | 50.0 | |
| UCl4–LiCl | UCl4–NaCl–KCl | UCl4–CsCl | ||||
| 973 | 1.28 · 101 | 4.22 · 103 | 4.98 · 10–2 | 6.48 · 102 | 3.50 · 10–3 | 6.23 · 102 |
| 1073 | 7.17 · 101 | 2.06 · 104 | 5.52 · 10–1 | 3.35 · 103 | 7.19 · 10–2 | 3.89 · 103 |
| 1173 | 2.99 · 102 | 7.70 · 104 | 4.05 | 1.31 · 104 | 8.82 · 10–1 | 1.77 · 104 |
Летучесть UCl4 возрастает на 1–2 порядка при увеличении температуры от 973 до 1173 K. При понижении концентрации тетрахлорида в расплавленных смесях с 50 до 2 мол. % ${{f}_{{{\text{UC}}{{{\text{l}}}_{{\text{4}}}}}}}$ уменьшается на несколько порядков своей величины: на 4–5 порядков – для смесей с CsCl, на 3–4 порядка – для смесей с NaCl–KCl и приблизительно на 2 порядка – для смесей с LiCl. При одинаковых температурах летучесть UCl4 понижается на 1–3 порядка при переходе от смесей UCl4–LiCl к смесям UCl4–CsCl (для расплавленных смесей UCl4–NaCl–KCl ${{f}_{{{\text{UC}}{{{\text{l}}}_{{\text{4}}}}}}}$ имеет промежуточные значения). Наибольшие изменения в летучести тетрахлорида урана для рассматриваемых переходов фиксируются при минимальных температурах и концентрациях UCl4 в расплавах, а также в случае расплавленных смесей UCl4–CsCl.
Резкое понижение летучести тетрахлорида урана при замене соли-растворителя в ряду LiCl, NaCl–KCl, CsCl и при понижении концентрации UCl4 с максимальной до минимальной в расплавах происходит, очевидно, в результате комплексообразования при взаимодействии тетрахлорида урана с хлоридами щелочных металлов в исследованных расплавленных смесях. При невысоких концентрациях UCl4 образуются комплексные хлоридные анионы ${\text{UCl}}_{7}^{{3 - }},$ ${\text{UCl}}_{6}^{{2 - }},$ а в концентрированных растворах, кроме того, – полимерные ${{{\text{U}}}_{2}}{\text{Cl}}_{{10}}^{{2 - }},$ ${{{\text{U}}}_{3}}{\text{Cl}}_{{14}}^{{2 - }},$ в которых атомы металла связаны между собой мостиковыми атомами хлора [20]. В расплавленных смесях родственных систем ThCl4–MCl (M = Cs, Rb, K, Na, Li) с помощью спектроскопии КРС зафиксированы комплексные ионы тех же стехиометрических составов [21].
Прочность комплексных анионов четырехвалентного урана возрастает по мере понижения контрполяризующего воздействия щелочных катионов в ряду от Li+ к Cs+ на анионы хлора, входящие в состав хлорокомплексных группировок. Это приводит к понижению летучести UCl4 в том же направлении. Наиболее отчетливо рассматриваемая тенденция должна проявляться в области с наиболее сильным комплексообразованием UCl4 – в его разбавленных растворах (c 2–5 мол. %) в расплавленных смесях, где коэффициенты активности тетрахлорида урана, как и многих других поливалентных хлоридов, близки к постоянной минимальной величине [22].
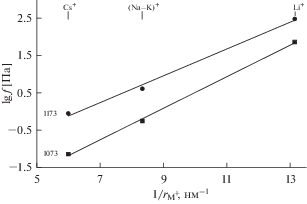
На рис. 4 представлена летучесть тетрахлорида урана для таких разбавленных растворов при температурах 1173 и 1073K в зависимости от обратных величин эффективных ионных радиусов щелочных металлов по Шеннону [23]. В случае эквимольной смеси NaCl–KCl в качестве эффективного радиуса катиона соли-растворителя взято среднеарифметическое значение радиусов Na+ и K+. Наблюдается практически линейное изменение ${{f}_{{{\text{UC}}{{{\text{l}}}_{4}}}}}$ в зависимости от обратного радиуса (ионного момента) щелочных катионов. Подобную зависимость уже наблюдали для различных термодинамических функций галогенидов других поливалентных элементов [19, 22, 24, 25]. Это дает возможность оценивать летучесть тетрахлорида урана из экспериментально еще не исследованных его расплавленных смесей с хлоридами щелочных металлов.
ЗАКЛЮЧЕНИЕ
Измерены впервые летучести компонентов насыщенных паров расплавленных смесей UCl4–NaCl–KCl, содержащих от 2 до ~50 мол. % UCl4, в широком интервале температур. Определен химический состав насыщенных паров. Сделан вывод о присутствии в них летучих комплексных соединений наиболее вероятного состава NaUCl5 и KUCl5.
Экспериментальные факты, установленные ранее и в настоящей работе, свидетельствуют о том, что в среде расплавленных хлоридов щелочных металлов ионы U4+ входят в состав комплексных анионных группировок, прочность которых возрастает при понижении концентрации ионов урана в растворах и уменьшении контрполяризующего воздействия на них со стороны щелочных катионов при переходе от LiCl к NaCl–KCl и к CsCl.
Работа (частично) выполнена с использованием оборудования центра коллективного пользования “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Смирнов М.В., Кудяков В.Я., Салюлев А.Б., Комаров В.Е., Посохин Ю.В., Афоничкин В.К. Летучести компонентов насыщенных паров расплавленных смесей UCl4–CsCl и UCl4–LiCl // Радиохимия. 1979. 21. № 1. С. 18–21.
Yoshimura T., Miyake Ch., Imoto Sh. Preparation of anhydrous uranium tetrachloride and measurements on its magnetic susceptibility // J. Nucl. Sci. and Technol. 1971. 8. № 9. P. 498–502.
Katz J.J., Seaborg G.T., Morss L.R. Chemistry of the actinide elements. London, N.Y.: Chapman and Hall. 1987. 1.
Katz J.J., Rabinowitch E. The chemistry of uranium: The element, its binary and related compounds. N.Y., London: McGraw-Hill Book Company, Inc. 1951. Part 1.
Brown D. The halides of the lanthanides and actinides. London, N.Y., Sydney, Tokyo, Mexico: John Wiley and Sons Ltd. 1968.
Смирнов М.В., Кудяков В.Я., Худоложкин В.Н., Шерстобитова И.А. Летучести компонентов расплавленных смесей KCl–ThCl4 // Труды Ин-та электрохим. УНЦ АН СССР. 1972. № 18. С. 33–40.
Смирнов М.В., Худоложкин В.Н., Кудяков В.Я., Шерстобитова И.А. Летучесть и активность ThCl4 и CsCl в их расплавленных смесях // Труды Ин-та электрохим. УНЦ АН СССР. 1973. № 20. С. 27–32.
Салюлев А.Б. Давление насыщенных паров и термодинамика растворов тетрахлорида гафния в расплавленных хлоридах щелочных металлов и их бинарных смесях. Дис. … канд. хим. наук. Свердловск, 1981.
Суворов А.В. Термодинамическая химия парообразного состояния. Л.: Химия. 1970.
Roine A. HSC Chemistry 7.0 Thermochemical Database. Finland: Outokumpu Research Oy. 2009.
Миронов В.Л., Бурылев Б.П. Давление насыщенного пара индивидуальных хлоридов и их бинарных смесей // Успехи термодинамики расплавов: материалы Всесоюзного семинара. Краснодар. 1976. С. 25–84.
Singh Z., Prasad R., Venugopal V., Sood D.D. The vaporization thermodynamics of uranium tetrachloride // J. Chem. Thermodynamics. 1978. 10. P. 129–124.
Wang L.L., Wallace T.C. Vacuum evaporation of KCl–NaCl salts: Part I. Thermodinamic modeling of vapor pressures of solid and liquid solutions // Metallurg. and Mater. Trans. 1996. 27B. P. 141–146.
Шугуров С.М. Термическая устойчивость неорганических ассоциатов в газовой фазе. Дис. … д-ра хим. наук. Санкт-Петербург, 2018.
Binnewies M., Schäfer H. Gasförmige Halogenidkomplexe und ihre Stabilität // Z. Anorg. Allg. Chem. 1974. 407. № 3. P. 327–344.
Arthers S.A., Beattie I.R. The vibrational spectra of some tetrachlorides in rare gas matrices with particular reference to the molecular shapes of ThCI4 and UCI4 // J. Chem. Soc., Dalton Trans. 1984. № 23. P. 819–826.
Zhang Ya., Shibata E., Kasai E., Nakamura T. Vapor pressure measurements for metal chloride systems by the Knudsen effusion method // Materials Trans. 2005. 46. № 6. P. 1348–1353.
Салюлев А.Б., Москаленко Н.И., Шишкин В.Ю., Зайков Ю.П. Селективное испарение компонентов расплавленных смесей (LiCl–KCl)эвт–BaCl2–SrCl2–NdCl3 при пониженных давлениях // Расплавы. 2020. № 4. С. 363–374.
Smirnov M.V., Kudyakov V.Ya. The saturation vapor pressure and decomposition potential of ThCl4 solutions in molten alkali chlorides // Electrochim. Acta. 1984. 29. № 1. P. 63–68.
Li B., Dai S., Jiang D. First principles dynamic simulations of UCln–NaCl (n = 3, 4) molten salts // ACS Appl. Energy Mater. 2019. 2. № 3. P. 2122–2128.
Photiadis G.M., Papatheodorou G.N. Co-ordination of thorium(IV) in molten alkali-metal chlorides and the structure of liquid and glassy thorium(IV) chloride // J. Chem. Soc., Dalton Trans. 1999. № 20. P. 3541–3548.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука. 1973.
Shannon R.D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides // Acta Crystallogr. 1976. A32. P. 751–767.
Salyulev A.B., Smolenski V.V., Moskalenko N.I. Saturated vapor pressure over molten mixtures of GaCl3 and alkali metal chlorides // Radiochemistry. 2004. 46. № 4. P. 343–347.
Smirnov M.V., Salyulev A.B., Kudyakov V.Ya. Thermodynamic properties and decomposition potential of HfCl4 solutions in molten alkali chlorides and their mixtures // Electrochim. Acta. 1984. 29. № 8. P. 1087–1100.
Дополнительные материалы отсутствуют.