Расплавы, 2021, № 3, стр. 303-314
Электрохимический синтез нанопорошков оксидов титана в расплавленной смеси хлоридов и нитратов щелочных металлов
Л. А. Елшина a, *, А. Г. Квашничев a, Д. В. Пелегов b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский Федеральный университет им. Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: yolshina@ihte.uran.ru
Поступила в редакцию 12.01.2021
После доработки 29.01.2021
Принята к публикации 01.02.2021
Аннотация
Проведен синтез наноразмерных частиц оксидов титана в расплавленной смеси хлоридов и нитратов щелочных металлов. Образованные порошки оксида аттестовали методами рентгеноструктурного анализа, спектроскопии комбинационного рассеяния и сканирующей электронной микроскопии. Синтез оксидов титана различной модификации и состава проходит при анодной поляризации высокочистого титана в расплавленной эвтектической смеси хлоридов цезия и натрия, содержащей 5 мас. % нитрата натрия, в гальваностатическом режиме плотностью тока 3.5 мА · см–2 в температурном интервале 540–700°С под атмосферой аргона. Фазовый состав продуктов оксидирования зависит от температуры синтеза, а размер частиц контролируется при помощи задаваемой плотности и температуры. Методами рентгеноструктурного анализа и спектроскопии комбинационного рассеяния было установлено, что образец, полученный при температуре синтеза 540°С однофазен и состоит из Cs1.36Ti6.64O16, а образцы, которые были синтезированы при температурах 600 и 650°С, образуют фазу TiO2 в смешанных модификациях анатаза и рутила. Образец, который был получен при температуре 700°С состоит из диоксида титана TiO2 (модификация рутила и брукита) и NaTi8O13. Методом сканирующей электронной микроскопии показано, что с ростом температуры синтеза размер частиц уменьшался. В образце, синтезированном при температуре 540°C и отожженном при температуре 200°С, содержится смесь наноразмерных и микроразмерных частиц трититаната цезия (более 50 нм). Образец диоксида титана, синтезированный при температуре 600°C, имеет размер частиц 20 нм, а образцы, синтезированные при температурах 650 и 700°С, имеют размер частиц 10–20 нм.
ВВЕДЕНИЕ
Диоксид титана в настоящее время находит многочисленные применения в качестве пигмента в лакокрасочной промышленности (титановые белила), в производстве бумаги, синтетических волокон, пластмасс, резиновых изделий, в производстве керамических диэлектриков, термостойкого и оптического стекла (в т.ч. для волоконной оптики), как компонент обмазки электродов для электросварки и покрытий литейных форм. Однако в последнее время самый пристальный интерес исследователей привлекают фотокаталитические свойства диоксида титана, и, в частности, возможность его применения в работе солнечных батарей [1–3]. Известно, что в наибольшей степени фотокаталитические свойства диоксида титана проявляется у нанокристаллических частиц [4], поэтому проводятся многочисленные исследования влияния способа получения наночастиц диоксида титана на его каталитические свойства. Использование нанопорошков диоксида титана снижает стоимость 1 кВт · ч в 5 раз по сравнению с аналогами на основе кремниевых полупроводниковых материалов. Кроме того, нанодиоксид титана применяют в космической отрасли и производстве специальных пластмасс для защиты от ультрафиолетового излучения, при изготовлении самоочищающихся стекол [5–7], фотокатализаторов очистки сточных вод [8, 9], электрохромных дисплеев, в производстве водорода при расщеплении воды [10–12].
Основным методом получения нанооксида титана в настоящее время являются традиционный золь-гель [13–15], гидротермальный или сольвотермический синтез [16–18]. В зависимости от условий процесса получают рентгеноаморфный, либо кристаллический TiO2 в форме рутила, анатаза или их смесей.
Синтез в расплавленных солях (MS synthesis) – простой метод синтеза простых и сложных оксидов желаемого состава. Расплавленные соли, такие как хлориды, нитраты и сульфаты щелочных металлов, часто используются как реакционная среда или растворитель для химической реакции, т.к. скорости диффузии компонентов в расплавленных солях много выше, чем в твердом состоянии. Следовательно, температура отжига не должна оказывать существенного влияния на MSS.
Оксиды многих металлов могут быть осаждены из расплавленных солей [19–21]. Существует несколько причин, делающих расплавленные соли привлекательной средой для синтеза оксидов. Это расширение возможностей формирования оксидов нужной морфологии, которую нельзя или слишком сложно получить упомянутыми выше способами, использования более широкого интервала температур оксидирования и большего разнообразия возможных химических реакций. Кроме того, при взаимодействии металлов с расплавленными солями реакции обычно протекают намного быстрее, чем в твердом теле. Более низкие температуры плавления расплавленных нитратов по сравнению с другими ионными расплавами, а также их термическая нестабильность делают их неподходящими для выращивания идеальных кристаллов, а вот порошки с высокоразвитой поверхностью в этих средах получены (ZrO2, Al2O3, PbO, TiO2 и др.) [22–26].
В настоящее время большую практическую значимость представляет синтез нанопорошков диоксида титана, который может быть осуществлен при оксидировании титана в хлоридно-нитратных расплавах в различных условиях [27]. Исследование коррозионно-электрохимического поведения титана в расплавленном хлоридно-нитратном электролите было опубликовано в [28].
Как было показано нашими предыдущими исследованиями, в расплаве CsCl–NaCl, содержащем нитрат натрия до ~5 мас. %, на поверхности титана при его бестоковой выдержке, так же как и его при анодной поляризации образуются рыхлые дефектные пленки оксида титана нестехиометрического состава с пониженным содержанием в них кислорода (52 и 48 ат. % титана и кислорода соответственно), а в объеме солевого электролита образуются значительные количества оксида титана (более 0.5 г на 50 г расплава в ходе единичного опыта) как в виде нано-, так и микроразмерных порошков. Образованные при бестоковом оксидировании титана порошки имеют разную дисперсность – от 1 нм (приблизительно 2%) до 2–3 мкм.
Известно, что особую ценность для практических применений представляют монодисперсные оксидные порошки. Очевидно, что для такого синтеза необходимо осуществлять оксидирование в режиме анодной поляризации. Для того, чтобы выбрать плотность тока, при которой будет образовываться монодисперсный порошок были записаны анодные поляризационные кривые титана в расплаве CsCl–NaCl, содержащем от 1 до 10 мас. % нитрата натрия, при 540–700°С. Плотность анодного тока, при которой образуются нанопорошки оксида титана, равна 3.5 мА · см–2. Исходя из анализа литературных данных, можно предположить, что синтез оксида титана в расплавленных солях электрохимическим методом способен решить вопрос, связанный с контролем размерности частиц и морфологии получаемого нанооксида.
Целью данного исследования было изучение морфологии и фазового состава образующихся при контролируемом электрохимическом синтезе нанопорошков диоксида титана и сложных оксидов на его основе в расплавленной эвтектической смеси хлоридов цезия и натрия, содержащей 5 мас. % нитрата натрия, в широком температурном интервале в атмосфере аргона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов TiO2 при анодной поляризации высокочистого титана проводили в расплавленной эвтектической смеси хлоридов цезия и натрия, содержащей 5 мас. % нитрата натрия, в гальваностатическом режиме плотностью тока 3.5 мА · см–2 в температурном интервале 540–700°С под атмосферой аргона при помощи потенциостата-гальваностата Autolab 302N. Порошок, синтезированный при 540°С, подвергался дополнительному отжигу при 200°С в течение 2 ч.
Титановые аноды помещали в расплав только после достижения заданной температуры эксперимента под током для предотвращения образования крупных кристаллов оксида титана при бестоковой выдержки.
Время синтеза подбирали экспериментально по виду гальваностатических кривых. Из-за образования на поверхности титана нанопорошков оксида титана на гальваностатической кривой наблюдались небольшие колебания потенциала. После того, как на кривой наблюдался резкий скачок потенциала, синтез прекращали.
Солевой плав после эксперимента охлаждали до комнатной температуры, измельчали и растворяли в дистиллированной воде.
Мелкодисперсный осадок фильтровали, либо центрифугировали, многократно промывали дистиллированной водой, высушивали либо на воздухе, либо в печи при температуре 200°С.
Полученные порошки были исследованы методами рентгеноструктурного анализа, спектроскопии комбинационного рассеяния и электронной микроскопии. Рентгеноструктурные исследования проводились на дифрактометре BRUKER D8 Discover в интервале углов 5 ≤ 2θ ≤ 80, проведение идентификации фаз проводилось с помощью картотеки PDF-2 ICDD 2010. Съемку образцов методом спектроскопии комбинационного рассеивания осуществляли на спектроскопе INTEGRA Spectra в интервале Рамановской частоты от 100 до 1000 см–1. Микрофотографии синтезированных пороков были сделаны на электронном микроскопе Carl Zeiss Workstation AURIGA GrossBeam (Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
На рис. 1 представлены типичные поляризационные кривые на титановом аноде в расплаве CsCl–NaCl–5% NaNO3 при температурах 600 и 650°С.
Рис. 1.
Поляризационные кривые образов, синтезированных при температуре 600 (1) и 650°С (2) в расплаве CsCl–NaCl–5% NaNO3.
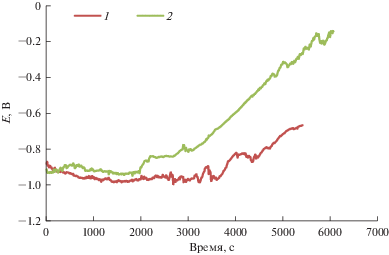
Анодные поляризационные кривые, снятые в гальваностатическом режиме, были использованы для определения времени синтеза. В начале поляризации наблюдается сдвиг потенциала в отрицательную сторону, связанный с образованием плохо сцепленных с металлической основой порошков диоксида титана. “Дребезг” на кривой соответствует процессу образования плохо сцепленного оксида титана и его осыпанию в расплавленную соль. Резкий скачок потенциала в положительную сторону свидетельствует об образовании на поверхности титана защитного слоя оксида и, как следствие, окончании синтеза. При повышении температуры синтеза время сокращалось с 5 ч при 540°С до 1.5 ч при 700°С.
Значения потенциалов, устанавливающихся на титановом аноде в ходе поляризации, закономерно сдвигаются в сторону положительных значений с увеличением температуры синтеза, что может свидетельствовать об изменении фазового состава продукта синтеза.
Микрофотографии нанопорошков, синтезированных при анодной поляризации титана в хлоридно-нитратном расплаве, приведены на рис. 2.
Рис. 2.
SEM-изображения порошков, синтезированных при 540 (а), 600 (б), 650 (в) и 700°С (г) в расплаве CsCl–NaCl–5% NaNO3.

На микрофотографиях видно, что порошок, синтезированный при температуре 540°С, представляет из себя смесь наноразмерных (до 50 нм) и микроразмерных частиц. Подобная размерность может быть вызвана агломерацией частиц в процессе отжига, который проводился для удаления воды из порошка. Порошки, полученные при температурах 600 и 650°С, имеют размерность частиц близкую к 20 нм. Это намного меньше, чем у предыдущего образца, т.к. данные порошки не подвергались отжигу. При увеличении температуры до 650°С отмечено появление нанотрубок в порошке. При растворении нанопорошков оксида титана, полученного при 700°С, в дистиллированной воде были получены устойчивые взвеси нанопорошка, которые не удалось осадить в высокоскоростной центрифуге при скорости вращения 6000 об./мин в течение 6 ч. Верхняя часть растворов с нанопорошком была слита, она оставалась в виде опалесцирующего раствора в течение нескольких месяцев. Нижняя часть была пипеткой помещена в чашки Петри и оставлена там для высушивания. На микрофотографии видны самые крупные частицы диоксида титана, которые были получены в данном эксперименте, размер которых достигает 10 нм. Все частицы выглядят в виде кристаллитов, с четкими углами. Таким образом, можно заключить, что повышение температуры синтеза приводит к значительному уменьшению размера оксидных порошков.
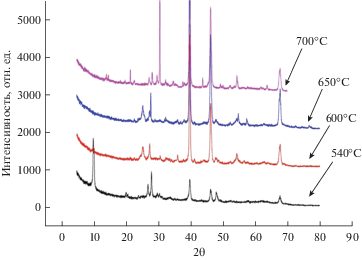
Идентификацию оксидной фазы проводили при помощи рентгеноструктурного анализа. Как видно из представленных на рис. 3 рентгенограмм, все пики хорошо выражены, не имеют уширений, что может быть связано с высокой степенью кристалличности образуемых при синтезе нанопорошков оксида титана.
Рис. 3.
Рентгенограмма образцов, синтезированных при температуре 540 (а), 600 (б), 650 (в) и 700°С (г) в расплаве CsCl–NaCl–5% NaNO3. Неотмеченные пики принадлежат подложке.
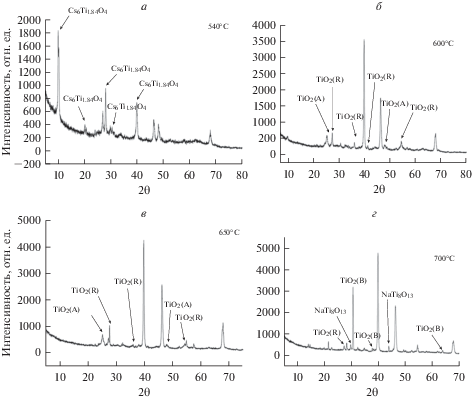
Порошок, синтезированный при температуре 540°С и отожженный при 200°С, представляет собой трититанат цезия с характеристическими пиками на 2θ = 20.8°, 2θ = 27.9°, 2θ = 31.7°, 2θ = 40° (рис. 3а). В литературе нам не удалось найти ссылки на синтез этого соединения, можно предположить, что он изоструктурен трититанату натрия, который является очень перспективным материалом для химических источников тока.
При электрохимическом синтезе при температуре 600°С нанопорошок представляет фазу TiO2 с преобладающей модификацией рутила в 2θ = 27.45°, 2θ = 37.9°, 2θ = = 41.2°, 2θ = 54.34°, с примесью минорных пиков анатаза на 2θ = 25.23° и 2θ = 47.57° (рис. 3б).
Рентгенограмма образца, синтезированного при 650°С, свидетельствует о возрастании интенсивности пиков и, как следствие, фазы рутила на 2θ = 27.45°, 2θ = 37.9° и 2θ = 54.34°, модификация анатаза также присутствует, но несколько в меньшем количестве и представлена на 2θ = 25.23° и 2θ = 47.57°.
Оксидный порошок, синтезированный при 700°С, является многофазным и впервые на рентгенограмме преобладающей фазой с очень высокими интенсивностями является модификация брукита, которая представлена на 2θ = 30.814°, 2θ = 37.819°, 2θ = 63.629°. Анатаз полностью отсутствует, а примесными фазами являются рутил с пиком, находящимся на 2θ = 27.390° и NaTi8O13, характерные пики данной фазы находятся на 2θ = 29.760° и 2θ = 43.929°. Фаза NaTi8O13, представляющая собой титанат натрия со смешанной валентностью титана Ti3+/Ti4+, была впервые получена в 1991 г. Акимото [29]. Основной фазой в порошке является диоксид титана в модификации брукита.
Таким образом, можно заключить, что повышение температуры электрохимического синтеза с 540 до 700°С приводит к изменению не только размерности и морфологии оксидного нанопорошка, но и его фазового состава.
Кроме того, идентификацию состава оксидных порошков осуществляли при помощи Рамановской спектроскопии (рис. 5 и 6).
Рис. 5.
Сравнительные Рамановские спектры порошков, синтезированных при температуре 540, 600, 650 и 700°С в расплаве CsCl–NaCl–5% NaNO3.
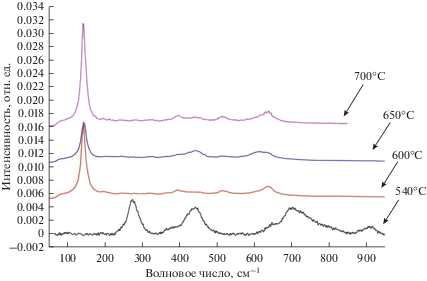
На Рамановском спектре порошка, полученного при 540°С, пики расположены на полосах комбинационного рассеяния 272, 444 и 697 см–1, аналогичных имеющимся в литературе данным для трититаната натрия. По результатам спектроскопии комбинационного рассеяния образца, полученного при 600°С, определяются характеристические для модификации анатаза TiO2 пики на полосах комбинационного рассеяния: 147, 398, 515 и 640 см–1. Известно, что преобладание анатаза свидетельствует о мелкодисперсности частиц вследствие более высокой стабильности нанооксида титана в модификации анатаза по сравнению с рутилом.
У образца нанопорошка, синтезированного при 650°С, по результатам спектроскопии комбинационного рассеяния выявляются две модификации TiO2 – анатаз и рутил. Доля рутила минимальная и его характеристический пик расположен на 448 см–1. А основные пики анатаза находится на тех же самых полосах комбинационного рассеяния, что и у образца, полученного при температуре 600°С.
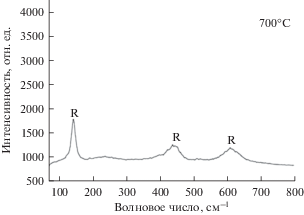
Съемку спектроскопии комбинационного рассеяния для образца, полученного при 700°С проводили в разных точках, т.к. рентгеноструктурный анализ показал многофазность образца. На рис. 6 измерен спектр однофазного TiO2 с модификацией рутила. Комбинационные полосы расположены на 144, 448 и 612 см–1. А на рис. 5 представлены пики сразу всех трех основных модификаций: рутила, анатаза и брукита. Комбинационные полосы рутила расположены аналогично синтезированному при 600°С, а анатаз был определен на 620 см–1. Брукит представлен относительно сложным колебательным спектром, основные полосы расположены на 398, 440 и 512 см–1.
Очевидно, что дополнительный отжиг нанопорошков оксида титана приводит к агломерированию частиц, а в следствии, к увеличению их размерности.
Синтез нанопорошков оксидов металлов, в том числе оксида титана, при анодной поляризации металлов в расплавленном хлоридно-нитратном электролите следует отнести к достаточно редким в химии диспергационным методам (“сверху вниз”): при анодной активации происходит ионизация металла, затем образовавшийся ион Men+, вступает в быструю химическую реакцию с кислородсодержащими ионами, находящимися в жидкой солевой фазе. Изменяя плотность тока, можно задавать концентрацию ионов металла в расплаве, которая, наряду с концентрацией кислородсодержащих ионов и определяет скорость образования новой фазы. Это позволяет управлять скоростью химической реакции, процессом зародышеобразования и, как следствие, дисперсностью образующихся порошков. Фазовый состав продуктов оксидирования титана в хлоридно-нитратном расплаве определяется температурой синтеза, повышение температуры синтеза также приводит к уменьшению размерности нанопорошков.
Синтезированный электрохимическим методом в расплаве солей при 600°С диоксид титана в модификации рутила был затем использован в синтезе нанокомпозитов состава Al–Al2O3 [30].
ВЫВОДЫ
При анодной поляризации титана в гальваностатическом режиме в расплавленной эвтектической смеси хлоридов цезия и натрия с 5 мас. % при температурах 540–700°С в объеме солевого электролита образуются нанопрошки оксида титана, а на поверхности титанового анода плотный защитный слой оксида титана, после образования которого синтез нанопорошка в объеме электролита прекращается.
Показано, что температура синтеза определяет фазовый состав нанопорошков оксида титана. Так, полученный при температуре синтеза 540°С нанопорошок однофазен и состоит из Cs1.36Ti6.64O16, а нанооксиды, полученные при температурах 600 и 650°С, образуют фазу TiO2 в смешанных модификациях анатаза и рутила. Образец, который был получен при температуре 700°С состоит из диоксида титана TiO2 (модификация рутила и брукита) и примесного титаната натрия NaTi8O13. Все образованные нанопорошки обладают высокой степенью кристалличности.
Морфологию нанопорошка можно успешно контролировать при помощи задаваемой плотности тока, а также температуры: размер кристаллов уменьшается при повышении температуры от 540 до 700°С с 50 до менее 20 нм.
Список литературы
Ma C., Wang L., Guo Z., Lv Y., Chen W., Ming H., Ma P., Wang J. // Colloids Surf. A Physicochem. Eng. Asp. 2018. 538. P. 94–99. https://doi.org/10.1016/j.colsurfa.2017.10.089
Liu X., Zhang C., Liu S., Xiong Y. // Optik (Stuttg).2018. 160. P. 277–282. https://doi.org/10.1016/j.ijleo.2018.02.008
Umale S.V., Tambat S.N., Sudhakar V., Sontakke S.M., Krishnamoorthy K. // Adv. Powder Technol. 2017. 28. P. 2859–2864. https://doi.org/10.1016/j.apt.2017.08.012
Ilaiyaraja P., Kumar Das T., Mocherla P.S.V., Sudakar C. // Sol. Energy Mater. Sol. Cells. 2017. 169. P. 86–97. https://doi.org/10.1016/j.solmat.2017.05.001
Adak D., Ghosh S., Chakrabarty P., Mondal A., Saha H., Mukherjee R., Bhattacharyya R. // Sol. Energy. 2017. 155. P. 410–418. https://doi.org/10.1016/j.solener.2017.06.014
Isaifan R.J., Samara A., Suwaileh W., Johnson D., Yiming W., Abdallah A.A., Aïssa B. // Sci. Rep. 2017. 7. P. 9466. https://doi.org/10.1038/s41598-017-07826-0
Cedillo-González E.I., Riccò R., Montorsi M., Montorsi M., Falcaro P., Siligardi C. // Build. Environ. 2014. 71. P. 7–14. https://doi.org/10.1016/j.buildenv.2013.09.007
Lofrano G., Libralato G., Casaburi A., Siciliano A., Iannece P., Guida M., Pucci L., Dentice E.F., Carotenuto M. // Sci. Total Environ. 2018. 624. P. 461–469. https://doi.org/10.1016/j.scitotenv.2017.12.145
Carbajo J., Bahamonde A., Faraldos M. // Mol. Catal. 2017. 434. P. 167–174. https://doi.org/10.1016/j. mcat.2017.03.018
Pérez-Larios A., Hernández-Gordillo A., Morales-Mendoza G., Lartundo-Rojas L., Mantilla Á., Gómez R. // Catal. Today. 2016. 266. P. 9–16. https://doi.org/10.1016/j.cattod.2015.12.029
Singh R., Dutta S. // Fuel. 2018. 220. P. 607–620. https://doi.org/10.1016/j.fuel.2018.02.068
Velázquez J.J., Fernández-González R., Díaz L., Pulido Melián E., Rodríguez V.D., Núñez P. // J. Alloys Compd. 2017. 721. P. 405–410. https://doi.org/10.1016/j.jallcom.2017.05.314
Epifani M., Comini E., Diaz R., Arbiol J. et al. Oxide nanopowders from the low-temperature processing of metal oxide sols and their application as gas-sensing materials // Sensors and Actuators B. 2006. 118. P. 105–109.
de Farias R.F., Arnold U., Martinez L. et al. Synthesis, characterization and catalytic properties of sol-gel derived mixed oxides // J. Physics and Chemistry of Solids. 2003. 64. P. 2385–2389.
Lee D.-S., Liu T.-K. Preparation of TiO2 sol using TiCl4 as a precursor // J. Sol-Gel Science and Technology. 2002. 25. № 2. P. 121–136.
Velázquez-Martínez S., Silva-Martínez S., Pineda-Arellano C.A., Jiménez-González A., Salgado-Tránsito I., Morales-Pérez A.A., Peña-Cruz M.I. Modified sol-gel/hydrothermal method for the synthesis of microsized TiO2 and iron-doped TiO2, its characterization and solar photocatalytic activity for an azo dye degradation // J. Photochemistry and Photobiology A: Chemistry. 2018. 359. P. 93–101.
Dong P., Cheng X., Huang Zh., Chen Y., Zhang Y., Nie X., Zhang X. In-situ and phase controllable synthesis of nanocrystalline TiO2 on flexible cellulose fabrics via a simple hydrothermal method // Materials Research Bulletin. 2018. 97. P. 89–95.
Santhi K., Navaneethan M., Harish S., Ponnusamy S., Muthamizhchelvan C. // Applied Surface Science. 2020. 500. P. 144058. https://doi.org/10.1016/j.apsusc.2019.144058
Zheng Y.-Zh., Zhang M.-L. Preparation and electrochemical properties of nickel oxide by molten salt synthesis // Materials Letters. 2007. 61. P. 3967–3968.
Li Z., Zhang Sh., Lee W.E. Molten salt synthesis of LaAlO3 powder at low temperatures // J. European Ceramic Society. 2007. 27. P. 3201–3205.
Li-hui Z., Qing-wei H. Morphology control of a α-Al2O3 platelets by molten salt synthesis // Ceramics International. 2011. 37. P. 249–255.
Yolshina L.A. Mechanism of Formation of Oxide Nanopowders by Anodic Oxidation of Metals in Molten Salts, Nanomaterials: Properties, Preparation and Processes, ISBN: 978-1-60876-627-7, NOVA Publishers, New York, USA, 2011. P. 255–293.
Elshina L.A., Kudyakov V.Ya., Malkov V.B., Molchanova N.G. Creation of thin oxide films and oxide nanopowders by anodic oxidation of metals in molten salts // Russian J. Inorganic Chemistry. 2008. 53. P. 539–544.
Yolshina L.A., Malkov V.B., A.N. Yolshin. The influence of formation conditions on the electrochemical behavior of lead oxide in sulfuric acid solution // J. Power Sources. 2009. 191. P. 36–41.
Yolshina L.A., Kudyakov V.Ya., Malkov V.B., Molchanova N.G. Corrosion and electrochemical behavior of aluminium treated with high-temperature pulsed plasma in CsCl–NaCl–NaNO3 melt // Corrosion science. 2011. 53. P. 2015–2026.
Elshina L.A., Elshina V.A. // Russian Metallurgy. 2020. № 2. P. 138–141. https://doi.org/10.1134/S0036029520020044
Elshina L.A., Kudyakov V.Ya., Malkov V.B., Elshin A.N. // Glass Physics and Chemistry. 2008. 34. № 5. P. 617–622. https://doi.org/10.1134/S1087659608050131
Elshina L.A., Kudyakov V.Ya., Malkov V.B., Plaksin S.V. // Protection of Metals and Physical Chemistry of Surfaces. 2010. 46. № 5. P. 587–592. https://doi.org/10.1134/S2070205110050151
Akimoto J., Takei H., Synthesis and crystal structure of NaTi8O13 // J. Solid State Chemistry. 1991. 90. № 1. P. 147–154.
Yolshina L.A., Kvashnichev A.G. Chemical interaction of liquid aluminum with metal oxides in molten salts // Materials and Design. 2016. 105. P. 124–132.
Дополнительные материалы отсутствуют.