Расплавы, 2021, № 3, стр. 284-293
Образование фосфатов бария и стронция в хлоридных расплавах
А. Б. Иванов a, *, Е. Д. Бызова a, В. А. Волкович a, А. В. Чукин a
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: chuvasch@yandex.ru
Поступила в редакцию 04.12.2020
После доработки 15.12.2020
Принята к публикации 21.12.2020
Аннотация
Исследованы процессы, проходящие при взаимодействии растворов хлоридов бария и стронция с ортофосфатом натрия в расплавах на основе эвтектических смесей LiCl–KCl (550°C), NaCl–KCl–CsCl (650°C), эквимольной смеси NaCl–KCl (750°C), а также NaCl–KCl–CsCl–LaCl3 (650°C) в инертной атмосфере. Методами химического и рентгенофазового анализа определены составы образующихся малорастворимых фосфатов. Изучено влияние мольного отношения фосфат-ионов к Sr2+/Ba2+ на фазовый состав осаждаемых фосфатов. Определены условия для количественного осаждения из расплава стронция и бария в виде фосфатов.
ВВЕДЕНИЕ
Пирохимическая переработка отработавшего ядерного топлива (ОЯТ) в расплавах на основе хлоридов щелочных металлов является альтернативой применяемой в настоящее время экстракционной технологии. После выделения из расплава делящихся материалов (урана, плутония) необходимо провести очистку электролита от остающихся электроотрицательных продуктов деления, к которым относятся редкоземельные, щелочноземельные и щелочные элементы. Одним из возможных методов очистки является фосфатное осаждение.
В работах [1–8] было рассмотрено образование фосфатов редкоземельных элементов из расплавов на основе смесей хлоридов щелочных металлов, представляющих интерес для пирохимической технологии переработки ОЯТ (NaCl–KCl, LiCl–KCl, NaCl–CsCl). В качестве реагента-осадителя были опробованы фосфаты лития, натрия, калия и аммония. Было показано, что на состав образующихся продуктов оказывают влияние катионный состав соли-растворителя, природа фосфата-осадителя и его избыток. При увеличении концентрации фосфата щелочного металла происходил переход от простых к двойным фосфатам: LnPO4 → Me3Ln2(PO4)3 → Me3Ln(PO4)2.
В ОЯТ реакторов на тепловых нейтронах содержится несколько изотопов стронция и бария (87Sr–92Sr и 136Ва–140Ва) и 1 т топлива, поступающего на переработку, содержит около 1.8 кг стронция и 4.3 кг бария с активностью 5100 и 7600 ТБк соответственно. Щелочноземельные металлы образуют малорастворимые фосфаты, однако в литературе практически отсутствуют сведения об образовании фосфатов этих элементов в хлоридных расплавах. Целью настоящей работы являлось исследование процессов осаждения фосфатов стронция и бария в расплавах на основе NaCl–KCl, LiCl–KCl и NaCl–KCl–CsCl, в том числе в присутствии редкоземельных элементов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты выполняли в расплавах на основе эвтектических смесей LiCl–KCl и NaCl–KCl–CsCl при 550°C, эквимольной смеси NaCl–KCl при 750°C. Также была проведена серия экспериментов в расплаве NaCl–KCl–CsCl с добавлением LaCl3 при температуре 650°C.
Осаждение фосфатов Sr/Ba проводили в тиглях из оксида алюминия. Расплавы, содержащие хлориды стронция и бария готовили растворением безводных SrCl2 или BaCl2 в расплаве соли-растворителя. Для перемешивания и удаления следов влаги и кислородсодержащих примесей расплавы при этом продували газообразным хлористым водородом. Для получения солевой смеси, содержащей хлориды лантана и стронция, в расплав NaCl–KCl–CsCl добавляли хлорид стронция и оксид лантана и проводили обработку газообразным хлористым водородом до полного перевода оксида лантана в хлорид и получения прозрачного расплава. Приготовленные таким образом солевые смеси хранили в перчаточном боксе в атмосфере аргона.
При проведении экспериментов по фосфатному осаждению в тигель к смеси предварительно приготовленных хлоридов добавляли необходимое количество безводного ортофосфата натрия (Na3PO4). Далее тигель помещали в стальную реторту и герметично закрывали крышкой. Реторту помещали в вертикальную печь, разогретую до требуемой температуры, вакуумировали и выдерживали под вакуумом в течение 30 мин до полного расплавления реакционной смеси. После этого реторту заполняли аргоном и выдерживали при заданной температуре 2 ч. По окончании выдержки реторту извлекали из печи и охлаждали. Из охлажденной реторты извлекали тигель. Замороженный плав в тигле обрабатывали 50 мл дистиллированной воды, подкисленной соляной кислотой. Полученные осадки фосфатов отфильтровывали, промывали дистиллированной водой, а затем снова размывали 20–30 мл дистиллированной воды до создания эмульсии для последующего гранулометрического анализа. Фильтрат и промывные воды объединяли для определения остаточного содержания бария или стронция. После проведения гранулометрического анализа, эмульсию, содержащую фосфаты бария либо стронция, фильтровали, осадок сушили при 180°C. Полученные осадки анализировали методом порошковой рентгеновской дифракции (дифрактометр PANalytical X’Pert PRO MPD, излучение Cu Kα, Ni фильтр). Размер частиц полученных фосфатов определяли при помощи лазерного гранулометрического анализатора ANALYSETTE 22 NanoTec plus с использованием приставки Wet Dispersion Unit с применением ультразвукового воздействия на образцы, для предотвращения возможной агломерации частиц во время измерений. Расчет размера частиц проводили по теории Фраунгофера.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
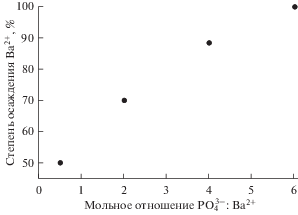
В присутствии фосфат-ионов происходит осаждение стронция и бария из хлоридных расплавов. На рис. 1 в качестве примера показано влияние количества вводимого осадителя на степень осаждения бария из расплава LiCl–KCl. Видно, что увеличение исходного мольного отношения ${\text{РО}}_{4}^{{3 - }}$ : Ва2+ приводит к увеличению степени осаждения, но для полного осаждения бария из расплава в статических условиях (без перемешивания расплава) необходим существенный избыток фосфата-осадителя.
Рис. 1.
Влияние количества, введенного Na3PO4 на полноту осаждения фосфата бария из расплава LiCl–KCl–BaCl2.
Результаты рентгенофазового анализа образующихся осадков (табл. 1) показали, что барий из расплавов на основе эвтектической смеси хлоридов лития и калия осаждается преимущественно в виде нормального ортофосфата Ba3(PO4)2. Только в одном случае было обнаружено присутствие двойного фосфата состава NaBaPO4. Основной фазой в осадках являлся фосфат лития. Фосфат лития имеет ограниченную растворимость в хлоридных расплавах, и его образование было ранее отмечено при исследовании процессов осаждения фосфатов редкоземельных элементов из расплавов на основе LiCl–KCl [2]. Таким образом, как и в случае осаждения фосфатов редкоземельных элементов, в присутствии в расплаве хлорида лития часть вводимого фосфата связывается в малорастворимый фосфат лития.
Таблица 1.
Влияние исходного мольного отношения ${\text{РО}}_{4}^{{3 - }}$ : Ва2+ в расплаве LiCl–KCl (550°С) на полноту осаждения бария и состав осадков
| Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Ba2+ | Степень осаждения, % | Фазовый состав осадка |
|---|---|---|
| 0.50 | 50.17 | Li3PO4, Ba3(PO4)2 |
| 2.02 | 69.97 | Li3PO4, Ba3(PO4)2 |
| 4.02 | 88.44 | Li3PO4, Ba3(PO4)2, NaBaPO4 |
| 6.04 | 99.89 | Li3PO4, Ba3(PO4)2 |
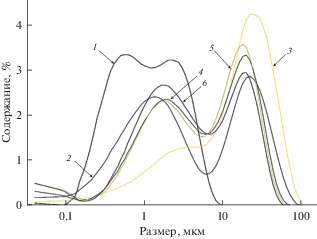
На рис. 2 представлены примеры результатов измерения размера частиц фосфатных осадков, полученных в расплаве LiCl–KCl–BaCl2. Измерения проводили с использованием ультразвуковой обработки. Осадки состояли из частиц микронных размеров. Основная масса частиц имела размер менее 30 мкм. На кривых распределения частиц по крупности присутствовали два максимума, около 2 и 20 мкм. Полученные результаты показали, что увеличение исходного мольного отношения фосфат-ионов к барию приводит к образованию частиц больших размеров, о чем свидетельствовало изменение профиля кривой распределения частиц по крупности и образование пика в области более высоких значений для большего избытка осадителя.
Рис. 2.
Дифференциальные кривые распределения частиц по размеру для фосфатов бария, полученных осаждением из расплавов LiCl–KCl–BaCl2 при 550°С. Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Ba2+: 1 – 0.50; 2 – 1.00; 3 – 2.02; 4 – 4.02; 5 – 6.04.
Для осаждения стронция и бария из расплавов на основе эквимольной смеси NaCl–KCl требовался существенно меньший избыток фосфат-ионов, по сравнению с расплавами LiCl–KCl (табл. 2). Одной из причин может быть отсутствие ионов лития в расплаве, которые связывали часть вводимого фосфата в малорастворимый Li3PO4. Осадки, полученные в расплавах NaCl–KCl–SrCl2, состояли из двойного фосфата натрия и стронция NaSrPO4 и оксофосфата стронция Sr10O(PO4)6. Только в одном случае было отмечено образование хлорофосфата стронция Sr5(PO4)3Cl. Признаков образования нормального ортофосфата стронция обнаружено не было. В случае расплавов NaCl–KCl–ВаCl2 основными фазами в осадках были нормальный и двойной фосфаты Ba3(PO4)2 и NaBaPO4 при исходных мольных отношениях ${\text{РО}}_{4}^{{3 - }}$ : Ва2+ от 2 до 5.
Таблица 2.
Влияние исходного мольного отношения ${\text{РО}}_{4}^{{3 - }}$ : Sr2+(Ва2+) в расплаве NaCl–KCl (750°С) на полноту осаждения стронция и бария и состав осадков
| Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Sr2+(Ва2+) | Степень осаждения, % | Фазовый состав осадка |
|---|---|---|
| Стронций | ||
| 1.12 | 97.33 | Sr5(PO4)3Cl |
| 4.46 | 98.56 | Sr10O(PO4)6, NaSrPO4 |
| 6.66 | 99.24 | Sr10O(PO4)6, NaSrPO4 |
| 8.81 | 99.94 | Sr10O(PO4)6, NaSrPO4 |
| Барий | ||
| 1.88 | 99.68 | NaBaPO4, Ba3(PO4)2, Ba5(PO4)3Cl |
| 3.29 | 99.10 | NaBaPO4, Ba3(PO4)2 |
| 4.38 | 98.82 | NaBaPO4, Ba3(PO4)2 |
| 5.25 | 99.14 | NaBaPO4, Ba3(PO4)2 |
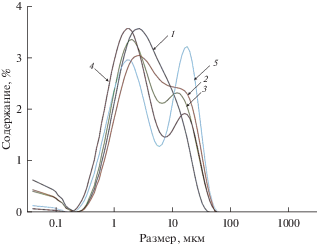
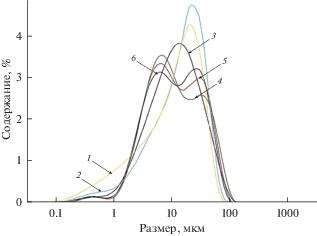
Результаты определения размера частиц фосфатов бария и стронция, полученных в расплавах NaCl–KCl при различных мольных отношениях ${\text{РО}}_{4}^{{3 - }}$ : Sr2+(Ва2+) представлены на рис. 3 и 4. Осадки состояли из более крупных частиц, чем в расплавах LiCl–KCl. Максимумы кривых распределения частиц по размеру находились около 30–60 мкм. Однозначного влияния исходного мольного отношения введенного фосфата к присутствующим щелочноземельным металлам на размер частиц образующихся фосфатов обнаружено не было.
Рис. 3.
Дифференциальные кривые распределения частиц по размеру для фосфатов стронция, полученных осаждением из расплавов NaCl–KCl–SrCl2 при 750°С. Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Sr2+: 1 – 0.68; 2 – 1.12; 3 – 2.23; 4 – 4.46; 5 – 6.66; 6 – 8.81.
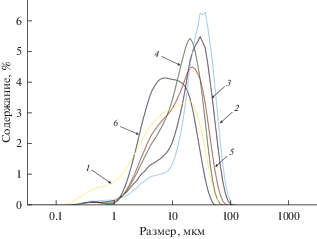
Рис. 4.
Дифференциальные кривые распределения частиц по размеру для фосфатов бария, полученных осаждением из расплавов NaCl–KCl–BaCl2 при 750°С. Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Ba2+: 1 – 0.53; 2 – 1.02; 3 – 1.88; 4 – 3.29; 5 – 4.38; 6 – 5.25.
Как и в случае расплавов NaCl–KCl для осаждения стронция и бария из расплавов NaCl–KCl–CsCl требовался незначительный избыток фосфата натрия (табл. 3). В случае осаждения стронция фазовый состав осадка изменялся по мере увеличения исходного мольного отношения ${\text{РО}}_{4}^{{3 - }}$ : Sr2+. При низких мольных отношениях осадок состоял преимущественно из хлорофосфата Sr5(PO4)3Cl. Увеличение количества введенного фосфата натрия привело к появлению двойного фосфата NaSrPO4, а при мольных отношениях ${\text{РО}}_{4}^{{3 - }}$ : Sr2+ более 10 в осадках также был обнаружен нормальный ортофосфат Sr3(PO4)2. В случае барийсодержащих систем состав осадков был в целом аналогичен, но хлорофосфат бария Ва5(PO4)3Cl присутствовал практически во всех образцах наравне с двойным фосфатом NaBaPO4.
Таблица 3.
Влияние исходного мольного отношения ${\text{РО}}_{4}^{{3 - }}$ : Sr2+(Ва2+) в расплаве NaCl–KCl–CsCl (650°С) на полноту осаждения стронция и бария и состав осадков
| Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Sr2+(Ва2+) | Степень осаждения, % | Фазовый состав осадка |
|---|---|---|
| Стронций | ||
| 0.87 | 77.64 | Sr5(PO4)3Cl |
| 1.75 | 94.14 | Sr5(PO4)3Cl, NaSrPO4 |
| 3.48 | 98.61 | NaSrPO4 |
| 6.99 | 97.83 | NaSrPO4 |
| 10.40 | 97.79 | Sr3(PO4)2, NaSrPO4 |
| 13.93 | 97.82 | Sr3(PO4)2, NaSrPO4 |
| Барий | ||
| 0.58 | 91.97 | Ba5(PO4)3Cl |
| 1.07 | 95.71 | Ba5(PO4)3Cl, NaBaPO4 |
| 2.16 | 98.38 | NaBaPO4, Ba3(PO4)2 |
| 4.35 | 99.48 | NaBaPO4, Ba3(PO4)2, Ba5(PO4)3Cl |
| 6.52 | 99.20 | NaBaPO4, Ba3(PO4)2, Ba5(PO4)3Cl |
| 8.71 | 99.77 | Ba5(PO4)3Cl |
Осадки были образованы из частиц несколько меньшего размера, чем в случае расплавов NaCl–KCl (рис. 5 и 6). Таким образом, наименьший размер частиц имели осадки, образованные в расплавах LiCl–KCl при 550°С. Более крупные частицы образовались в расплавах NaCl–KCl–CsCl при 650°С и самые крупные – в расплавах NaCl–KCl при 750°С. Вероятно, что одним из факторов, оказывающих влияние на размер частиц осадков фосфатов щелочноземельных металлов, является температура и повышение температуры приводит к образованию более крупных частиц фосфатов.
Рис. 5.
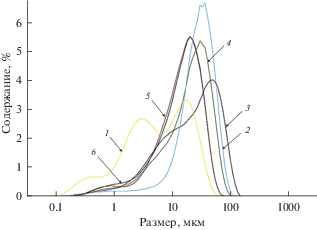
Дифференциальные кривые распределения частиц по размеру для фосфатов стронция, полученных осаждением из расплавов NaCl–KCl–CsCl–SrCl2 при 650°С. Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Sr2+: 1 – 0.87; 2 – 1.75; 3 – 3.48; 4 – 6.99; 5 – 10.40.
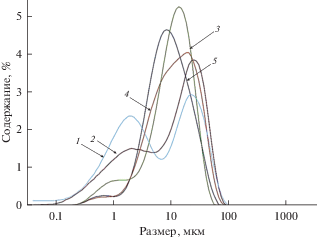
Рис. 6.
Дифференциальные кривые распределения частиц по размеру для фосфатов бария, полученных осаждением из расплавов NaCl–KCl–CsCl–ВаCl2 при 650°С. Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Ba2+: 1 – 0.58; 2 – 1.07; 3 – 2.16; 4 – 4.35; 5 – 6.52; 6 – 8.71.
При реализации метода фосфатного осаждения для очистки технологических расплавов от электроотрицательных продуктов деления в электролитах наряду с ионами щелочноземельных металлов будут присутствовать и ионы редкоземельных элементов. Поэтому представляло интерес рассмотреть возможное влияние ионов РЗЭ на осаждение фосфатов щелочноземельных металлов. Эксперименты выполняли при 650°С в расплавах на основе эвтектической смеси NaCl–KCl–CsCl, содержащих 7.8 мас. % SrCl2 и 10.7 мас. % LaCl3. Соотношение молярных концентраций стронция и лантана в расплаве составляло 1.1. Результаты экспериментов представлены в табл. 4.
Таблица 4.
Влияние исходного мольного отношения ${\text{РО}}_{4}^{{3 - }}$ : Sr2+ в расплаве NaCl–KCl–CsCl–LaCl3 (650°С) на полноту осаждения стронция и состав осадков
| Мольное отношение ${\text{РО}}_{4}^{{3 - }}$ : Sr2+ | Степень осаждения Sr, % | Фазовый состав осадка |
|---|---|---|
| 0.57 | 29.6 | LaPO4 |
| 1.01 | 42.5 | LaPO4, Sr5(PO4)3Cl |
| 1.90 | 99.3 | LaPO4, NaSrPO4, Sr5(PO4)3Cl |
| 3.18 | 99.7 | Na6La(PO4)3, NaSrPO4 |
| 4.16 | 98.8 | LaPO4, NaSrPO4, Sr5(PO4)3Cl |
Из сопоставления данных, представленных в табл. 3 и 4 видно, что присутствие в расплаве ионов лантана оказывает существенное влияние на полноту осаждения стронция. При введении фосфата натрия в расплав первым начинает осаждаться лантан. При мольном отношении ${\text{РО}}_{4}^{{3 - }}$ : Sr2+ около 0.6 в рентгенофазовый анализ не обнаружил присутствия в осадке фосфата стронция, хотя по данным химического анализа концентрация стронция в расплаве уменьшилась примерно на 30%. При мольных отношениях ${\text{РО}}_{4}^{{3 - }}$ : Sr2+ более 1 осадок представлял смесь фосфата лантана и различных фосфатов стронция. Лантан преимущественно осаждался в виде нормального моноклинного ортофосфата LaPO4. Только в одном образце был обнаружен двойной фосфат лантана и натрия. Стронций, как и в случае осаждения из расплавов NaCl–KCl–CsCl–SrCl2 при мольных отношениях ${\text{РО}}_{4}^{{3 - }}$ : Sr2+ менее 7 был представлен хлорофосфатом Sr5(PO4)3Cl и двойным фосфатом NaSrPO4. Хотя редкоземельные и щёлочноземельные металлы способны образовывать двойные фосфаты, никаких признаков, указывающих на их присутствие в полученных образцах, обнаружено не было.
Результаты определения размера частиц осадков фосфатов стронция и лантана представлены на рис. 7. На зависимостях присутствуют два выраженных максимума, около 3 и 30 мкм. Видно, что в отличие от осадков, полученных в расплавах, не содержавших хлорид РЗЭ, размер частиц был существенно меньше. При этом минимальный размер частиц был у осадка, полученного при минимальном количестве введенного фосфата (кривая 1 на рис. 4). Данный осадок в основном состоял из фосфата лантана (табл. 4). Таким образом, первый максимум на кривых распределения частиц по размеру отвечает фосфату лантана, а второй – фосфатам стронция. Отсутствие пика выше 10 мкм на кривой 1 на рис. 4 указывает на отсутствие в осадке заметных количеств фосфата стронция, что хорошо согласуется с результатами рентгенофазового анализа.
ВЫВОДЫ
Было исследовано взаимодействие фосфата натрия с хлоридными расплавами различного катионного состава, содержащими ионы стронция и бария. В результате определены условия (исходные мольные отношения фосфата к щелочноземельному металлу), при которых достигается полное осаждение стронция и бария, из расплавов LiCl–KCl–МCl2; NaCl–KCl–МCl2; NaCl–KCl–CsCl–МCl2; NaCl–KCl–CsCl–LaCl3–SrCl2 (М = Ba, Sr).
Установлен фазовый состав образующихся фосфатов. В зависимости от условий проведения процесса возможно осаждение простых фосфатов M3(PO4)2, двойных фосфатов NaMPO4, хлорофосфатов М5(PO4)3Cl (М = Sr, Ba), а также Sr10O(PO4)6. В присутствии в расплаве ионов лития имеет место осаждение малорастворимого фосфата лития и для выведения из расплава стронция и бария требуется значительный избыток фосфат-ионов.
Показано, что в присутствии ионов редкоземельных элементов (лантана) фосфат ионы вначале преимущественно взаимодействуют с РЗЭ. Доказательств образования двойных фосфатов РЗЭ и щелочноземельных металлов получено не было. Фосфатные осадки состоят из частиц преимущественно имеющих размер от 1 до 100 мкм.
Список литературы
Hudry D., Bardez I., Rakhmatullin A., Bessada C., Bart F., Jobic S., Deniard P. // J. Nucl. Mater. 2008. 381. P. 284–289. https://doi.org/10.1016/j.jnucmat.2008.09.005
Volkovich V.A., Griffiths T.R., Thied R.C. // Phys. Chem. Chem. Phys. 2003. 5. P. 3053–3060. https://doi.org/10.1039/b302280n
Волкович В.А., Гриффитс Т.Р., Васин Б.Д., Якимов С.М., Медведев Е.О. Исследование процессов образования фосфатов лантаноидов в расплавах эвтектической смеси 3LiCl–2KCl // Расплавы. 2007. № 3. С. 24–31.
Volkovich V.A., Griffiths T.R., Thied R.C. // J. Nucl. Mater. 2003. 323. P. 49–56. https://doi.org/10.1016/j.jnucmat.2003.08.024
Volkovich V.A., Ivanov A.B., Yakimov S.M., Polovov I.B., Vasin B.D., Griffiths T.R., Chukin A.V., Shtolts A.K. // ECS Transactions. 2012. 50. № 11. P. 517–527. https://doi.org/10.1149/05011.0517ecst
Volkovich V.A., Ivanov A.B., Yakimov S.M., Polovov I.B., Vasin B.D., Chukin A.V., Shtolts A.K., Griffiths T.R. Formation of rare earth phosphates in NaCl–2CsCl-based melts // Molten Salts Chemistry and Technology, M. Gaune-Escard and G.M. Haarberg, Editors, John Wiley & Sons Inc., Hoboken. 2014. P. 481–488.
Волкович В.А., Иванов А.Б., Якимов С.М., Васин Б.Д., Чукин А.В., Штольц А.К. Осаждение фосфатов редкоземельных элементов из расплавов на основе эвтектической смеси NaCl–2CsCl // Расплавы. 2014. № 6. С. 58–69.
Ivanov A.B., Volkovich V.A., Malltsev D.S., Sukhikh V.V., Griffiths T.R. // ECS Transactions, 2016. 75. № 15. P. 313–321. https://doi.org/10.1149/07515.0313ecst
Дополнительные материалы отсутствуют.