Расплавы, 2021, № 4, стр. 406-415
Получение и электрохимические свойства двойных литий-замещенных натрий-ванадиевых бронз
М. И. Пантюхина a, b, *, О. И. Гырдасова c, О. А. Неволина b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
c Институт химии твердого тела УрО РАН
Екатеринбург, Россия
* E-mail: marpantyuhina@yandex.ru
Поступила в редакцию 22.12.2020
После доработки 13.01.2021
Принята к публикации 20.01.2021
Аннотация
С использованием методов мягкой химии из формиатов натрия и лития NaHCOO·2H2O, LiHCOO·H2O и формиата ванадила VO(HCOO)2·H2O с последующим отжигом при 600°С по керамической технологии были получены литий-замещенные натрий-ванадиевые бронзы (ОВБ) состава Na2– хLiхV12O30 (0.6 ≤ x ≤ 1.4). Проведено электрохимическое циклирование ячеек с катодом и анодом из них, а также с расплавленным литиевым анодом и электролитом на основе гексаоксоцирконата лития. Показано, что бронзы состава Na2 –хLiхV12O30 обратимо интеркалируются по катионам лития при повышенных температурах 460–560°С. С помощью сканирующей электронной спектроскопии (СЭМ) на микроскопе JEOL JSM 6390 LA показано, что кристаллы ОВБ Na2– хLiхV12O30 после циклирования распадаются на более тонкие пластинчатые агрегаты. По результатам энергодисперсионного рентгеновского анализа (ЭДРА) установлено неравномерное распределение натрия в кристаллитах фазы ОВБ Na2– хLiхV12O30 после циклирования при сохранении фазового состава образца. Использование двойных литий-натриевых ванадиевых бронз совместно с литийпроводящими твердыми электролитами перспективно и требует дальнейших исследований.
ВВЕДЕНИЕ
Создание полностью твердофазных литиевых источников тока с твердым электролитом (ТЭЛ) до сих пор остается актуальной проблемой. Эта задача в настоящее время становится важной в связи с потребностью в таких устройствах в области спецтехники, электротранспорта, систем хранения энергии и т.д. Электрические параметры литиевых и литий-ионных аккумуляторов в основном определяются характеристиками материала катода. Помимо высокой практической емкости в материале катода должны отсутствовать фазовые переходы при интеркаляции/деинтеркаляции лития. Это дает возможность многократного циклирования устройства без механического разрушения морфологической структуры катодного материала, что, в свою очередь, позволит значительно повысить ресурс работы.
В литературе достаточно описаны различные оксиды ванадия (V2O5, V6O13, LiV3O8 и др.) применительно к литиевым источникам тока [1]. Меньше исследованы для этих целей оксидные ванадиевые бронзы типа β (ОВБ-β) Na2V12O30 – δ [2, 3]. Известно, что ОВБ этого типа отличаются обширными областями гомогенности, химической стойкостью и высокой электропроводностью [2–4]. Ее кристаллографические особенности обеспечивают существенную подвижность катионов, внедренных в ванадий-кислородный каркас. Особенный интерес вызывает практическое приложение ОВБ в качестве высокоэффективных катодных материалов металл-ионных батарей, которые демонстрируют высокую плотность энергии (зарядная емкость до 650 мА · ч/г) и значительную стабильность цикла [5–9].
Электрохимическое поведение материала в значительной степени зависит от его поверхности, размера кристаллитов и морфологии частиц. Полученные в последнее десятилетие ОВБ этого типа в наносостоянии продемонстрировали улучшенную по сравнению с коммерческими кинетику процесса интеркаляции/деинтеркаляции ионов Mn+ [10]. Вместе с тем, присутствие лития в составе материала катода многократно повышает обратимость этого процесса. Имеются публикации, демонстрирующие высокую подвижность лития в структуре V2O5, однако литиевые ОВБ LixV2O5 обычно получаемые при электрохимическом внедрении Li в V2O5, метастабильны, что ограничивает их использование в качестве катода [10].
Фазы Na0.33V2O5 и Li0.33V2O5 изоструктурны [10, 11], с близкими параметрами элементарных ячеек, поэтому представляется целесообразным использовать в качестве катода ОВБ со смешенным Na/Li катионом. Катионы натрия в структуре ОВБ Na0.33V2O5 обеспечивают термодинамическую стабильность материала, а внедренные в матрицу бронзы катионы Li+ благодаря малому ионному радиусу привносят высокую литиевую проводимость в материал катода. Вместе с тем, работ по изучению электрохимических свойств двойных литий-натриевых бронз Na2 –хLiхV12O30 сравнительно мало [11–15]. Обычно бронзы типа Na2 –хLiхV12O30 получают по традиционной керамической технологии, при этом методе синтеза используют инертную атмосферу [15].
Целью настоящей работы является разработка нового метода синтеза и изучение электрохимических параметров Na0.33 –xLixV2O5 (Na2 –хLiхV12O30). В работе проведено электрохимическое циклирование ячейки Na2 –хLiхV12O30 | электролит на основе гекса-оксометаллата лития | Na2 –хLiхV12O30 с меньшим содержанием лития с целью исследования возможности использования таких бронз в высоко- и среднетемпературных вторичных источниках тока. Также была проведена попытка тестирования ячейки с катодом из Na2 –хLiхV12O30 и расплавленным литиевым анодом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гекса-оксоцирконат лития Li8ZrO6 был получен этиленгликоль-нитратным методом из карбоната лития (Li2CO3; ос. ч.), оксида циркония (ZrO2; х. ч.) с последующим синтезом по керамической технологии. Синтез проводили в герметичном реакторе из жаропрочной стали под вакуумом с периодической продувкой сухим гелием поэтапно в интервале температур от 300 до 980°С [16].
Синтез двойных ОВБ состава Na2 –хLiхV12O30 (0.6 ≤ x ≤ 1.4) осуществляли по прекурсорной технологии. В качестве прекурсоров были использованы полученные по оригинальной методике формиаты натрия, лития NaHCOO·2H2O, LiHCOO·H2O и формиат ванадила VO(HCOO)2·H2O. Формиаты, взятые в стехиометрических соотношениях, растворяли в воде с добавлением 3–4 мл НСООН, и выпаривали досуха. Образующийся кристаллический осадок отжигали на воздухе при 600°С в течение 2 ч.
Рентгенофазовый анализ (РФА) синтезированных образцов проводили на дифрактометре Rigaku DMAX-2200PC (Japan) в фильтрованном СuKα-излучении. Набор первичных данных, анализ фазового состава образцов осуществляли по соответствующим программам c использованием картотеки PDF2.
Керамические образцы материала катода, анода и электролита получали в виде таблеток, диаметром 6 и/или 15 мм. Для этого порошки синтезированных составов прессовали на прессе ПГР-10 под давлением 10 МПа. Затем спекали: двойные литий-натриевые ванадиевые бронзы при 590°С в течение 5 ч на воздухе; электролит Li8ZrO6 – при 900°С в течение 10 ч в реакторе под гелием в засыпке из того же материала. Кажущаяся плотность керамики твердого электролита Li8ZrO6 составила 94–97% от теоретической. Для литий-натриевых ванадиевых бронз, выбранных составов (Li1.4Na0.6V12O30 и Li0.6Na1.4V12O30) она находилась в пределах 85–92%.
Морфологические особенности образцов двойных литий-натриевых ОВБ до и после циклирования исследованы методом сканирующей электронной микроскопии (СЭМ) на микроскопе JEOL JSM 6390 LA (коэффициент увеличения от 5 до 300 000, разрешающая способность 3.0 нм при 30 кВ). Определение их химического состава подтверждалось энергодисперсионным рентгеновским анализом (ЭДР) с использованием анализатора ЕХ-23010BU. Анализ выполнялся по 20 точкам в разных участках образца.
В работе были использованы ячейки, прозванные “кресло-качалка”. Электрохимическая ячейка состояла из литий-ванадиевой бронзы с большим содержанием по литию – Li1.4Na0.6V12O30, предполагаемый анод |ТЭЛ – Li8ZrO6| Li0.6Na1.4V12O30 – катод. В целях избежания дендритообразования, в качестве электролита/сепаратора в работе был использован твердый электролит на основе гекса-оксоцирконата лития Li8ZrO6 с униполярной литий-ионной проводимостью. Кинетическая устойчивость такого электролита и возможность его применения была исследована нами ранее в работах [16–20]. В работе был использован предварительно очищенный путем механической чистки поверхности металлический литий марки ЛЭ-1 99.8%. Все операции очистки лития и сборки ячейки проводились в герметичном боксе с сухой аргоновой атмосферой. Предварительно спеченный образец твердого электролита Li8ZrO6 (плотность более 94% от теоретической) в виде диска толщиной 2–3 мм и диаметром около 15 мм помещали в никелевую пробирку, диаметром 20 мм, высотой 3 мм, в которую помещался металлический литий. Сверху находилась предварительно спеченная таблетка катодного материала ОВБ – Li0.6Na1.4V12O30.
Методами циклической вольтамперометрии и импедансной спектроскопии была исследована электрохимическая система Li1.4Na0.6V12O30|Li8ZrO6|Li0.6Na1.4V12O30 на потенциостате-гальваностате Autolab 302M при температурах 460–560°С. Эксперименты были проведены в атмосфере сухого аргона в специально разработанной ячейке для измерения электрохимических характеристик. Падение напряжения из-за внутреннего сопротивления ячейки определяли методом разрыва по току и импедансной спектроскопией [21]. О наличии или отсутствии взаимодействия на границах электрод | электролит судили по изменению общего сопротивления всей исследуемой системы. Сочетание этих двух методов позволяет правильно интерпретировать годографы импеданса, полученные с помощью импедансной спектроскопии. Циклирование ячеек было выполнено в гальваностатическом режиме при плотностях тока от 1.5 до 6 мА/см2. Годографы импеданса обрабатывались с помощью программы ZView.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе были синтезированы образцы двойных ОВБ состава Na2 –хLiхV12O30 –δ (0.6 ≤ x ≤ 1.4). Методом РФА была установлена их однофазность. На рис. 1 в качестве примера приведены дифрактограмма для литий-замещенной натрий-ванадиевой бронзы Li1.4Na0.6V12O30 и штрих-дифрактограмма для стандарта Na0.33(V2O5) картотеки PDF2.
Рис. 1.
Дифрактограмма фазы состава; а – Li1.4Na0.6V12O30 после синтеза; б – штрих-дифрактограмма для стандарта Na0.33(V2O5) картотеки PDF2 № 01-073-6271.

Гальваностатическим методом с помощью методов импедансной спектроскопии было осуществлено циклирование электрохимической ячейки Li1.4Na0.6V12O30|Li8ZrO6| Li0.6Na1.4V12O30 при температуре 552°С в инертной атмосфере в количестве десяти циклов. На рис. 2а представлены зарядно-разрядные кривые, полученные в гальваностатическом режиме со скоростью 1.5 С (3 мA/см2). С учетом массы катодного материала (таблетки) пропускалось 50 Кл на цикл заряд/разряд. Степень заряда-разряда составляла ~85% от теоретической удельной емкости. Для исследуемой ячейки Li1.4Na0.6V12O30|Li8ZrO6|Li0.6Na1.4V12O30 потенциал разомкнутой цепи составил примерно 0.1 В. Было установлено, что такая электрохимическая ячейка с катодом на основе двойной литий-натриевой ванадиевой бронзы обратимо циклируется. На рис. 2б приведены годографы ячейки Li1.4Na0.6V12O30|Li8ZrO6|Li0.6Na1.4V12O30, снятые после 1-го и 2-го цикла при температуре 552°С. Из результатов видно, что сопротивление всей системы возрастает и ее вольтамперные характеристики изменяются при циклировании. Это может быть связано, во-первых, как с природой интеркаляционного соединения, так и с процессом интеркаляции. Структура электродного материала может подвергаться необратимой реакции при интеркаляции ионов лития и тем самым изменяться с увеличением числа циклов, что может приводить к образованию необратимых фаз [22]. Во-вторых, это может быть так называемая “механическая” причина – потеря электрического контакта в композитном электроде [22].
Рис. 2.
Зрядно-разрядные кривые (а) и годографы импеданса, снятые после 1-го и 2-го цикла (б) для электрохимической ячейки Li1.4Na0.6V12O30|Li8ZrO6|Li0.6Na1.4V12O30 при температуре 552°С.

Нами также было проведено циклирование (50 Кл) ячейки Li|Li8ZrO6|Li0.6Na1.4V12O30 при плотности тока 2 мА/см2 при температуре 502°С в инертной атмосфере. Было совершено 3 цикла заряда–разряда. Показано, что такая электрохимическая система с катодом на основе двойной литий-натриевой ОВБ циклируется, но кривые заряда-разряда не целиком совпадают, что, возможно, связано с взаимодействием на границе электрод | электролит.
На рис. 3 и в табл. 1 представлены микрофотографии, карты распределения элементов и результаты ЭДР-анализа двойных литий-натриевых ОВБ до (рис. 3а) и после (рис. 3б) циклирования. В процессе циклирования массивные кристаллы ОВБ Na2– хLiхV12O30 распадаются на более тонкие пластинчатые агрегаты. Кроме того, было установлено, что до циклирования натрий (литий не определяется энергодисперсионным рентгеновским анализом) равномерно распределен по кристаллитам и содержится в среднем ~4.5 ат. %. После циклирования некоторые области более мелких кристаллитов обедняются до ~1.5 ат. % по натрию, что следует из данных ЭДР-анализа (рис. 3а, 3б). Можно предположить, что в мелких кристаллитах электродного материала после циклирования повышается доля лития, который, вероятно, интеркалируется в Na2– хLiхV12O30. Изменений в фазовом составе образца катода Li1.4Na0.6V12O30 по данным РФА после циклирования не было обнаружено (рис. 4), что, вероятно, связано с тем, что изменение состава фазы происходит в пределах области ее гомогенности. Вышесказанное косвенно свидетельствует о деинтеркаляции/интеркаляции лития в образцах Na2– хLiхV12O30 при сохранении общей структуры.
Рис. 3.
СЭМ-снимки, карта распределения элементов (mapping) и результаты ЭДР-анализа Li1.4Na0.6V12O30 до (а) и после (б) циклирования.
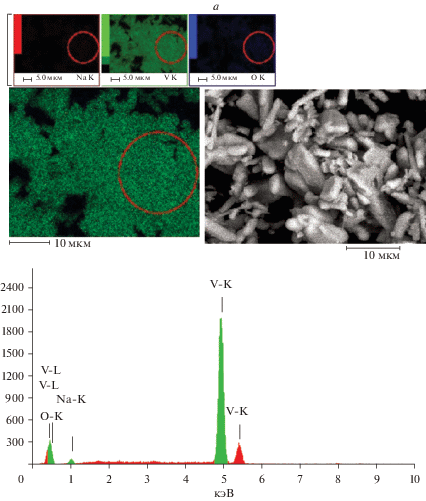
Рис. 3.
Окончание

ЗАКЛЮЧЕНИЕ
В работе впервые получены ОВБ Na2– хLiхV12O30 – δ (0.6 ≤ x ≤ 1.4) при термолизе сложного карбоксилатного комплекса Na2 –хLiх(HCOO)2.[VO(HCOO)2]12·nH2O. Установлено, что бронзы состава Na2 –хLiхV12O30 – δ обратимо интеркалируются по катионам лития при повышенных температурах 460–560°С. Использование двойных литий-натриевых ванадиевых бронз совместно с твердыми электролитами для среднетемпературных источников тока перспективно и требует дальнейших исследований.
Авторы выражают благодарность Шевелину Петру Юрьевичу за проведение циклирования электрохимических ячеек.
Работа выполнена в соответствии с государственным заданием и планами научно-исследовательских работ ИВТЭ и ИХТТ УрО РАН.
Список литературы
McNulty D., D. Buckley N., O’Dwyer C. Synthesis and electrochemical properties of vanadium oxide materials and structures as Li-ion battery positive electrodes // J. Power Sources. 2014. 267. P. 831–873.
Lu Y., Wu J., Liu J., Lei M., Tang Sh., Lu P., Yang L., Yang H., Yang Q. Facile Synthesis of Na0.33V2O5 Nanosheet-Graphene Hybrids as Ultrahigh Performance Cathode Materials for Lithium Ion Batteries // ACS Appl. Mater. Interfaces. 2015. 31. № 7. P. 17 433–17 440.
Song X., Xiao F., Li X., Li Zh. Uniform β-Na0.33V2O5 nanorod cathode providing superior rate capability for lithiumion batteries // Nanotechnology. 2020. 31. P. 094001.
Podval’naya N.V., Volkov V.L. Composition and formation kinetics of sodium polyvanadates in vanadium (IV, V) solutions // Synthesis and Properties of Inorganic Compounds. 2006. 51. № 3. P. 357–361.
Wen J., Zhang Y., Lu Y., Augustyn V., Dunn B., Chen Z., Shen M. High-performance supercapacitors based on intertwined CNT/V2O5 nanowire nanocomposites // Adv. Mater. 2011. 23. № 6. P. 791–795.
Fergus J.W. Recent developments in cathode materials for lithium ion batteries // J. Power Sources. 2010. 195. № 4. P. 939–954.
Dong W., Sakamoto J. and B. Dunn B. Electrochemical properties of vanadium oxide aerogels and aerogel nanocomposites // J. Sol-Gel Sci. Technol. 2003. 26. № 1–3. P. 641–644.
Yan M., He P., Chen Y., Wang S. and ect. Water-lubricated Intercalation in V2O5·nH2O for high-capacity and high-rate aqueous rechargeable zinc batteries // Adv. Mater. 2018. 30. P. 1703725.
Przesniak-Welenc M., Karczewski J., Smalc-Koziorowska J., Łapinski M., Sadowskia W., Koscielska B. The influence of nanostructure size on V2O5 electrochemical properties as cathode materials for lithium ion batteries // RSC Adv. 2016. 6. P. 55689–55697.
Baba M., Kumagai N., Kobayashi H., Nakano O., Nishidate K. Fabrication and electrochemical characteristics of all-solid-state lithium-ion batteries using V2O5 thin films for both electrodes // Electrochem. Solid State Lett. 1999. 2. № 7. P. 320–322.
Bondarenka V., Grebinskij S., Mickevičius S., Tvardauskas H., Kačiulis S., Volkov V., Zakharova G., Pašiškevičius A. Valence of vanadium in hydrated compounds // Lithuanian J. Physics. 2007. 47. № 3. P. 333–342.
Koksharova I.U., Koksharov A.G., Fotiev A.A. Dissolution kinetics of vanadium oxide bronzes M2+ (M2+)V12O30 (M+ = Na, Li; M2+ = Ca, Sr) in acids and alkalies // Inorganic materials. 1996. 32. № 7. P. 775–777.
Shkerin S.N., Gyrdasova O.I., Volkov V.L. Electrode system Ni/NayAlxV12O30 Al3+: an impedance spectroscopy study // Russian J. Electrochemistry. 2002. 38. № 5. P. 496–506.
Zhang W., Xu G., Yang L., Ding J. Ultra-long Na2V6O16·xH2O nanowires: large-scale synthesis and application in binder-free flexible cathodes for lithium ion batteries // RSC. Adv. 2016. 6. № 7. P. 5161–5168.
Нестеров А.А., Клёнушкин А.А., Медведев Б.С. Разработка методов синтеза фаз состава Na0.33 –xLixV2O5 перспективных для создания катодных материалов // Материалы конф. “Фундаментальные и прикладные проблемы современной химии и материаловедения”. 2015. С. 11.
Shchelkanova M.S., Pantyukhina M.I., Kalashnova A.V., Plaksin S.V. Electrochemical properties of Li8 – 2xMxZrO6 (M = Mg, Sr) solid electrolytes // Solid State Ionics. 2016. 290. P. 12–17.
Щелканова М.С., Пантюхина М.И., Шевелин П.Ю., Суслов Е.А. Исследование кинетической устойчивости твердых электролитов из систем Li8 – 2xMxZrO6 (M = Mg, Sr), Li8 –x Zr1 –xVxO6 в расплаве металлического лития // Расплавы. 2014. № 6. С. 90–96.
Пантюхина М.И., Щелканова М.С., Плаксин С.В. Синтез и электрохимические свойства твердых растворов Li8 –xZr1 –xNbxO6 // Физика твердого тела. 2013. 55. № 4. С. 650–652.
Андреев О.Л., Баталов Н.Н. Устойчивость литий-проводящих твердых электролитов по отношению к металлическому литию (термодинамическое моделирование) // Электрохимическая энергетика. 2008. 8. № 2. С. 76–79.
Пантюхина М.И., Шевелин П.Ю., Суслов Е.А., Баталов Н.Н. Синтез И электрохимические свойства литий-ванадиевых бронз LiхV2O5 (х = 0.1, 0.3) // Расплавы. 2018. № 1. С. 125–130.
Bard A.J., Faulkner L.R. Electrochemical methods: Fundamentals and Applications 2001.
Whittingham M.S. Lithium batteries and cathode materials // Chem. Rev. 2004. 104. P. 4271–4301.
Дополнительные материалы отсутствуют.



