Расплавы, 2021, № 4, стр. 354-364
Влияние материала подложки на кинетику и механизм электроосаждения кремния из расплава KCl–KF–K2SiF6
С. И. Жук a, b, *, Т. А. Гевел a, b, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
* E-mail: ZhukSI83@mail.ru
Поступила в редакцию 11.01.2021
После доработки 28.01.2021
Принята к публикации 03.02.2021
Аннотация
В работе методом циклической хроновольтамперометрии изучено влияние материала подложки на кинетику и механизм электроосаждения кремния из (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С. Показано, что на стеклоуглеродном, серебряном и кремниевом электроде электроосаждение кремния протекает в области потенциалов от –0.05 до –0.20 В относительно потенциала кремниевого квазиэлектрода сравнения с формированием пика катодного тока. На основании анализа зависимостей ip(ν1/2) и Ep(ln ν) установлено, что исследуемый процесс на вышеперечисленных электродах протекает в одну стадию в условиях необратимой электрохимической реакции. На никелевом электроде электроосаждение кремния протекает при потенциале отрицательнее 0.20 В относительно потенциала кремниевого квазиэлектрода сравнения с деполяризацией, связанной с формированием соединения Ni2Si. По уравнению Мацуды–Аябэ для электрохимически необратимого процесса оценен коэффициент диффузии электроактивных ионов, который составил от 2.8· 10–5 до 5.8 · 10–5 см2/с в зависимости от материала катодной подложки. На основании электрохимических измерений определены параметры электроосаждения кремния на разных катодных подложках.
ВВЕДЕНИЕ
В настоящее время кремний является важным элементом, используемым в современной электронике [1, 2]. Фотоэлектрические преобразователи и электронные устройства лишь часть сфер возможного применения кремния. Одним из перспективных методов получения кремния и кремнийсодержащих композиционных материалов с заданным составом и морфологией является электроосаждение из расплавов солей.
Существует ряд работ, направленных на изучение закономерностей электроосаждения кремния из расплавленных галогенидов щелочных металлов при разных температурах, в которых источником кремния служат гексафторсиликат кремния, оксид кремния, монокристаллический или металлургический кремний и ряд других соединений [3–8]. Перспективными являются способы получения кремния из водорастворимых систем KF–KCl–K2SiF6 при температуре 700–750°С кинетика и механизм электроосаждения кремния из которых на углероде хорошо изучен [9–17].
Наряду с элементарным кремнием интерес представляют и материалы на его основе, а именно кремниевые порошки, волокна, пленки, а также кремний-металлические композиты и многослойные системы. В этой связи остро встает вопрос о влиянии на процесс электроосаждения и электрокристаллизации кремния не только состава галогенидного расплава и условий поляризации, но и природы материала подложки. Использование различных подложек, в том числе, взаимодействующих с кремнием, может открыть возможности получения кремниевых материалов с новыми свойствами с целью их применения в новых устройствах преобразования и накопления энергии. Так, интерес могут представлять такие подложки как медь, никель и серебро, являющиеся хорошими электрическими проводниками тока.
Целью данной работы было изучение влияния материала подложки на кинетику и механизм электроосаждения кремния из расплава (мол. %) 66.51KF–33.26KCl–0.23K2SiF6. Ранее в работе [14] были проведены работы, направленные на изучение возможности электроосаждения кремния на стеклоуглероде, графите, серебре, никеле и вольфраме, в то время как внимание механизму и кинетике электроосаждения кремния уделено не было.
ЭКСПЕРИМЕНТ
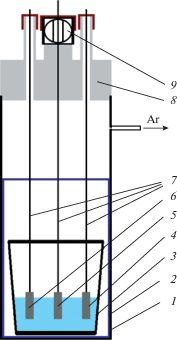
Эксперименты проводили в закрытой кварцевой трехэлектродной ячейке в атмосфере аргона, схема которой изображена на рис. 1. Контейнером для электролита служил стеклоуглеродный тигель. Для предотвращения взаимодействия кварцевой ячейки с возгонами использовали экран из никелевого листа толщиной 0.7 мм. Для сохранения инертной атмосферы при смене электрода было предусмотрено шлюзовое устройство. В качестве электрода сравнения и вспомогательного электрода использовали монокристаллический кремний (99.99%, Китай). В качестве рабочего электрода использовали полупогруженные стеклоуглеродные, серебряные, кремниевые и никелевые пластинки размерами 10 × 1 × 5 мм, которые перед измерениями полировали.
Рис. 1.
Схема экспериментальной ячейки: 1 – кварцевая ячейка, 2 – никелевый экран, 3 – стеклоуглеродный стакан, 4 – вспомогательный электрод, 5 – рабочий электрод, 6 – электрод сравнения, 7 – молибденовый токоподвод, 8 – фторопластовая крышка ячейки, 9 – шлюзовое устройство.
Кинетику электровосстановления кремния изучали в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6. Для приготовления электролита использовали KF·HF марки х. ч. и KCl марки о. с. ч., а также K2SiF6 марки ч. д. а; KF·HF предварительно нагревали в тигле до температуры 280°С, выдерживали до удаления HF из смеси, далее плавили и охлаждали. С целью фторирования оксидных примесей K2SiF6 смешивали с NH4F в соотношении 50 : 1 в массовом отношении, нагревали до 300°С и выдерживали в течение 5 ч. Приготовленные реагенты до проведения эксперимента хранили в эксикаторе.
Перед экспериментом соли смешивали, загружали в стеклоуглеродный тигель и помещали в экспериментальную ячейку. Смесь нагревали до 750°С и в течение 2–3 ч вели очистной электролиз с нерастворимым графитовым анодом при потенциале 1.3 В относительно кремниевого электрода сравнения для удаления примесей. Температуру в измерительной ячейке контролировали при помощи термопары S-типа и термопарного модуля USB-TC01 (National Instruments, США).
Для регистрации циклических хроновольтамперограмм использовали PGSTAT AutoLab 302N с ПО Nova 1.11 (MetrOhm, Нидерланды). Омическое падение напряжения в измерительной цепи определяли методом импеданса и компенсировали его с помощью Nova 1.11.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 2 и 3 приведены типичные хроновольтамперограммы, полученные на стеклоуглероде и серебре в расплаве KF–KCl–K2SiF6 при температуре 750°С и скорости развертки потенциала от 0.1 до 0.5 В/с. На представленных зависимостях виден один катодный и один анодный пик восстановления и окисления кремния, указывающие на то, что электровосстановление кремния в условиях эксперимента протекает в одну стадию. Ситуация не меняется и при повышении скорости развертки потенциала до 1.5 В/с.
Рис. 2.
Циклические хроновольтамперограммы, полученные на стеклоуглероде в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С и скоростях развертки 0.1; 0.2; 0.3; 0.4; 0.5 В/с.
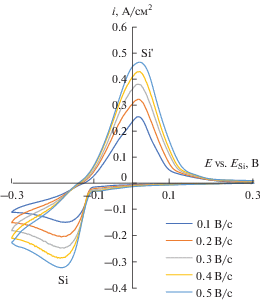
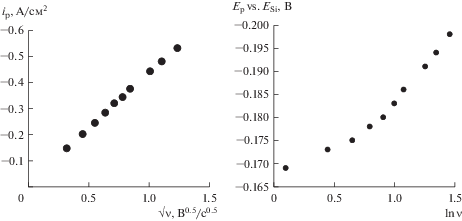
Рис. 3.
Зависимости ip–ν0.5 и Ep–ln ν, полученные на стеклоуглероде в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С в результате вольтамперных измерений.
Заметно, что пики катодной плотности тока на стеклоуглеродном электроде в 1.2–1.5 раза больше пиков катодной плотности тока на серебряном электроде. Это можно объяснить тем фактом, что поверхность серебра свободна от оксидных соединений, которые при температуре эксперимента разлагаются [18]. В свою очередь поверхность стеклоуглеродного электрода может быть покрыта нестехиометрическими соединениями углерода и кислорода CxO [19, 20], которые могут облегчить разряд ионов Si4+ за счет формирования промежуточных соединений SiyO.
Рис. 4.
Циклические хроновольтамперограммы, полученные на серебре в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С и скоростях развертки 0.1; 0.2; 0.3; 0.4; 0.5 В/с.
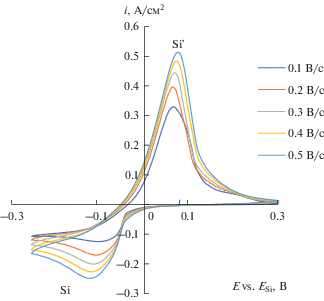
Рис. 5.
Зависимости ip–ν0.5 и Ep–ln ν, полученные на серебре в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С в результате вольтамперных измерений.
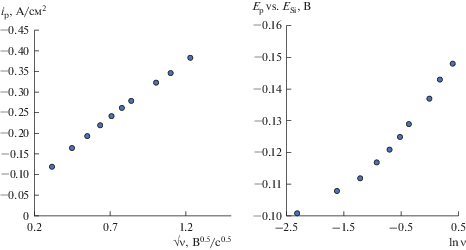
На рис. 6 приведены циклические хроновольтамперограммы, полученные на кремниевом электроде. На кремниевом электроде также регистрируется один катодный пик Si, связанный с электровосстановлением кремния. На обратной развертке заметен анодный пик Si' и дальнейшее возрастание анодного тока при смещении потенциала в область положительных значений. Анодный пик связан с растворением кремния, осажденного во время прямой развертки тока, поскольку последний является энергетически менее устойчивым. Возрастание анодного тока при дальнейшем смещении потенциала электрода в область положительных значений (волна Si ") обусловлено анодным растворением кремниевой подложки.
Рис. 6.
Циклические хроновольтамперограммы, полученные на кремнии в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С и скоростях развертки 0.1; 0.2; 0.3; 0.4; 0.5 В/с.
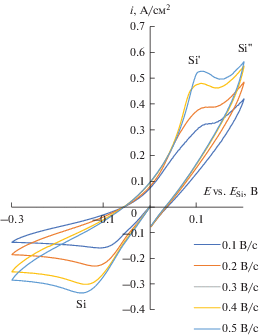
Стоит отметить, что на стеклоуглеродном, серебряном и кремниевом электроде потенциал пика катодной плотности тока при увеличении скорости развертки потенциала смещается в отрицательную область. Нелинейная зависимость потенциала пика катодной плотности тока от логарифма скорости развертки потенциала в интервале скоростей развертки от 0.1 до 1.0 В/с позволяет сделать вывод о квазиобратимом характере электрохимической реакции электровсстановления кремния в таких условиях [21]. Наличие одного пика катодной плотности тока позволяет сделать вывод, что электроосаждение кремния на этих подложках протекает по реакции:
Рис. 7.
Зависимости ip–ν0.5 и Ep–ln ν, полученные на кремнии в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С в результате вольтамперных измерений.
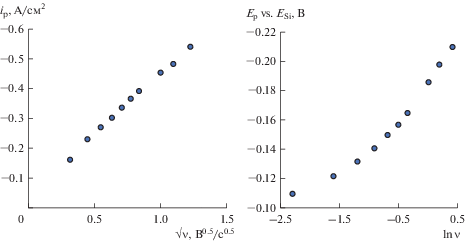
На циклических хроновольтамперограммах, полученных на никелевом электроде (рис. 8), имеется пик катодной плотности тока NiSi и катодная волна Si, которые могут быть связаны с образованием соединения Ni2Si по реакции:
(2)
${\text{S}}{{{\text{i}}}^{{4 + }}} + 4{\text{e}} + {\text{Ni}} = {\text{N}}{{{\text{i}}}_{2}}{\text{Si}},$Рис. 8.
Циклические хроновольтамперограммы, полученные на никеле в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С и скоростях развертки 0.1; 0.2; 0.3; 0.4; 0.5 В/с.
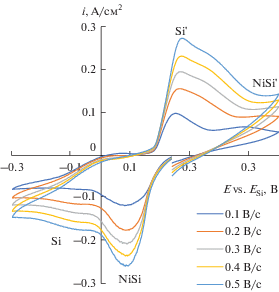
Рис. 9.
Зависимости ip–ν0.5 и Ep–ln ν, полученные на никеле в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С в результате вольтамперных измерений.
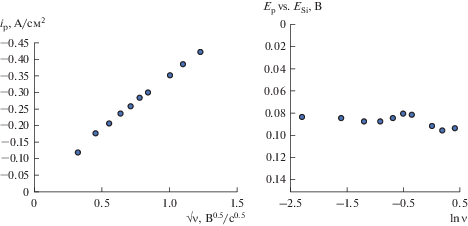
Из хроновольтамперограмм, полученных на стеклоуглероде, кремнии и серебре, была произведена оценка коэффициента диффузии кремнийсодержащих ионов в ходе электролиза расплава KF–KCl–K2SiF6 при температуре 750°С. В интервале скоростей развертки от 1 до 1.5 В/с на указанных подложках обратимые электрохимические процессы не реализуются. Подтверждением этого является то, что с увеличением скорости развертки происходит сдвиг потенциала пика. Поэтому для оценки коэффициента диффузии применимо уравнение Мацуды–Аябэ для необратимого электрохимического процесса [21]:
(3)
${{i}_{{\text{p}}}} = 0.496zF(\alpha zF){1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{(RT)}^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}C{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\nu }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$В оценочных расчетах нами было принято, что значение коэффициента переноса равно 0.5, и электрохимический процесс является необратимым. Расчет проводили для подложек, не взаимодействующих с кремнием – серебро, кремний и стеклоуглерод.
Результаты расчетов приведены в табл. 1. Заметно, что рассчитанные значения для серебрянного электрода существенно отличаются от значений, полученных для стеклоуглеродного и кремниевого электрода, что может быть свидетельством более сложного механизма электровосстановления кремния на серебре. Одним из факторов, оказывающих влияние на этот процесс, может являться зарождение кремниевых кластеров на поверхности серебра.
Таблица 1.
Коэффициенты диффузии кремнийсодержащих электроактивных ионов в расплаве (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С
| ν, В/с | D · 105, см2/с | ||
|---|---|---|---|
| СУ | Si | Ag | |
| 1.0 | 5.61 | 5.84 | 2.96 |
| 1.2 | 5.51 | 5.51 | 2.83 |
| 1.5 | 5.39 | 5.53 | 2.77 |
Исходя из полученных данных, можно сделать вывод, что электроосаждение кремния на кремнии, серебре и стеклоуглероде следует вести при плотностях катодного тока ниже 0.15 А/см2 и при потенциалах отрицательнее –0.1 В относительно кремниевого электрода. Так как при плотности катодного тока 0.15 А/см2 в исследуемой системе не достигаются острые диффузионные ограничения, что позволяет получать однородные хорошо сцепленные осадки. Полученные данные необходимы для выбора параметров и разработки способов электроосаждения кремния и материалов на его основе управляемой морфологии из расплавленных солей на различных подложках.
ВЫВОДЫ
В работе методом циклической хроновольтамперометрии исследована кинетика и некоторые особенности механизма электроосаждения кремния из расплава (мол. %) 66.51KF–33.26KCl–0.23K2SiF6 при температуре 750°С на стеклоуглероде, кремнии, серебре и никеле. Установлено, что процесс электроосаждения кремния на стеклоуглероде, серебре и кремнии протекает в одну 4-х электронную стадию. На стеклоуглероде, серебре и кремнии электровосстановление кремния протекает в условиях квазиобратимой электрохимической реакции в одну стадию. Электровосстановление кремния на никеле протекает с деполяризацией, вызванной образованием соединения Ni2Si.
По уравнению Мацуды–Аябе для электрохимически необратимого процесса при скоростях развертки потенциала выше 1 В/с были оценены значения коэффициента диффузии электроактивных ионов кремния к катодам из серебра, стеклоуглерода и кремния, которые составили 2.8 ⋅ 10–5–2.9 ⋅ 10–5 см2/с для серебра и 5.3 ⋅ 10–5–5.8 ⋅ 10–5 см2/с для стеклоуглерода и кремния, соответственно. Предположено, что меньшие значения коэффициента диффузии электроактивных ионов кремния к серебряному катоду могут являться результатом влияния фазозарождения на кинетику электроосаждения кремния на данном электроде.
Работа выполнена в рамках бюджетного финансирования (тема АААА-А16-116051110162-3).
Список литературы
Ren W., Zhou Y., Li J.-T., Huang L., Sun Sh.-G. Si anode for next-generation lithium-ion battery // Current Opinion in Electrochem. 2019. 18. P. 46–54.
Liu Z., Sofia S.E., Laine H.S., Woodhouse M., Wieghold S., Peters, I.M., Buonassisi T. Revisiting thin silicon for photovoltaics: A technoeconomic perspective // Energy and Environmental Science. 2020. 13. P. 12–23.
Juzeliunas E., Fray D.J. Silicon electrochemistry in molten salts // Chemical Reviews. 2020. 120. P. 1690–1709.
Sakanaka Y., Murata A., Goto T., Hachiya K. Electrodeposition of porous Si film from SiO2 in molten BaCl2–CaCl2–NaCl // J. Alloys and Comp. 2017. 695. P. 2131–2135.
Zou X., Ji L., Yang X., Lim T., Yu E.T., Bard A.J. Electrochemical formation of a p–n junction on thin film silicon deposited in molten salt // J. Am. Chem. Soc. 2017. 139. P. 16 060–16 063.
Bieber A.L., Massot L., Gibilaro M., Cassayre L., Taxil P., Chamelot P. Silicon electrodeposition in molten fluorides // Electrochim. Acta. 2012. 62. P. 282–289.
Кузнецова С.В., Долматов B.C., Кузнецов С.А. Вольтамперометрическое исследование электровосстановления комплексов кремния в хлоридно-фторидном расплаве // Электрохимия. 2009. 45. С. 797–803.
Rao G.M., Elwell D., Feigelson R.S. Electrodeposition of silicon onto graphite // J. Electrochem. Soc. 1981. 128. № 8. P. 1708–1711.
Laptev M.V., Isakov A.V., Grishenkova O.V., Vorob’ev A.S., Khudorozhkova A.O., Akashev L.A., Zaikov Yu.P. Electrodeposition of thin silicon films from the KF–KCl–KI–K2SiF6 melt // J. Electrochem. Soc. 2020. 167. № 4. 042506.
Зайков Ю.П., Исаков А.В., Аписаров А.П., Чемезов О.В. Получение кремния электролизом галогенидных и оксидно-галогенидных расплавов // Цветные металлы. 2013. № 2. С. 58–62.
Maeda K., Yasuda K., Nohira T., Hagiwara R., Homma T. Silicon electrodeposition in water-soluble KF–KCl molten salt: Investigations on the reduction of Si(IV) ions // J. Electrochem. Soc. 2015. 162. № 9. P. D444–D448.
Зайков Ю.П., Жук С.И., Исаков А.В., Гришенкова О.В., Исаев В.А. Электроосаждение кремния из расплава KF–KCl–KI–K2SiF6 // Расплавы. 2016. № 5. С. 441–454.
Фроленко Д.Б., Мартемьянова З.С., Барабошкин А.Н., Плаксин С.В. Электроосаждение кремния из фторидно-хлоридных расплавов // Расплавы. 1993. № 5. С. 42–49.
Zhuk S.I., Isakov A.V., Apisarov A.P., Grishenkova O.V., Isaev V.A., Vovkotrub E.G., Zaykov Y.P. Electrodeposition of continuous silicon coatings from the KF–KCl–K2SiF6 melts // J. Electrochem. Soc. 2017. 164. № 8. P. H5135–H5138.
Yasuda K., Maeda K., Nohira T., Hagiwara R., Homma T. Silicon electrodeposition in water-soluble KF–KCl molten salt: Optimization of electrolysis conditions at 923 K // J. Electrochem. Soc. 2016. 163. № 3. P. D95–D99.
Худорожкова А.О., Исаков А.В., Катаев А.А., Редькин А.А., Зайков Ю.П. Плотность расплавов KF–KCl–KI // Расплавы. 2020. № 3. С. 291–301.
Гевел Т.А., Жук С.И., Устинова Ю.А., Суздальцев А.В., Зайков Ю.П. Электровыделение кремния из расплава KCl–K2SiF6 // Расплавы. 2021. № 2. Р. 187–198.
Turkdogan E.T. Physical chemistry of high-temperature technology, Academic Press, NY., 1980.
Некрасов В.Н., Лимановская О.В., Суздальцев А.В., Зайков Ю.П., Храмов А.П. Хронопотенциометрия на углеродном аноде в расплавах KF–AlF3–Al2O3 // Расплавы. 2011. № 2. С. 18–29.
Лебедев А.С., Суздальцев А.В., Фарленков А.С., Поротникова Н.М., Акашев Л.А., Вовкотруб Э.Г., Анфилогов В.Н. Карботермический синтез, свойства и структура SiC // Неорганические материалы. 2020. № 1. С. 22–29.
Bard A.J., Faulkner L.R. Electrochemical methods: fundamentals and applications, 2nd ed. – John Wiley & Sons. N.Y., 2001.
Дополнительные материалы отсутствуют.


