Расплавы, 2022, № 1, стр. 49-60
Электроосаждение кремния из расплавов на основе легкоплавкой системы LiCl–KCl–CsCl
О. Б. Павленко a, b, *, Ю. А. Устинова a, С. И. Жук a, b, А. В. Суздальцев a, b, Ю. П. Зайков a, b
a Уральский федеральный университет
Екатеринбург, Россия
b Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: pavlenko.olga@urfu.ru
Поступила в редакцию 01.09.2021
После доработки 21.09.2021
Принята к публикации 29.09.2021
- EDN: HWAIPL
- DOI: 10.31857/S0235010622010066
Аннотация
В работе изучена возможность применения систем LiCl–KCl–CsCl–LiF–K2SiF6 и LiCl–KCl–CsCl–K2SiF6 для электролитического получения кремния. Методом вольтамперометрии изучена кинетика электровыделения кремния на стеклоуглероде при температуре 480–550°С. Установлено, что электроосаждения кремния в условиях эксперимента протекают в одну 4-х электронную стадию и не является электрохимически обратимым. По результатам электрохимических измерений оценены коэффициенты диффузии ионов кремния в расплавах на основе системы LiCl–KCl–CsCl, которые составили 3.2 · 10–5 и 7.2 · 10–6 см2/с при температуре 480 и 550°С, соответственно, а также выбраны условия электроосаждения кремния. Исследована структура и морфология осадков кремния, полученных в потенциостатических условиях. Показано, что при уменьшении концентрации хлорида лития в расплаве происходит формирование осадков кремния от дендритов до волокон.
ВВЕДЕНИЕ
Благодаря распространенности и свойствам, кремний широко применяется в микро- и наноэлектронике, солнечной энергетике, для изготовления полупроводниковых элементов, фотосенсоров и в других областях. В последнее время активно ведутся теоретические и экспериментальные исследования, направленные на разработку литий-ионных аккумуляторов с анодом на основе кремния, поскольку кремний в сравнении с углеродом обладает большей теоретической емкостью по литию [1]. Однако применимость кремния в той или иной области определяется структурой, морфологией и чистотой кремния. Задачами современных научных работ являются синтез нано- и микроразмерных волокон кремния с воспроизводимыми структурными характеристиками [2], тонких пленок высокочистого кремния заданной морфологии, а также синтез кремния с контролируемым содержанием микропримесей элементов III или V группы периодической таблицы элементов [3].
Перспективными являются способы электролитического получения нано- и микроразмерного кремния из расплавленных смесей галогенидов щелочных и щелочноземельных металлов с добавками соединений кремния (K2SiF6, SiO2, Na2SiF6, SiCl4) [2–20], характеризующиеся относительно низкими температурами (550–850°С), простотой исполнения и возможностью управляемого синтеза кремния с заданной структурой, размерами и содержанием примесей. Так, в зависимости от условий электролиза и состава расплавленного электролита при электролизе могут быть получены сплошные осадки [2, 5, 6], в том числе тонкие пленки (до 450 нм) [10], микрокристаллические дендриты, нано- и микроразмерные волокна [4, 7–9, 12]. Наибольшее распространение для электроосаждения и электрорафинирования кремния получили расплавы на основе систем KF–KCl, в которые добавляют K2SiF6 и SiO2 [5–11]. Несмотря на возможность относительно простого отделения полученного кремния от водорастворимого электролита (KF–KCl), применение таких расплавов сопровождается разрушительным воздействием KF на материалы электролизера, требует относительно высокой рабочей температуры процесса (690–780°С) и, как результат, характеризуется низкой термической устойчивостью соединений кремния в расплаве. Также необходимо удаление примесей типа Н2О, НF из KF при подготовке расплавленной смеси KF–KCl.
Для снижения агрессивности электролита и температуры процесса, а также с целью повышения чистоты получаемого кремния могут быть использованы электролиты на основе легкоплавких хлоридов щелочных металлов.
В данной работе исследована возможность электроосаждения кремния из расплавов на основе легкоплавкой системы LiCl–KCl–CsCl с добавкой K2SiF6 при температурах 480–550°С.
Эвтектика LiCl–KCl–CsCl с температурой плавления около 260°С [21] ранее была использована для получения аммиака [22], электроосаждения лантаноидов [23] и электрорафинирования урана [24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление расплавов
Расплавы LiCl–KCl–CsCl для электрохимических измерений и электролизных испытаний готовили из индивидуальных реагентов LiCl квалификации х. ч., KCl квалификации х. ч. и CsCl квалификации о. с. ч. (АО “Вектон”, Россия, СПб), которые нагревали в условиях вакуума, плавили в атмосфере аргона и затем подвергали зонной перекристаллизации [25]. Полученные хлориды после зонной перекристаллизации смешивали в заданных пропорциях в аргоновом перчаточном боксе (ЗАО “Спектроскопические системы”, Россия) с контролируемым содержанием примесей (влага и кислород – до 0.1 ppm) и переплавляли в стеклоуглеродном тигле при температуре 800°С. Состав полученной солевой смеси контролировали путем спектрального анализа образца смеси и по значению температуры ликвидуса расплава, которую определяли термическим анализом и методом дифференциальной сканирующей калориметрией (ДСК) на синхронном термоанализаторе STA 449F1 Jupiter (NETZSCH, Германия).
В качестве кремнийсодержащей добавки использовали K2SiF6 квалификации х. ч. (АО “Вектон”, Россия), который предварительно очищали от кислородсодержащих примесей и влаги HF-фторированием: K2SiF6 смешивали с NH4F, поэтапно нагревали до 450°С и выдерживали при данной температуре в течение 6 ч [10]. Очищенный K2SiF6 хранили в перчаточном боксе и добавляли в расплав LiCl–KCl–CsCl непосредственно перед измерениями. Время и полноту растворения навески K2SiF6 определяли в отдельных экспериментах по изменению содержания кремния после ее загрузки в расплав.
Экспериментальная установка
Эксперименты проводили в перчаточном боксе с атмосферой аргона в герметичной кварцевой реторте, которую размещали в печи сопротивления. Схема реторты указана на рис. 1.
Рис. 1.
Схема экспериментальной ячейки: 1 – термопара; 2 – пробки из вакуумной резины; 3 – фторопластовая крышка; 4 – кварцевая реторта; 5 – уровень расплава внутри стакана; 6 – стеклоуглеродный тигель; 7 – рабочий электрод (стеклоуглерод); 8 – электрод сравнения (Si); 9 – вспомогательный электрод (Si); 10 – молибденовые токоподводы; 11 – расплав.
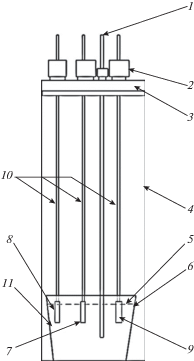
Стеклоуглеродный тигель 6 с исследуемым электролитом размещали на дне кварцевой реторты 4, которую закрывали фторопластовой крышкой со штуцерами 3, в которых при помощи резиновых пробок 2 крепили термопару 1, стеклоуглеродный рабочий электрод 7, кремниевый противоэлектрод 9 и кремниевый квазиэлектрод сравнения 8. Фотографии электродов приведены на рис. 2. Токоподводы к рабочему электроду и противоэлектроду, а также потенциалосъемник электрода сравнения выполняли из молибденовых стержней диаметром 3 мм, которые экранировали кварцевыми трубками для защиты от вероятных возгонов солей.
Рис. 2.
Электроды для исследования: а – стеклоуглеродный рабочий электрод в графитовой втулке; б – кремниевый противоэлектрод; в – кремниевый квазиэлектрод сравнения.

Температуру печи и расплава задавали и контролировали при помощи термопары S-типа, терморегулятора “Варта ТП-703” и термопарного модуля USB-ТС01 (National Instruments, США).
Электрохимические измерения
Параметры и закономерности электроосаждения кремния из исследуемого расплава исследовали методом циклической вольтамперометрии, после чего проводили электроосаждение кремния на стеклоуглероде в потенциостатическом режиме. Для измерений и электролиза использовали потенциостат-гальваностат AutoLAB 302N c ПО Nova 1.11 (The Metrohm, Нидерланды) с пределом по току 1 А. С целью определения и компенсации омического падения напряжения измерительной цепи использовали процедуру прерывания тока (I-Interrupt).
Анализ катодных осадков
После проведения электролиза осадки извлекали из расплава, остужали и затем очищали от электролита путем многократной промывки в дистиллированной воде в условиях ультразвукового диспергирования с использованием диспергатора SONOPULS UW mini 20 (Bandelin Electronic GmbH, Германия). Содержание кремния, основных и примесных элементов в расплаве до и после электрохимических измерений и электролиза определяли спектрально-эмиссионным методом с использованием спектрометра iCAP 6300 Duo (Thermo scientific, США). Структуру и элементный состав катодного осадка определяли на сканирующем электронном микроскопе Tescan Vega 4LMS (TESCAN, Чехия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты хроновольтамперных измерений
Предварительные электрохимические измерения и попытки электроосаждения кремния были проведены из расплава эвтектического состава (мас. %) 30.3LiCl–15.3KCl–54.4CsCl с добавкой 1 мас. % K2SiF6 (0.13 мас. % кремния) при температуре 300–350°С, однако плотность тока электроосаждения кремния в данной системе не превышала 1 мА/см2, а содержание кремния в расплаве после электролиза составило 0.02 мас. %. Такой результат может быть обусловлен относительной термической устойчивостью K2SiF6 и низкими константами скоростей обменных реакций K2SiF6 с компонентами расплава при 300°С.
Для повышения усвоения кремния хлоридным расплавом следующие серии измерений были выполнены в расплаве с добавкой фтор-ионов, а также в расплаве с повышенным содержанием катионов щелочного металла большего радиуса (цезия), которые увеличивают комплексообразующую способность кремния (энергию связей в комплексных анионах ${\text{MeF}}_{x}^{{z - }}$) [26]. А именно,
– в расплаве эвтектического состава (мас. %) 30.3LiCl–15.3KCl–54.4CsCl с добавками 1 мас. % LiF и 0.05 мас. % K2SiF6 при повышенной температуре (480°С);
– в расплаве (мас. %) 8.7LiCl–9.8KCl–81.5CsCl (tликв = 436°С) с добавкой 1.17 мас. % K2SiF6 при температуре 550°С.
На рис. 3 показаны циклические хроновольтамперограммы, характеризующие кинетику электроосаждения и электроокисления кремния на стеклоуглероде в расплаве LiCl–KCl–CsCl–LiF–K2SiF6 при температуре 480°С и скорости развертки потенциала от 0.01 до 1 В/с.
Рис. 3.
Циклические хроновольтамперограммы на стеклоуглероде в расплаве (мас. %) 30.3LiCl–15.3KCl–54.4CsCl–1LiF–0.05K2SiF6 при 480°С и скоростях развертки потенциала от 0.01 до 1.0 В/с.

Электровосстановление ионов кремния начинается при потенциалах отрицательнее –0.1 В относительно потенциала кремниевого квазиэлектрода сравнения, при этом в области потенциалов около –0.3 В формируется один четкий пик электровосстановления. При увеличении скорости развертки потенциала с 0.01 до 1 В/с потенциал пика электровосстановления ионов кремния смещается с –0.25 до –0.34 В. Это указывает на то, что исследуемый катодный процесс не является электрохимически обратимым. На анодной ветви хроновольтамперограмм имеется один четкий пик электроокисления кремния, потенциал которого при повышении скорости развертки смещается в область положительных значений.
Из представленных зависимостей можно предположить, что электроосаждение кремния протекает в одну стадию по реакции (1):
На рис. 4 показаны циклические хроновольтамперограммы, характеризующие кинетику электроосаждения и электроокисления кремния на стеклоуглероде в расплаве LiCl–KCl–CsCl–K2SiF6 при температуре 550°С и скорости развертки потенциала от 0.01 до 1.5 В/с.
Рис. 4.
Циклические хроновольтамперограммы на стеклоуглероде в расплаве (мас. %) 8.7LiCl–9.8KCl–81.5CsCl–1.17K2SiF6 при 550°С и скоростях развертки потенциала от 0.01 до 1.5 В/с.

Электровосстановление ионов кремния начинается при потенциалах отрицательнее –0.3 В относительно потенциала кремниевого квазиэлектрода сравнения. При увеличении скорости развертки потенциала с 0.1 до 1.5 В/с потенциал пика электровосстановления ионов кремния смещается от –0.42 до –0.5 В. Это указывает на то, что исследуемый процесс не является электрохимически обратимым, при этом электроосаждение кремния протекает в одну стадию по реакции (1).
Оценка коэффициента диффузии ионов кремния
На основании проведенных электрохимических измерений были оценены коэффициенты диффузии ионов кремния по уравнениям для обратимого процесса с осаждением твердого осадка и необратимого электрохимического процесса [27]:
(2)
${{I}_{{\text{p}}}} = 0.611 \cdot {{(zF)}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}{{(RT)}^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}Sc{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\nu }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$(3)
${{I}_{{\text{p}}}} = 0.496 \cdot zF{{(\alpha \cdot zF)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{(RT)}^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}Sc{{D}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\nu }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Мольную концентрацию ионов кремния рассчитывали по формуле $С_{{{\text{Si}}}}^{{\text{o}}}$ = ωiρ/Mi, где ωi – массовая доля K2SiF6; ρ – плотность расплава, г/см3; Мi – молярная масса K2SiF6, г/моль.
Результаты оценки приведены в табл. 1. Значения коэффициентов диффузии, оцененные по уравнению (3), составили 3.2 · 10–5 и 7.2 · 10–6 см2/с при температуре 480 и 550°С, соответственно. Там же для сравнения приведены значения коэффициентов диффузии ионов кремния в расплаве KF–KCl–K2SiF6 при 750°С.
Таблица 1.
Коэффициенты диффузии ионов кремния в расплавах на основе систем LiCl–KCl–CsCl и KF–KCl
| Расплав, мас. % | $C_{{{\text{Si}}}}^{{\text{o}}}$, моль/см3 | t, °С | ρ, г/см3 | DSi, см2/с | |
|---|---|---|---|---|---|
| ур. (2) | ур. (3) | ||||
| 30.3LiCl–15.3KCl–54.4CsCl–1LiF + + 0.05K2SiF6 | 5.43 · 10–6 | 480 | 2.37 [28] | 8.22 · 10–6 | 3.2 · 10–5 |
| 8.7LiCl–9.8KCl–81.5CsCl + 1.17K2SiF6 | 1.42 · 10–4 | 550 | 2.65 [28] | 2.4 · 10–6 | 7.2 · 10–6 |
| 60.4KF–38.8KCl + 0.8K2SiF6 | 6.65 · 10–5 | 750 | 1.83 | 2.4 · 10–6 [2] | 5.5 · 10–6 [2] |
Стоит отметить, что значения коэффициентов диффузии оценены для процесса, протекающего в условиях диффузионных затруднений, хотя отсутствие обратимости исследуемого процесса может быть связано с замедленным разрядом кремния из прочных кремнийсодержащих комплексных анионов, а также замедленными химическими реакциями в расплаве.
Электролизные испытания
На основании электрохимических измерений для электроосаждения кремния из расплавов LiCl–KCl–CsCl–LiF–K2SiF6 и LiCl–KCl–CsCl–K2SiF6 были выбраны следующие параметры: потенциостатический электролиз при потенциале –0.4 В относительно потенциала кремниевого квазиэлектрода сравнения и температуре от 480 до 550°С.
На рис. 5 представлены микрофотографии осадка кремния, полученного на стеклоуглеродном электроде в результате 10-часового электролиза расплава 30.3LiCl–15.3KCl–54.4CsCl–1LiF с добавкой 0.05K2SiF6. Видно, что полученный кремний представлен дендритами разветвленной формы длиной 10–20 мкм и толщиной 0.5–2 мкм.
Рис. 5.
Микрофотографии осадка кремния, полученного на стеклоуглероде при электролизе расплава (мас. %) 30.3LiCl–15.3KCl–54.4CsCl–1LiF–0.05K2SiF6. Температура 480°С, длительность – 10 ч.

На рис. 6 представлены SEM-микрофотографии осадка кремния, полученного на стеклоуглеродном электроде в результате 3-часового электролиза расплава 8.7LiCl–9.8KCl–81.5CsCl с добавкой 1.17K2SiF6. В данном случае были получены упорядоченные волокна кремния воспроизводимой структуры с толщиной от 1 до 10 мкм.
Рис. 6.
Микрофотографии осадка кремния, полученного на стеклоуглероде при электролизе расплава (мас. %) 8.7LiCl–9.8KCl–81.5CsCl–1.17K2SiF6. Температура 550°С, длительность – 3 ч.

Таким образом, полученные в работе результаты указывают на принципиальную возможность использования легкоплавких расплавов на основе системы LiCl–KCl–CsCl с добавками K2SiF6 для электролитического получения дендритов и волокон кремния с управляемой структурой.
ВЫВОДЫ
В работе изучена возможность применения систем LiCl–KCl–CsCl–LiF–K2SiF6 и LiCl–KCl–CsCl–K2SiF6 для электролитического получения кремния. Методом циклической вольтамперометрии изучена кинетика электровосстановления ионов кремния на стеклоуглероде при температуре 480–550°С. На основании полученных результатов показано, что исследуемый процесс протекает в одну 4-х электронную стадию и не является электрохимически обратимым, поскольку при повышении скорости развертки потенциала потенциал пика электровосстановления ионов кремния смещается в область отрицательных значений.
По результатам электрохимических измерений оценены коэффициенты диффузии ионов кремния в расплавах на основе системы LiCl–KCl–CsCl, которые составили 3.2 · 10–5 и 7.2 · 10–6 см2/с при температуре 480 и 550°С соответственно, а также выбраны условия электроосаждения кремния.
В потенциостатическом режиме (при потенциале –0.4 В относительно потенциала кремниевого квазиэлектрода сравнения) проведено электроосаждение кремния из расплавов LiCl–KCl–CsCl–LiF–K2SiF6 и LiCl–KCl–CsCl–K2SiF6 при температуре 480 и 550°С, соответственно. В результате были получены осадки кремния в виде дендритов и волокон, в том числе, с воспроизводимой структурой.
Работа выполнена в рамках соглашения № 075-03-2020-582/1 от 18.02.2020 (номер темы 0836-2020-0037). Спектральный анализ и дифференциальная сканирующая калориметрия образцов электролитов были выполнены с использованием оборудования и методик ЦКП “Состав вещества” Института высокотемпературной электрохимии УрО РАН.
Список литературы
Galashev A.Y., Vorob’ev A.S. First principle modeling of a silicene anode for lithium ion batteries // Electrochimica Acta. 2021. 378. P. 138143.
Зайков Ю.П., Жук С.И., Исаков А.В., Гришенкова О.В., Исаев В.А. Электроосаждение кремния из расплава KF–KCl–KI–K2SiF6 // Расплавы. 2016. № 5. С. 441–454.
Laptev M., Khudorozhkova A., Isakov A., Grishenkova O., Zhuk S., Zaikov Yu. // J. Serbian Chemical Society. 2021. 86. P. 1–13. https://doi.org/10.2298/JSC200917065L
Гевел Т.А., Жук С.И., Устинова Ю.А., Суздальцев А.В., Зайков Ю.П. Электровыделение кремния из расплава KCl–K2SiF6 // Расплавы. 2021. № 2. С. 187–198.
Фроленко Д.Б., Мартемьянова З.С., Барабошкин А.Н., Плаксин С.В. Электроосаждение кремния из фторидно-хлоридных расплавов // Расплавы. 1993. № 5. С. 42–49.
Zhuk S.I., Isakov A.V., Apisarov A.P., Grishenkova O.V., Isaev V.A., Vovkotrub E.G., Zaykov Y.P. Electrodeposition of continuous silicon coatings from the KF–KCl–K2SiF6 melts // J. Electrochem. Soc. 2017. 164. № 8. P. H5135–H5138.
Исаков А.В., Чанг К., Джанг С., Зайков Ю.П. Электрохимическое получение тонких пленок Si в расплавах KF–KCl–KI–K2SiF6 // Цветные металлы. 2017. № 11. С. 49–54.
Чемезов О.В., Виноградов–Жабров О.Н., Аписаров А.П., Исаков А.В., Плаксин С.В., Поволоцкий И.М., Мурзакаев А.М., Малков В.Б., Зайков Ю.П. Структура нано- и микрокристаллических осадков кремния, полученных электролитическим рафинированием Si в расплаве KCl–СsCl–KF–K2SiF6 // Перспективные материалы: Функциональные наноматериалы и высокочистые вещества. 2010. № 9. С. 277–282.
Чемезов О.В., Исаков А.В., Аписаров А.П., Брежестовский М.С., Бушкова О.В., Баталов Н.Н., Зайков Ю.П., Шашкин А.П. Электролитическое получение нановолокон кремния из расплава KCl–KF–K2SiF6–SiO2 для композиционных анодов литий-ионных аккумуляторов // Электрохимическая энергетика. 2013. 13. № 4. С. 201–204.
Laptev M.V., Isakov A.V., Grishenkova O.V., Vorob’ev A.S., Khudorozhkova A.O., Akashev L.A., Zaikov Yu.P., Electrodeposition of thin silicon films from the KF–KCl–KI–K2SiF6 melt // J. Electrochem. Soc. 2020. 167. P. 042506.
Maeda K., Yasuda K., Nohira T., Hagiwara R., Homma T. Silicon electrodeposition in water-soluble KF–KCl molten salt: Investigations on the reduction of Si(IV) ions // J. Electrochem. Soc. 2015. 162. № 9. P. D444–D448.
Sharma I.G., Mukherjee T.K. A study on purification of metallurgical grade silicon by molten salt electrorefining // Metallurgical Tranactions B. 1986. 17B. P. 395–397.
Li J., Ren H., Yin X., Lu J., Li J. Electrochemical behavior of Si(IV) on the mo electrode in the CaCl2–CaF2–CaO–SiO2 melt // Russ. J. Electrochem. 2019. 55. № 5. P. 392–400.
Кузнецова С.В. Долматов В.С., Кузнецов С.А. Вольтамперометрическое исследование электровосстановления комплексов кремния в хлоридно-фторидном расплаве // Электрохимия. 2009. 45. № 7. С. 797–803.
Haaberg G.M., Faniyeh L., Martinez A.M., Osen K.S. Electrodeposition of silicon from fluoride melts // Electrochim. Acta. 2013. 100. P. 226–228.
De Lepinay J., Bouteillon J., Traore S., Renaud D., Barbier M.J. Electroplanting silicon and titanium in molten fluoride media // J. Appl. Electrochem. 1987. 17. P. 294–302.
Bieber A.L., Massot L., Gibularo M., Cassayre L., Taxil P., Chamelot P. Silicon electrodeposition in molten fluorides // Electrochim. Acta. 2012. 62. P. 282–289.
Cai Z., Li Y., He X., Liang J. Electrochemical behavior of silicon in the NaCl–KCl–NaF–SiO2 // Metallurgical and material transaction B. 2010. 41. № 8. P. 1033–1137.
Cai Z., Li Yu., Tian W. Electrochemical behavior of silicon compound in LiF–NaF–KF–Na2SiF6 molten salt // Ionics. 2011. 17. P.821–826.
Бойко О.И., Делимарский Ю.К., Чернов Р.В. Электровосстановление Si(IV) из фторидно-хлоридного расплава // Укр. хим. журн. 1985. 51. № 4. С. 385–390.
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. Тройные системы. М.: Химия. 1977.
Jiarong Y., Wei W., Wei X. Electrochemical synthesis of ammonia in molten salts // J. Energy Chemistry 2020. 43. P.195–207.
Kharina E.A., Kaychenkova R.Yu., Dedyukhin A.S., Shchetinskiy A.V., Yamshchikov L.F. Potentiometric study of lanthanum containing melts based on the eutectic mixrure of lithium, potassium and cesium chlorides // AIP Conf.Proc. 2015. 020037-1–020037-5.
Kui L., Jiajia S., Ligi Z., Yuxue S. The Application of low-melting LiCl–KCl–CsCl eutectic to electrodeposit uranium metal // J. Electrochem. Soc. 2019. 166. № 13. P. 606–616.
Шишкин В.Ю., Митяев В.С. Очистка галогенидов щелочных металлов методом зонной плавки // Изв. АН СССР. Неорг. мат. 1982. № 11. С. 1917–1918.
Воробьев А.С., Суздальцев А.В., Галашев А.Е. Энергия связей в расплавленных системах M–Al–Zr–O–F (M = Li, Na, K) // Расплавы. 2019. № 2. С. 156–166.
Bard A.J., Faulkner L.R. Electrochemical methods: fundamentals and applications, 2nd ed. John Wiley & Sons. NY. 2001.
Антипин Л.Н., Важенин С.Ф. Электрохимия расплавленных солей. М.: Металлургия, 1964.
Дополнительные материалы отсутствуют.


