Растительные ресурсы, 2019, T. 55, № 2, стр. 195-212
Клеточный рост основной паренхимы стебля в морфогенезе побега Piceа abies (Pinaceae)
В. Б. Скупченко *
Санкт-Петербургский государственный лесотехнический университет им. С.М. Кирова
г. Санкт-Петербург, Россия
* E-mail: vlask@VS16579.spb.edu
Поступила в редакцию 03.09.2018
После доработки 21.11.2018
Принята к публикации 11.01.2019
Аннотация
Морфогенез и рост побега Picea abies (L.) H. Karst. под покровами почки и после ее раскрытия происходит путем пролиферации клеток у большинства его структур, включая сердцевину. Скорость удвоения числа клеток сердцевины прямолинейно связана со средней суточной температурой воздуха в период от начала весенней вегетации до 39%-ного годичного прироста стебля в длину. В последующем до завершения сезонного продольного прироста стебля формирование сердцевины осуществляется в основном путем объемного роста клеток. За период морфогенеза годичного побега от начала пролиферации его клеток в почке весной до завершения продольного прироста стебля проходит около пяти–шести циклов удвоения числа клеток сердцевины. В поперечных стенках клеток растущей сердцевины накапливается больше микрофибрилл кристаллической целлюлозы, обладающих двойным лучепреломлением света, чем в продольных. Микрофибриллы наряду с выполнением механической функции, вероятно, создают в поперечных стенках ориентированную в радиальном и тангенциальном направлениях систему апопласта сердцевины. В паренхиме сердцевины от начала вегетационного периода и до момента максимального набухания почки также наблюдается структурная анизотропия: поскольку тангенциальный и радиальный диаметры клеток преобладают над продольным размером, в поперечных направлениях возможен более легкий симпластный транспорт метаболитов, на единицу длины пути которого приходится меньшее число клеточных мембран и стенок, чем в продольном. На поздних этапах развития стебля в результате образования узких первичных пор в продольных стенках клеток сердцевины также создаются условия поддержания симпластного радиального транспорта метаболитов от проводящих пучков центрального цилиндра к оси стебля. Структурные факторы анизотропии сердцевины, вероятно, обусловливают синхронизацию ориентации митотического аппарата и формирование поперечных клеточных пластинок при цитокинезе клеток.
Развитие органов растения начинается из инициальных клеток апикальных меристем побегов и корней, которые в результате деления вычленяют дочерние меристематические клетки. Последние в зависимости от положения в апикальной меристеме под действием комплекса малоизученных факторов включают конкретную морфогенетическую программу развития и формируют популяции клеток, дифференцирующиеся в определенные ткани органа растения. Только у вегетативных побегов ели насчитывается порядка 62 типов специализированных клеток и тканей. Процесс формирования апикальными меристемами новых побегов у представителей рода Picea A. Dietr. осуществляется в продолжение двух вегетационных периодов. Хронология процессов формирования из апикальной меристемы структур вегетативного побега ели достаточно подробно описана на уровне тканей листа, стебля и почки [1, 2]. Остаются невыясненными механизмы клеточного роста, осуществляющие формирование тканей этих структур побега. В частности, неясно на каких этапах развития формирование структур побега осуществляется только увеличением числа клеток результате их пролиферации, а на каких – ростом размеров клеток. Неизвестно, сколько циклов удвоения числа меристематических клеток проходит от начала весенней пролиферации до зрелого состояния ткани и какая ориентация деления клеток преобладает в различных тканях. Неизученной остается и зависимость процессов деления и роста клеток побега ели от температуры. Подробная информация об этих процессах позволяет решать вопрос о динамике потребности развивающихся тканей в элементах питания и энергетических затратах на осуществление процессов роста структур побега, а также выявить закономерности их морфогенеза. Данные сведения при последующих физиологических исследованиях предоставляют практическую возможность оценивать направление трофики и метаболизма всего растения на различных этапах развития его органов и при выращивании его частей в культуре ткани.
Влияние эндогенных и экзогенных факторов на клеточный рост привлекает широкое внимание исследователей. Опыты по выращиванию растений при минимально возможных температурах показали, что скорость роста и деления меристематических клеток замедляется в десятки раз, но картина морфогенеза не отличается от таковой при оптимальной температуре [3–7]. Структура клеточного цикла существенно изменяется только под влиянием таких экстремальных условий, как широкие температурные колебания, изменения ритма освещения, повреждающие процедуры митоза или любые подобные факторы; считается, что температурное регулирование клеточного цикла еще мало изучено [8]. При умеренных температурах в листьях кукурузы, подсолнечника и Arabidopsis thaliana скорость деления клеток и их роста, а также продолжительность этих процессов линейно изменяются с температурой и имеют общий характер, что справедливо как для экспериментов в камерах роста при постоянных температурах, так и в полевых условиях при свободно флуктуирующих температурах [9–11].
В регуляции деления и роста клеток важную роль выполняют фитогормоны. В частности, на корнях Arabidopsis thaliana установлено, что избыток цитокининов ингибирует рост корня путем замедления скорости пролиферации клеток меристемы корня. Помимо замедления пролиферации происходит также замедление перехода клеток к растяжению. В случае если концентрация эндогенных ЦК уменьшена либо ослаблена их рецепция, наблюдается стимуляция пролиферации, вследствие чего увеличивается скорость перехода клеток к растяжению. Все это приводит к тому, что корень растет быстрее [12]. Ауксин 2,4-D сильно влияет на скорость роста корня, поскольку воздействует на все основные процессы роста корня. Впервые было показано, что нарушение перераспределения ауксинов у мутанта Arabidopsis thaliana pin4, а также нарушение ответа на ауксиновый сигнал у shy2-31 вызывают задержку клеток в меристеме. В результате этого несколько увеличивается скорость образования клеток и скорость перехода клеток меристемы к объемному росту, а также усиление такого роста клеток в зоне растяжения, что приводит к увеличению объема корня [13].
Значительное внимание уделяется роли клеточных оболочек в детерминации ориентации деления и роста клеток, а также в инициации листовых примордиев. Установлено, что центральным процессом в морфогенезе многоклеточных и одноклеточных организмов является создание специфического паттерна дифференциального роста клеточных стенок, в особенности на внешней границе органа или организма [14]. Имеются сведения о связи между прохождением плоскостей клеточных делений, ориентацией микротрубочек и распределением напряжений, возникающих в меристематических тканях при образовании листовых примордиев [15, 16]. Рост клетки наиболее интенсивно происходит в направлении поперечном упаковки целлюлозных микрофибрилл клеточной стенки [17, 18]. На основе анализа серии экспериментов над апикальными меристемами побегов табака по влиянию деления и роста клеток на морфогенез сделан вывод о важной роли клеточных стенок в этом взаимодействии с уровнем организма [19]. Изучены особенности клеточных делений наружного слоя клеток меристем соцветий Arabidopsis thaliana L-er pUBQ1: 2x-tdTomato-29-1, наблюдаемых при реальном изображении с использованием лазерной сканирующей конфокальной микроскопии, и построена трехмерная модель прогнозирования положения новой клеточной стенки. В частности доказано, что правило Эрреры, согласно которому новая клеточная стенка формируется по принципу мыльного пузыря в плоскости деления, соответствующей кратчайшему пути, который разделит на половину материнскую клетку не всегда выполнимо. На самом деле правила ориентации новой клеточной стенки оказываются разными в зависимости от местоположения клеток в меристеме [20]. Клеточный рост побегов хвойных, в частности Picea остается мало изученным.
Митотическое деление клетки осуществляется в результате сложных биохимических подготовительных процессов, протекающих в продолжении пресинтетического G1, синтетического S и премитотического G2 периодов интерфазы митоза [21–24]. Они включают накопление исходных продуктов, из которых синтезируются биологические мембраны клеточного ядра и других органелл клетки, происходит удвоение количества ДНК, увеличивается количество РНК, структурных, энзиматических, двигательных белков [25]. Активизируется дыхание, в результате которого накапливаются макроэргические соединения, а также образуются строительные молекулярные блоки, необходимые для синтеза целого комплекса веществ [26]. Для этого клетка наряду с углеводами должна быть обеспечена достаточным резервом соединений, содержащих азот, фосфор, калий, магний и др. элементы. Эти процессы осуществляются при участии соответствующего соотношения фитогормонов.
Для роста клетки в процессе ее дифференциации требуется иной набор фитогормонов и питательных веществ. В этот период клетка нуждается в повышенном снабжении продуктами фотосинтеза для построения углеводной оболочки клетки и, вероятно, в меньшей мере, чем при митозе, минеральными элементами. Об этом, в частности, свидетельствуют подробные цитологические исследования основ дифференциации клеток ксилемы корня ели Picea abies (L.) H. Karst. [27].
Цель исследования – установить, на каких этапах морфогенеза побега ели формирование структур основной ткани стебля осуществляется только увеличением числа меристематических клеток в результате их пролиферации, а на каких – преимущественно ростом объема клеток в процессе их дифференциации. Сколько циклов деления меристематических клеток проходит от инициальных клеток до зрелого состояния ткани. Выявить зависимость скорости деления клеток данной ткани от температуры.
МАТЕРИАЛ И МЕТОДЫ
Объектами исследования служили побеги 2-го порядка ветвления на окончаниях ветвей ели европейской Picea abies (L.) H. Karst. в возрасте 80–90 лет, произрастающей в дендрарии Санкт-Петербургской лесотехнической академии. Побеги фиксировали 70%-ным этанолом периодически через 1-2 недели в продолжение их морфогенеза от ранней весны и до окончания сезонного осевого роста его стебля в середине вегетационного периода. Метеорологические данные получены на сайте “Архив погоды в городах России за последние полвека” [28].
Постоянные микропрепараты изготовлены из поперечных и продольных срезов побегов толщиной 15–20 мкм, полученных на вибрационном микротоме [29]. Срезы окрашивали нуклеальным красителем метиловым зеленым – пиронином G [30]. Исследование препаратов выполнено с помощью микроскопа Бимед 5 и поляризационного микроскопа Полам С 111.
Морфометрический анализ тканей и клеток побегов выполнен в световом микроскопе при помощи модернизированного автором винтового окулярного микрометра МОВ-1-15х методом их линейного интегрирования с применением “формулы прямоугольников” [31, 32]. Данный способ измерения позволяет получать сведения о площадях сечений тканей в произвольном сочетании их встречаемости в поле зрения светового микроскопа. На основе этой методики по всем срокам фиксации на поперечных срезах была измерена площадь сечения всех тканей в средней части стебля. Также измерена средняя длина стебля, что позволило рассчитать объем его тканей. Затем на продольных и поперечных срезах определены средние диаметры клеток в трех направлениях и рассчитан их объем. На основе этих данных было определено изменение количества клеток конкретной ткани стебля в процессе формирования побегов от начала весеннего развития в почке до окончания продольного сезонного роста. Средняя суточная скорость удвоения числа клеток паренхимы сердцевины (${{I}_{{{\text{у д в }}{\text{.}}}}}$) определялась по формуле:
Все измерения выборочных средних выполнены с ошибкой репрезентативности не более 5% [34].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В качестве модельной структуры при изучении клеточного роста листонесущего стебля побега в настоящей работе принят элемент его основной ткани – паренхима сердцевины. Выбор данной ткани обосновывается четким характером ориентации деления клеток в ее онтогенезе.
Рис. 1.
Формирование структур побега Picea abies (L.) H. Karst. в почке в период от ранней весны до достижения длины стебля 4.4% от годичного прироста. № 1, 2 – зачаток побега в терминальной почке ранней весной до начала деления его клеток; длина стебля 1.1% от годичного прироста. № 1 – зачаток побега: 1 – апикальная меристема, 2 – зачаток хвои, 3 – меристема паренхимы коры, 4 – прокамбий центрального цилиндра стебля, 5 – меристема паренхимы сердцевины. № 2 – меристема паренхимы сердцевины (поляризованный свет): 6 – стенки клеток поперечные продольной оси стебля с высоким двойным лучепреломлением света, 7 – интерфазные ядра клеток. Масштабная линейка: № 1 – 250 мкм, № 2 – 20 мкм. № 3, 4, 5 – зачаток побега в терминальной почке в период начала деления клеток меристемы сердцевины; длина стебля 2.8% от годичного прироста. № 3 – верхушка зачатка побега: 1 – апикальная меристема, 2 – зачатки первых кроющих чешуй новой почки, 3 – зачаток хвои, 4 – меристема сердцевины, 5 – прокамбий центрального цилиндра, 6 – таниновые клетки. № 4, 5 – меристема сердцевины. № 4 – поляризованный свет: 1 – поперечные стенки клеток с высоким двойным лучепреломлением света, 2 – гранулы крахмала, 3 – поздняя телофаза делящегося ядра материнской клетки осевого ряда. Масштабная линейка: № 3 – 250 мкм, № 4 – 50 мкм, 5 – 20 мкм. № 6, 7, 8 – зачаток побега в терминальной набухающей почке; длина стебля 4.4% от годичного прироста. № 6 – верхушка зачатка побега: 1 – апикальная меристема, 2 – молодые кроющие чешуи новой почки, 3 – меристема сердцевины. № 7, 8 – меристема сердцевины. № 7 – поляризованный свет: 1 – стенки клеток поперечные продольной оси стебля с высоким двойным лучепреломлением света в четырехклеточном ряду, 2 – гранулы крахмала. № 8: 2 – интерфазные ядра, 3 – поздняя телофаза делящегося ядра в одной из клеток многоклеточного ряда. Масштабная линейка: № 6 – 250 мкм, № 7 – 25 мкм, № 8 – 30 мкм. Fig. 1. Formation of shoot structures in Picea abies (L.) H.Karst. apical bud form dormancy release until shoot reaches 4.4% of its annual elongation. No. 1, 2 – shoot primordium in terminal bud in early spring before the cell division; stem length 1.1% of the annual increment. No. 1 – shoot primordium: 1 – apical meristem, 2 – needle primordia, 3 – cortical parenchymal meristem, 4 – stele procambium, 5 – pith parenchymal meristem. Bar = 250 µm. No. 2 – pith parenchymal meristem (polarized light): 6 – highly birefringent cell walls transverse to the longitudinal axis of stem, 7 – interphase cell nuclei. Bar = 20 µm. No. 3, 4, 5 – shoot primordium in terminal bud in the early stage of the pith parenchymal meristem cell division, stem length 2.8% of the annual increment. No. 3 – shoot apex primordium: 1 – apical meristem, 2 – bud scales primordia, 3 – needle primordia, 4 – pith meristem, 5 – stele procambium, 6 – tannin cells. Bar = 250 µm. No. 4, 5 – pith meristem. No. 4 – polarized light: 1 – highly birefringent cell walls transverse to the longitudinal axis of stem in four-cell rows, 2 – starch granules, 3 – late telophase of dividing parent cell nucleus of the cell column. No.4 Bar = 50 µm. No. 5 Bar = 20 µm. No. 6, 7, 8 – shoot primordium in swelling terminal bud; stem length 4.4% of annual increment. No. 6 – shoot apex primordium: 1 – apical meristem, 2 – bud scales primordia, 3 – pith meristem. Bar = 250 mcm. No. 7, 8 – pith meristem. No. 7 – polarized light: 1 – highly birefringent cell walls transverse to the longitudinal axis of stem in four-cell row, 2 – starch granules. Bar = 25 µm. No. 8: 2 – interphase nuclei, 3 – late telophase of the dividing cell nucleus in one of the cells of multicellular row. Bar = 30 µm.
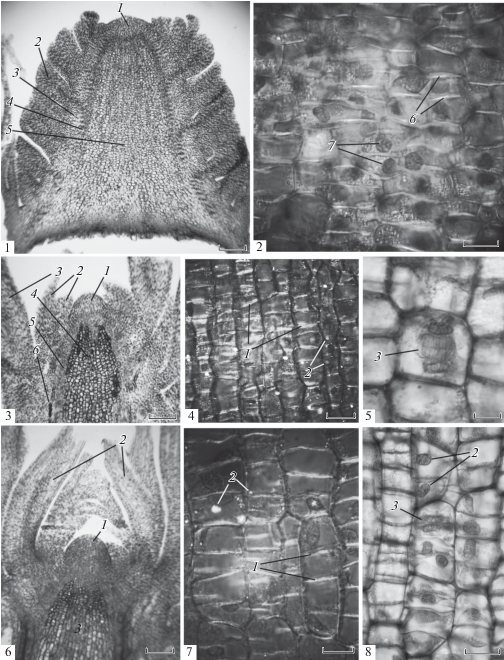
Клетки меристемы паренхимы сердцевины стебля зачатка побега новой генерации появляются в апексе побега предыдущей генерации в процессе завершения формирования им зрелых структур почки и окончания прироста стебля в длину в середине вегетационного периода (рис. 2, № 7, 7) [2].
Рис. 2.
Формирование структур побега Picea abies (L.) H. Karst. в период от завершения набухания почки до окончания продольного годичного прироста стебля. № 1, 2, 3 – зачаток побега в период завершения набухания терминальной почки; длина стебля 8.2% от годичного прироста. № 1 – верхушка зачатка побега: 1 – апикальная меристема, 2 – зачаток кроющей чешуи, 3 – кроющие чешуи новой почки, 4 – меристема сердцевины. № 2, 3 – меристема сердцевины с многоклеточными осевыми рядами клеток. № 2 – поляризованный свет: высокое двойное лучепреломление света поперечной стенок клеток толстостенной клетки склереиды – 1 и тонкостенной паренхимной клетки – 2; 3 – гранулы крахмала. № 3: интерфазное ядро – 2, поздняя анафаза делящегося ядра клетки осевого ряда – 3. Масштабная линейка: № 1 – 250 мкм, № 2 – 25 мкм, № 3 – 30 мкм. № 4, 5 – молодой побег, выросший после распускания терминальной почки; длина стебля 39.2% от годичного прироста. № 4 – верхушка побега с терминальной почкой: 1 – апикальная меристема, 2 – зачаток кроющей чешуи, 3 – кроющие чешуи почки, 4 – паренхима сердцевины. № 5 – паренхима сердцевины со склереидами. № 5 – поляризованный свет: 1 – поперечные стенки тонкостенной клетки с высоким двойным лучепреломлением света, 2 – склереида, 3 – гранулы крахмала. Масштабная линейка: № 4 – 250 мкм, № 5 – 50 мкм. № 6, 7, 8 – побег в период завершения продольного годичного прироста; длина стебля 100% от годичного прироста. № 6 – паренхима сердцевины (поляризованный свет): 1 – щелевидные первичные поры, вытянутые поперек продольной оси стебля, 2 – продольные клеточные стенки, 3 – высокое двойное лучепреломление света поперечных клеточных стенок. № 7 – верхушка побега с терминальной почкой: 1 – апикальная меристема в период окончания формирования кроющих чешуй почки и переходу к заложению листовых примордиев побега следующей генерации, 2 – кроющие чешуи почки, 3 – паренхима сердцевины почки, 4 – прокамбиальные тяжи, соединяющие апекс с центральным цилиндром стебля, 5 – паренхима коры почки, 6 – смоляное вместилище в основании кроющих чешуй почки, 7 – инициальные клетки меристемы сердцевины листонесущего стебля следующей генерации. № 8 – поперечный срез стебля на середине его длины: 1 – тонкостенные клетки паренхимы сердцевины, 2 – группа склереид, 3 – ксилема центрального цилиндра, 4 – прокамбиальная зона, 5 – флоэма центрального цилиндра, 6 – паренхима листовой лакуны, 7 – паренхима первичной коры, 8 – осевые смоляные каналы первичной коры, 9 – воздухоносная паренхима листовой подушки, 10 – эпидерма с гиподермой, 11 – проводящий пучок листового следа. Масштабная линейка: № 6 – 25 мкм. № 7, 8 – 250 мкм. Fig. 2. Formation of Picea abies (L.) H. Karst. shoot structures form the end of bud swelling until completion of stem elongation. No. 1, 2, 3 – shoot primordium at the end of terminal bud swelling; stem length 8.2% of the annual increment. No. 1 – shoot apex primordium: 1 – apical meristem, 2 – scale primordium, 3 – scales of the new bud, 4 – pith meristem. Bar = 250 µm. No. 2, 3 – pith meristem with multicellular columns. No. 2 – polarized light: highly birefringent transverse walls of 1 – thick-walled sclereid and 2 – thin-walled parenchymal cell; 3 – starch granules. Bar = 25 µm. No. 3: interphase nucleus – 2, late anaphase of dividing cell nucleus of cell column – 3. Bar = 30 µm. No. 4, 5 – young shoot, grown after terminal bud burst; stem length 39.2% of the annual increment. No. 4 – tip of the shoot with terminal bud: 1 – apical meristem, 2 – scale primordium, 3 – bud scales, 4 – pith parenchyma. 5 – pith parenchyma with sclereids. Bar = 250 µm. No. 5 polarized light: 1 – highly birefringent transverse walls of thin-walled cells, 2 – sclereids, 3 – granules of starch. Bar = 50 µm. No. 6, 7, 8 – shoot at the completion of annual stem elongation; stem length 100% of the annual increment. No. 6 – pith parenchyma (polarized light): 1 – slit-like primordial pits stretched across the longitudinal axis of stem, 2 – the longitudinal cell wall, 3 – highly birefringent transverse cell walls. Bar = 25 µm. № 7 – tip of the shoot with terminal bud: 1 – apical meristem at the final of scales formation and transition to the initiation of leaf primordia on the shoot of next generation, 2 – bud scales, 3 – bud pith parenchyma, 4 – procambial strands connecting apex with stele, 5 – bud pith parenchyma, 6 – resin receptacles at the base of the bud scales, 7 – initial pith meristem cells of the next generation leaf-bearing shoot. No. 8 – cross section of midpoint of stem: 1 – thin-walled cells of pith parenchyma, 2 – sclereids with thickened cellular walls, 3 – xylem of stele, 4 – procambial zone, 5 – phloem of stele, 6 – leaf gap parenchyma, 7 – primary bark parenchyma, 8 – vertical resin canals in the primary cortex, 9 – aerenchyma of leaf-cushion, 10 – epidermis with hypodermis, 11 – vascular bundle of leaf trace. Bar = 250 µm.
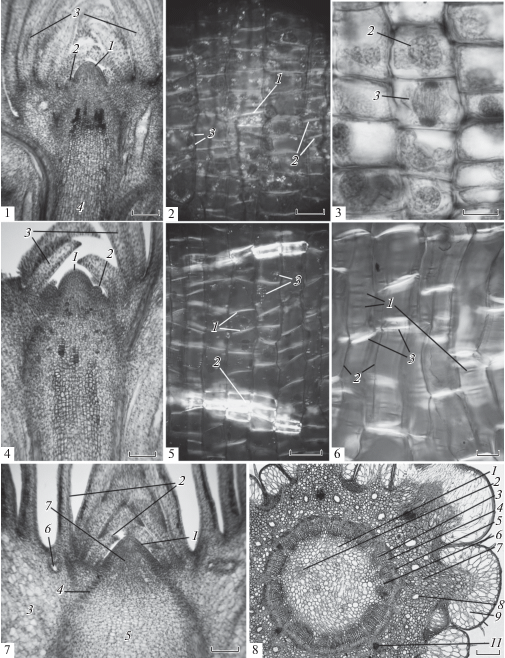
Заложение основной массы клеток меристемы паренхимы сердцевины стебля будущего листонесущего побега осуществляется апексом во второй половине вегетационного периода вместе с листовыми примордиями. От середины до конца вегетационного периода апикальной меристемой формируется полный набор листовых примордиев фитомеров зачатка побега, число которых предопределяет длину, диаметр стебля и количество инициальных клеток колонок паренхимы сердцевины будущего листонесущего побега [32].
Таблица 1.
Морфометрическая характеристика объемного и клеточного роста паренхимы сердцевины в процессе морфогенеза побега Picea abies (L.) H. Karst. Table 1. Morphometric characteristics of volumetric and cellular growth of pith parenchyma in Picea abies (L.) H. Karst. shoot morphogenesis.
| Дата наблюдения Date of observation |
Средняя суточная температура
воздуха за периоды между
сроками фиксации образцов, °С Average daily air temperature for the periods between sample fixation dates, °С |
Длина стебля, мм/%
от полного годичного прироста Stem length, mm/% of the annual length increment |
Объем сердцевины, мм3 Pith volume, mm3 |
Число клеток сердцевины Number of pith cells |
Средний объем клетки
сердцевины, мкм3 Average pith cell volume, μm3 |
Осевой диаметр клетки
сердцевины, мкм Axial pith cell diameter, µm |
Радиальный и тангенциальный
диаметры клетки сердцевины, мкм Radial and tangential pith cell diameter, µm |
Число циклов удвоения клеток
за периоды между сроками
фиксации образцов Number of cell doubling cycles for the periods between sample fixation dates |
Скорость удвоения клеток в сутки
за периоды между сроками
фиксации образцов Rate of daily cell doubling for the periods between sample fixation dates |
|---|---|---|---|---|---|---|---|---|---|
| 17 апреля April 17 |
3.59 | 1.39/1.1 | 0.2318 | 44 600 | 5203 | 14.35 | 26.32 | 0 | 0 |
| 27 апреля April 27 |
8.56 | 3.45/2.8 | 0.7183 | 90 900 | 7898 | 21.4 | 26.55 | 1.027 | 0.103 |
| 17 мая May 17 |
5.31 | 5.52/4.4 | 1.3072 | 160 100 | 8167 | 18.42 | 29.1 | 0.817 | 0.041 |
| 23 мая May 23 |
15.45 | 10.20/8.2 | 3.189 | 318 000 | 10 027 | 15.85 | 34.76 | 0.990 | 0.165 |
| 29 мая May 29 |
18.05 | 49/39.2 | 27.522 | 1 277 300 | 25 415 | 34.37 | 37.58 | 2.006 | 0.207 |
| 16 июня June 16 |
21.34 | 125/100 | 119.28 | 2 219 300 | 140 722 | 105.93 | 50.37 | 0.797 | 0.050 |
Ранней весной (17 апреля – вегетационный период 1995 г.) при сумме средних суточных положительных температур воздуха порядка 130 °С у зачатков побегов в почках еще не обнаруживается ростовых процессов. Каждый зачаток побега имеет стебель конусовидной формы с апикальной меристемой и многочисленными листовыми примордиями, плотно располагающимися на его боковой поверхности (рис. 1, № 1, 2). Осевая часть стебля сложена меристемой паренхимы сердцевины, которая окружена системой прокамбиальных тяжей центрального цилиндра с листовыми лакунами и с отходящими от нее прокамбиальными тяжами листовых следов, окруженных меристемой паренхимы первичной коры. В каждом листовом примордии находится прокамбиальный тяж, вокруг которого располагаются меристемы эндодермы, складчатого мезофилла, гиподермы, окруженные одним слоем клеток протодермы.
Митозы отсутствуют во всех тканях побега. В зачатке стебля, который имеет длину 1.1% от полного сезонного прироста, меристема паренхимы коры с протодермой преобладают по объему и числу клеток по отношению к остальным тканям. Меристема сердцевины занимает 22.7% объема стебля. Поперечные стенки ее клеток оси стебля обладают бо́льшим двойным лучепреломлением света, чем продольные. Средний продольный диаметр клеток меристемы сердцевины в 1.83 раза меньше, чем поперечный (см. табл. 1). Объем ее клеток в 5 раз больше, чем в прокамбии и паренхиме коры.
По достижении суммы положительных температур воздуха порядка 220 °С при средней суточной температуре воздуха 8.56 °С во всех тканях зачатка побега началось деление клеток. При этом стебель вырос по длине по отношению к ранневесеннему состоянию в 2.5 раза, что составляет лишь 2.8% от его полного сезонного прироста. Стебель приобрел более остроконическую форму (рис. 1, № 3–5). Апекс начал формировать в основании валикообразные бугорки кроющих чешуй, которые, интенсивно разрастаясь, образовали двухслойный свод покровов новой терминальной почки. В прокамбиальных тяжах центрального цилиндра стебля и листовых следов началась дифференциация клеток протофлоэмы и протоксилемы. Причем элементы протофлоэмы появляются первыми и достигают парциального объема в стебле порядка 4.5%. Протоксилема нарастает медленнее и имеет в 3.9 раза меньший объем, чем протофлоэма. Практически одновременно с появлением первых зрелых элементов проводящих тканей в центральном цилиндре стебля в меристеме паренхимы коры началось образование смоляных вместилищ. Наряду с этим произошло интенсивное разрастание таниновых клеток, расположенных с внешней стороны от протофлоэмы. Их объем увеличился по сравнению с ранневесенним состоянием более чем в 4 раза в основном за счет роста в направлении вдоль оси стебля. Произошло увеличение парциального объема тканей, расположенных на периферии от флоэмы. Парциальный объем центрального цилиндра при этом снизился.
Сердцевинная паренхима увеличилась в объеме в 3.1 раза. В ней в результате поперечных делений в средней части стебля по длине образовались вертикальные ряды из двух клеток (рис. 1, № 4, 5), а в основании – из трех клеток. У поперечных стенок клеток по сравнению с продольными, оптическая анизотропия значительно выше. В сердцевине появились пластиды, содержащие много мелких гранул крахмала (рис. 1, № 5); в телофазных клетках они отсутствует.
По мере того как длина стебля зачатка побега в почке достигла 4.4% от полного сезонного прироста, каждая материнская клетка меристемы сердцевины сформировала осевую колонку, состоящую в верхней части стебля из 2–3 клеток, в средней его части – из 3–4 клеток, а в основании – из 4–6 клеток (рис. 1, № 6, 7, 8). Поперечные стенки клеток сердцевины сохраняют высокое двойное лучепреломление света. В центральном цилиндре объем протофлоэмы превышает объем протоксилемы в 2.7 раза. Паренхима листовых лакун составляет 25.3% от объема центрального цилиндра стебля. По сравнению с паренхимой коры в сердцевине содержится значительно меньше пластид с гранулами крахмала, что, вероятно, связано с интенсивным влиянием углеводов на процессы метаболизма ее активно делящихся клеток. Крахмалоносные пластиды сосредоточены в слоях лакунарной паренхимы от уровня флоэмы и далее к периферии стебля в клетках паренхимы коры, вокруг смоляных вместилищ коры. Клетки лакунарной паренхимы имеют радиальное удлинение, что, очевидно, способствует радиальному транспорту веществ от проводящих тканей в направлении к клеткам сердцевины.
В состоянии максимального набухания почки длина стебля составляет 8.2% от полного сезонного прироста (рис. 2, № 1–3). Зачатки хвои имеют длину 5.6 мм, что в 19 раз больше, чем в ранневесенний период. За время удлинения стебля от 4.4 до 8.2% сезонного прироста произошло преобладание роста хвои над ним как по объему, так и по длине: стебель вырос по оси в 1.6–1.8 раза, а хвоя – в 2.5–2.7 раза. Одновременно активизировался рост основания хвоинок в виде листовых подушек, которые, примыкая друг к другу, образовали плотный покров на поверхности стебля. Рост снования хвоинок происходил в основном путем пролиферации клеток, при некотором увеличении их среднего объема. Апекс сформировал свод из 4–5 слоев кроющих чешуй терминальной почки. Таким образом, еще под покровами материнской почки зачаток побега сформировал новую молодую терминальную почку (рис. 2, № 1).
В результате деления клеток сердцевины поперечными стенками образовались вертикальные ряды из 8 клеток (рис. 2, № 3). В продольных стенках клеток сформировались щелевидные примордиальные поры, вытянутые в поперечном направлении и обеспечивающие более свободный радиальный и тангенциальный транспорт метаболитов. У поперечных стенок клеток сердцевины, по сравнению с продольными, сохранилось преобладание оптической анизотропии. Кроме этого в сердцевине появились отдельные склереиды и она заполнилась большим количеством пластид с крахмальными гранулами (рис. 2, № 2).
В рассматриваемый период произошло преобладание скорости роста ксилемы над флоэмой и тканей на периферии от центрального цилиндра стебля: таниновой обкладки флоэмы, смоляных вместилищ, паренхимы коры, эпидермы и основания хвоинок. Парциальный объем сердцевины снизился от 11.8 до 10.1%.
В клетках паренхимы относительно широких листовых лакун на продольных стенках, также как и в сердцевине, образовались узкие первичные поры вытянутые поперек оси стебля. Вероятно, это способствовало более интенсивному радиальному транспорту веществ по паренхиме лакун от проводящих пучков центрального цилиндра, как к сердцевине, так и в направлении кортекса. В данный период клетки меристемы лакунарной паренхимы уменьшились в объеме в 1.3–1.4 раза, а их число возросло в 4.4–4.6 раза. В результате их деления поперечными стенками, образовались 2–3 клеточные колонки; клетки прошли 2.18 циклов деления, что в 2.2 раза больше, чем в сердцевине.
В период от раскрытия материнской почки до разрастания стебля, в длину на 39% полного сезонного прироста, сформировался свод из 6–7 слоев кроющих чешуй молодой терминальной почки (рис. 2, № 4). Клетки паренхимы сердцевины сохраняют высокую оптическую анизотропию поперечных стенок. В ней также образовалось значительное количество клеток склереид в виде линзовидных групп (до 11.6% от объема сердцевины), уплощенных поперек оси стебля. Клетки склереид имеют заметно меньший продольный диаметр, чем тонкостенные клетки сердцевины, прекратив объемный рост (рис. 2, № 5, 6). Склереиды располагаются против листовых лакун в системе проводящих пучков центрального цилиндра и, вероятно, при своем росте лучше обеспечены флоэмными метаболитами, содержащими ассимиляты, чем тонкостенные клетки сердцевины.
В центральном цилиндре парциальный объем флоэмы практически не изменился, но увеличился у прокамбиальной зоны в 1.39–1.43 раза и особенно вырос у ксилемы – в 2.33–2.41 раза, а также незначительно у паренхимы сердцевины. Отношение площади сечения флоэмы к ксилеме достигло 1.02. Из всего комплекса тканей стебля наибольший рост среднего объема клетки (в 17–18 раз) произошел в воздухоносной паренхиме листовых подушек. Клетки паренхимы листовых лакун выросли по объему в 3.7–3.8 раза, разрастаясь в основном в продольном направлении. Обнаружено также увеличение числа этих клеток в 1.39–1.43 раза, которые за данный период прошли 1.239 циклов удвоения. Продолжилась тенденция большей скорости роста объема тканей стебля, расположенных снаружи от центрального цилиндра.
Хвоя приобрела окончательную длину – порядка 15.0 мм. Ниже отделительного слоя хвои над листовой подушкой образовался укороченный черешок листа длиной около 0.38–0.42 мм. Общая длина листовой подушки за период увеличилась более чем в 3.5 раза.
В период удлинения стебля от 39 до 100% сезонного прироста меристематический апекс побега завершил формирование свода кроющих чешуй терминальной почки, приобрел максимальные сезонные размеры. При этом сформировался укороченный стебель почки, несущий кроющие чешуи и имеющий заметно больший диаметр, чем расположенный ниже удлиненный листонесущий стебель. Общий объем сердцевины последнего вырос в 4.33 раза. При этом ее клетки прошли в среднем 0.797 циклов удвоения. Тонкостенные клетки сердцевины увеличились в объеме в 5.54 раза (рис. 2, № 6–8). Они сохранили высокую оптическую анизотропию поперечных стенок. В продольных стенках этих клеток присутствуют щелевидные первичные поры размером 2.2 × 13.2 мкм, вытянутые в поперечном направлении (рис. 2, № 6). Объем клеток склереид вырос незначительно – в 1.173 раза. Парциальный объем сердцевины по отношению к суммарному объему всех тканей стебля снизился от 11.42 на 1.3%. При этом парциальный объем склереид в сердцевине вырос на 5.7%. В проводящих пучках центрального цилиндра стебля преобладало нарастание объема ксилемы и он превысил объем флоэмы в 2.68 раза.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Темп удвоения числа клеток сердцевинной меристемы довольно четко проявляет линейную зависимость от средней суточной температуры на этапе развития побега от начала весеннего роста до состояния, когда длина стебля достигает 39% от полной длины годичного прироста (рис. 3). На этом этапе развития побега повышение средней суточной температуры от 5 до 15 °С соответствует увеличению скорости удвоения числа клеток сердцевинной меристемы за сутки в 4.9 раза. Подъем средней суточной температуры в интервале 8–18 °С приводит к повышению скорости удвоения клеток за сутки в 2.8 раза. Таким образом, в последнем температурном интервале выполняется известное правило Вант-Гоффа, согласно которому повышение температуры на каждые 10 °С соответствует увеличению скорости химических и биологических реакций в 2–3 раза (Q10 = 2–3) [35].
Рис. 3.
Зависимость между средней суточной скоростью удвоения числа клеток паренхимы сердцевины стебля побега Picea abies (L.) H. Karst., сроками фиксации объектов и средней суточной температурой воздуха. По горизонтали – средняя суточная температура воздуха, °С; по вертикали – средняя суточная скорость удвоения клеток. Fig. 3. The relationship between average daily air temperature and average daily rate of pith parenchyma cell doubling in shoots of Picea abies (L.) H. Karst. between sample fixation dates. X-axis – the average daily temperature, °С; y-axis – the average daily rate of cell doubling.
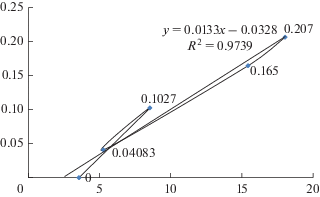
Результаты линейной зависимости от температуры удвоения числа клеток сердцевины стебля в диапазоне от 5–18 °С на данном этапе развития побега ели согласуются с наблюдениями за клеточным ростом при умеренных температурах у листьев кукурузы, подсолнечника и Arabidopsis thaliana [9–11]. Вероятно, структура клеточного цикла меристемы сердцевины растущих побегов ели в период от начала весеннего роста до состояния, когда длина стебля достигает 39% от полной длины годичного прироста побега в диапазоне температур 5–18 °С существенно не изменяется, поскольку в этот период наблюдается прямолинейный характер зависимости удвоения числа клеток сердцевины от температуры. При этом в период от начала весенней пролиферации клеток развивающегося в почке зачатка побега до 4.4% годичного прироста стебля в длину питание его тканей, вероятно, осуществляется главным образом по элементам протофлоэмы, которая продолжает более активный рост по сравнению с протоксилемой. Элементы протоксилемы в данный период не имеют возможности активного проявления транспортных функций, поскольку зачаток побега покрыт многочисленными слоями кроющих чешуй почки и не способен к интенсивной транспирации. Транспирационный ток обусловливает передвижение воды в ксилеме по градиенту водного потенциала [26].
В период удлинения стебля от 39 до 100% сезонного прироста скорость удвоения числа клеток сердцевины существенно затормаживается, составляя 0.047 циклов удвоения в сутки, хотя средняя суточная температура воздуха составляла порядка 21 °С. В этот период резко активизировался рост объема клеток сердцевины. На этапе внутрипочечного роста стебля подобная скорость удвоения числа клеток была возможна уже при средней суточной температуре всего лишь 5.2 °С. Наблюдаемое торможение процесса удвоения числа клеток сердцевины побегов ели в данный период, вероятно, связано с включением эндогенных механизмов, стимулирующих их переход от активного деления к объемному росту, что обнаруживается, например, по изменению соотношения ауксинов и цитокининов у Arabidopsis thaliana [12, 13]. Всего за период развития годичного побега от начала процесса пролиферации клеток его зачатка в почке весной до завершения продольного прироста стебля, хвои и формирования почек клетки сердцевины проходят в среднем 5.64 циклов удвоения их числа.
Полученные данные о темпе удвоения числа клеток сердцевинной меристемы побегов ели показывают, что продолжение линии тренда до оси температуры согласно уравнению
где $x$ – средняя суточная температура воздуха, теоретически соответствует возможности появления митозов при средней температуре воздуха выше 2.5 °С.В настоящей работе установлено, что в процессе формирования в почке и в начале внепочечного развития молодой побег осуществляет рост преимущественно путем деления клеток. Соответственно для поддержания такого сложного физиологического процесса молодые побеги нуждаются в достаточно интенсивном питании, в особенности минеральными элементами [21]. Последующий рост сердцевины осуществляется преимущественно путем увеличения объема ее клеток.
За период от начала вегетации до завершения осевого роста стебля клетки сердцевины постоянно растут в направлениях поперек оси стебля и вдоль нее (см. табл. 1). Продольный диаметр клеток сердцевины от начала вегетационного периода и до момента максимального набухания почки колеблется в относительно небольшом интервале 14–21 мкм, при этом поперечный диаметр всегда заметно превышает продольный. Степень удвоения исходной длины стебля за этот период, равная 2.830, практически совпадает с числом удвоения количества клеток – 2.834. Следовательно, на основании показателей роста в длину зачатка побега ели в почке можно сделать заключение о темпе удвоения числа клеток сердцевины делением поперечными клеточными пластинками. Это согласуется с предложением определять оптимальную температуру деления и роста клеток на основании анализа скорости роста корней [8].
Преобладание двойного лучепреломления в поперечных стенках клеток сердцевины наблюдается как в начале ее формирования из апекса побега [36], так и в продолжение всего ее онтогенеза. Анизотропию клеточной оболочки и ее двойное лучепреломление обусловливают кристаллические участки микрофибрилл целлюлозы [37]. Таким образом, есть основание считать, что поперечные стенки клеток сердцевины побегов ели с большим двойным лучепреломлением света содержат большее количество кристаллической (т.е. мицеллярной) целлюлозы, чем продольные. Как отмечает К. Эсау, “Прочность на растяжение – одно из замечательных свойств целлюлозы” [38]. Следовательно, наблюдаемое нами накопление большего количества кристаллической целлюлозы в поперечных стенках клеток сердцевины, чем в продольных, обеспечивает их дополнительную устойчивость к растяжению. Это обусловливает поддержание стабильности диаметра цилиндра развивающейся сердцевины и примыкающей к ней системы проводящих пучков, не препятствуя осевому росту стебля. Возможно, большее накопление кристаллической целлюлозы в поперечных стенках клеток создает систему механических напряжений, которые участвуют в синхронизации ориентировки поперечного направления формирующихся клеточных пластинок при цитокинезе клеток меристемы сердцевины побегов ели. Связь между прохождением плоскостей клеточных делений и распределением напряжений, возникающих в меристематических тканях, обнаружена при образовании листовых примордиев Vinca minor [15].
Целлюлозно-пектиновые оболочки клеток представляют собой внеплазматическое свободное пространство с большой внутренней поверхностью, функционирующие как активный адсорбент [39, 40]. Неодревесневшие целлюлозно-пектиновые оболочки построенны из относительно рыхло сложенных фибрилл, между которыми остаются многочисленные пустоты и ходы, вытянутые параллельно волокнам. По ним может распространяться вода и растворенные в ней вещества, омывая внешний периметр клеток [41]. Таким образом, можно предполагать, что поперечные стенки клеток сердцевины побега ели с фибриллами кристаллической целлюлозы образуют систему апопласта, ориентированную в радиальном направлении от проводящих пучков центрального цилиндра побега к его оси.
От начала вегетационного периода и до момента максимального набухания почки диаметр клеток в поперечном направлении стебля всегда заметно превышает их продольный размер. Следовательно, в паренхиме сердцевины в данный период развития стебля создается структурная анизотропия, связанная с тем, что в поперечном направлении на единицу длины симпластного пути транспорта метаболитов встречается меньшее число клеточных мембран и стенок, чем в продольном. Благодаря этому вероятно усиливается транспорт метаболитов от проводящих пучков центрального цилиндра в поперечном направлении к оси сердцевины.
На поздних этапах развития стебля наблюдается образование первичных узких пор в продольных стенках клеток сердцевины. При этом в темном поле поляризационного микроскопа продольные стенки тонкостенных клеток приобретают небольшое свечение при таком угле поворота предметного столика, когда начинают ярко светиться поперечные стенки. Это свидетельствует о том, что в продольных стенках тонкостенных клеток сердцевины мицеллы целлюлозы ориентированы поперек продольной оси стебля. Первичные поры в поляризационном микроскопе наблюдаются в виде темных участков продольных стенок, лишенных кристаллической целлюлозы. Щелевидные первичные поры ориентируются длинной стороной параллельно участкам клеточной стенки, содержащим мицеллы целлюлозы расположенных поперек оси стебля. За счет образования первичных узких пор, вероятно, возможна дополнительная активизация симпластного радиального транспорта веществ в сердцевину от проводящих пучков центрального цилиндра стебля.
Данные структурные факторы анизотропии растущей паренхимы сердцевины также определенным образом могут обеспечивать лучшее распространение и биофизических факторов от проводящих пучков центрального цилиндра к оси стебля. Структурная анизотропия сердцевины, вероятно, обусловливает поляризацию транспорта метаболитов от проводящих пучков центрального цилиндра к его оси в поперечном направлении и способствует синхронизации ориентации митотического аппарата и формированию поперечных клеточных пластинок при цитокинезе клеток сердцевины.
В период от максимального набухания почки до завершения продольного роста стебля в сердцевине развиваются линзовидные группы толстостенных клеток склереид. Характерно, что линзы склереид всегда уплощены поперек оси стебля и располагаются против листовых лакун. Склереиды также, вероятно, дополняют возникновение структурной анизотропии сердцевины. Склереидные группы клеток являются компонентом гетерогенной сердцевины, характерной для рода Picea A. Dietr., на этапе роста однолетнего побега. Они образуют ребра жесткости и обеспечивают стеблю необходимую прочность [42].
Массовый характер описанных выше процессов клеточного роста, протекающих в многочисленных точках роста побегов в кроне дерева, в конечном итоге оказывает влияние на изменение общего уровня обмена веществ всего древесного организма в продолжение различных этапов его морфогенеза, что должно быть предметом дальнейших исследований. Результаты данных исследований могут быть использованы в работах, связанных с изучением процессов роста ели как при ее искусственном выращивании, так и в естественных древостоях, при восстановлении лесов, экологическом мониторинге, биоиндикации изменений окружающей среды, в области фенологии этой древесной породы.
ВЫВОДЫ
Заложение основной массы клеток меристемы сердцевины будущего листонесущего стебля осуществляется апексом побега во второй половине вегетационного периода вместе с меристематическими зачатками фитомеров хвои. На следующий год, после зимнего покоя, при сумме положительных температур 220 °С начинается пролиферация клеток во всех тканях зачатка побега под покровами материнской почки. При этом каждая клетка меристемы сердцевины листонесущего стебля зачатка побега приступает к делению клеточными пластинками, поперечными оси стебля, выполняя функции материнской клетки вертикального ряда клеток паренхимы сердцевины. Рост сердцевины весной в продолжение периода развития под покровами почки и сразу после ее раскрытия осуществляется главным образом благодаря увеличению числа клеток путем их пролиферации. Суточный темп удвоения числа клеток сердцевины проявляет линейную зависимость от средней суточной температуры на этапе развития побега от начала весеннего роста до момента, когда длина растущего стебля достигает порядка 39% от полной длины годичного прироста побега. В последующем до завершения удлинения стебля рост сердцевины осуществляется в основном путем увеличений объема клеток, а суточный темп удвоения числа клеток резко снижается, несмотря на высокую среднюю суточную температуру воздуха.
Наличие большего количества кристаллической целлюлозы в поперечных стенках клеток сердцевины, чем в продольных, обеспечивает их дополнительную механическую прочность. Это обусловливает поддержание стабильности диаметра цилиндра развивающейся сердцевины и примыкающей к ней системы проводящих пучков, не препятствуя осевому росту стебля.
От начала вегетационного периода и до момента максимального набухания почки диаметр клеток сердцевины в поперечном направлении стебля всегда заметно превышает их продольный размер. В паренхиме сердцевины в данный период развития стебля создается структурная анизотропия облегченного симпластного поперечного транспорта метаболитов, связанная с тем, что в этом направлении на единицу длины встречается меньшее число клеточных мембран и стенок, чем в продольном. На поздних этапах развития стебля за счет образования первичных узких пор в продольных стенках клеток сердцевины также создаются условия поддержания симпластного радиального транспорта метаболитов от проводящих пучков центрального цилиндра к оси стебля.
В период от максимального набухания почки до завершения продольного роста стебля в сердцевине развиваются линзовидные группы толстостенных клеток склереид. Линзы склереид всегда уплощены поперек оси стебля и располагаются против листовых лакун. Они придают дополнительную механическую прочность сердцевине от боковых нагрузок на стебель, но не препятствуют его осевому росту. Склереиды также, вероятно дополняют возникновение структурной анизотропии сердцевины.
Структурная анизотропия сердцевины, вероятно, обусловливает поляризацию транспорта метаболитов от проводящих пучков центрального цилиндра в поперечном направлении, что способствует синхронизации ориентации митотического аппарата и формированию поперечных клеточных пластинок при цитокинезе клеток сердцевины.
Список литературы
Скупченко В.Б., Ладанова Н.В. 1984. Развитие хвои Picea obovata (Pinaceae). – Бот. журн. 69 (2): 203–206.
Скупченко В.Б. 1985. Органогенез вегетативных и репродуктивных структур ели. Л. 80 с.
Гриф В.Г. 1956. О возможности деления клеток у растений при отрицательных температурах. – Докл. АН СССР. 108(4): 734–737.
Гриф В.Г. 1963. Действие низких температур на митоз и хромосомы растений. – Цитология. 5(4): 404–413.
Гриф В.Г. 1981. Применение коэффициента температурной зависимости при изучении митотического цикла у растений. – Цитология. 23 (2): 166–173.
Гриф В.Г., Валович Е.М. 1973а. Действие низких положительных температур на рост и деление клеток при прорастании семян. – Цитология. 15 (11): 1362–1369.
Гриф В.Г., Валович Е.М. 1973б. Митотический цикл клеток растений при минимальной температуре митоза. – Цитология. 15(12): 1510–1514.
Гриф В.Г., Иванов В.Б., Мачс Е.М. 2002. Клеточный цикл и его параметры у цветковых растений. – Цитология. 44 (10): 936–980.
Ben-Haj-Salah H., Tardieu F. 1995. Temperature effects expansion rate of maize leaves without change in spatial distribution of cell length. Analysis of the coordination between cell division and cell expansion. – Plant Physiol. 109(3): 861–870. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC161387/
Granier C., Tardieu F. 1998. Is thermal time adequate for expressing the effects of temperature on sunflower leaf development? – Plant Cell Environ. 21(7): 695–703.
Granier C., Massonnet C., Turc O., Muller B., Chenu K., Tardieu F. 2002. Individual leaf development in Arabidopsis thaliana: a stable thermal-time-based programme. – Ann. Bot. 89(5): 595–604. https://dx.doi.org/10.1093%2Faob%2Fmcf085
Филин А.Н. 2015. Анализ роста мутанта Arabidopsis thaliana по генам, контролирующим скорость синтеза цитокининов. – Вестник МГОУ. Серия “Естественные науки”. 2: 14–17.
Филин А.Н., Иванов В.Б. 2016. Влияние 2,4-Д на пролиферацию и растяжение клеток в корнях Arabidopsis thaliana. – Физиол. растений. 63(1): 174–179.
Барлоу П.У. 1994. Деление клеток в меристемах и значение этого процесса для органогенеза и формообразования растений. – Онтогенез. 25(5): 5–28.
Selker J.M.L. 1990. Microtubule patterning in apical epidermal cells of Vinca minor preceding leaf emergence. – Protoplasma. 158: 95–108.
Green P.B., Selker J.M.L. 1991. Mutual alignment of cell walls, cellulose, and cytoskeletons: their role in meristems. – In: Cytoskeletal basis of plant growth and form. Ed. C.W. Lloyd. London. P. 303–322.
Gertel E.T., Green P.B. 1977. Cell growth pattern and wall microfibrillar arrangement. – Plant Physiol. 60(2): 247–254. https://doi.org/https://doi.org/10.1104/pp.60.2.247
Hable W.E., Bisgrove S.R., Kropf D.L. 1998. To shape a plant – the cytoskeleton in plant morphogenesis. – Plant Cell. 10(11): 1772–1774. https://doi.org/https://doi.org/10.1105/tpc.10.11.1772
Fleming A.J. 2006. The co-ordination of cell division, differentiation and morphogenesis in the shoot apical meristem: a perspective. – J. Exp. Bot. 57(1): 25–32. https://doi.org/https://doi.org/10.1093/jxb/eri268
Shapiro B.E., Tobin C., Mjolsness E., Meyerowitz E.M. 2015. Analysis of cell division patterns in the Arabidopsis shoot apical meristem. – PNAS. Apr 14. 112 (15): 4815–4820. https://doi.org/https://doi.org/10.1073/pnas.1502588112
Мэзия Д. 1963. Митоз и физиология клеточного деления. М. 427 с.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Д. 1994. Молекулярная биология клетки. 2-е изд.Т. 1. Пер. с англ. М. 517 с. http://biology.org.ua/files/lib/Alberts_et_al_vol1.pdf
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Д. 1994. Молекулярная биология клетки: 2-е изд. Т. 2. Пер. с англ. М. 539 с. http://biology.org.ua/files/lib/Alberts_et_al_vol2.pdf
Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Д. 1994. Молекулярная биология клетки. 2-е изд. Т. 3. Пер. с англ. М. 504 с. http://biology.org.ua/files/lib/Alberts_et_al_vol3.pdf
Hall J.L., Flowers T.J., Roberts R.M. 1981. Plant cell structure and metabolism. Ed. 2. London, New York. 543 p.
Galston A.W., Davies P.J., Satter R.L. 1980. The life of the green plant. 3 edition. Englewood Cliffs. NJ. 552 p.
Гамалей Ю.В. 1972. Цитологические основы дифференциации ксилемы. Л. 144 с.
Архив погоды в городах России за последние полвека. www.atlas-yakutia.ru
Скупченко В.Б. 1979. Вибрационная микротомия мягких тканей. Сер. препринт. сообщ. “Новые научные методики”. Коми фил. АН СССР. Вып. 2. Сыктывкар. 56 с.
Пирс Э. 1962. Гистохимия. Теоретическая и прикладная. Пер. с англ. М. 963 с.
Выгодский М.Я. 1983. Справочник по высшей математике. М. 870 с.
Скупченко В.Б., Ладанова Н.В., Тужилкина В.В. 1997. Формирование побегов и их функциональная организация в кроне Picea obovata (Pinaceae). – Бот. журн. 82(5): 16–27.
Fiorani F., Beemster G.T.S. 2006. Quantitative analyses of cell division in plants. – Plant Mol. Biol. 60: 963–979. https://doi.org/https://doi.org/10.1007/s11103-005-4065-2
Лакин Г.Ф. 1980. Биометрия. М. 293 с.
Кнорре Д.Г., Крылова Л.Ф., Музыкантов В.С. 1990. Физическая химия: Учеб. для биол. факультетов ун-тов и пед. вузов. – 2-е изд., испр. и доп. М. 416 с.
Скупченко В.Б. 2012. Структурная организация оболочек клеток апикальных меристем побегов Picea obovata и Picea abies (Pinaceae). – Бот. журн. 97(12): 1579–1588.
Эзау К. 1969. Анатомия растений. Пер с англ. М. 564 с.
Эзау К. 1980. Анатомия семенных растений. Кн. 1. Пер с англ. М. 218 с.
Саляев Р.К. 1969. Поглощение веществ растительной клеткой. М. 206 с.
Саляев Р.К., Швецова И.В. 1969. Адсорбционные свойства изолированных стенок растительной клетки. – Физиол. растений. 16: 447–451.
Курсанов А.Л. 1976. Транспорт ассимилятов в растении. М. 647 с.
Еремин В.М., Чавчавадзе Е.С. 2015. Анатомия вегетативных органов сосновых (Pinaceae Lindl.). Брест. 692 с.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


