Растительные ресурсы, 2019, T. 55, № 2, стр. 213-230
Определение активности супероксиддисмутазы и полифенолоксидазы в древесине Betula pendula var. carelica (Betulaceae) при разной степени нарушения ксилогенеза
К. М. Никерова 1, *, Н. А. Галибина 1, Ю. Л. Мощенская 1, М. Н. Бородина 1, И. Н. Софронова 1
1 Федеральный исследовательский центр “Карельский научный центр Российской академии наук” Институт леса КарНЦ РАН
г. Петрозаводск, Россия
* E-mail: knikerova@yandex.ru
Поступила в редакцию 17.10.2018
После доработки 12.02.2019
Принята к публикации 17.04.2019
Аннотация
В статье освещены результаты модификации условий для определения супероксиддисмутазной и полифенолоксидазной активностей в тканях ксилемы и флоэмы у древесных растений на примере карельской березы (Betula pendula Roth var. carelica (Mercl.) Hämet-Ahti). При апробации предложенных методов проведения реакций и математической оценки активности учтены некоторые минорные особенности протекания данных реакций. Показано разнонаправленное поведение ферментов супероксиддисмутазы и полифенолоксидазы при разных сценариях ксилогенеза у березы.
Образование активных форм кислорода (АФК) необходимо для жизнедеятельности любого растительного организма. Низкий уровень АФК всегда присутствует в клетках, вовлекаясь в ее нормальный метаболизм. АФК задействованы в гормональной регуляции экспрессии генов защиты от стресса, их рассматривают как сигнальные молекулы, контролирующие активность стресс-протекторных систем [1, 2]. Поскольку избыток АФК возникает при действии практически любого фактора окружающей среды, в клетке существуют различные механизмы, направленные на поддержание определенного оптимального уровня АФК. В их основе лежит работа ферментов и неэнзиматических компонентов, образующих вместе антиоксидантную систему (АОС). Ферменты АОС принимают участие в регуляции метаболизма в ходе онтогенеза, обеспечивая быстрое приспособление организма к постоянно изменяющимся условиям среды [3].
Наши исследования показали изменение активности ферментов АОС (каталазы (КАТ) и пероксидазы (ПОД)) при нарушении ксилогенеза у карельской березы (Betula pendula Roth var. carelica (Mercl.) Hämet-Ahti). Ксилогенез – процесс формирования древесины, играет ключевую роль в повышении продуктивности древесных растений. Карельская береза – форма березы повислой (B. pendula var. pendula), у которой в результате нарушения деятельности камбия в местах аномалий формируется узорчатая древесина, представляет собой уникальный объект для изучения механизмов ксилогенеза. В период активной камбиальной деятельности у растений с аномальной структурой древесины в тканях ствола активность КАТ и ПОД значительно выше, чем в нормальных по строению тканях [4–8]. В ряду растений карельской березы с увеличением степени узорчатости древесины активность ПОД возрастает [9], что позволяет проводить количественную экспресс-диагностику аномальной древесины карельской березы по определению активности гваякол-пероксидазы в ксилеме [10]. Отличительные особенности по активности ферментов антиоксидантной системы проявляются у карельской березы уже на ранних этапах онтогенеза, когда внешние видимые признаки еще отсутствуют [5, 7].
Принимая во внимание повышенную активность ПОД и КАТ в камбиальной зоне карельской березы, мы предположили, что другие ферменты АОС, связанные за счет метаболических реакций с ПОД и КАТ, также могут биохимически отражать структурные аномалии и служить для их обнаружения на разных этапах онтогенеза. В данной статье особое внимание мы уделяем двум ферментам: супероксиддисмутазе (СОД) (EC 1.15.1.1) и полифенолоксидазе (ПФО) (EC 1.14.18.1). СОД является неотъемлемой частью АОС и выступает на первой линии защиты, а вот вопрос о том, относится ли ПФО к АОС растений, остается дискуссионным.
За счет деятельности СОД поддерживается баланс между супероксид-радикалом и перекисью водорода, которые играют роль вторичных мессенджеров во многих процессах. Среди них: толерантность при высоких и низких температурах; сигнальная активация генов, ответственных за стресс; защита от патогенов за счет запуска пероксидаз; поддержание взаимодействия между активными формами кислорода и азота; регуляция генов, связанных с фотосинтезом во время естественного старения и клеточной смерти; контроль за ростом и развитием растений и др. [11].
ПФО, в основном, относят к ключевым ферментам вторичного метаболизма, выделяя данный фермент в отдельную линию защиты с выполнением особых функций в окислительных процессах растения [3, 12, 13]. Однако некоторые исследователи включают ее непосредственно в состав АОС [14, 15]. Для древесных растений изучение ПФО активности представляет особый интерес в связи с участием в процессах синтеза лигнина [16, 17]. Также ПФО приписывают роль в оценке качества древесины за счет того, что фермент контролирует реакции окислительного потемнения тканей [17–20].
Есть большое количество работ, в которых описаны методы определения активности СОД и ПФО. Как правило, активности данных ферментов имеют относительные значения (% от контроля при воздействии различных факторов), и ввиду отсутствия информации о некоторых минорных особенностях протекания реакций, сравнение результатов исследований между разными видами растений становится практически невозможным. Дополнительные трудности могут возникнуть, если предстоит анализ тканей древесного растения, так как информация о подборе условий для проведения реакции определения активностей СОД и ПФО для древесного растения в известной нам литературе недостаточна.
Таким образом, целью нашей работы является модификация имеющихся методов определения активностей СОД и ПФО и их адаптация для определения активностей в тканях ствола древесных растений (на примере карельской березы). А также проверка гипотезы о различных метаболических стратегиях данных ферментов у карельской березы при разных сценариях ксилогенеза.
МАТЕРИАЛ И МЕТОДЫ
Растительный материал
В качестве объектов исследования мы отбирали высокоствольные растения карельской березы с высокой степенью узорчатости древесины (узорчатые растения) и растения, у которых признак узорчатости не проявился (безузорчатые растения). Всего было взято 26 растений: 16 узорчатых и 10 безузорчатых. Все растения были выращены из сеянцев, полученных из семян от контролируемого опыления деревьев карельской березы. Растения карельской березы произрастали на лесосеменной плантации в Медвежьегорском районе Республики Карелия. Возраст растений 25 лет.
Исследование проводили в период камбиального роста (30 июня 2016 г.), когда изменения метаболического статуса клеток камбиальной зоны могут привести к появлению структурных аномалий ксилемы и флоэмы. На стволе березы вырезали окошки 10 × 6 см и отделяли кору от древесины. С поверхности древесины соскабливали ткани ксилемы, куда входили материнские клетки ксилемы и наружные слои прироста ксилемы текущего года. С внутренней поверхности коры препарировали ткани флоэмы, которые включали камбиальную зону, проводящую флоэму и самые внутренние слои непроводящей флоэмы. Отбор образцов тканей ствола контролировали под световым микроскопом. У узорчатых растений карельской березы ткани отбирали из участков ствола с характерными вздутиями, неровностями, крупными бугорками и бугорчатыми выпуклостями. Весь растительный материал замораживали в жидком азоте и хранили в низкотемпературной морозильной камере при –70 °C.
Биохимические исследования
Ткани ксилемы и флоэмы растирали с жидким азотом и гомогенизировали при 4 °C в буфере следующего состава: 50 мМ Hepes (pH 7.5), 1 мМ ЭДТА, 1 мМ ЭГТА, 3 мМ ДТТ, 5 мМ MgCl2, 0.5 мМ PMSF. После 20-минутной экстракции гомогенат центрифугировали при 10 000 g в течение 20 мин (центрифуга MPW-351R, Польша). Далее проводили диализ при 4 °C в течение 18–20 ч против буфера для гомогенизации, разбавленного в 10 раз [21]. В полученных после диализа ферментативных препаратах спектрофотометрически (СФ 2000, Россия) определяли активность ферментов.
Об активности СОД судили по ингибированию фотовосстановления нитросинего тетразолия (НСТ). Инкубационная среда для определения активности СОД содержала 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 210 мкМ метионин, 24 мкМ рибофлавин, 0.1% тритон Х-100. Для определения активности СОД измеряли уменьшение оптической плотности при 560 нм после 30 минут инкубации. Активность СОД выражали в усл. ед. на 1 мг белка за 30 минут (усл. ед./мг белка). Содержание белка в ферментативном препарате определяли по методу Бредфорда.
Для определения активности ПФО в качестве субстрата использовали пирокатехин. Инкубационная среда для определения активности ПФО содержала 50 мМ K, Na-фосфатный буфер (рН 5), 16.4 мМ пирокатехин. Для определения активности ПФО измеряли увеличение оптической плотности при длине волны 420 нм, где поглощают продукты окисления пирокатехина. Время наблюдения за реакцией – 20 минут. Активность ПФО выражали в усл. ед. на 1 мг белка за 1 минуту (усл. ед./мг белка).
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Математическая обработка
Математическая обработка данных осуществлялась в среде Microsoft Excel. Эксперименты проводили в 10 (для безузорчатых) и 16 (для узорчатых растений) биологических повторностях. На диаграммах приведены средние значения и их стандартные ошибки (n = 10 и 16 соответственно). Для оценки достоверности различий использовали двухвыборочный t-тест с различными дисперсиями. Статистически значимыми считали различия при р ≤ 0.01.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Подбор условий для определения активности супероксиддисмутазы
Некоторые сложности в определении активности СОД рассматриваются еще со времен знаменитой работы “Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels” [22], в которой активность СОД было предложено определять по ингибированию фотовосстановления НСТ. Позднее вышла статья о спектрофотометрическом приложении данного метода [23], который сейчас широко используется исследователями. Суть реакции в том, что на свету рибофлавин генерирует супероксид-радикалы, которые окисляют НСТ в присутствии метионина до формазана, имеющего синюю окраску. СОД, находящаяся в ферментативном препарате, катализирует образование перекиси водорода, используя рибофлавин в качестве источника супероксид-радикала и метионин в качестве донора водорода. При этом не происходит окисление НСТ, и соответственно синяя окраска не развивается в той или иной степени. Подавление образования синей окраски прямо пропорционально активности СОД. За единицу активности СОД принимают количество фермента, вызывающее 50% ингибирования фотовосстановления НСТ [14, 24–26].
Для определения активности СОД были подготовлены рабочие растворы: 1.72 мМ НСТ, 2.1 мМ метионин, 1%-й тритон Х-100, 0.24 мМ рибофлавин [27]. В качестве контрольного варианта (D1 в формуле для расчета) использовали следующую смесь: 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 210 мкМ метионин, 24 мкМ рибофлавин, 0.1%-й тритон Х-100. Общий объем инкубационной среды – 1 мл. В качестве опытного варианта (D2 в формуле для расчета) использовали смесь: 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 210 мкМ метионин, 24 мкМ рибофлавин, 0.1%-й тритон Х-100 и 500 мкл ферментного препарата. Общий объем инкубационной среды – 1 мл.
Пробы инкубировали под светом флюоресцентных ламп [28]. Постоянный световой режим является важным условием протекания реакции, так как образование рибофлавином супероксидных радикалов интенсивно протекает при облучении, и при различных видах нестандартного светового воздействия активность СОД может изменяться [29]. После 30 мин инкубации измеряли оптическую плотность образцов при длине волны 560 нм против холостой кюветы, содержащей фосфатный буфер. При дальнейшем наблюдении за реакцией во времени окраска не становилась интенсивнее.
При проведении анализа было обнаружено, что оптические плотности некоторых опытных образцов превосходили оптическую плотность контрольного образца, при чем при изменении концентраций рибофлавина и метионина этого эффекта избежать не удавалось. Подобный эффект мог быть вызван присутствием в ферментных препаратах веществ, подобных метионину и рибофлавину. Для устранения их мешающего воздействия были проведены дополнительные серии измерений, при которых в инкубационную среду поочередно не добавляли метионин и рибофлавин.
Дополнительная серия измерений 1 (в инкубационной среде отсутствовал метионин):
В качестве контрольного варианта (D3 в формуле для расчета) использовали следующую смесь: 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 24 мкМ рибофлавин, 0.1%-й тритон Х-100. Общий объем инкубационной среды – 1 мл. В качестве опытного варианта (D4 в формуле для расчета) использовали смесь: 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 24 мкМ рибофлавин, 0.1%-й тритон Х-100 и 500 мкл ферментного препарата. Общий объем инкубационной среды – 1 мл.
Дополнительная серия измерений 2 (в инкубационной среде отсутствовал рибофлавин):
В качестве контрольного варианта (D5 в формуле для расчета) использовали следующую смесь: 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 210 мкМ метионин, 0.1%-й тритон Х-100. Общий объем инкубационной среды – 1 мл. В качестве опытного варианта (D6 в формуле для расчета) использовали смесь: 50 мМ K, Na-фосфатный буфер (рН 7.8), 172 мкМ НСТ, 210 мкМ метионин, 0.1%-й тритон Х-100 и 500 мкл ферментного препарата. Общий объем инкубационной среды – 1 мл.
При наблюдении за дополнительными сериями измерений для опытных образцов, мы отметили развитие окраски, выраженное в разной степени у разных образцов, что подтверждает присутствие в ферментных препаратах веществ, подобных метионину и рибофлавину. А, как известно, система рибофлавин–метионин является источником активных форм кислорода [30] (рис. 1).
Рис. 1.
Измерение активности супероксиддисмутазы в образцах ксилемы и флоэмы. a – инкубационная среда содержит НСТ, метионин и рибофлавин, b – инкубационная среда без рибофлавина, c – инкубационная среда без метионина. Слева направо: 1 – контрольная проба, 2 и 3 – инкубационная среда с добавлением ферментных препаратов из тканей ксилемы карельской березы, 4 и 5 – инкубационная среда с добавлением ферментных препаратов из тканей флоэмы карельской березы. Fig. 1. Changes in superoxide dismutase activity in xylem and phloem samples. a – incubation medium containing NBT, methionine and riboflavin, b – incubation medium without riboflavin, c – incubation medium without methionine. Left to right: 1 – control sample, 2 and 3 – incubation medium with addition of enzyme from B. pendula var. carelica xylem tissues, 4 and 5 – incubation medium with addition of enzyme form B. pendula var. carelica phloem tissues.

Показатель степени ингибирования образования окраски (В), который соответствует условной активности супероксиддисмутазы, определяли по формуле:
Для нахождения активности СОД (А) использовали формулу:
где V – объем супернатанта, мл; m – масса белка в навеске, взятой для анализа, мг; 2 – коэффициент, показывающий разведение супернатанта; 10 – длина оптического пути, мм.Подбор условий для определения активности полифенолоксидазы
Обычно активность полифенолоксидазы выражают в условных единицах, как количество фермента, вызывающее увеличение оптической плотности на 0.1, 0.01 или 0.001 единицу абсорбции за 1 минуту. В качестве субстрата реакции чаще всего используют пирокатехин [31–34].
Для определения активности ПФО был подготовлен 1 М раствор пирокатехина. За единицу активности ПФО принимали увеличение оптической плотности на 0.001 единицу абсорбции за 1 минуту [35–39]. Часто расчет ПФО ведется именно по изменению оптической плотности на 0.001 единицу абсорбции, в связи с тем, что эта величина позволяет оценить окислительные возможности пирокатехина во многих растительных объектах. Использование для расчета активности ПФО увеличения абсорбции на 0.01 [40, 41] и даже 0.1 [42–44] единицу, вероятно, связано с наличием высокой активности ПФО в изучаемых объектах. Инкубационная среда содержала 50 мМ K, Na-фосфатный буфер (рН 5), 16.4 мМ пирокатехин. Общий объем инкубационной среды – 1.22 мл.
Ферментные препараты могут существенно отличаться друг от друга по значению оптической плотности при 420 нм, также добавление пирокатехина приводит к изменению оптической плотности. Поэтому для получения корректных результатов эти факты нужно обязательно учитывать при расчете активности ПФО.
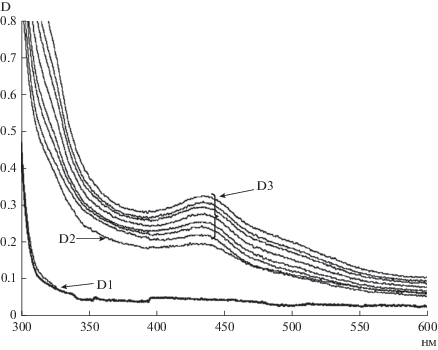
Для изучаемых объектов была адаптирована следующая схема определения полифенолоксидазной активности. В качестве холостой пробы использовали фосфатный буфер. Первая кювета (D1 в формуле для расчета) содержала фосфатный буфер и 16.4 мМ пирокатехин. Во вторую кювету (D2 в формуле для расчета) к фосфатному буферу добавляли 200 мкл ферментного препарата. Измеряли оптические плотности при 420 нм относительно холостой кюветы, содержащей фосфатный буфер. Затем во вторую кювету добавляли пирокатехин, тем самым, запуская реакцию полифенолоксидазного окисления, и наблюдали за реакцией в течение 20 минут, периодически измеряя оптическую плотность (D3 в формуле для расчета) при длине волны 420 нм против холостой кюветы (рис. 2).
Рис. 2.
Изменение электронных спектров инкубационной смеси, содержащей: (D1) фосфатный буфер и 16.4 мМ пирокатехин (оптическая плотность практически не изменяется за время наблюдения за реакцией); (D2) фосфатный буфер и 200 мкл ферментного препарата; (D3) фосфатный буфер, 200 мкл ферментного препарата и 16.4 мМ пирокатехин (оптическая плотность увеличивается при наблюдении за реакцией, что связано с окислением пирокатехина). Общий объем инкубационной смеси во всех вариантах 1.22 мл. Измерения производили через 1, 3, 5, 7, 10, 15, 20 мин после запуска реакции. По горизонтали: длина волны; по вертикали: оптическая плотность. Fig. 2. Changes in the electronic spectra of incubation mixture containing: (D1) phosphate buffer and 16.4 mm pyrocatechin (optical density is almost unchangeable for the duration of observation); (D2) phosphate buffer and 200 µl of enzyme; (D3) phosphate buffer, 200 µl of enzyme and 16.4 mm pyrocatechin (optical density increases during the observation, which is associated with the pyrocatechin oxidation). The total volume of each incubation mixture was 1.22 ml. Measurements were made 1, 3, 5, 7, 10, 15, 20 min after start of reaction. X-axis: wavelength, nm; y-axis: optical density.
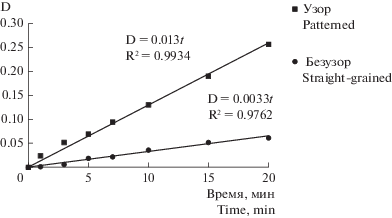
Для нахождения активности ПФО сначала строили график зависимости изменения оптической плотности образца (D) от времени (рис. 3), где D = D3 – D2 – D1, D1 и D3 – изменяются при наблюдении за реакцией во времени, для каждой точки измерения оптической плотности при разном времени будут принимать новые значения.
Рис. 3.
График зависимости изменения оптической плотности от времени реакции в образцах ксилемы узорчатых (узор) и безузорчатых (безузор) растений карельской березы. По горизонтали: время наблюдения за реакцией (t); по вертикали: оптическая плотность (D). На графике отображены уравнения зависимостей с указанием коэффициента аппроксимации (R2). Fig. 3. Dependence of the optical density on the duration of the reaction in the patterned and straight-grained xylem samples of B. pendula var. carelica. X-axis: time of measurement (t, min); y-axis: optical density (D). The graph shows the dependence equations and the approximation coefficient (R2).
Затем находили активность фермента (А) используя формулу:
Активность СОД и ПФО у безузорчатых и узорчатых растений карельской березы
В результате проведенного исследования получено, что активность СОД у узорчатых растений по сравнению с безузорчатыми была выше как в тканях ксилемы, так и в тканях флоэмы. Статистическая обработка данных с применением двухвыборочного t-теста с различными дисперсиями показала, что различия значимы: в ксилеме (p = 0.0051) и во флоэме (p = 0.00065). При этом в тканях флоэмы активность СОД превосходила таковую в тканях ксилемы в 6 и 4 раза у безузорчатых и узорчатых растений соответственно (рис. 4).
Рис. 4.
Активность СОД (усл. ед./мг белка) в ксилеме и флоэме у безузорчатых (безузор) и узорчатых (узор) растений карельской березы. Различия значимы при p ≤ 0.01 (**) и p ≤ 0.001 (***). Fig. 4. SOD activity (U/mg protein) in xylem and phloem of straight-grained and patterned B. pendula var. carelica. Differences are significant at p ≤ 0.01 (**) and p ≤ 0.001 (***).

Активность СОД повышается при возрастании уровня свободнорадикальных процессов, которые, как правило, связывают с различными видами стрессовых воздействий: водный дефицит, переувлаженение почвы, различное световое и температурное воздействие, обработка растений озоном, тяжелыми металлами, гормонами, инокуляция патогенами [11, 24, 27, 45–47]. Формирование аномальной древесины у карельской березы сопровождается повышением степени паренхиматизации проводящих тканей [48, 49]. В ходе камбиального роста здесь происходит изменение программ клеточной дифференцировки: вместо ситовидных трубок флоэмы, сосудов и волокон ксилемы формируются клетки паренхимы [50]. Сценарии ксилогенеза, при которых идет образование безузорчатой и узорчатой древесины, отличаются между собой по способу утилизации основной транспортной формы сахаров у березы – сахарозы. При формировании нормальной по строению древесины (преобладают сосуды и волокна) метаболизация сахарозы идет преимущественно сахарозосинтазой [51] с образованием УДФ-глюкозы и фруктозы. УДФ-глюкоза расходуется непосредственно на синтез компонентов клеточных стенок, выводя, тем самым, углеродные субстраты из обмена веществ. При нарушении камбиальной деятельности (увеличение количества паренхимных клеток) гидролиз сахарозы происходит преимущественно по инвертазному пути [52], в результате которого дисахарид расщепляется на глюкозу и фруктозу. Избыток гексоз утилизируется за счет работы цикла Кребса и пентозофосфатного пути. При этом образуются АФК за счет деятельности ферментов дегидрогеназ и оксигеназ [53–55]. К тому же, клетки паренхимы характеризуются активными дыхательными процессами, благодаря чему в электрон-транспортной цепи образуется большое количество супероксидных радикалов [11, 56].
В конце июня дифференцирующаяся ксилема является основным местом потребления ассимилятов, донорами которых служат фотосинтезирующие листья. У обычной березы имеет место интенсивный поток сахарозы из флоэмы в ксилему, где она расходуется на формирование структурных элементов древесины, а у карельской березы отток сахарозы из флоэмы замедлен, и ее использование в значительной степени происходит во флоэме [51]. Ранее было показано, что метаболизация сахарозы во флоэме у березы происходит преимущественно по инвертазному пути [52], а в ксилеме – по сахарозосинтазному пути [51]. Вероятно, причиной более высокой активности СОД в аномальных тканях, по сравнению с нормальными по строению тканями, и в тканях флоэмы, по сравнению с тканями ксилемы, является возрастание метаболизации сахарозы по инвертазному пути в паренхимных клетках и, как следствие, интенсивное образование АФК.
Образующаяся в результате работы СОД перекись водорода нейтрализуется КАТ и ПОД, активность которых в период камбиального роста у узорчатых растений выше, чем у безузорчатых [4, 6, 8]. Высокая активность ПОД, которая часто выполняет оксидазную функцию, сопровождается образованием супероксид-радикалов [57], что также может повышать активность СОД в аномальных тканях.
Ферменты АОС находятся во взаимосвязи друг с другом за счет образования и утилизации АФК. Поддержание необходимого для клетки равновесия супероксид-радикалов и перекиси водорода происходит за счет взаимосвязанного функционирования СОД, ПОД и КАТ [11, 47]. Известны взаимопревращения АФК друг в друга при поддержании свободнорадикальных процессов и ферментативных превращений [2]. Кроме того, активный синтез фенольных соединений у растений делает возможным использование АФК в качестве субстратов окислительных пероксидазных и полифенолоксидазных реакций [58]. Продуктами реакции каталазного окисления являются вода и молекулярный кислород, который, в свою очередь, может вызвать возрастание активности ПФО. Так, КАТ, ПОД и ПФО связаны друг с другом посредством молекулярного кислорода, как продукта каталазной реакции, и фенолов растительного организма, а также перекиси водорода, генерируемой деятельностью СОД [50, 60].
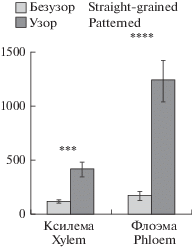
Изучение активности ПФО выявило те же закономерности, как и для СОД. Статистическая обработка данных с применением двухвыборочного t-теста с различными дисперсиями показала, что активность ПФО в узорчатых тканях превосходила таковую у безузорчатых растений в ксилеме в 3.5 раза (p = 0.00015), а во флоэме в 7 раз (p = 0.000095). При этом, у безузорчатых растений активность ПФО во флоэме была выше по сравнению с ксилемой в 1.5 раза, в то время как у узорчатых растений – в 3 раза (рис. 5).
Рис. 5.
Активность ПФО (усл. ед./мг белка) в ксилеме и флоэме у безузорчатых (безузор) и узорчатых (узор) растений карельской березы. Различия значимы при p ≤ 0.001 (***) и p ≤ 0.0001 (****). Fig. 5. PPO activity (U/mg protein) in xylem and phloem of straight-grained and patterned B. pendula var. carelica. Differences are significant at p ≤ 0.001 (***) and p ≤ 0.0001 (****).
В качестве сигнальной молекулы, запускающей гены ПФО, может выступать перекись водорода [61], большие количества которой, судя по активности СОД (рис. 4), ПОД и КАТ [4, 6–8], образуются в узорчатых тканях. Продуктами полифенолоксидазной реакции являются высокоактивные молекулы – хиноны, образующие семихинонные радикалы, которые ковалентно присоединяться к другим молекулам или генерируют большое количество супероксидных радикалов, приводя, в свою очередь, к увеличению активности СОД [61, 62]. Следует отметить, что высокий уровень экспрессии генов, кодирующих ПФО, наблюдается в паренхимных клетках. Например, такой эффект обнаруживали в клетках ксилемной паренхимы у растений томата при поранении [61], в паренхиме плодов и листьев оливы при созревании [19]. Информация о количественных значениях ПФО в известной нам литературе недостаточна, и, в основном, представлена для травянистых растений. Так, при расчете активности ПФО, используя увеличение абсорбции на 0.001 единицу, было показано, что у цветов брокколи она достигает сотен и тысяч условных единиц [37], у плодов водяного ореха около 1000 [38], а у щавеля около 1300 [39].
Повышение активности ПФО может быть обусловлено ее участием в синтезе лигнина [16, 17]. Высокоактивные хиноны могут модифицировать и сшивать большое количество клеточных молекул с получением полимеров [33]. При этом одревеснение клеточных стенок трахеальных и волокнистых элементов происходит с участием клеток паренхимы: синтезирующиеся в них монолигнолы экспортируются в клеточную стенку соседних одревесневающих клеток [63–67]. В предыдущих наших исследованиях было показано, что в тканях ксилемы у B. pendula var. carelica выше жесткость структуры клеточной стенки, по сравнению с B. pendula var. pendula, за счет увеличения доли компонентов фенольной природы, как в составе лигнина, так и в виде поперечных диферуловых мостиков [68].
Кроме того, в клетках паренхимы содержится большое количество фенолов [69], таким образом, нет недостатка для действия ПОД и ПФО, которые, выполняя сходные каталитические функции, нейтрализуют перекись водорода и активный кислород, наличие которых сопровождает активные дыхательные процессы в этих тканях.
Таким образом, на примере безузорчатых и узорчатых растений карельской березы, различающихся по структуре древесины, показана не раз отмечаемая в литературе, взаимосвязь ферментов АОС. Причиной возрастания активности ферментов антиоксидантной защиты при аномальном ксилогенезе является возрастание роли инвертазного пути при утилизации сахарозы.
ЗАКЛЮЧЕНИЕ
Методы определения активности ферментов не являются статичным явлением. Проведенное исследование еще раз подтверждает сложность подбора условий для проведения биохимических реакций и необходимость их адаптации в соответствии с особенностями разных объектов.
Предложенные в статье методы определения активности СОД и ПФО, как нам кажется, позволят учитывать особенности ферментного препарата исследуемых образцов, что особенно важно для тканей древесного растения.
Используя модифицированные методы, мы определили активность СОД и ПФО у карельской березы в нормальных и аномальных тканях ксилемы и флоэмы. Оказалось, что и активность СОД, и активность ПФО, будучи вовлеченными в общую цепь реакций АОС, отличаются у узорчатых и безузорчатых растений карельской березы, подтверждая их различный метаболический статус при разных сценариях ксилогенеза.
Список литературы
Desikan R., Mackerness S.A.-H., Hancock J.T., Neill S.J. 2001. Regulation of the Arabidopsis transcriptome by oxidative stress. – Plant Physiol. 27(1): 159–172. https://doi.org/10.1104/pp.127.1.159
Apel K., Hirt H. 2004. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. – Annu. Rev. Plant Biol. 55: 373–399.https://doi.org/10.1146/annurev.arplant.55.031903.141701
Polovnikova M.G., Voskresenskaya O.L. 2008. Activities of antioxidant system components and polyphenol oxidase in ontogeny of lawn grasses under megapolis conditions. – Russ. J. Plant Physiol. 5(5): 699–705.https://doi.org/10.1134/S1021443708050154
Галибина Н.А., Целищева Ю.Л., Андреев В.П., Софронова И.Н., Никерова К.М. 2013. Активность пероксидазы в органах и тканях деревьев березы повислой. – Ученые записки ПетрГУ. Серия Естественные и технические науки. 133(4): 7–13. http://uchzap.petrsu.ru/files/n133.pdf
Никерова К.М., Галибина Н.А., Мощенская Ю.Л., Новицкая Л.Л., Подгорная М.Н., Софронова И.Н. 2016. Каталазная активность в листовом аппарате у сеянцев березы повислой разных форм (Betula pendula Roth): var. pendula и var. carelica (Mercklin). – Труды КарНЦ РАН. Серия Экспериментальная биология. 11: 68–77.https://doi.org/10.17076/eb460
Никерова К.М., Галибина Н.А. 2017. Влияние нитратного азота на пероксидазную активность в тканях Betula pendula Roth var. pendula и B. pendula var. carelica (Mercklin). – Сибирский лесной журнал. 1: 15–24.https://doi.org/10.15372/SJFS20170102
Никерова К.М., Галибина Н.А., Мощенская Ю.Л., Новицкая Л.Л., Подгорная М.Н., Софронова И.Н. 2018. Ферменты антиоксидантной системы – индикаторы разных сценариев ксилогенеза: в раннем онтогенезе и во взрослом состоянии (на примере Betula pendula Roth). – Труды КарНЦ РАН. Серия Экспериментальная биология. 6: 68–80.https://doi.org/10.17076/eb787
Никерова К.М., Галибина Н.А., Мощенская Ю. Л., Новицкая Л. Л., Подгорная М. Н., Софронова И. Н. 2019. Участие каталазы и пероксидазы в процессах ксилогенеза у карельской березы. – Лесоведение. 2: 115–127. https://doi.org/10.1134/S0024114819020086
Галибина Н.А., Мошкина Е.В., Никерова К.М., Мощенская Ю.Л., Знаменский С.Р. 2016б. Активность пероксидазы как индикатор степени узорчатости древесины карельской березы. – Лесоведение. 4: 294–304.
Галибина Н.А., Никерова К.М. Способ диагностики узорчатой текстуры древесины карельской березы: Пат. 2596013, № 2015114510/13; Заявл. 17.04.2015, Опубл. 27.08.2016, Бюл. № 24.
Jajic I., Sarna T., Strzalka K. 2015. Senescence, stress, and reactive oxygen species. – Plants. 4(3): 393–411.https://doi.org/10.3390/plants4030393
Cakmak I., Römheld V. 1997. Boron deficiency-induced impairments of cellular functions in plants. – Plant Soil. 193(1–2): 71–84.https://doi.org/10.1023/A:1004259808322
Guo H., Sun Y., Li Y., Liu X., Zhang W., Ge F. 2014. Elevated CO2 decreases the response of the ethylene signaling pathway in Medicago truncatula and increases the abundance of the pea aphid. – New Phytol. 201(1): 279–291.https://doi.org/10.1111/nph.12484
Vatankhah E., Niknam V., Ebrahimzadeh H. 2010. Activity of antioxidant enzyme during in vitro organogenesis in Crocus sativus. – Biol. Plant. 54(3): 509–514.https://doi.org/10.1007/s10535-010-0089-9
Abdalla M.M. 2011. Beneficial effects of diatomite on the growth, the biochemical contents and polymorphic DNA in Lupinus albus plants grown under water stress. – Agric. Biol. J. N. Am. 2(2) 207–220.https://doi.org/10.5251/abjna.2011.2.2.207.220
Boudet A.M., Kajita S., Grima-Pettenati J., Goffner D. 2003. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. – Trends Plant Sci. 8(12): 576–581.https://doi.org/10.1016/j.tplants.2003.10.001
Yang H.Q., Zhou C.S., Wu F.H., Cheng J.Y. 2010. Effect of nitric oxide on browning and lignification of peeled bamboo shoots. – Postharvest Biol. Tec. 57(1): 72–76.https://doi.org/10.1016/j.postharvbio.2010.02.004
Dehon L., Macheix J.J., Durand M. 2002. Involvement of peroxidases in the formation of the brown coloration of heartwood in Juglans nigra. – J. Exp. Bot. 53(367): 303–311.https://doi.org/10.1093/jexbot/53.367.303
Ortega-Garcia F., Blanco S., Angeles M., Perag J. 2008. Polyphenoloxidase and its relationship with oleuropein concentration in fruits and leaves of olive (Olea europaea) cv. ‘Picual’ trees during fruit ripening. – Tree Physiol. 28(1): 45−54.https://doi.org/10.1093/treephys/28.1.45
Newman S.M., Tantasawat P., Steffens J.C. 2011. Tomato Polyphenol Oxidase B Is Spatially and Temporally Regulated during Development and in Response to Ethylene. – Molecules. 16(1): 493–517. https://doi.org/10.3390/molecules16010493
Галибина Н.А., Новицкая Л.Л., Никерова К.М. 2016. Избыток экзогенных нитратов подавляет формирование аномальной древесины у карельской березы. – Онтогенез. 47(2): 83–91. https://doi.org/10.7868/S047514501602004X
Beauchamp C., Fridovich I. 1971. Superoxide dismutase: Improved assays applicable to acrylamide gels. – Anal. Biochem. 44(1): 276–287.https://doi.org/10.1016/0003-2697(71)90370-8
Beyer W.F., Fridovich I. 1987. Assaying for superoxide dismutase activity: some large consequences of minor changes in conditions. – Anal. Biochem. 161(2): 559–566.https://doi.org/10.1016/0003-2697(87)90489-1
Chen Y., Zhang M., Chen T., Zhang Y., An L. 2006. The relationship between seasonal changes in anti-oxidative system and freezing tolerance in the leaves of evergreen woody plants of Sabina. – S. Afr. J. Bot. 72(2): 272–279.https://doi.org/10.1016/j.sajb.2005.09.004
El-Mashad A.A.A., Mohamed H. I. 2012. Brassinolide alleviates salt stress and increases antioxidant activity of cowpea plants (Vigna sinensis). – Protoplasma. 2012. 249(3): 625–635.https://doi.org/10.1007/s00709-011-0300-7
Rodrigues L.C.A., Martins J.P.R., de Almeida Júnior O., Guilherme L.R.G., Pasqual M., de Castro E.M. 2017. Tolerance and potential for bioaccumulation of Alternanthera tenella Colla to cadmium under in vitro conditions. – Plant Cell Tiss. Organ Cult. 130(3): 507–519.https://doi.org/10.1007/s11240-017-1241-4
Jain K., Kataria S., Guruprasad K.N. 2004. Effect of UV-B radiation on antioxidant enzymes and its modulation by benzoquinone and α-tocopherol in cucumber cotyledons. – Curr. Sci. 87(1): 87–90. https://www.jstor.org/stable/24107986
Сердюков Ю.А., Новицкий Ю.И. 2013. Действие слабого постоянного магнитного поля на активность антиоксидантных ферментов у проростков редиса. – Физиология растений. 60(1): 66–74.https://doi.org/10.7868/S0015330313010065
Магин Д.В., Левин Г., Попов И.Н. 1999. Простой метод измерения активности супероксиддисмутазы с помощью фотосенсибилизированной хемилюминесценции. – Вопр. мед. химии. 45(1): 70–79. http://pbmc.ibmc.msk.ru/pdf/PBMC-1999-45-1-70-ru
Tzeng D.D.S., Tzeng H.C., Chen R.S., Cheng A.H., Tsai C.C., Chen C.W., Hwang T.C., Yeh Y., DeVay J.E. 1996. The use of MR formulation as a novel and environmentally safe photodynamic fungicide for the control of powdery mildew. – Crop Prot. 15(4): 341–347.https://doi.org/10.1016/0261-2194(95)00106-9
Raymond J., Rakariyatham N., Azanza J.L. 1993. Purification and some properties of polyphenoloxidase from sunflower seeds. – Phytochemistry. 34(4) 927–931.https://doi.org/10.1016/S0031-9422(00)90689-7
Ziyan E., Perkyardimci S. 2004. Purification and characterization of Pear (Pyrus communis) Polyphenol Oxidase. – Turk. J. Chem. 28(5) 547–557. http://journals.tubitak.gov.tr/chem/issues/kim-04-28-5/kim-28-5-3-0305-1.pdf
Ortega-Garcia F., Peragon J. 2009. The response of phenylalanine ammonia-lyase, polyphenol oxidase and phenols to cold stress in the olive tree (Olea europaea L. cv. Picual). – J. Sci. Food Agric. 89(9): 1565–1573.https://doi.org/10.1002/jsfa.3625
Pandey N., Archana 2013. Antioxidant responses and water status in Brassica seedlings subjected to boron stress. – Acta Physiol. Plant. 35(3): 697–706.https://doi.org/10.1007/s11738-012-1110-z
Muchuweti M., Mupure C., Ndlala A., Kasiyamhuru A. 2006. Characterization of polyphenol oxidase from Uapaca kirkiana fruit. – J. Sci. Food Agric. 86(2): 328–332.https://doi.org/10.1002/jsfa.2329
Ünal M.Ü., Şener A. 2006. Determination of some biochemical properties of polyphenol oxidase from Emir Grape (Vitis vinifera L. cv. Emir). – J. Sci. Food Agr. 86(14): 2374–2379. https://doi.org/10.1002/jsfa.2627
Gawlik-Dziki U., Szymanowska U., Baraniak B. 2007. Characterization of polyphenol oxidase from broccoli (Brassica oleracea var. botrytis italica) florets. – Food Chem. 105(3): 1047–1053.https://doi.org/10.1016/j.foodchem.2007.05.012
Zhu Z.J., Zhan L.J. 2010. Characterization of Polyphenol Oxidase from Water Caltrop (Trapa Acornis Nakano) Fruits. – J. Food Biochem. 34(6): 1125–1140.https://doi.org/10.1111/j.1745-4514.2010.00353.x
Alici E.H., Arabaci G. 2016. Determination of SOD, POD, PPO and CAT Enzyme Activities in Rumex obtusifolius L. – ARRB. 11(3): 1–7.https://doi.org/10.9734/ARRB/2016/29809
Zheng X., Ye L., Jiang T., Jing G., Li J. 2012. Limiting the deterioration of mango fruit during storage at room temperature by oxalate treatment. – Food Chem. 130(2): 279–285.https://doi.org/10.1016/j.foodchem.2011.07.035
Huang H., Jian Q., Jiang Y., Duan X., Qu H. 2016. Enhanced chilling tolerance of banana fruit treated with malic acid prior to low-temperature storage. – Postharvest Biol. Technol. 111: 209–213.https://doi.org/10.1016/j.postharvbio.2015.09.008
Murata M., Tsurutani M., Hagiwara S., Homma S. 1997. Subcellular Location of Polyphenol Oxidase in Apples. – Biosci., Biotech., Bioch. 61(9): 1495–1499.https://doi.org/10.1271/bbb.61.1495
Tian S., Xu Y., Jiang A., Gong Q. 2002. Physiological and quality responses of longan fruit to high O2 or high CO2 atmospheres in storage. – Postharvest Biol. Technol. 24(3): 335–340.https://doi.org/10.1016/S0925-5214(01)00153-3
Zhao Y., Tu K., Shao X., Jing W., Su Z. 2008. Effects of the yeast Pichia guilliermondii against Rhizopus nigricans on tomato fruit. – Postharvest Biol. Tec. 49(1): 113–120.https://doi.org/10.1016/j.postharvbio.2008.01.001
Бараненко В.В. 2006. Супероксиддисмутаза в клетках растений. Цитология. – 48(6): 465–474. http://www.tsitologiya.cytspb.rssi.ru/48_6/baranenko.pdf
Прадедова Е.В., Ишеева О.Д., Саляев Р.К. 2009. Супероксиддисмутаза вакуолей клеток растений. – Биологические мембраны: Журнал мембранной и клеточной биологии. 26(1): 21–30.
Mittler R., Vanderauwera S., Gollery M., Van Breusegem F. 2004. Reactive oxygen gene network of plants. – Trends Plant Sci. 9(10): 1360–1385.https://doi.org/10.1016/j.tplants.2004.08.009
Барильская Л.А. 1978. Структурный анализ узорчатой древесины карельской березы. Ботан. журн. – 63(6): 805–811.
Любавская А.Я. 1978. Карельская береза. М. 158 с.
Novitskaya L.L., Kushnir F.V. 2006. The role of sucrose in regulation of trunk tissue development in Betula pendula Roth. – J. Plant Growth Regul. 25(1): 18–29.https://doi.org/10.1007/s00344-004-0419-2
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. 2015а. Активность сахарозосинтазы в тканях ствола карельской березы в период камбиального роста. – Физиология растений. 62(3): 410–419.https://doi.org/10.7868/S0015330315030057
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. 2015б. Активность инвертазы в тканях ствола карельской березы. – Физиология растений. 62(6): 804–813.https://doi.org/10.7868/S0015330315060068
Донцов В.И., Крутько В.Н., Мрикаев Б.М., Уханов С.В. 2006. Активные формы кислорода как система: значение в физиологии, патологии и естественном старении. – Труды ИСА РАН. 19: 50–69. http://www.isa.ru/proceedings/images/documents/2006-19/50-69.pdf
Couee I., Sulmon C., Gouesbet G., El Amrani A. 2006. Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants. – J. Exp. Bot. 57(3): 449–459.https://doi.org/10.1093/jxb/erj027
Wellen K.E., Thompson C.B. 2010. Cellular metabolic stress: Considering how cells respond to nutrient excess. – Mol. Cell. 40(2): 323–332.https://doi.org/10.1016/j.molcel.2010.10.004
Гарифзянов А.Р., Жуков Н.Н., Иванищев В.В. 2011. Образование и физиологические реакции активных форм кислорода в клетках растений. – Соврем. проблемы науки и образования. 2. Электронный научный журнал. http://www.science-education.ru/96-4600
Минибаева Ф.В., Гордон Л.X. 2003. Продукция супероксида и активность внеклеточной пероксидазы в растительных тканях при стрессе. – Физиология растений. 50(3): 459–464.
Запрометов М.Н. 1993. Фенольные соединения: Распространение, метаболизм и функции в растениях. М. 272 с.
Wang S.Y., Jiao H.J., Faust M. 1991. Changes in the activities of catalase, peroxidase, and polyphenol oxidase in apple buds during bud break induced by thidiazuron. – J. Plant Growth Regul. 10(1–4): 33–39.https://doi.org/10.1007/BF02279308
Sheptovitsky Y.G., Brudvig G.W. 1996. Isolation and characterization of spinach photosystem II membrane-associated catalase and polyphenol oxidase. – Biochemistry. 35(50): 16255–16263.https://doi.org/10.1021/bi9613842
Thipyapong P., Hunt M.D., Steffens J.C. 2004. Antisense downregulation of polyphenol oxidase results in enhanced disease susceptibility. – Planta. 220(1): 105–107.https://doi.org/10.1007/s00425-004-1330-6
Steffens J.C., Harel E., Hunt M.D. 1994. Polyphenol oxidase. In: Genetic engineering of plant secondary metabolism. Recent advances in phytochemistry (Proceedings of the Phytochemical Society of North America). Boston, MA, 28: 275–312.
Pickett-Heaps J.D. 1968. Xylem wall deposition. – Protoplasma. 65(1–2): 181–205. https://doi.org/10.1007/BF01666378
McCann M.C., Bush M., Milioni D., Sado P., Stacey N.J., Catchpolea G., Defernezb M., Carpitac N.C., Hofted H., Ulvskove P., Wilsonb R.H., Robertsa K. 2001. Approaches to understanding the functional architecture of the plant cell wall. – Phytochemistry. 57(6): 811–821.https://doi.org/10.1016/S0031-9422(01)00144-3
Mellerowicz E.J., Baucher M., Sundberg B., Boerjan W. 2001. Unravelling cell wall formation in the woody dicot stem. – Plant Mol. Biol. 47(1-2): 239–274.https://doi.org/10.1007/978-94-010-0668-2_15
Mellerowicz E.J., Sundberg B. 2008. Wood cell walls: biosynthesis, developmental dynamics. – Curr. Opin. Plant. Biol. 11(3): 293–300.https://doi.org/10.1016/j.pbi.2008.03.003
Schuetz M., Smith R., Ellis B. 2013. Xylem tissue specification, patterning, and differentiation mechanisms. – J. Exp. Bot. 64(1): 11–31.https://doi.org/10.1093/jxb/ers287
Галибина Н.А., Теребова Е.Н. 2014. Физико-химические свойства клеточных стенок тканей ствола деревьев Betula pendula Roth – Ученые записки ПетрГУ. Серия Естественные и технические науки. 141(4): 19–25. http://uchzap.petrsu.ru/files/n141.pdf
Mace M.E., Veech J.A., Beckman C H. 1972. Fusarium wilt of susceptible and resistant tomato isolines: histochemistry of vascular browning. – Phytopathology. 62(65): 651–654. https://www.apsnet.org/publications/phytopathology/backissues/Documents/1972Articles/Phyto62n06_651.pdf
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


