Растительные ресурсы, 2022, T. 58, № 2, стр. 179-196
Сравнительная реакция сеянцев Betula pubescens (Betulaceae) на высокие концентрации CU, NI и CD в субстрате в условиях песчаной культуры
И. В. Дроздова 1, *, И. Б. Калимова 1, Н. В. Алексеева-Попова 1, А. И. Беляева 1
1 Ботанический институт им. В.Л. Комарова РАН
г. Санкт-Петербург, Россия
* E-mail: idrozdova@binran.ru
Поступила в редакцию 21.12.2021
После доработки 17.02.2022
Принята к публикации 03.03.2022
- EDN: DAUIYN
- DOI: 10.31857/S0033994622020042
Аннотация
Исследовали действие меди, никеля и кадмия (1 и 5 мМ) на накопление биомассы, аккумуляцию физиологически необходимых элементов сеянцами березы пушистой (Betula pubescens Ehrh.) и содержание в них основных фотосинтетических пигментов. На основе анализа значений фактора транслокации выявлено активное передвижение никеля и кадмия в надземные органы и существование отчетливого корневого барьера для меди. Сделан вывод об относительно высокой устойчивости сеянцев B. pubescens к повышенным концентрациям меди, никеля и кадмия в питательной среде, проявляющейся в ходе эксперимента в отсутствии существенного снижения накопления биомассы опытными растениями по сравнению с контрольными, незначительных изменениях баланса физиологически необходимых макро- и микроэлементов, а также содержания хлорофиллов и каротиноидов. Это делает данный вид перспективным для дальнейших исследований в области фиторемедиации территорий, загрязненных тяжелыми металлами.
В Российской Федерации более половины всей площади, находящейся под лиственными древесными породами, занимают представители рода Betula [1]. Эта порода дает высококачественное сырье для разных отраслей промышленности: деревообрабатывающей, медицинской, пищевой, а также широко используется для озеленения городской среды. Ее ценность определяется экологической пластичностью, неприхотливостью, способностью расти и возобновляться в различных лесорастительных условиях, в том числе на гарях, а также в условиях хронического атмосферного загрязнения. Хотя большинство древесных видов более чувствительны к действию повышенных концентраций тяжелых металлов, чем травянистые растения, некоторые быстрорастущие виды, такие как Salix spp. [2] и Acer pseudoplatanus [3], а также виды рода Betula [4], выработали в ходе эволюции устойчивость к этим неблагоприятным факторам почвенной среды. Изучение содержания ряда тяжелых металлов в листьях древесных растений, наиболее часто используемых для озеленения городов (тополь, береза, рябина, липа, вяз, ясень) показало, что береза обладает ярко выраженной способностью к аккумуляции тяжелых металлов: Cd, Pb и Ni [5]. В настоящее время считается, что помимо травянистых растений – гипераккумуляторов тяжелых металлов, для целей фиторемедиации интересны и некоторые древесные виды, например, представители родов Populus и Salix [6], Quercus suber L. [7]. Устойчивость разных видов рода Betula к повышенным концентрациям тяжелых металлов в окружающей среде не только дает возможность использовать их в качестве биоиндикаторов загрязнения [8, 9], но и свидетельствует о высоком фиторемедиационном потенциале этих видов [10].
В условиях северной тайги на территории России береза пушистая Betula pubescens Ehrh. является одним из доминантов растительных сообществ. Присущий данному виду высокий адаптационный потенциал обеспечивает возможность его произрастания на нарушенных участках, непригодных для других древесных пород. Благодаря способности к вегетативному возобновлению, береза пушистая быстро восстанавливается на гарях, поскольку ее подземные органы часто сохраняют жизнеспособность после пожара. Кроме того, она продуцирует очень большое количество мелких семян, легко распространяемых ветром с прилегающих к гари территорий [11]. Береза пушистая, как листопадная порода, более устойчива к антропогенному загрязнению по сравнению с вечнозелеными хвойными породами. Поэтому она часто выживает даже в зоне локального (импактного) загрязнения, создающегося в непосредственной близости от промышленного производства – источника загрязнения или в зонах хранения отходов предприятий по добыче металлов, хотя при сильном антропогенном загрязнении она имеет небольшую высоту стволов или образует кустарниковую форму [4, 12]. Это подтверждает ранее высказанное предположение, что фенотипическая пластичность – альтернативный механизм устойчивости для долгоживущих древесных растений [3, 13].
Следует отметить, что древесные растения вследствие более продолжительной жизни в большей степени, чем однолетние и двулетние, подвергаются действию стрессовых абиотических факторов. Наряду с этим, естественное семенное возобновление древесных растений на загрязненных тяжелыми металлами почвах часто может быть затруднено в связи с тем, что прорастание семян и формирование корневых систем сеянцев происходит в верхней, наиболее загрязненной части почвенного профиля.
В настоящее время, в среднем около 11% почв территории России имеет высокий уровень загрязнения тяжелыми металлами, а в некоторых регионах этот показатель по ряду элементов превышает предельно допустимые значения [14]. Загрязнение огромных площадей металлами, среди которых значительное место занимают такие элементы, как Cu, Ni и Cd, является результатом антропогенной деятельности, связанной с работой предприятий металлургической, химической промышленности, утилизацией бытовых отходов, переработкой отходов рудных производств, нарушением режима внесения минеральных удобрений и пестицидов. При техногенном загрязнении металлы концентрируются преимущественно в поверхностном слое почвы и находятся в форме оксидов и свободных ионов, последнее повышает их доступность для растений [15]. В связи с этим, они поглощаются растениями в количествах, превышающих их физиологическую потребность, что оказывает токсическое действие. Оно проявляется в нарушении метаболизма, снижении продуктивности и даже гибели растений [16]. Характер и степень ингибирующего действия тяжелых металлов на рост, развитие, фотосинтез, дыхание, водный обмен растений зависят от степени их токсичности, концентрации в окружающей среде и продолжительности воздействия, а также от биологических особенностей вида [17].
В большинстве работ, посвященных исследованию влияния повышенных концентраций тяжелых металлов на основные физиологические процессы, объектами исследования являются травянистые растения. Менее изучены реакции древесных видов на высокое содержание тяжелых металлов в почвах. Работы экспериментального характера, направленные на изучение действия конкретных металлов на важнейшие физиолого-биохимические показатели лиственных древесных растений немногочисленны [18–20]. Это делает крайне актуальным изучение механизмов их устойчивости к высоким концентрациям тяжелых металлов.
Целью настоящей работы является сравнительное исследование особенностей накопления Ni, Cu и Cd сеянцами B. pubescens и их влияния на некоторые физиологические показатели растений при внесении повышенных доз металлов в питательную среду.
МАТЕРИАЛ И МЕТОДЫ
Сбор семян для проведения эксперимента проводили с деревьев B. pubescens, произрастающих на территории Ботанического сада им. Петра Великого Ботанического института им. В.Л. Комарова РАН в г. Санкт-Петербург. Сеянцы выращивали в песчаной культуре в вегетационных сосудах объемом 1 л (по 10 сеянцев на сосуд) в контролируемых условиях при 16-ти часовом фотопериоде и температуре 21 °С с поливом дистиллированной водой, а с момента развертывания семядолей – питательным раствором Арнона в течение двух месяцев. Затем, растения контрольного варианта продолжали поливать питательным раствором, а в опытных вариантах – к нему добавляли растворы сернокислых солей Cu, Ni и Cd, содержащие действующие концентрации этих металлов 1 и 5 мМ. В каждом варианте опыта было по пять вегетационных сосудов.
Образцы для последующего анализа отбирали три раза в ходе развития растений: на 3-и, 7-е, 10-е сутки после внесения металлов. При фиксации корней сеянцев для удаления адсорбированных металлов их отмывали дистиллированной водой, выдерживали 30 мин в растворе детергента (Tris/MES + EGTA, pH 6.0), повторно отмывали дистиллированной водой, затем подсушивали на фильтровальной бумаге. Сеянцы разделяли по органам на корень, стебель и листья, определяли их сырую биомассу на аналитических весах с точностью до 0.1 мг, а затем фиксировали при 105 °С и высушивали при 70 °С до постоянного веса, после чего определяли сухую биомассу. Данные о различиях сырой и сухой массы сеянцев использовали для расчета содержания воды в органах сеянцев.
Для определения содержания химических элементов сухие образцы растительного материала озоляли в муфельной печи при 450 °С в течение 12 ч. Золу растворяли в смеси кислот 1.5 М HCl и 3.71 М HNO3. Концентрации K, Mg, Fe, Mn, Cu, Ni, Cd в растениях определяли на атомно-абсорбционном спектрофотометре Квант-АФА (“Кортэк”, Россия) c использованием государственных стандартных образцов (ГСО 7190-95, 8092-94, 7325-96, 7272-96). На основании полученных данных был вычислен фактор транслокации (ФТ) – отношение среднего содержания Cu, Ni и Cd в листьях к среднему содержанию соответствующего металла в корнях сеянцев [21].
Образцы для анализа на содержание хлорофиллов a и b, каротиноидов отбирали на 10-е сутки эксперимента. Количественное определение их содержания было проведено на спектрофотометре Specol 11 (“Carl Zeiss”, Германия) в 100% ацетоновой вытяжке без предварительного разделения с последующим расчетом по формуле Лихтентайлера [22].
Количественные данные были обработаны с помощью однофакторного дисперсионного анализа с использованием программы Statistica 12. Данные представлены как средние значения и их стандартные отклонения. Достоверность различий вариантов опыта по изученным параметрам оценивали по непараметрическому критерию Краскела–Уоллиса.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
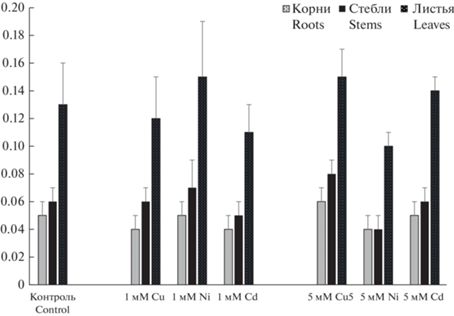
Визуальные наблюдения за состоянием растений показали, что признаки токсичности Cu, Cd и Ni первоначально проявились на 7 сут после внесения металлов. Наиболее отчетливо действие повышенных концентраций Cu и Ni было выражено при концентрации 5 мМ: наблюдался хлороз молодых листьев, а также некротические пятна на листьях отдельных растений. Подобные симптомы в вариантах с Cd стали заметны уже при концентрации 1 мМ. В целом, увеличение экспозиции усиливало отрицательное действие металлов и тем больше, чем выше была их концентрация в субстрате. Следует отметить, что в опытных вариантах наряду с сеянцами, у которых наблюдались фитотоксические симптомы, связанными с повышенным содержанием металлов, были обнаружены явно здоровые сеянцы, практически не отличающиеся от контрольных. Это может свидетельствовать о существенной внутривидовой изменчивости устойчивости B. pubescens по отношению к тяжелым металлам, отчетливо проявившейся при повышенных концентрациях металлов в питательной среде. Возможно вследствие этого, несмотря на наблюдающиеся визуальные симптомы токсичности у отдельных растений средние значения сухой массы органов сеянцев во всех экспериментальных вариантах сохранялись на стабильном уровне с незначительными колебаниями (рис. 1), т.е. изученные металлы в испытанных концентрациях не оказывали существенного влияния на накопление сухой массы органами сеянцев B. pubescens. Величина биомассы сеянцев в условиях загрязнения среды солями тяжелых металлов является интегральным показателем степени их развития и может выступать в качестве индикатора устойчивости к воздействию металлов [23]. Отсутствие сколько-нибудь значимых различий в накоплении биомассы сеянцами B. pubescens в контрольном и опытных вариантах свидетельствует об их высокой устойчивости к изученным металлам. По данным Borgegård, Rydin [24], растения B. pendula и B. pubescens, не отобранные специально по устойчивости к тяжелым металлам, выживают, когда их высаживают на почвах, сформированных в районе отвалов рудников по добыче Cu, что, по мнению авторов, подразумевает, наличие у этих видов рода Betula генетически обусловленной толерантности к металлам.
Рис. 1.
Сухая биомасса органов сеянцев Betula pubescens на конец эксперимента. По горизонтали – варианты опыта; по вертикали – масса, г/растение. Fig. 1. Dry biomass content in Betula pubescens seedling organs at the end of the experiment. X-axis – test variants; y-axis – weight, g plant–1.
Исследованные концентрации металлов также не вызывали снижения содержания воды в органах сеянцев в большинстве вариантов опыта. Статистически значимое уменьшение оводненности обнаружено главным образом под влиянием Ni: для корней сеянцев – при концентрациях 1 и 5 мМ, а для остальных изученных органов – при концентрации 5 мМ (рис. 2). Известно, что в присутствии тяжелых металлов оводненность клеток и тканей уменьшается в гораздо меньшей степени, чем остальные показатели водного режима растений, что связано главным образом с увеличением устьичного сопротивления и/или снижением транспирации [16].
Рис. 2.
Относительное содержание воды в органах сеянцев Betula pubescens на конец эксперимента. По горизонтали – варианты опыта; по вертикали – содержание воды, %. Звездочкой отмечены статистически значимые различия между показателем оводненности в контрольном и опытном вариантах, n = 5, p < 0.05. Fig. 2. Relative water content in Betula pubescens seedling organs at the end of the experiment. X-axis – test variants; y-axis – water content, %. Symbol * indicates the significant differences in water content between control and test variant at p < 0.05 according to ANOVA (n = 5).

В ходе эксперимента изучали характер накопления и распределения по органам Cu, Ni и Cd у растений опытных вариантов по сравнению с контрольным на 3-и, 7-е и 10-е сутки после внесения металлов в питательную среду (рис. 3). Растения контрольного варианта накапливали незначительные количества Cu, особенно в надземной части (3.04–4.27 мг/кг). В литературе отмечается более низкое содержание Cu в листьях Betula по сравнению с другими лиственными видами умеренного пояса на Европейской территории [25]. В корнях средние концентрации Cu были более высокими, чем в надземной части, но ≤7.4 мг/кг, т.е. не превышающие содержание Cu в растениях из незагрязненных регионов [26]. Концентрация Ni в растениях контрольного варианта также не превышала фоновых значений: минимальный уровень был отмечен в листьях (0.75 мг/кг), а максимальный (2.45 мг/кг) – в корнях.
Рис. 3.
Содержание Cu, Ni и Cd в органах сеянцев Betula pubescens на 3-е (a), 7-е (b) и 10-е (c) сутки экспозиции на металлах. По горизонтали – органы растений, варианты опыта; по вертикали – средняя концентрация металла, мг/кг. Звездочкой отмечены статистически значимые различия между средними значениями концентраций металлов в контрольном и опытных вариантах, n = 5, p < 0.05. Fig. 3. The content of Cu, Ni, and Cd in Betula pubescens seedling organs on the third (a), seventh (b) and tenth (c) days of exposure to metals. X-axis – test variant, plant organs; y-axis – mean metal concentration, mg kg–1. Symbol * indicates the significant differences in metal concentrations between control and test variant at p < 0.05, according to ANOVA (n = 5).
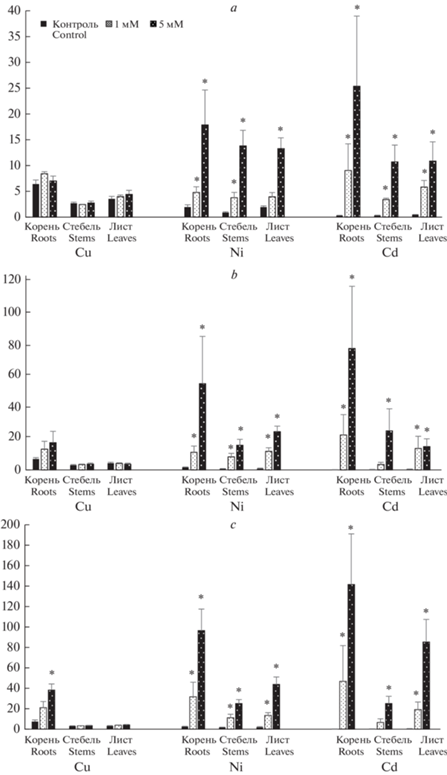
Содержание Cd в органах контрольных растений было довольно высокое: в листьях – до 0.47 мг/кг, в корнях – до 0.29 мг/кг. Ранее нами были зафиксированы также достаточно высокие концентрации Cd в листьях B. pubescens, произрастающей в ряде ООПТ г. Санкт-Петербурга и Ленинградской области [27]. Так, содержание Cd в листьях B. pubescens, собранных в Юнтоловском заказнике, составило 0.57 мг/кг, что в 3.5 раза превышает уровень элемента в хвое Pinus sylvestris, а также в надземной части Sphagnum angustifolium.
В опытных вариантах по мере возрастания содержания всех изученных металлов в питательной среде и увеличения срока экспозиции их средняя концентрация наиболее значительно по сравнению с контролем увеличивалась в корнях сеянцев (рис. 3). Однако скорости поглощения исследованных металлов растениями существенно различались. Так, в опытных вариантах с Cu на третьи сутки после внесения металла не наблюдалось статистически значимого увеличения средней концентрации Cu по сравнению с контролем не только в надземных органах, но и в корневой системе сеянцев, что свидетельствует о низкой скорости поглощения металла (рис. 3). Установленные в экспериментах скорости адсорбции меди корневыми системами высших растений сравнимы с наименьшими, полученными для других жизненно важных элементов [28]. В корневой системе на 7-е сутки экспозиции происходило увеличение содержания Cu в 2 раза по сравнению с контролем при концентрации 1мМ и в 2.5 раза – при концентрации 5 мМ, а затем к 10-м суткам отмечен дальнейший рост концентрации металла в корнях: в 3 и 5 раз соответственно.
В листьях и стеблях сеянцев опытных вариантов на протяжении всего эксперимента не было зафиксировано достоверно более высокого по сравнению с контролем накопления Cu (рис. 3). При этом почти не проявился дозовый эффект накопления металла. Сходные характеристики распределения Cu по органам, и прежде всего слабое передвижение ее в листья, были отмечены для растений B. pubescens и B. pendula, произрастающих в естественных условиях на почвах с высоким уровнем полиметаллического загрязнения [29, 30]. По-видимому, даже в условиях повышенного доступного уровня содержания Cu в среде в надземную часть сеянцев B. pubescens поступает лишь небольшая часть металла, поглощенная корнями, что согласуется с литературными данными, полученными в эксперименте с близкородственным видом – B. pendula [10]. Анализ концентрации тяжелых металлов в листьях B. pubescens, которая произрастала на почвах, загрязненных тяжелыми металлами, показал, что концентрации Zn, Pb и Cd в них превышали таковые в листьях деревьев, растущих на незагрязненных почвах, примерно на один порядок величины, тогда как концентрации Cu были аналогичными [24]. Такой незначительный перенос Cu в надземные органы может объясняться низкой подвижностью Cu за счет связывания ее в ксилемном соке в комплексные соединения и частичной рециркуляцией Cu по флоэме к корням, а также эффективным механизмом связывания металла в труднорастворимые соединения в корнях [31]. Можно полагать, что это один из основных механизмов устойчивости к повышенным дозам Cu в питательной среде.
У растений B. pubescens были выявлены резкие различия между изученными металлами по такому важному показателю, как поступление их в надземные органы. Эффективность транспорта элементов из подземных органов в надземные оценивалась по величине ФТ, которая зависит от ряда причин, в том числе от свойств элемента, видовой стратегии растения по отношению к данному элементу, концентрации элемента в питательной среде. Известно, что значение ФТ > 1, даже в случае токсичных элементов, характерно для видов-гипераккумуляторов, а для остальных видов – величина ФТ < 1 [32].
В наших опытах значение ФТ для Cu в контрольном варианте было ниже 1 и существенно не отличалось от такового для опытных вариантов на 3-е сутки после внесения металлов (рис. 4). На 7-е и 10-е сутки ФТ в значительной степени снижался в опытных вариантах при обеих концентрациях Cu. Низкие темпы транслокации Cu в листья свидетельствует о том, что Cu в сеянцах B. pubescens малоподвижна, что было установлено и в экспериментах с другими древесными видами, например, рода Salix [33] и Fraxinus angustifolia [34].
Рис. 4.
Отношение содержания Cu, Ni и Cd в листьях к их содержанию в корнях у сеянцев Betula pubescens (фактор транслокации) на 3-е (a), 7-е (b) и 10-е (c) сутки экспозиции на металлах. По горизонтали – варианты опыта; по вертикали – величина фактора транслокации. Fig. 4. The ratio of metal concentration in the leaves to that in the roots (translocation factor) of Betula pubescens seedlings on the third (a), seventh (b) and tenth (c) days of exposure to metals. X-axis – test variants; y-axis – the value of the translocation factor.

Результаты наших исследований, полученные в этой и предыдущей работах [35], а также данные других авторов [31] ясно показывают, что Ni с гораздо большей скоростью, чем Cu поглощается растениями и гораздо более интенсивно накапливается в надземных органах. Увеличение содержания Ni в среде выращивания привело к резкому повышению его концентрации во всех органах опытных растений (рис. 3). Например, уже через трое суток после внесения 1 мМ Ni содержание металла в корнях сеянцев повышается в 2.5 раза по сравнению с контролем, а после внесения 5 мМ Ni – в 9 раз, при этом наблюдается значительное увеличение накопления металла со временем: его концентрация в корнях на 7-е сутки эксперимента увеличивается в 7 и 34 разa соответственно. На этом сроке наблюдения статистически значимые различия между концентрациями Ni в корнях и надземных органах проявляются для концентрации 5 мМ, а на 10-е сутки опыта – также и для концентрации 1 мМ. Таким образом, к концу эксперимента становится отчетливо выраженной барьерная функция корней, содержание Ni в корнях в 2 раза превосходит уровень его накопления в листьях и в 2–4 раза в стеблях.
Значения ФТ для Ni на 3-е и 7-е сутки экспозиции были выше, чем для Cd и Cu (рис. 4), что свидетельствует о более высокой скорости транспорта Ni. Известно, что на скорость передвижения отдельных металлов по тканям растения существенное влияние оказывает механизм их транспорта. К настоящему времени установлено, что большая часть Cd присутствует в ксилемном соке в ионной форме, что, по-видимому, является приоритетной причиной его связывания с клеточными стенками [36]. В свою очередь, Ni может перемещаться по ксилеме как в форме свободного иона, так и в комплексе с низкомолекулярными лигандами, что предотвращает его связывание с компонентами клеточных стенок. Кроме того, установлено, что Ni перемещается по растению преимущественно по симпласту, а транспорт симпластических ионов в растении ограничен в незначительной степени [37].
При обеих испытанных концентрациях транслокация Ni в надземные органы снижалась в ходе эксперимента. У растений, выращенных при концентрации Ni 1 мМ, на 3-е и 7‑е сутки после внесения металлов значение ФТ металла было выше, чем при концентрации 5 мМ, тогда как спустя 10 суток его значения при обеих концентрациях практически не различались. Ранее было установлено, что величина фактора транслокации для Ni может меняться во времени и в зависимости от концентрации металла в среде [38].
В ходе эксперимента отмечено эффективное поглощение Cd корневой системой и накопление в надземных органах опытных растений уже через трое суток после внесения металла в среду выращивания (рис. 3). Исследования, проведенные на сеянцах древесных растений как в полевых, так и в экспериментальных условиях, указывают на высокую подвижность Cd при его поглощении из почвы и передвижении в надземные органы растений [26, 39]. Максимальное среднее содержание Cd независимо от его концентрации в среде выращивания обнаружено в корнях растений (рис. 3). При этом к концу эксперимента наблюдается значительное накопление металла и в надземных органах. Так, на 10-е сутки эксперимента в варианте опыта 5 мМ содержание Cd в листьях сеянцев в 2 раза превосходило уровень Ni, а Cu – в 20 раз. Следует отметить, что при концентрации Ni 5 мМ его содержание в листьях сеянцев за весь период наблюдения увеличивается достаточно равномерно. При аналогичной же концентрации Cd его содержание в листьях особенно резко – в 5.7 раза возрастает к концу эксперимента. Благодаря этому становится очевидным преимущественное накопление Cd в листьях по сравнению со стеблями. Известно, что более высокие концентрации Cd в листьях, по сравнению с ветвями растений возможны только в случаях сильных аккумуляторов данного металла [40]. В ряде исследований, проведенных как в полевых, так и в экспериментальных условиях выявлена способность некоторых видов рода Betula накапливать высокие концентрации Cd в надземных органах без проявления визуальных симптомов токсичности [41–44]. Это может указывать на присущую этим видам высокую устойчивость к Cd.
Значения ФТ для Cd в контрольном варианте было выше 1, что также позволяет сделать вывод об усиленной аккумуляции данного элемента, хотя исходя из абсолютных содержаний Cd в надземных органах B. pubescens, мы, конечно, не можем отнести данный вид к гипераккумуляторам Cd в “классическом” понимании этого термина [45].
В опытных вариантах значения ФТ для Cd зависели от дозы металла в питательной среде: при более низкой его концентрации наибольшая величина ФТ отмечена на 3-е сутки после внесения металла (рис. 4). При более высокой концентрации Cd (5 мМ), напротив, наблюдался рост показателя ФТ с увеличением времени экспозиции. Значительное накопление Cd в листьях сеянцев может указывать на интенсивный дальний транспорт иона Cd. Очевидно, что сеянцы B. pubescens обладают высокой эффективностью транспортных систем, обеспечивающих быстрый перенос и накопление Cd в надземных органах. Однако следует учитывать, что Cd является одним из самых опасных металлов из-за его высокой подвижности и низкой концентрации, при которой начинает проявляться его токсическое воздействие на растения [46]. Можно предположить, что отмеченные при 5 мМ Cd чрезвычайно высокие его концентрации в листьях сеянцев – 85 мг/кг – могут свидетельствовать о возможном нарушении барьерной функции корня к концу опыта, что при более длительной экспозиции могло бы привести к существенным проявлениям токсических эффектов.
Известно, что стресс, вызванный действием высоких концентраций тяжелых металлов, нарушает метаболизм и оказывает влияние на содержание фотосинтетических пигментов в высших растениях. Главной причиной снижения содержания хлорофиллов при этом является подавление их синтеза, связанное в первую очередь с непосредственным действием металлов на активность ферментов биосинтеза. Кроме того, нарушение синтеза хлорофилла в присутствии тяжелых металлов может быть вызвано вытеснением ими ионов Mg2+ из молекулы хлорофилла. Некоторые металлы, например Cu, в больших концентрациях замедляют связывание молекул хлорофиллов с белками в светособирающих комплексах фотосистем. Известно, что тяжелые металлы способны изменять функционирование мембран хлоропластов и ингибировать работу белков фотосистемы II [16]. По нашим данным, в присутствии высоких концентраций Ni в субстрате не обнаружено снижения содержания фотосинтетических пигментов в листьях сеянцев B. pubescens (табл. 1). Напротив, в варианте с внесением Ni в концентрации 1 мM содержание хлорофилла b увеличивалось на 13%, а содержание каротиноидов – на 27%. Содержание хлорофилла а в листьях опытных растений при обеих концентрациях Ni было на уровне контрольных растений (табл. 1). Активация синтеза пигментов может быть связана с необходимостью поддержания фотосинтетических процессов на определенном уровне в неблагоприятных условиях произрастания. Высокий уровень поллютантов вызывает торможение синтеза и разрушение фотосинтетических пигментов, но при более низкой интенсивности воздействия может наблюдаться стимуляция их образования. Согласно принципу множественности адаптаций, она реализуется тем эффективнее, чем больше первичных приспособительных реакций имеется у растительного организма [47].
Таблица 1.
Содержание фотосинтетических пигментов в листьях сеянцев Betula pubescens на конец эксперимента, мг/кг сырой массы Table 1. The photosynthetic pigment contents in the leaves of Betula pubescens seedlings at the end of the experiment, mg kg–1 of wet weight
| Вариант опыта Test variant |
Хлорофилл a Chlorophyll a |
Хлорофилл b Chlorophyll b |
Каротиноиды Carotenoids |
a/b |
|---|---|---|---|---|
| Контроль Control |
2.00 ± 0.06 | 1.05 ± 0.07 | 0.37 ± 0.02 | 1.90 |
| Cu 1 мМ | 1.83 ± 0.09 | 0.96 ± 0.08 | 0.38 ± 0.02 | 1.91 |
| Cu 5 мМ | 1.82 ± 0.05* | 0.96 ± 0.04 | 0.33 ± 0.02 | 1.90 |
| Ni 1 мМ | 2.13 ± 0.07 | 1.19 ± 0.05* | 0.47 ± 0.05* | 1.79 |
| Ni 5 мМ | 1.99 ± 0.09 | 1.03 ± 0.07 | 0.40 ± 0.02 | 1.93 |
| Cd 1 мМ | 1.91 ± 0.08 | 1.03 ± 0.02 | 0.36 ± 0.05 | 1.95 |
| Cd 5 мМ | 1.78 ± 0.05* | 0.89 ± 0.06* | 0.34 ± 0.01 | 2.00 |
Примечания. В таблице представлены средние значения и стандартные отклонения (m ± SD, n = 5). Звездочкой отмечены статистически значимые различия между средними значениями концентраций пигментов в контрольном и опытном вариантах, p < 0.05. Notes. All data presented as mean ± SD (n = 5). Symbol * indicates the significant differences of element pigment between control and test variant at p < 0.05 according to ANOVA.
В листьях сеянцев в вариантах с внесением 1 мМ Cu и Cd, уровень хлорофиллов a и b достоверно не изменился (табл. 1). В то время как при концентрации 5 мM Cu содержание хлорофилла a было снижено на 9%. При этой же концентрации Cd было выявлено уменьшение содержания хлорофилла a на 11% и еще более существенное снижение содержания хлорофилла b – на 15% от контроля. Изменения в содержании пигментов, в частности, хлорофиллов, часто используются в качестве индикаторной реакции повреждения, происходящего под действием поллютантов. При этом в разных исследованиях отмечается как уменьшение величины соотношения хлорофиллов a и b, что согласуется с большей устойчивостью к неблагоприятным факторам среды хлорофилла b [48], так и увеличение отношения a/b за счет большей устойчивости хлорофилла a [49]. Следует отметить, что, несмотря на количественные изменения в содержании пигментов, проявившиеся под влиянием повышенных концентраций тяжелых металлов, соотношение содержания хлорофиллов в листьях сеянцев меняется незначительно, что указывает на устойчивость к ним фотосинтетического аппарата B. pubescens. Об устойчивости фотосинтетической способности другого вида рода Betula – B. populifolia в широком диапазоне нагрузки тяжелыми металлами: от очень низких до очень высоких их концентраций сообщают Salisbury et al. [50].
В связи с тем, что негативное действие высоких концентраций металлов, не только токсичного Cd, но и эссенциальных Cu и Ni, может вызывать изменения минерального обмена, изучали их влияние на уровень содержания ряда основных физиологически необходимых элементов в растениях B. pubescens. В табл. 2 представлены данные по содержанию в сеянцах K, Mg, Fe, Mn и Zn в зависимости от содержания изученных металлов в питательной среде. Следует отметить, что во всех вариантах опыта наблюдается базипетальный характер распределения для Fe и акропетальный – для K, Mg и Mn. Наиболее существенными были различия по уровню содержания Fe, концентрация которого в корнях B. pubescens была в 7–34 раза выше, чем в надземных органах.
Таблица 2.
Содержание макро- и микроэлементов в органах сеянцев Betula pubescens на конец эксперимента Table 2. Content of macro- and microelements in the organs of Betula pubescens seedlings at the end of the experiment
| Вариант опыта Test variant |
K | Mg | Fe | Mn | Zn |
|---|---|---|---|---|---|
| % | мг/кг сухой массы mg kg–1 dry weight |
||||
| Корни Roots |
|||||
| Контроль Control |
1.29 ± 0.10 | 0.24 ± 0.20 | 316 ± 70 | 21.7 ± 2.3 | 21.3 ± 3.2 |
| Cu 1 мМ | 1.45 ± 0.12 | 0.31 ± 0.03 | 535 ± 105 | 26.7 ± 1.2 | 24.4 ± 6.7 |
| Cu 5 мМ | 1.51 ± 0.05 | 0.28 ± 0.01 | 544 ± 90 | 35.9 ± 9.9 | 16.3 ± 1.1 |
| Ni 1мМ | 0.97 ± 0.10* | 0.27 ± 0.01 | 474 ± 32* | 20.5 ± 2.0 | 27.4 ± 4.0 |
| Ni 5 мМ | 0.87 ± 0.05* | 0.27 ± 0.02 | 766 ± 72* | 24.5 ± 1.1 | 28.3 ± 3.4 |
| Cd 1 мМ | 1.13 ± 0.06 | 0.30 ± 0.02* | 539 ± 61* | 22.4 ± 3.0 | 21.7 ± 3.3 |
| Cd 5 мМ | 1.23 ± 0.07 | 0.31 ± 0.02* | 413 ± 50 | 22.4 ± 1.6 | 23.5 ± 4.2 |
| Стебли Stems |
|||||
| Контроль Control |
1.06 ± 0.10 | 0.13 ± 0.01 | 46.3 ± 9.5 | 15.6 ± 2.2 | 26.4 ± 3.4 |
| Cu 1 мМ | 0.69 ± 0.02* | 0.15 ± 0.01 | 32.9 ± 5.6 | 9.94 ± 1.58 | 19.3 ± 3.1 |
| Cu 5 мМ | 0.73 ± 0.09* | 0.17 ± 0.01* | 40.4 ± 8.2 | 9.37 ± 1.21* | 20.7 ± 3.7 |
| Ni 1 мМ | 1.02 ± 0.07 | 0.18 ± 0.03 | 34.0 ± 2.7 | 8.64 ± 0.67* | 15.0 ± 2.3 |
| Ni 5 мМ | 0.70 ± 0.10* | 0.10 ± 0.01 | 22.3 ± 2.5* | 6.34 ± 0.22* | 15.7 ± 2.0 |
| Cd 1 мМ | 0.57 ± 0.05* | 0.13 ± 0.02 | 19.9 ± 2.9* | 6.51 ± 0.25* | 16.0 ± 1.2 |
| Cd 5 мМ | 0.67 ± 0.03* | 0.13 ± 0.02 | 18.4 ± 6.9* | 11.7 ± 0.9 | 21.2 ± 4.5 |
| Листья Leaves |
|||||
| Контроль Control |
2.09 ± 0.10 | 1.46 ± 0.10 | 46.3 ± 5.6 | 91.7 ± 31.2 | 27.1 ± 3.2 |
| Cu 1 мМ | 2.07 ± 0.07 | 1.46 ± 0.07 | 53.6 ± 7.4 | 82.8 ± 21.8 | 28.2 ± 3.0 |
| Cu 5 мМ | 1.91 ± 0.03 | 1.37 ± 0.11 | 63.7 ±9.3 | 48.2 ± 6.5 | 27.9 ± 5.3 |
| Ni 1 мМ | 2.27 ± 0.07 | 1.46 ± 0.12 | 32.8 ± 5.5 | 50.3 ± 5.1 | 26.3 ± 3.4 |
| Ni 5 мМ | 2.16 ± 0.20 | 1.37 ± 0.11 | 25.6 ± 4.1* | 41.0 ± 3.2 | 29.9 ± 3.6 |
| Cd 1 мМ | 1.90 ± 0.05 | 1.44 ± 0.05 | 51.6 ± 8.6 | 35.9 ± 1.0 | 27.1 ± 2.8 |
| Cd 5 мМ | 2.19 ± 0.08 | 1.35 ± 0.08 | 47.9 ± 3.6 | 53.7 ± 12.4 | 24.8 ± 2.5 |
Примечания. В таблице представлены средние значения со стандартными отклонениями (m ± SD, n = 5). Звездочкой отмечены статистически значимые различия между средними значениями концентраций элементов в контрольном и опытном вариантах, p < 0.05. Notes. All data presented as mean ± SD (n = 5). Symbol * indicates the significant differences of element concentrations between control and test variant at p < 0.05 according to ANOVA.
На фоне обеих испытанных концентраций Cu и Cd и при уровне Ni 5 мМ в питательной среде наблюдалось статистически значимое снижение содержания К в стеблях опытных растений по сравнению с контрольными (табл. 2). Избыточное поступление Ni сопровождалось также уменьшением уровня K в корнях. Установлено, что под влиянием высоких концентраций тяжелых металлов происходит изменение проницаемости мембран и усиление выхода ионов K+ из клеток корня и стебля [46]. Снижение концентрации K после 7 сут воздействия Cu и Cd в корнях и побегах опытных растений по сравнению с контрольными было продемонстрировано в водной культуре B. pubescens [51]. Антагонистическое взаимодействие между Cd и K в растениях было показано также в работах Zhang et al. [52] и Rabêlo et al. [53]. Кадмий, не являясь физиологически необходимым элементом, может перемещаться в растении от корней к побегам с помощью переносчиков минеральных питательных веществ, в том числе K, что нарушает его поступление в растение [52].
Высокие концентрации Ni и Cd в питательной среде оказали существенное влияние на поступление и распределение Fe по органам B. pubescens. Токсическое действие высоких доз Ni проявилось в существенном снижении концентрации Fe в листьях и стеблях, а Cd – в стеблях растений опытных вариантов по сравнению с контролем (табл. 2). Характерно, что в корнях сеянцев под действием Ni и Cd содержание Fe, напротив, повышалось (табл. 2). Антагонистический характер его взаимодействия с Ni и Cd проявляется в данном случае в нарушении передвижения Fe в надземные органы. Установлено, что основной транспортной формой Fe в растении является Fe2+. В условиях индуцированного избытком тяжелых металлов окислительного стресса может наблюдаться ингибирование восстановления Fe3+ в апопласте клеток корня, что, в свою очередь, приводит к подавлению дальнего транспорта Fe [52, 54, 55]. Дефицит Fe сопровождался развитием визуальных признаков хлороза, наблюдаемого нами на листьях некоторых менее устойчивых особей B. pubescens.
Другим симптомом отрицательного влияния испытанных концентраций тяжелых металлов является статистически значимое практически во всех вариантах опыта снижение содержания Mn в стеблях сеянцев и тенденция к снижению в листьях B. pubescens (табл. 2). Подавление транслокации Mn под действием Cu, Ni и Cd свидетельствует об антагонизме между этими элементами и было отмечено в других исследованиях в природных и экспериментальных условиях [56, 57]. Не выявлено существенного влияния Cu, Ni и Cd на уровень накопления Mg и Zn в сеянцах B. pubescens. Таким образом, токсичность изученных тяжелых металлов проявилась в нарушении поглощения и транслокации сеянцами B. pubescens таких физиологически необходимых элементов питания, как K, Fe и Mn.
ЗАКЛЮЧЕНИЕ
В настоящей работе выявлены особенности аккумуляции Cu, Ni и Cd и их влияние на накопление биомассы, минеральный состав и содержание фотосинтетических пигментов у сеянцев Betula pubescens в условиях эксперимента. Показано, что при выращивании сеянцев B. pubescens в песчаной культуре на фоне повышенных концентраций (1 и 5 мМ) этих металлов отсутствовали значимые различия в аккумуляции биомассы надземных органов и корней у растений опытных и контрольного вариантов. Избыток тяжелых металлов в среде выращивания не оказывал также существенного влияния на оводненность органов сеянцев. Накопление всех исследованных металлов с увеличением их концентрации в питательной среде наиболее значительно возрастало в корневой системе сеянцев. В надземной части содержание металлов увеличивалось по сравнению с контролем в меньшей степени, особенно Cu. На основе анализа величин фактора транслокации выявлено активное передвижение Ni и Cd в надземные органы и существование отчетливого корневого барьера для Cu. Установлена временная специфика аккумуляции металлов в органах сеянцев. При более длительной экспозиции отмечено уменьшение скорости транслокации элементов в надземные органы, за исключением варианта с концентраций Cd 5 мМ.
На фоне обеих изученных концентраций Cu и Cd наблюдалось небольшое снижение содержания K в стеблях сеянцев, а в варианте с Ni – в корнях сеянцев. Практически во всех случаях отмечено более низкое по сравнению с контролем содержание Mn в стеблях сеянцев B. pubescens под действием всех изученных металлов. В надземных органах растений опытных вариантов установлено уменьшение содержания Fe, и, напротив, увеличение его концентрации в корнях. Антагонистический характер взаимодействия Fe с Ni и Cd проявился в данном случае в нарушении его передвижения в надземные органы.
Влияние изученных концентраций тяжелых металлов на содержание фотосинтетических пигментов зависело от дозы вносимого элемента. При концентрации 1мМ Cu или Cd уровень хлорофиллов a и b не изменился, а при аналогичной концентрации Ni наблюдалось увеличение содержания хлорофилла b и каротиноидов. Под влиянием концентраций Cu и Cd 5 мМ отмечено снижение содержания хлорофиллов a и b на 9–15% по сравнению с контролем. Однако, несмотря на количественные изменения в содержании пигментов, соотношение хлорофилл a/хлорофилл b сохранялось на стабильном уровне с небольшими колебаниями.
Полученные нами результаты позволяют сделать вывод об относительно высокой устойчивости сеянцев B. pubescens к действию повышенных концентраций Cu, Ni и Cd. Для B. pubescens характерна способность к транслокации достаточно больших концентраций Ni и Cd в листья, а также возможность поддерживать существенно не отличающуюся от контроля биомассу во время всего эксперимента, даже при избытке такого токсичного металла, как Cd. В сочетании с высокой семенной продуктивностью это делает данный вид перспективным для использования в области фиторемедиации почв, загрязненных тяжелыми металлами.
Список литературы
Дроздов С.Н., Холопцева Е.С., Сазонова Т.А. 2014. Свето-температурная характеристика сеянцев березы пушистой Betula pubescens (Betulaceae). – Известия высших учебных заведений. Лесной журнал. 1(337): 27–36. https://www.elibrary.ru/item.asp?id=21227828
Kahle H. 1993. Response of roots of trees to heavy metals. – Environ. Exp. Bot. 33(1): 99–119. https://doi.org/10.1016/0098-8472(93)90059-O
Turner A.P., Dickinson N.M. 1993. Survival of Acer pseudoplantanus L. (sycamore) seedlings on metalliferous soils. – New Phytol. 123(3): 509–521. https://doi.org/10.1111/j.1469-8137.1993.tb03763.x
Denny H.J., Wilkins D.A. 1987. Zinc tolerance in Betula spp. I. Effects of external concentration of zinc on growth and uptake. – New Phytol. 106(3): 517–524. https://doi.org/10.1111/j.1469-8137.1987.tb00156.x
Кузнецова Т.Ю. 2009. Влияние тяжелых металлов на некоторые физиолого-биохимические показатели растений poдa Betula L.: Автореф. дис. … к-та биол. наук. Петрозаводск. 24 с.
Capuana M. 2011. Heavy metals and woody plants - biotechnologies for phytoremediation. – iForest – Biogeosciences and Forestry. 4(1): 7–15. https://doi.org/10.3832/ifor0555-004
Gogorcena Y., Larbi A., Andaluz S., Carpena R.O., Abadía A., Abadía J. 2011. Effects of cadmium on cork oak (Quercus suber L.) plants grown in hydroponics. – Tree Physiology. 31(12): 1401–1412. https://doi.org/10.1093/treephys/tpr114
Петункина Л.О., Сарсацкая А.С. 2015. Береза повислая как индикатор качества городской среды. – Вестник Кемеровского государственного университета. 4-3(64): 68–71. https://www.elibrary.ru/item.asp?id=24986475
Samecka-Cymerman A., Kolon K., Kempers A. 2009. Short shoots of Betula pendula Roth. as bioindicators of urban environmental pollution in Wrocław (Poland). – Trees. 23(5): 923–929. https://doi.org/10.1007/s00468-009-0334-z
Rosselli W., Keller C., Boschi K. 2003. Phytoextraction capacity of trees growing on a metal contaminated soil. – Plant and Soil. 256(2): 265–272. https://doi.org/10.1023/A:1026100707797
Горшков В.В., Ставрова Н.И., Катютин П.Н. 2005. Структура популяций Betula pubescens (Betulaceae) в северотаежных лесных сообществах с различной давностью нарушения. – Растительные ресурсы. 41(2): 1–16. https://www.elibrary.ru/item.asp?id=9150183
Зверев В.Е. 2009. Смертность и возобновление березы извилистой в зоне воздействия медно-никелевого комбината в период значительного сокращения выбросов: Результаты 15-летнего мониторинга. – Экология. 4: 271–277. https://doi.org/10.31857/S0367059721040041
Thompson J.D. 1991. Phenotypic plasticity as a component of evolutionary change. – Trends Ecol. Evol. 6(8): 246–249. https://doi.org/10.1016/0169-5347(91)90070-E
Мотузова Г.В. 2000. Устойчивость почв к химическому воздействию. М. 57 с.
Ильин В.Б. 2012. Тяжелые металлы и неметаллы в системе почва–растение. Новосибирск. 218 с.
Титов А.Ф., Казнина Н.М., Таланова В.В. 2014. Тяжелые металлы и растения. Петрозаводск. 194 с. http://elibrary.krc.karelia.ru/311/1/titov_a.f._kaznina_n.m._talanova_v.v._tjazhelye_metally_i_rastenija.pdf
Казнина Н.М., Титов А.Ф., Топчиева Л.В., Лайдинен Г.Ф., Батова Ю.В. 2012. Влияние возрастных различий на реакцию растений ячменя на действие кадмия. – Физиология растений. 59(1): 74–79. https://www.elibrary.ru/item.asp?id=17312890
Utriainen M.A., Kärenlampi L.V., Kärenlampi S.O., Schat H. 1997. Differential tolerance to copper and zinc of micropropagated birches tested in hydroponics. – New Phytol. 137(3): 543–549. https://doi.org/10.1046/j.1469-8137.1997.00840.x
Österås A.H., Ekvall L., Greger M. 2000. Sensitivity to, and accumulation of cadmium in Betula pendula, Picea abies, and Pinus sylvestris seedlings from different regions in Sweden. – Can. J. Bot. 78(11): 1440–1449. https://doi.org/10.1139/b00-119
Kopponen P., Utriainen M., Lukkari K., Suntioinen S., Kärenlampi L., Kärenlampi S. 2001. Clonal differences in copper and zinc tolerance of birch in metal-supplemented soil. – Environmental Pollution. 112(1): 89–97. https://doi.org/10.1016/s0269-7491(00)00096-8
Pandey V.C., Singh K., Singh R.P., Singh B. 2012. Naturally growing Saccharum munja L. on the fly ash lagoons: A potential ecological engineer for the revegetation and stabilization. – Ecol. Eng. 40: 95–99. https://doi.org/10.1016/j.ecoleng.2011.12.019
Lichtenthaler H.K. 1987. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. – Methods in Enzymology. 148: 350–382. https://doi.org/10.1016/0076-6879(87)48036-1
Иванов Ю.В., Савочкин Ю.В., Кузнецов Вл.В. 2011. Сосна обыкновенная как модельный объект для изучения механизмов адаптации хвойных к действию тяжелых металлов. 1. Изменение морфометрических и физиологических параметров при развитии сеянцев сосны в условиях хронического действия цинка. – Физиология растений. 58(5): 728–736. https://www.elibrary.ru/item.asp?id=16766030
Borgegård S.-O., Rydin H. 1989. Biomass, root penetration and heavy metal uptake in birch, in a soil cover over copper tailings. – J. Appl. Ecol. 26(2): 585–595. https://doi.org/10.2307/2404084
Hagen-Thorn A., Stjernquist I. 2005. Micronutrient levels in some temperate European tree species: a comparative field study. – Trees. 19(5): 572–579. https://doi.org/10.1007/s00468-005-0416-5
Kabata-Pendias A., Pendias H. 2001. Trace Elements in Soils and Plants. 3rd Edition, CRC Press Inc., Boca Raton, Fl. 403 p. https://doi.org/10.1201/9781420039900
Дроздова И.В., Алексеева-Попова Н.В., Беляева А.И. 2015. Уровень содержания тяжёлых металлов в системе почва-растение некоторых особо охраняемых природных территорий г. Санкт-Петербурга и Ленинградской области. – В сб.: Экологические проблемы промышленных городов: Тез. докл. 7-й Всероссийской научно-практической конф. с международным участием. Саратов. С. 251–254.
Graham R. 1981. Absorption of Copper by Plant Roots. – In: Copper in Soils and Plants. Sydney. P. 141–163.
Kozlov M., Haukioja E., Bakhtiarov A., Stroganov D., Zimina S. 2000. Root versus canopy uptake of heavy metals by birch in an industrially polluted area: Contrasting behaviour of nickel and copper. – Environ. Polluti. 107(3): 413–420. https://doi.org/10.1016/S0269-7491(99)00159-1
Maurice C., Lagerkvist A. 2000. Using Betula pendula and Telephora caryophyllea for soil pollution assessment. – Soil Sediment Contam. 9(1): 31–50. https://doi.org/10.1080/10588330091134185
Liao M., Hedley M., Woolley D., Brooks R., Nichols M. 2000. Copper uptake and translocation in chicory (Cichorium intybus L. cv. Grasslands Puna) and tomato (Lycopersicon esculentum Mill. cv. Rondy) plants grown in NFT system. I. Copper uptake and distribution in plants. – Plant and Soil. 221(2): 135–142. https://doi.org/10.1023/A:1004843505053
Jing Y., Cui H., Li T., Zhao Z. 2014. Heavy metal accumulation characteristics of Nepalese alder (Alnus nepalensis) growing in a lead-zinc spoil heap, Yunnan, southwestern China. – iForest – Biogeosciences and Forestry. 7(4): 204–208. https://doi.org/10.3832/ifor1082-007
Kuzovkina Y., Knee M., Quigley M. 2010. Cadmium and copper uptake and translocation in five willow (Salix L.) species. – Int. J. Phytoremediation. 6(3): 269–287. https://doi.org/10.1080/16226510490496726
Arduini I., Godbold D.L., Onnis A. 1996. Cadmium and copper uptake and distribution in Mediterranean tree seedlings. – Physiol. Plant. 97(1): 111–117. https://doi.org/10.1111/j.1399-3054.1996.tb00486.x
Дроздова И.В., Алексеева-Попова Н.В., Беляева А.И., Калимова И.Б. 2014. Влияние меди, никеля и кадмия на рост и некоторые физиологические параметры сеянцев Pinus sylvestris и Picea abies (сем. Pinaceae). – Растительные ресурсы. 50(4): 554–556. https://www.elibrary.ru/item.asp?id=22260671
Rabêlo F., Gaziola S., Rossi M., Silveira N., Wójcik M., Bajguz A., Piotrowska-Niczyporuk A., Lavres J., Linhares F., Azevedo R., Vangronsveld J., Alleoni L. 2021. Unraveling the mechanisms controlling Cd accumulation and Cd-tolerance in Brachiaria decumbens and Panicum maximum under summer and winter weather conditions. – Physiol. Plant. 173(1): 20–44. https://doi.org/10.1111/ppl.13160
Серегин И.В., Кожевникова А.Д. 2008. Роль тканей корня и побега в транспорте и накоплении кадмия, свинца, никеля и стронция. – Физиология растений. 55(1): 5–26. https://www.elibrary.ru/item.asp?id=9590996
Кожевникова А.Д., Серегин А.В., Схат Х. 2020. Накопление никеля исключателем Thlaspi arvense и гипераккумулятором Noccaea caerulesces при кратковременной и длительной инкубации. – Физиология растений. 67(2): 167–176. https://doi.org/10.31857/S0015330320020086
Gussarsson M. 1994. Cadmium-induced alterations in nutrient composition and growth of Betula pendula seedlings: the significance of fine root as a primary target for cadmium toxicity. – J. Plant Nutrition. 17(12): 2151–2163. https://doi.org/10.1080/01904169409364871
Brekken A., Steinnes E. 2004. Seasonal concentrations of cadmium and zinc in native pasture plants: consequences for grazing animals. – Science of the Total Environment. 326 (1–3): 181–195. https://doi.org/10.1016/j.scitotenv.2003.11.023
Мялик А.Н., Дашкевич М.М., Галуц О.А. 2020. Микроэлементный состав растительного сырья берёзы бородавчатой в условиях юго-запада Беларуси. – В сб.: От растения до лекарственного препарата: Тез. докл. международной науч. конф. M. С. 260–269. http://hbc.bas-net.by/hbcinfo/books/Mialik2020-2.pdf
Кузнецова Т.Ю., Ветчинникова Л.В., Титов А.Ф. 2015. Аккумуляция тяжелых металлов в различных органах и тканях березы в зависимости от условий произрастания. – Труды Карельского научного центра РАН. 1: 86–94. https://doi.org/10.17076/eco27
Науменко О.А., Соколова О.Я., Бибарцева Е.В. 2015. Характеристика видовых особенностей кадмий связывающей способности древесных растений города Оренбурга. – Вестник Оренбургского государственного университета. 10 (185): 225–228. http://vestnik.osu.ru/2015_10/51.pdf
Fernández R., Bertrand A., Casares A., García R., González A., Tamés R.S. 2008. Cadmium accumulation and its effect on the in vitro growth of woody fleabane and mycorrhized white birch. – Environ. Pollut. 152(3): 522–529. https://doi.org/10.1016/j.envpol.2007.07.011
Reeves R., Baker A., Jaffré T., Erskine P., Echevarria G., van der Ent A. 2017. A global database for plants that hyperaccumulate metal and metalloid trace elements. – New Phytol. 218(2): 407–411. https://doi.org/10.1111/nph.14907
Barceló J., Poschenrieder C. 1990. Plant water relations as affected by heavy metal stress: A review. – J. Plant Nutr. 13(1): 1–37. https://doi.org/10.1080/01904169009364057
Усманов И.Ю., Рахманкулова З.Ф., Кулагин А.Ю. 2001. Экологическая физиология растений. М. 223 с.
Öncel I., Keleş Y., Üstün A. 2000. Interactive effects of temperature and heavy metal stress on the growth and some biochemical compounds in wheat seedlings. – Environ. Pollut. 107(3): 315–320. https://doi.org/10.1016/S0269-7491(99)00177-3
Zengin F., Munzuroglu O. 2005. Effects of some heavy metals on content of chlorophyll, proline and some antioxidant chemicals in bean (Phaseolus Vulgaris L.) seedlings. – Acta biologica Cracoviensia. Series botanica. 47(2): 157–164. https://abcbot.pl/pdf/47_2/157-164.pdf
Salisbury A., Gallagher F., Caplan J., Grabosky J. 2018. Maintenance of photosynthesis by Betula populifolia in metal contaminated soils. – Sci. Total Environ. 625: 1615–1627. https://doi.org/10.1016/j.scitotenv.2017.12.279
Gussarsson M., Jensen P. 1992. Effects of copper and cadmium on uptake and leakage of K+ in birch (Betula pendula) roots. – Tree Physiol. 11(3): 305–313. https://doi.org/10.1093/treephys/11.3.305
Zhang X., Gao B., Xia H. 2014. Effect of cadmium on growth, photosynthesis, mineral nutrition and metal accumulation of bana grass and vetiver grass. – Ecotoxicol. Environ. Saf. 106: 102–108. https://doi.org/10.1016/j.ecoenv.2014.04.025
Rabêlo F.H.S., Lux A., Rossi M.L., Martinelli A.P., Cuypers A., Lavres J. 2018. Adequate S supply reduces the damage of high Cd exposure in roots and increases N, S and Mn uptake by Massai grass grown in hydroponics. – Environ. Exp. Botany. 148(4): 35–46. https://doi.org/10.1016/j.envexpbot.2018.01.005
Черемисина А.И., Шевякова Н.И., Кузнецов Вл.В. 2012. Динамика аккумуляции никеля и возможные причины дефицита железа в листьях гибридной формы амаранта. – Вестник РУДН, серия Агрономия и животноводство. 3: 21–30. http://agrojournal.rudn.ru/agronomy/article/view/1718
Sebastian A., Prasad M. 2016. Iron plaque decreases cadmium accumulation in Oryza sativa L. and serves as a source of iron. – Plant Biol. 18(6): 1008–1015. https://doi.org/10.1111/plb.12484
Burton K., Morgan E., Roig A. 1986. Interactive effects of cadmium, copper and nickel on the growth of sitka spruce and studies of metal uptake from nutrient solutions. – New Phytol. 103(3): 549–557. https://doi.org/10.1111/j.1469-8137.1986.tb02892.x
Wang M., Zou J., Duan X., Jiang W., Liu D. 2007. Cadmium accumulation and its effects on metal uptake in maize (Zea mays L.). – Bioresour. Technol. 98(1): 82–88. https://doi.org/10.1016/j.biortech.2005.11.028
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


