Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1262-1270
Кальциевый транзиент и секреция медиатора в разных участках нервного окончания лягушки при изменении условий входа ионов кальция
Э. Ф. Хазиев 1, 2, 3, *, Д. В. Балашова 3, А. Н. Ценцевицкий 1, 2, Э. А. Бухараева 1, Д. В. Самигуллин 1, 2, 3
1 Казанский институт биохимии и биофизики “Казанский научный центр Российской академии наук”
Казань, Россия
2 Казанский (Приволжский) федеральный университет
Казань, Россия
3 Казанский национальный исследовательский технический университет им. А.Н. Туполева
Казань, Россия
* E-mail: eduard.khaziev@gmail.com
Поступила в редакцию 25.06.2019
После доработки 07.07.2019
Принята к публикации 07.07.2019
Аннотация
В экспериментах на нервно-мышечном препарате лягушки исследовали особенности кальциевого ответа и секреции квантов ацетилхолина в разных участках протяженной нервной терминали при изменении условий входа кальция. Используя кальций-чувствительный флуоресцентный краситель, анализировали вход Ca2+ (Ca2+-транзиент) в проксимальном и дистальном участках нервного окончания при увеличении содержания ионов K+, под действием блокаторов N‑ и L-типов кальциевых каналов, а также при блокировании кальций-активируемых калиевых каналов. Проведенное исследование показало, что при равномерной плотности распределения потенциал-зависимых кальциевых каналов вдоль нервного окончания проксимо-дистальный декремент кальциевого транзиента и интенсивности квантовой секреции сохраняется при дополнительном открывании потенциал-зависимых кальциевых каналов путем калиевой деполяризации, при прореживании этих каналов специфическими блокаторами, но изменяется при блокировании кальций-активируемых калиевых каналов.
Нервно-мышечный синапс позвоночных является классическим и широко используемым объектом для изучения механизмов реализации и модуляции синаптической передачи возбуждения в быстрых синапсах химического типа. Как хорошо известно, вход Ca2+ после пресинаптического потенциала действия запускает секрецию и определяет интенсивность выделения квантов нейромедиатора [1]. Однако, достаточно трудно точно оценить количество Ca2+, вошедшего в нервное окончание в ответ на стимул. Сложность обусловлена очень малыми размерами нервной терминали, не позволяющими использовать микроэлекрод для измерения входящего кальциевого тока [2, 3]. Для оценки входа Ca2+ в ответ на нервный стимул в настоящее время применяют метод регистрации кальциевого транзиента – флуоресцентного сигнала, отражающего изменение свечения кальций-чувствительного красителя при связывании с Ca2+ [4].
Нервные окончания лягушки существенно различаются по размерам и числу терминальных ответвлений [5, 6]. Вдоль протяженной терминали происходит изменение формы потенциала действия от преимущественно отрицательно направленного к полностью положительному сигналу [7–10]. Изменение пресинаптического потенциала действия сопровождается изменением вероятности высвобождения нейромедиатора в разных участках терминали [11–14]. Причинами, определяющими различие параметров квантового освобождения ацетилхолина вдоль терминали, могут быть морфологические особенности разных участков, в частности, диаметр поперечного сечения терминали, определяющий длину синаптического контакта, и количество активных зон секреции в каждом участке [15, 16], разная плотность и проводимость потенциал-зависимых ионных (калиевых, натриевых и кальциевых) каналов, участие кальциевых каналов разных типов, различия в функционировании активных зон секреции в разных участках нервной терминали, разная работа систем, обеспечивающих поддержание внутриклеточной концентрации Ca2+ [7].
Ранее при использовании методов кальциевого имиджинга мы показали наличие проксимо-дистального декремента амплитуды кальциевого транзиента, проявляющегося в уменьшении входа Ca2+ в нервную терминаль лягушки по направлению от проксимальной части нервного окончания к дистальной [17, 18]. Однако иммуногистохимический анализ не выявил различий в плотности распределения кальциевых каналов вдоль нервного окончания [19]. В связи с этим возникает вопрос, почему при одинаковой плотности кальциевых каналов наблюдается уменьшение величины кальциевого ответа и соответственно снижение вероятности секреции квантов ацетилхолина. Пытаясь ответить на этот вопрос, мы провели анализ входа кальция в проксимальном и дистальном участках протяженных двигательных нервных окончаний лягушки и сопоставили его с изменением интенсивности вызванной квантовой секреции в этих участках при модуляции активности потенциал-чувствительных кальциевых каналов путем блокады их отдельных подтипов. В ходе экспериментов с использованием флуоресцентного красителя, специфичного к Ca2+, анализировали вход этих ионов (Ca2+-транзиент) и параметры вызванного квантового освобождения ацетилхолина в проксимальном и дистальном участках нервной терминали в контроле и под действием блокаторов N- и L-типов кальциевых каналов, а также при увеличении содержания ионов K+ в растворе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты на изолированном препарате кожно-грудинной мышцы озерной лягушки Rana ridibunda проводили в соответствии с этическими принципами и нормативными документами, рекомендованными Европейским научным фондом (ESF) и декларацией о гуманном отношении к животным. В каждой серии экспериментов использовали 3–5 животных, у которых анализировали 1–3 синапса. Выделение препарата и процесс очистки мышцы от соединительной ткани производили в растворе Рингера следующего состава (мМ): NaCl – 113.0, KCl – 2.5, NaHCO3 – 3.0, CaCl2 – 1.8; pH раствора поддерживали на уровне 7.2–7.4.
Выделенный препарат кожно-грудинной мышцы с фрагментом нерва помещали в чашку Петри для загрузки флуоресцентного кальциевого красителя. На короткий отрезок нерва длиной 2–3 мм помещали каплю краски Oregon Green 488 BAPTA-1 Hexapotassium Salt, cell impermeant в концентрации 50 мМ объемом 0.1–0.3 мкл, после чего производили инкубацию препарата в два этапа. На первом этапе выдерживали препарат в растворе Рингера в условиях комнатной температуры в течение 4–6 ч во влажной камере. На втором – 15–20 ч в холодильнике при температуре 8 ± 2°C. На этом этапе отмывался краситель, попадающий на препарат снаружи, и загрузка кальциевого красителя происходила за счет диффузии и антероградного аксонного транспорта [20–22]. При таком способе загрузки непроникающий сквозь клеточную мембрану краситель загружается только в цитозоль нервного окончания, что позволяет регистрировать кальциевые сигналы только от пресинаптической нервной клетки. После загрузки флуоресцентного красителя в нервные терминали, препарат помещали в ванночку объемом 5 мл, через которую протекал перфузионный раствор Рингера с пониженным содержанием Са2+ и повышенным Mg2+ (мМ): NaCl – 113.0, KCl – 2.5, NaHCO3 – 3.0, MgCl2 – 6.0, CaCl2 – 0.9 (pH 7.2–7.4, температура 20.0 ± 0.5°C). При освещении препарата монохроматическим светом с длиной волны 488 нм, возбуждающей краситель, производили регистрацию увеличения свечения в ответ на стимуляцию двигательного нерва прямоугольными электрическими импульсами сверхпороговой амплитуды и длительностью 0.2 мс. Выбирали терминали длиной не менее 100 мкм, проксимальным считали участок на расстоянии 30% длины всей терминали от окончания миелиновой оболочки нерва, дистальным – 30% от кончика терминали.
Для регистрации изменения флуоресцентного свечения красителя в терминали использовали высокоскоростную камеру Neuro CCD (Redshirt Imaging), которая позволяет локально оценивать низкоамплитудные быстрые кальциевые сигналы в различных участках нервной терминали. Амплитуду Са2+-транзиента оценивали как 100% × ΔF/F0, где ΔF изменение интенсивности флуоресценции в ответ на стимуляцию относительно базовой флуоресценции F0 без стимула [23].
Для оценки среднего квантового состава постсинаптических ответов осуществляли регистрацию внеклеточных токов нервного окончания и токов концевой пластинки при помощи стандартной микроэлектродной техники. Экстраклеточные микроэлектроды с диаметром кончика 2.5–3.5 мкМ, заполненные раствором Рингера или NaCl (0.5 мМ), имели сопротивление 1.0–1.5 МОм. Отведенные сигналы после фильтрации до 10 кГц усиливали и подавали на вход 16-ти разрядного АЦП, квантуя с интервалом 10 мкс. Регистрацию токов проводили с использованием раствора Рингера с пониженным содержанием Ca2+ (мМ): NaCl – 113.0, KCl – 2.5, NaHCO3 – 3.0, MgCl2 – 4.0, CaCl2 – 0.3. Средний квантовый состав токов концевой пластинки оценивали методом “выпадений” [24].
В экспериментах были использованы следующие вещества (все фирмы Sigma): конотоксин GVIA, нитрендипин, ибериотоксин, д-тубокурарин. Поскольку некоторые реактивы растворялись в ДМСО (диметилсульфоксид), конечная концентрация которого в растворе не превышала 0.1%, то предварительно были проведены эксперименты по анализу эффектов растворителя на исследуемые процессы. Было показано, что на протяжении более 2-х ч регистрации ДMСO не оказывал достоверно значимого влияния на амплитуду Ca2+-транзиента.
Для статистической обработки экспериментально полученных сигналов Ca2+-транзиента использовали стандартные методы определения средних величин, стандартных ошибок, параметрический t-критерий Стьюдента для попарно связанных вариант и критерий Манна–Уитни. Достоверность различия средних значений определяли при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В контрольных условиях амплитуда Ca2+-транзиента снижалась по мере удаления от проксимального к дистальному участку на 39.9 ± 5.6% (n = 22, p < 0.05). Величина квантового состава в контроле составила 0.45 ± 0.06 (n = 10) в проксимальной части и 0.31 ± 0.09 (n = 7) – в дистальной.
При деполяризации нервного окончания происходит увеличение вероятности открытия кальциевых каналов [1]. Можно ожидать, что в различных участках терминали деполяризация приведет к изменению транзиента в разной степени вследствие особенностей разных участков – различные диаметры поперечного сечения терминали, количество активных зон секреции в каждом участке, разная плотность и проводимость потенциал-зависимых ионных каналов, участие кальциевых каналов разных типов, различия в функционировании активных зон секреции. Повышение внеклеточной концентрации калия вызывало уменьшение мембранного потенциала клетки [25]. При увеличении концентрации ионов калия в омывающем препарат растворе от 2.5 до 10 мМ, амплитуда Ca2+-транзиента увеличивалась в равной мере в проксимальной части – на 16.7 ± 3.5% (n = 7, p < 0.05), и в дистальной – на 16.6 ± 2.2% (n = 6, p < 0.05) (рис. 1А, Б, рис. 2), что указывает на одинаковый прирост концентрации Са2+ и, равное количество дополнительно открывшихся кальциевых каналов в проксимальном и дистальном участках терминали.
Рис. 1.
Ca2+-транзиент в проксимальной и дистальной частях нервного окончания в контроле и в присутствии повышенной до 10 мМ концентрации ионов K+ (А и Б), конотоксина (В и Г), нитрендипина (Д и Е), ибериотоксина (Ж и З).
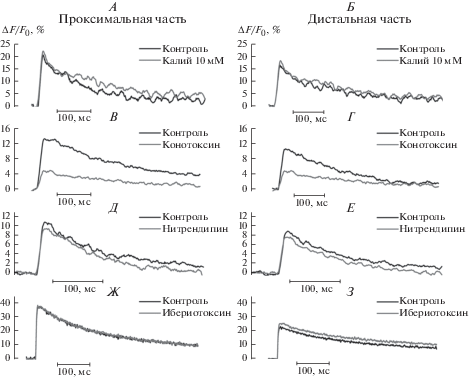
Рис. 2.
Изменения амплитуды Ca2+-транзиента по отношению к контролю (принят за 1), измеренные в проксимальной и дистальной частях нервного окончания под действием блокаторов N-типа кальциевых каналов (конотоксин), L-типа кальциевых каналов (нитрендипин), при увеличенной до 10 мМ концентрации ионов K+ и под действием ибериотоксина.
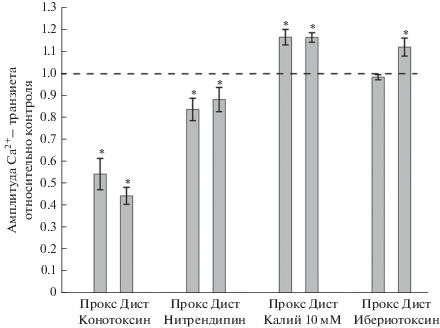
Основным типом кальциевых каналов, обеспечивающих вход кальция в нервное окончание лягушки после развития пресинаптического потенциала действия, являются потенциал-зависимые каналы N-типа [26]. Обработка нервно-мышечного препарата специфическим антагонистом кальциевых каналов N-типа конотоксином GVIA в концентрации 300 нМ приводила к снижению амплитуды Ca2+-транзиента в проксимальной части на 45.6 ± 7.2% (n = 7, p < 0.05), а в дистальной на 55.5 ± 3.9% (n = 6, p < 0.05) (рис. 1А, рис. 2А, Б), при этом достоверного различия в степени снижения кальциевого ответа в разных участках не наблюдалось. Под действием конотоксина GVIA квантовый состав достоверно снизился на 57.4 ± 5.2% (n = 11, p < 0.05) в проксимальной части и на 46.4 ± 8.8% (n = 7, p < 0.05) – в дистальной (рис. 1В, Г, рис. 2). Уменьшение среднего квантового состава под действием блокатора N-типа кальциевых каналов в проксимальном и дистальном участках синапса также не различалось достоверно.
Ранее нами установлено, что помимо основного N-типа кальциевых каналов, на нервных окончаниях лягушки находятся каналы L-типа [27]. Специфический блокатор кальциевых каналов L-типа нитрендипин в концентрации 5 мкМ снижал Ca2+-транзиент в проксимальной части на 16.2 ± 5.1% (n = 13, p < 0.05) и в дистальной на 11.7 ± 5.5% (n = 11, p < 0.05) по отношению к контролю, без достоверного отличия в разных участках (рис. 1Д, Е, рис. 2). В присутствии нитрендипина квантовый состав уменьшился относительно контрольной величины на 28.3 ± 4.9% (n = 13, p < 0.05) в проксимальной части и на 34.1 ± 3.2% (n = 12, p < 0.05) – в дистальной. Достоверного различия в эффектах нитрендипина на квантовый состав в разных частях нервной терминали также не наблюдалось.
Кальций-активируемые калиевые каналы нервного окончания участвуют в формировании амплитуды и длительности пресинаптического потенциала действия, и, вследствие этого, определяют уровень деполяризации пресинаптической мембраны [28]. Блокатор кальций-активируемых калиевых каналов ибериотоксин в концентрации 100 нМ мкМ не изменял Ca2+-транзиент в проксимальной части (–1.5 ± 1.2%, n = 17, p > 0.05) и достоверно увеличивал Ca2+-транзиент в дистальной части нервного окончания на 12.2 ± 4.1% (n = 17, p < 0.05) по отношению к контролю (рис. 1Ж, З, рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По мере удлинения немиелинизированной части аксона наблюдается изменение параметров вызванного нервным импульсом освобождения квантов ацетилхолина в протяженных нервно-мышечных синапсах лягушки. Описано уменьшение интенсивности вызванной секреции квантов, оцениваемой по величине квантового состава [11, 13, 14], повышение степени синхронности секреции квантов [29], разная выраженность влияния физиологически активных соединений [29]. Поскольку ведущим звеном, запускающим процесс секреции квантов, является вход Ca2+ после развития потенциала действия [1, 30], естественно предположить, что именно этот фактор является основным в определении проксимо-дистального декремента параметров квантовой секреции. Действительно, при регистрации интенсивности свечения специфического кальций-чувствительного флуоресцентного красителя нами установлено, что по мере удаления от проксимальной части к дистальной вход кальция в нервное окончание в ответ на нервный импульс уменьшается [17, 18]. Это может быть связано с изменением плотности кальциевых каналов вдоль протяженной нервной терминали. Однако наши исследования иммунофлуоресцентным методом с использованием специфических антител к кальциевым каналам N- и L-типов [19], а также работа R. Robitaille с соавт. [31], показали, что кальциевые каналы равномерно распределены вдоль нервного окончания. Представленные в данном исследовании эксперименты показали, что величина кальциевого ответа уменьшается при блокировании кальциевых каналов N-типа конотоксином GVIA и нитрендипином – блокатором дигидропиридин-чувствительных каналов L-типа. Причем, эти эффекты в равной степени проявлялись и в проксимальной и в дистальной частях синапса. Дополнительная деполяризация нервного окончания при повышении внеклеточной концентрации калия приводила к увеличению амплитуды кальциевого ответа также в равной степени в разных участках. Блокада кальций-активируемых калиевых каналов ибериотоксином вызывала увеличение входа Ca2+ только в дистальной части терминали. Это указывает на то, что проксимо-дистальный декремент Ca2+-транзиента обусловлен неравномерным распределением потенциал-чувствительных и кальций-зависимых калиевых каналов. Изменение Ca2+-транзиента при блокировании каналов сопровождалось уменьшением числа освободившихся квантов в ответ на нервный импульс, одинаково проявляющимся в разных участках синапса. Таким образом, полученные данные свидетельствуют о том, что потенциал-зависимые кальциевые каналы N- и L-типов участвуют в реализации входа Ca2+ в двигательное нервное окончание лягушки, их активация приводит к повышению интенсивности вызванного нервным стимулом освобождения квантов ацетилхолина. Эти каналы в равной степени представлены в разных участках протяженной терминали, а их “прореживание” с помощью специфических каналоблокаторов приводит к снижению как входа Ca2+ в терминаль, так и уменьшению числа выделяющихся квантов медиатора в одинаковой мере в проксимальной и дистальной частях протяженного синаптического контакта. И только блокирование кальций-активируемых калиевых каналов выявило разницу в изменении входа кальция в нервное окончание. Возникает вопрос, в чем же причина наличия проксимо-дистального декремента амплитуды Ca2+-транзиента?
Как показали J.M. Pattillo с соавт. [32] и Dittrich с соавт. [33], существует зависимость между формой потенциала действия и пресинаптическим кальциевым током. Хорошо известно, что по мере удаления от проксимального отдела нервного окончания к дистальному изменяется форма потенциала действия [7]. Изменение формы электрических ответов вдоль нервного окончания на разных расстояниях от конца миелинизированной части нерва объясняется различным вкладом разных типов потенциал-зависимых каналов, распределенных по поверхности мембраны [7]. Установлено, что натриевые каналы присутствуют с наибольшей плотностью в проксимальной части каждой терминальной ветви и почти не детектируемы в дистальной части. Kалиевые каналы с более высокой плотностью расположены в средних частях нервного окончания [7]. Таким образом, по-видимому, разная степень активности или разное число натриевых и калиевых каналов обеспечивает разный уровень деполяризации в разных участках и определяет наличие проксимо-дистального декремента Ca2+-транзиента. Нельзя также исключить вклада изменения размера и архитектуры активных зон секреции вдоль уменьшающегося по диаметру нервного окончания [7].
Таким образом, проведенное исследование показало, что при равномерной плотности распределения потенциал-зависимых кальциевых каналов вдоль протяженного нервного окончания в синапсе лягушки проксимо-дистальный декремент Ca2+-транзиента и интенсивности квантовой секреции сохраняется при дополнительном открывании кальциевых каналов путем калиевой деполяризации, при прореживании этих каналов специфическими блокаторами, но изменяется при блокировании кальций-активируемых калиевых каналов, участвующих в формировании пресинаптического потенциала действия. Это указывает на важную роль параметров пресинаптического потенциала действия в обеспечении проксимо-дистального декремента входа кальция и квантовой секреции в нервно-мышечном синапсе лягушки.
Список литературы
Burnashev N., Rozov A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37(5): 489–495. 2005.
Borst J.G., Sakmann B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383(6599): 431–434. 1996.
Yazejian B., DiGregorio D.A., Vergara J.L., Poage R.E., Meriney S.D., Grinnell A.D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J. Neurosci. 17(9): 2990–3001. 1997.
Tsien R.Y. Fluorescence ratio imaging of dynamic intracellular signals. Acta Physiol. Scand. Suppl. 582: 6. 1989.
Bennett M.R., Lavidis N.A. Quantal secretion at release sites of nerve terminals in toad (Bufo marinus) muscle during formation of topographical maps. J. Physiol. 401: 567–579. 1988.
Nudell B.M., Grinnell A.D. Inverse relationship between transmitter release and terminal length in synapses on frog muscle fibers of uniform input resistance. J. Neurosci. 2(2): 216–224. 1982.
Mallart A. Presynaptic currents in frog motor endings. Pflugers Arch. 400(1): 8–13. 1984.
Katz B., Miledi R. The effect of local blockage of motor nerve terminals. J. Physiol. 199(3): 729–741. 1968.
Braun M., Schmidt R.F. Potential changes recorded from the frog motor nerve terminal during its activation. Pflugers. Arch. Gesamte Physiol. Menschen Tiere. 287(1): 56–80. 1966.
Зефиров А.Л., Халилов И.А. Анализ электрической активности в различных участках нервного окончания амфибий. Физиология медиаторов. Периферический синапс: тез. докл. V Всесоюз. симпозиума (июнь 1984 г.). 97–99. Казань. 1984. [Zefirov A.L., Halilov I.A. Analiz elektricheskoj aktivnosti v razlichnyh uchastkah nervnogo okonchaniya amfibij. Fiziologiya mediatorov. Perifericheskij sinaps : tez. dokl. V Vsesoyuz. simpoziuma (iyun' 1984 g.). 97–99. Kazan’. 1984. (In Russ.)].
Bennett M.R., Lavidis N.A. Variation in quantal secretion at different release sites along developing and mature motor terminal branches. Brain Res. 281(1): 1–9. 1982.
D'Alonzo A.J., Grinnell A.D. Profiles of evoked release along the length of frog motor nerve terminals. J. Physiol. 359: 235–258. 1985.
Bennett M.R., Jones P., Lavidis N.A. The probability of quantal secretion along visualized terminal branches at amphibian (Bufo marinus) neuromuscular synapses. J. Physiol. 379: 257–274. 1986.
Bukcharaeva E., Samigullin D., Nikolsky E.E., Vyskocil F. Cyclic AMP synchronizes evoked quantal release at frog neuromuscular junctions. Physiol. Res. 49(4): 475–479. 2000.
Davey D.F., Bennett M.R. Variation in the size of synaptic contacts along developing and mature motor terminal branches. Brain Res. 281(1): 11–22. 1982.
Bennett M.R., Lavidis N.A., Armson F.M. Changes in the dimensions of release sites along terminal branches at amphibian neuromuscular synapses. J. Neurocytol. 16(2): 221–237. 1987.
Khaziev E., Golovyahina A., Bukharaeva E., Nikolsky E, Samigullin D. Action of ATP on Ca2+-transient in different parts of the frog motor nerve ending. BioNanoScience. 2017https://doi.org/10.1007/s12668-016-0350-6
Samigullin D.V., Vasin A.L., Bukharaeva E.A., Nikolsky E.E. Characteristics of calcium transient in different parts of frog nerve terminal in response to nerve impulse. Dokl. Biol. Sci. 431(1): 83–85. 2010.
Nurullin L.F., Mukhitov A.R., Tsentsevytsky A.N., Petrova N.V., Samigullin D.V., Malomouzh A.I., Bukharaeva E.A., Vyskočil F., Nikolsky E.E. Voltage-Dependent P/Q-Type Calcium Channels at the Frog Neuromuscular Junction. Physiol. Res. 60: 815–823. 2011.
Peng Y.Y., Zucker R.S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10(3): 465–473. 1993.
Neher E. The use of fura-2 for estimating Ca buffers and Ca fluxes. Neuropharmacol. 34(11): 1423–1442. 1995.
Shahrezaei V., Cao A., Delaney K.R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J. Neurosci. 26(51): 13240–13249. 2006.
Samigullin D.V., Khaziev E.F., Zhilyakov N.V., Bukharaeva E.A., Nikolsky E.E. Loading a Calcium Dye into Frog Nerve Endings Through the Nerve Stump: Calcium Transient Registration in the Frog Neuromuscular Junction. J. Vis. Exp. (125) e55122.https://doi.org/10.3791/55122
Del Castillo J., Katz B. Quantal components of the end-plate potential. J. Physiol. 124: 560–573. 1954.
Matyushkin D.P., Shabunova I.A., Sharovarova G.M., Vinogradova I.M. On Potassium Functional Feedback in Neuromuscular Junction. J. Neurosci. Res. 3: 441–450. 1978.
Khaziev E., Samigullin D., Zhilyakov N., Fatikhov N., Bukharaeva E., Verkhratsky A. Nikolsky E. Acetylcholine-Induced Inhibition of Presynaptic Calcium Signals and Transmitter Release in the Frog Neuromuscular Junction. Front. Physiol. 7: 621.https://doi.org/10.3389/fphys.2016.00621
Tsentsevitsky A.N., Samigullin D.V., Nurullin L.F., Khaziev E.F., Nikolsky E.E., Bukharaeva E.A. Presynaptic Voltage-Dependent Calcium Channels at the Frog Neuromuscular Junction. Frogs genetic diversity, neural development and ecological implications. Nova Science Publishers. Inc. New York. Chapter 5. 179–194. ISBN: 978-1-63117-626-5. 2014.
Roncarati R., Di Chio M., Sava A., Terstappen G.C., Fumagalli G. Presynaptic localization of the small conductance calcium-activated potassium channel SK3 at the neuromuscular junction. Neuroscience. 104(1): 253–262. 2001.
Bukcharaeva E.A., Kim K.C., Moravec J., Nikolsky E.E., Vyskocil F. Noradrenaline synchronizes evoked quantal release at frog neuromuscular junctions. J. Physiol. 517 (Pt 3): 879–888. 1999.
Pang Z.P., Südhof T.C. Cell biology of Ca2+-triggered exocytosis. Curr. Opin. Cell Biol. 22(4): 496–505. 2010.https://doi.org/10.1016/j.ceb.2010.05.001
Robitaille R., Adler E.M., Charlton M.P., Strategic location of calcium channels at transmitter release sites of frog neuromuscular synapses. Neuron. 5. 773–779. 1990.
Pattillo J.M., Yazejian B., DiGregorio D.A., Vergara J.L., Grinnell A.D., Meriney S.D. Contribution of presynaptic calcium-activated potassium currents to transmitter release regulation in cultured Xenopus nerve–muscle synapses. Neuroscience. 102. 229–240. 2001.
Dittrich M., Homan A.E., Meriney S.D. Presynaptic mechanisms controlling calcium-triggered transmitter release at the neuromuscular junction. Curr. Opin. Physiol. 15–24.https://doi.org/10.1016/j.cophys.2018.03.004
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


