Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1247-1261
Влияние витаминов группы В на раннее развитие крысят с пренатальной гипергомоцистеинемией
О. В. Яковлева 1, *, А. Р. Зиганшина 1, Е. В. Герасимова 1, А. Н. Арсланова 1, И. З. Ярмиев 1, А. Л. Зефиров 2, Г. Ф. Ситдикова 1
1 Казанский (Приволжский) федеральный университет
Казань, Россия
2 Институт нейронаук, Казанский государственный медицинский университет
Казань, Россия
* E-mail: a-olay@yandex.ru
Поступила в редакцию 01.07.2019
После доработки 29.07.2019
Принята к публикации 08.08.2019
Аннотация
Повышенный уровень гомоцистеина в плазме – гипергомоцистеинемия (гГЦ) считается независимым фактором риска ранних прерываний беременности, отслойки плаценты, преэклампсии и других осложнений. Одним из факторов развития гГЦ является дефицит витаминов группы В. При этом как недостаток, так и избыток витаминов могут оказывать нейротоксические эффекты и вызывать окислительный стресс. Целью нашей работы было исследование эффектов применения витаминов группы В во время беременности у крыс с гГЦ на раннее развитие и уровень глутатиона в плазме потомства. В потомстве крыс с гГЦ наблюдали высокую смертность, снижение массы тела, повышение концентрации гомоцистеина и уменьшение уровня восстановленного глутатиона в плазме, а также задержку развития сенсо-моторных рефлексов и ряда поведенческих реакций, анализируемых в тестах Открытое поле и Ротарод. Введение в рацион беременным крысам с гГЦ витаминов группы В (В6, В9, В12) привело к снижению смертности, повышению массы тела потомства и уровня глутатиона и частичному предотвращению нарушений сенсо-моторного развития. При этом мы наблюдали уменьшение уровня гомоцистеина, которое, однако, не достигало контрольных значений. Также отмечено положительное влияние витаминов группы В на уровень тревожности и мышечную силу животных с пренатальной гГЦ. Однако горизонтальная двигательная активность, число вертикальных стоек, балансировка на вращающемся цилиндре не восстанавливались до контрольного уровня. Таким образом, использование витаминов группы В, несмотря на положительное влияние на физическое развитие и формирование рефлексов, не предотвращало нарушений координации движений в сложных поведенческих актах, что, по-видимому, связано с тем, что уровень гомоцистеина в плазме не восстанавливался до нормальных значений и/или неспособностью используемого комплекса полностью нейтрализовать негативные последствия хронической гГЦ.
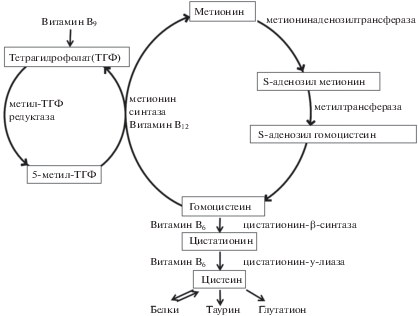
Гомоцистеин – это серосодержащая аминокислота, образующаяся в ходе метаболизма метионина [1, 2]. Гомоцистеин может преобразоваться обратно в метионин в реакции реметилирования с помощью метионинсинтазы, использующей в качестве донора метильной группы 5-метил-тетрагидрофолат (рис. 1). Гомоцистеин также метаболизируется под действием цистатионин β-синтазы до цистатионина, который далее распадается с помощью цистатионин γ-лиазы до цистеина и α-кетобутирата. Витамины В6, В12 и фолиевая кислота являются важными кофакторами ферментов метаболизма гомоцистеина (рис. 1) [1, 3–5]. Несмотря на некоторые различия в регуляции метаболизма тиолов у грызунов и людей, основные ферменты и реакции метионинового цикла одинаковы, поэтому крыс и мышей широко используют для моделирования экспериментальной гипергомоцистеинемии (гГЦ), изучения данной патологии и путей ее коррекции [6, 7].
Согласно литературным данным в норме у человека концентрация гомоцистеина в плазме варьирует от 5 до 10 мкМ. Увеличение концентрации выше 15 мкМ диагностируется как гГЦ [2, 5, 8]. Генетические мутации ферментов метаболизма гомоцистеина, дефицит витаминов группы В, избыток метионина и нарушения выделительной функции, прием некоторых лекарственных препаратов приводит к повышению уровня гомоцистеина в организме [9, 10]. гГЦ ведет к повреждению и активации эндотелиальных клеток, выстилающих стенки сосудов, повышает риск тромбозов, запускает атерогенный процесс и нейродегенерацию [10, 11, 29]. Еще в конце прошлого века было обнаружено, что гГЦ, связанная с нехваткой фолиевой кислоты или витамина B12, приводит к серьезным патологиям беременности, таким как преэклампсия, отслойка плаценты, тромбоэмболия, дефекты нервной трубки и внутриутробная задержка роста [12–15]. Анализ клинических данных выявил высокую потребность в фолиевой кислоте во время беременности для оптимального роста и развития материнских и фетальных тканей, защиты от дефектов нервной трубки плода, нормального роста и развития потомства [9, 11, 16], что подтверждается и экспериментальными исследованиями на животных [9, 17–21].
Ряд модельных исследований на грызунах с пренатальной гГЦ свидетельствует о физических и неврологических нарушениях развития потомства на ранних и поздних этапах онтогенеза [3, 13, 22–25], одним из путей предотвращения которых является прием витаминов группы В. Действительно, популяционные исследования свидетельствуют, что прием фолиевой кислоты, витаминов В12 и В6 в различных комбинациях способствует снижению уровня гомоцистеина в некоторых случаях, однако, насколько они эффективны в снижении патологий, обусловленных гГЦ, остается не до конца выясненным [8, 12]. Применение фолиевой кислоты при моделировании гГЦ у крыс в ранний постнатальный период приводило к восстановлению активности Na+/K+-АТФазы, снижению уровня окислительного стресса и нейронального повреждения [26–28]. Однако, избыточное потребление фолиевой кислоты, особенно при дефиците витамина В12, может привести к потенциальным рискам для здоровья [8, 16, 29], таким как нарушение когнитивных функций, развитие инсулиновой резистентности и ожирение у детей [16, 30].
Целью нашей работы было исследование влияния диеты с повышенным содержанием витаминов группы В (В6, В9, В12) у беременных и кормящих самок с гГЦ на сенсо-моторное развитие их потомства и уровень глутатиона в плазме крови.
МЕТОДЫ ИССЛЕДОВАНИЯ
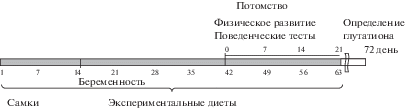
Объектом исследования были крысы линий Вистар из питомника лабораторных животных “Пущино” в возрасте от 2 до 72 дней. Животные содержались в условиях вивария КФУ в полипропиленовых клетках (32 × 40 × 18 см) при стабильной комнатной температуре, 12-часовом режиме дня/ночи и свободном доступе к корму и воде. Эксперименты проводились в соответствии с Директивой ЕС 2010/63/EU для экспериментов на животных и одобрены Локальным этическим комитетом КФУ (протокол № 8 от 5.05.2015). Крысы были разделены на 4 группы: 1) контрольная (К) – крысята (n = 53, N = 7, где n – количество крысят в эксперименте, N – количество пометов), рожденные самками, находящимися на стандартном рационе питания; 2) гомоцистеиновая (ГЦ) – крысята (n = 53, N = 9) от самок на метиониновой диете (7.7 мг/кг в сутки) для моделирования гГЦ; 3) витаминная (В) – крысята (n = 34, N = 5) от самок на витаминной диете, получавших перед планированием, во время беременности и в период лактации витамин В6 (10 мкг/кг), витамин В9 (0.25 мкг/кг) и витамин В12 (0.25 мкг/кг); 4) опытная витаминная (ГЦ + В) – крысята (n = 36, N = 5) от самок на метиониновой диете, получавших витамины (рис. 2). В опытах использовались самки от 9 до 12 месяцев повторно рожавшие. Витамины В6, В12, В9 (CSPC Ouyi Pharmaceutical Co. Ltd, КНР) вводили в рацион поочередно самкам крыс по четным (В6) и нечетным дням (В12 и В9) за две недели перед планированием, во время беременности и в период лактации. Подбор концентрации и схемы подачи витаминов осуществлялись на основе данных по обязательному содержанию витаминов в корме лабораторных животных [31] и эквивалентной дозе потребления у человека в пересчете на массу тела животного [16].
Определение содержания гомоцистеина производили электрохимическим методом в условиях квадратно-волновой вольтамперометрии [32] в плазме крови самок перед подсадкой самца и через неделю после окончания лактационного периода, а также в плазме крови потомства – на 72-й день жизни [22]. Концентрацию восстановленного глутатиона в плазме крови крыс с пренатальной гГЦ определяли классическим спектрофотометрическим методом (ПЭ9600, Экрос, Россия) в реакции с реактивом Элмана (5,5'-дитио-бис-(2-нитробензойная к-та) [33].
У животных всех групп определяли массу тела при рождении и количество животных в помете, регистрировали день отлипания ушной раковины, появления первичного волосяного покрова, прорезывания резцов и открытия глаз. Смертность определяли как процент умерших крысят относительно рожденных за весь период наблюдений.
Для исследования созревания соматосенсорной системы использовали стандартную батарею тестов для оценки развивающегося поведенческого фенотипа крыс в период вскармливания [22, 34–36] (табл. 1). Тесты проводили за 2 дня до возраста формирования рефлекса в контроле согласно методическим указаниям [34] и литературным данным [35, 36], и регистрировали возраст крысят, в котором впервые появлялся наблюдаемый рефлекс (табл. 1). Тесты проводили до полного формирования рефлекса во всех пометах. Использовали следующие тесты.
Таблица 1.
Эффекты пренатальной гипергомоцистеинемии и витаминной терапии на формирование рефлексов у потомства
| Тест, регистрируемый параметр |
группа К (n = 53, N = 7) |
группа ГЦ (n = 53, N = 9) |
группа В (n = 34, N = 5) |
группа ГЦ + В (n = 36, N = 5) |
|---|---|---|---|---|
| Отрицательный геотаксис, день формирования рефлекса | 6(5–7) | 6(6–8)* | 5(4–8) | 6(4–6)# |
| Избегание обрыва, день формирования рефлекса | 6(5–7) | 7(6–8)* | 6(6–7.25) | 6(4–6)# |
| Маятниковый рефлекс проводится на 8-й день, количество поворотов головы | 7(5–11) | 2(1–4)* | 6(2–7) | 4(3–6)*# |
| Избегание обрыва, вызванное визуальным стимулом, день формирования рефлекса | 14(12–15) | 16(16–17)* | 14(14–15) | 14(14–16)# |
| Переворот в падении, день формирования рефлекса | 12(12–16) | 19(16–19)* | 12(12–14) | 12(12–14)# |
| Реакция на акустический стимул, день формирования рефлекса | 10(8–10) | 10(9–11)* | 8(8–10) | 10(10–12)* |
| Обоняние, день формирования рефлекса | 14(12–15) | 16(14–19)* | 13(12–14) | 14(14–16)# |
Тест “Переворачивание на плоскости”. Крысенка помещали на спину на плоской поверхности, быстро отпускали и измеряли время, необходимое для возвращения в нормальное положение. Формирование рефлекса считали завершенным, если животное возвращалось на все 4 лапы.
Тест “Отрицательный геотаксис”. Опыт проводили 1 раз в день в течение 1 мин. Крысенка помещали на наклонную плоскость (25°) головой вниз. Рефлекс считался сформированным, если животное поворачивалось на 180°.
Тест “Избегание обрыва”. Крысенка помещали на возвышающуюся над клеткой платформу таким образом, чтобы передние лапы касались края стола. Формирование рефлекса считалось завершенным, если в течение 10 с животное отползало от края площадки.
Тест “Реакция на акустический стимул”. Рефлекс считали сформированным, если животное реагировало вздрагиванием на акустический стимул. Движение животного регистрировали визуально. Тест проводился, начиная с 7-го дня жизни.
Тест “Обонятельная реакция” проводился после открытия глаз. Животное помещали на середину рейки шириной 6 см с делениями. Рейку располагали между двумя клетками. Определяли, выбирает ли животное направление к клетке с сибсами и матерью, в которой оно содержалось перед опытом.
Тест “Визуальное избегание обрыва” проводился после открытия глаз. Животное располагали у края приподнятой площадки. Формирование рефлекса считалось завершенным, если в течение 10 с крысенок отползал от края площадки.
Тест “Переворот в свободном падении”. Животное, держали спиной вниз на высоте 60 см над мягкой поверхностью и быстро отпускали. Визуально фиксировался переворот животного в воздухе и приземление на все 4 лапы. Тест проводился, начиная с 14-го дня жизни крысы.
Тест “Маятник” выполнялся совместно с тестом “Отрытое Поле” на 8-й день после рождения. Измеряли количество поворотов за 1 мин. Повороты определяли как изменение направления головы и туловища в горизонтальной плоскости приблизительно на 90° за счет перемещения передних лап, когда задние конечности поджаты и неподвижны.
Тест “Открытое поле” позволяет оценить динамику и выраженность элементарных поведенческих актов у грызунов в стрессовых условиях [37, 38]. Тест проводили на 8-й и 16-й дни жизни животных. Крыс помещали в центр круглой арены диаметром 30 см (на 8-й день жизни) и 60 см диаметром (на 16-й день жизни), которая была разлинована на квадраты размером 5 × 5 и 10 × 10 см соответственно (Open Science, Россия). Оценивали вертикальную и горизонтальную двигательную активность и груминг. Каждый тест записывался с помощью цветной видеокамеры Sony SSC-G118 (Китай), захватывающей приставки и программы Pinnacle на персональном компьютере, и обсчитывался после проведения эксперимента независимым исследователем. Тест проводили в течение 1 и 3 мин в зависимости от возраста. После каждой пробы манеж очищали от продуктов дефекации/уринации и тщательно протирали этиловым спиртом.
Развитие мышечной силы анализировали в тесте “Удержание на горизонтальной сетке” на 16-й и 21-й дни жизни животного. Крыса помещалась на проволочной сетке и мягко встряхивалась, чтобы дать ей возможность зацепиться за проволоку [39]. Сетка переворачивалась на 180° и удерживалась на высоте 45 см над дном клетки. Записывалось время в секундах, проведенное на сетке. Для анализа использовалось наибольшее значение из трех попыток в течение одного подхода.
В тесте “Ротарод” (Neurobotix, Россия) оценивали общую моторную функцию конечностей, а также двигательно-координационные нарушения [37, 40]. Регистрировали время удержания на вращающемся цилиндре животного при скорости 5 об/мин. Проводили три сессии с интервалом 20–30 мин. Лучший результат записывался. Тест проводили на 16-й и 21-й день жизни крысят.
Статистическую обработку проводили при помощи методов непараметрической и параметрической статистики для сравнения количественных признаков с использованием пакета прикладных программ Origin Pro software (OriginLab Corp, США). Для проверки выборки на нормальное распределение применяли тест Колмогорова–Смирнова и F-тест для равных дисперсий. При непараметрическом распределении групповые данные сравнивались при помощи теста Краскела–Уоллиса (Kruskal–Wallis test) с последующим анализом U-критерия Манна–Уитни. При нормальном распределении групповые данные сравнивались с использованием однофакторного дисперсионного анализа с последующим апостериорным анализом Бонферрони для оценки значения p. Различия считались статистически значимыми при p < 0.05; n – количество животных. Все результаты представлены в виде M ± m, где М – среднее значение, m – ошибка среднего либо М(Q1–Q2), где М – медиана, Q – квартиль.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Подбор концентраций витаминов, концентрация гомоцистеина и глутатиона. Для витаминной диеты животных мы использовали коктейль витаминов группы В: В6 – пиридоксин, В9 – фолиевая кислота и В12 - цианокобаламин. При использовании витаминов в дозах, превышающих рекомендуемые для потребления грызунами – В6 – 40 мкг/кг, В12 – 0.3 мкг/кг и В9 – 0.3 мкг/кг [31], наблюдали высокую смертность новорожденных (до 100% к 8-му дню жизни), что, по-видимому, обусловлено тератогенными эффектами фолиевой кислоты и пиридоксина [18, 29, 41–43]. Поэтому нами был проведен подбор оптимальных доз витаминов – витамин В6 – 10 мкг/кг, В12 – 0.25 мкг/кг, В9 – 0.25 мкг/кг и схемы введения (витамин В6 – по четным и витамины В9, В12 – нечетным дням), который позволил получить полноценное потомство и низкую смертность животных в группе В. Для подтверждения формирования гГЦ у самок и их потомства измеряли концентрацию гомоцистеина в плазме. Концентрация гомоцистеина в плазме самок, находящихся на стандартной диете, составляла 8.2 ± 0.3 мкМ (n = 16) и самок, находящихся на метиониновой диете – 31.7 ± 2.2 мкМ (n = 16). В плазме потомства крыс группы ГЦ наблюдалось повышенное содержание гомоцистеина до 22.1 ± 2.6 мкМ относительно контроля (6.2 ± 0.4 мкМ, n = 16). Таким образом, нами было подтверждено развитие гГЦ у самок, находящихся на метиониновой диете, а также и у их потомства. Добавление витаминов группы В в рацион самок контрольной группы не изменяло уровня гомоцистеина ни в плазме самок (9.3 ± 0.6 мкМ, n = 15), ни в плазме их потомства (8.2 ± 2.1 мкМ, n = 16). Использование витаминов достоверно снижало содержание гомоцистеина как в плазме самок, находящихся на метиониновой диете (18.1 ± 1.1 мкМ, n = 12, p < 0.05), так и в плазме их потомства (17.4 ± 0.8 мкМ, n = 15, p < 0.05), однако этот параметр не достигал контрольных значений. Как видно из рис. 1, витамины В6, В9 и В12 являются кофакторами ферментов метаболизма гомоцистеина [1, 14, 18], популяционные данные свидетельствуют о снижении уровня гомоцистеина при приеме не только фолиевой кислоты [44, 45], но и при применении витаминов B6, B12, бетаина [46, 47]. Однако в экспериментальных исследованиях на животных данные о влиянии фолиевой кислоты на концентрацию гомоцистеина неоднозначны, что предполагает наличие механизмов действия фолиевой кислоты и других витаминов группы В, не связанных с понижением уровня гомоцистеина [26, 27, 48, 49].
Окисление гомоцистеина в клетках приводит к образованию супероксидного аниона и перекиси водорода, которые играют роль в индукции аномалий плода [10, 12, 15, 23, 24, 50]. В нашем исследовании в плазме крысят с пренатальной гГЦ (n = 16) мы наблюдали снижение концентрации восстановленного глутатиона относительно контрольной группы (рис. 3А, n = 16, p < 0.05), тогда как использование витаминов группы В приводило к повышению уровня глутатиона до уровня контроля (рис. 3А, n = 15, p < 0.05). Известно, что фолиевая кислота и витамин В12 обладают антиоксидантными свойствами, нейтрализуя активные формы кислорода в условиях окислительного стресса, таких как гестационный диабет и преэклампсия [50–53], а витамин B6 необходим для синтеза цистатионина и глутатиона [1, 14, 28]. Поэтому дополнительное введение в рацион витаминов группы В увеличивает антиоксидантный потенциал организма, что проявляется в повышении уровня восстановленного глутатиона и таким образом снижает повреждающее действие радикалов.
Рис. 3.
Влияние пренатальной гипергомоцистеинемии и терапии витаминами группы В на физическое развитие крысят и уровень глутатиона в плазме. A. Уровень восстановленного глутатиона в плазме крыс в группах контроль (белый столбик), ГЦ (штрихованный столбик), В (серый столбик) и ГЦ + В (серый штрихованный столбик). Результаты представлены в виде среднего значения и ошибки среднего. Б. Смертность крысят в группах контроль, ГЦ, В и ГЦ + В. Темно-серая часть круга – выжившие крысята, светло-серая – умершие в %. В. Масса тела животных на 2-е, 30-е и 72-е сутки после рождения в группах контроль (белые столбики), ГЦ (штрихованные столбики), В (серые столбики) и ГЦ + В (серые штрихованные столбики). Результаты представлены в виде среднего значения и ошибки среднего. Г. Диаграмма размаха (внутри диаграммы медиана – линия, среднее – точка) отражает размер (белые диаграммы) и массу (серые диаграммы) помета в группах контроль, ГЦ, В и ГЦ + В. * p < 0.05 относительно контроля, # p < 0.05 относительно группы ГЦ.
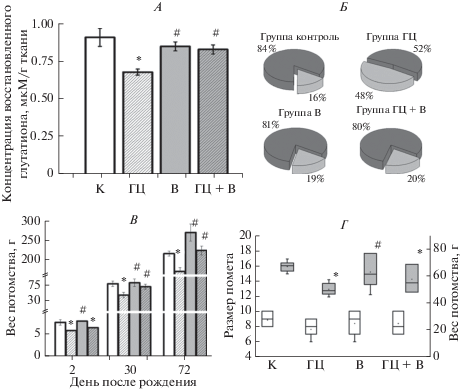
Выживаемость, физическое развитие и масса тела крысят. В группе ГЦ наблюдали высокую смертность потомства (48%) по сравнению с контрольной группой (16%) (рис. 3Б). Введение витаминов группы В приводило к снижению смертности крысят с пренатальной гГЦ до 20%, что не отличалось от контрольных значений. В группе В смертность не отличалась от контроля (рис. 3Б). Наиболее важным показателем соматического развития животных является масса тела при рождении. В группе ГЦ наблюдалось достоверное снижение массы тела при рождении до 6.04 ± 0.15 г (n = 53, р < 0.05) относительно контрольной группы (7.97 ± 0.62 г, n = 53, рис. 3В, Г) [22, 23]. Известно, что повышение уровня гомоцистеина на поздних сроках беременности является причиной развития хронической фетоплацентарной недостаточности и внутриутробной гипоксии плода. Это приводит к рождению детей с низкой массой тела, снижению функциональных резервов всех жизнеобеспечивающих систем новорожденного и развитию целого ряда осложнений периода новорожденности [13, 21, 22, 25].
Масса тела при рождении в группе В соответствовала контрольным значениям – 7.60 ± 0.49 г, (n = 34, р > 0.05), а в группе ГЦ + В была достоверно ниже, чем у контрольных животных 6.80 ± 0.29 г (n = 36, p < 0.05, рис. 3В), однако, к 4-й неделе жизни масса тела крысят ГЦ + В группы восстанавливается до контрольных значений (рис. 3В). Количество крысят в помете от самок, находящихся на контрольной и модифицированных диетах, достоверно не изменялось (p > 0.05, рис. 3Г). Оценка физического развития крысят (отлипание ушной раковины, появление первичного волосяного покрова, прорезывание резцов, открытие глаз) в группах ГЦ, В и ГЦ + В не выявила значимых отставаний в развитии при сравнении с показателями контрольных животных (p > 0.05, данные не представлены).
Развитие сенсо-моторных рефлексов. Рефлексы новорожденных необходимы для выживания после родов и адаптации к новым условиям среды, а их оценка помогает определить уровень развития и способность к выживанию. Слабовыраженные или поздно сформированные рефлексы свидетельствуют о различных патологиях ЦНС [34]. Литературные и собственные данные свидетельствуют, что у животных с пренатальной гГЦ происходит задержка в формировании целого ряда сенсорно-моторных рефлексов [3, 14, 22, 23, 26] (табл. 1).
В случае дефицита витаминов группы В нарушение рефлексов у крысят с гГЦ может быть связано с сенсорной нейропатией, гипотонией, атаксией и дистонией пирамидного тракта [3, 53]. Недостаток витамина В12 ведет к демиелинизации нервных волокон как в периферической, так и центральной нервной системе, что обусловлено его влиянием на метиониновый цикл, а также на синтез жирных кислот [14, 54, 55]. Введение в рацион крысам с гГЦ витаминов группы В привело к восстановлению большей части анализируемых параметров до уровня контроля (табл. 1). Однако в таких тестах как “Маятник” и “Обоняние” – количество поворотов головы и день формирования рефлекса достоверно отличались как от результатов группы ГЦ и контрольной группы (табл. 1). В тесте “Реакция на акустический стимул” день формирования рефлекса у крысят ГЦ + В не отличался от ГЦ группы (р > 0.05). Во всех анализируемых сенсо-моторных тестах крысята группы В показали результаты, сопоставимые с контролем (табл. 1).
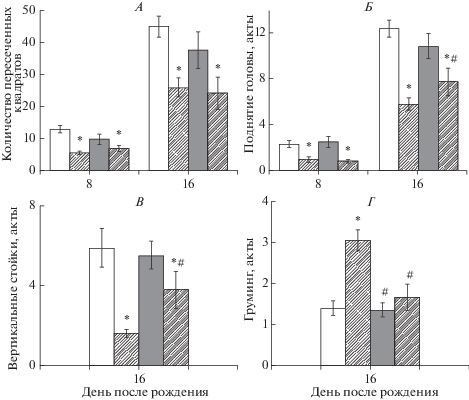
Анализ поведенческих реакций в тесте “Открытое поле”. В нашей работе мы наблюдали снижение горизонтальной двигательной активности у животных с пренатальной гГЦ на 8-й и 16-й дни жизни крысят (5.4 ± 0.6 и 25.9 ± 2.9 пересеченных квадратов, соответственно, n = 53, p < 0.05, рис. 4А) относительно контрольных значений (12.9 ± 1.1 и 45.4 ± 3.2 квадратов соответственно, n = 53). Введение витаминов группы В не приводило к восстановлению горизонтальной двигательной активности животных с пренатальной гГЦ, более того, на 16-й день жизни группа В также показала снижение числа пересеченных квадратов (рис. 4А). Анализ количества поднятий головы в группе ГЦ на 8-й день жизни крысят показал достоверное снижение (0.9 ± 0.2, n = 53, p < 0.05, рис. 4Б) по сравнению с контрольными значениями (2.3 ± 0.3, n = 53). В группе В количество поднятий головы не отличалось от контроля. При этом использование витаминной диеты не привело к восстановлению данного параметра до контрольных значений (0.7 ± 0.1 в группе ГЦ + В, n = 36, p < 0.05). На 16-й день жизни анализировали как количество поднятий головы (12.4 ± 0.7 в контроле), так и число вертикальных стоек (5.8 ± 0.9 в контроле). У крыс группы ГЦ эти показатели были достоверно ниже контрольных значений (5.8 ± 0.5 и 1.5 ± 0.2 соответственно, n = 53, p < 0.05, рис. 4Б, В). В группе животных с терапией витаминами группы В наблюдалось повышение обоих значений, однако они не достигли уровня контроля (рис. 4Б, В). В группе В число поднятий головы и вертикальных стоек не отличалось от контроля (рис. 4Б, В).
Рис. 4.
Влияние пренатальной гипергомоцистеинемии и терапии витаминами группы В на двигательную активность и уровень тревожности в тесте “Открытое поле”. Количество пересеченных квадратов (А) и число поднятий головы (Б) на 8-й и 16-й дни жизни животного. Вертикальные стойки (В) и число актов груминга (Г) на 16-й день жизни животного. Белый столбик – контрольная группа, штрихованный столбик – группа ГЦ, серый столбик – группа В, серый штрихованный столбик – группа ГЦ + В. * p < 0.05 относительно контрольной группы, # p < 0.05 относительно группы ГЦ. Результаты представлены в виде среднего значения и ошибки среднего.
Известно, что у крысят, родившихся от самок с дефицитом витаминов группы В и повышенным содержанием гомоцистеина, наблюдается апоптоз нейронов и астроцитов в гиппокампе, стриатуме и мозжечке, что может приводить к нарушению двигательной активности [3, 27]. Подобный эффект наблюдался и у потомства мышей, находящихся на диете с дефицитом фолатов в период беременности [56].
Снижение вертикальной активности и высокий уровень груминга в условиях гГЦ отражает более высокий уровень тревожности у животных (рис. 4В, Г ), что может быть обусловлено снижением содержания дофамина, серотонина и норадреналина и повышением активности моноаминоксидаз в тканях головного мозга крыс с гГЦ [57]. Подобный эффект также наблюдался у потомства мышей при использовании диеты с дефицитом витаминов группы В [58], что может быть связано с угнетением реакции метилирования вследствие истощения S-аденозилметионина [53] и концентрации дофамина [59]. Введение витаминов группы В в наших условиях приводило к снижению актов груминга у животных с пренатальной гГЦ до контрольных значений (рис. 4Г). В исследованиях на человеке также показано снижение тревожности у женщин при использовании витамина В6 [60].
Исследование мышечной силы и двигательной координации. В контрольной группе в тесте “Удержание на горизонтальной сетке” с возрастом увеличивается время пребывания крысенка на сетке: к 16-му дню жизни составляет 20.9 ± 5.1 с и к 21-му дню – 51.3 ± 3.9 с (рис. 5А). В группе B время пребывания крысят на горизонтальной сетке соответствовало контрольным значениям (n = 34, p > 0.05).
Рис. 5.
Анализ мышечной силы и координации движений крысят с пренатальной гипергомоцистеинемией и терапией витаминами группы В. А. Время виса в секундах в тесте “Удержание на горизонтальной сетке” на 16-й и 21-й дни жизни животного. Б. Время пребывания на вращающемся цилиндре в тесте “Ротарод” в секундах на 16-й и 21-й дни жизни. Белый столбик – контрольная группа, штрихованный столбик – группа ГЦ, серый столбик – группа В, серый штрихованный столбик – группа ГЦ + В. *,#p < 0.05. * – относительно контрольной группы, # – относительно группы ГЦ. Результаты представлены в виде среднего значения и ошибки среднего.
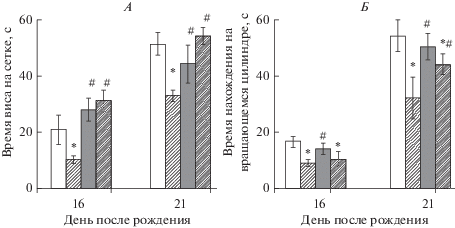
У крыс группы ГЦ наблюдалось снижение времени удержания на сетке относительно контроля, которое на 16-й день жизни составило 10.4 ± 1.2 с, а на 21-й день – 32.9 ± 1.9 с (n = 53, p < 0.05, рис. 5А). Введение витаминов группы В самкам с гГЦ полностью предотвращало патологические изменения у их потомства, и время пребывания на сетке достоверно увеличивалось по отношению к показателям ГЦ группы до 31.0 ± 3.8 с и 54.0 ± 13.1 с (n = 36, p < 0.05) на 16-й и 21-й день жизни соответственно (рис. 5А).
Координацию движений оценивали в тесте “Ротарод” по времени пребывания на вращающемся цилиндре. У крыс группы ГЦ время пребывания на вращающемся цилиндре составило 8.9 ± 1.4 с и 32.2 ± 7.6 с на 16-й и 21-й день жизни соответственно (n = 53, p < 0.05), что значительно меньше, чем у контрольной группы – 16.1 ± 1.9 c и 54.2 ± 8.0 с, n = 53 (рис. 5Б). В группе B время пребывания крысят на вращающемся цилиндре соответствовало контрольным значениям (n = 34, p > 0.05, рис. 5Б). В группе ГЦ + В время пребывания на вращающемся цилиндре составило 10.5 ± 2.6 с и 44.1 ± 3.6 с к 16-му и 21-му дню жизни соответственно эти значения не достигли уровня контроля (n = 36, p < 0.05, рис. 5Б). Двигательные нарушения у животных с гГЦ, связанные с накоплением гомоцистеина в тканях мозга и апоптозом нейронов, особенно в мозжечке, наблюдались и в предыдущих исследованиях [3, 23, 27]. По данным литературы неонатальная терапия крыс с гГЦ фолиевой кислотой улучшала двигательную активность в тесте “Ротарод” [27], однако скорость плавания в тесте Морриса не восстанавливалась [54].
ЗАКЛЮЧЕНИЕ
Таким образом, нами было проведен анализ использования комплекса витаминов группы В для предотвращении нарушений раннего развития потомства, вызванного пренатальной гГЦ. В большинстве предыдущих исследований гГЦ у беременных вызывали снижением содержания фолиевой кислоты или витаминов В6 и В12 [3, 58], тогда как в нашей модели диета крыс самок содержала только повышенный уровень метионина. Данные о роли витаминов в нормализации метаболизма гомоцистеина неоднозначны [8, 12, 26, 27, 49]. При этом назначение высоких доз фолатов беременным остается основным методом лечения гГЦ и связанных с ним тромбозов [16], несмотря на имеющиеся данные о негативном влиянии сверхвысоких концентраций фолиевой кислоты, особенно при монотерапии [8, 16]. Эпидемиологические исследования указывают на то, что положительные эффекты фолиевой кислоты проявляются только при нормальных уровнях витамина В12, тогда как высокие дозы фолата при дефиците витамина В12 приводят к когнитивным нарушениям [61]. Поэтому применение именно комплекса витаминов группы В может способствовать эффективному снижению концентраций гомоцистеина и профилактике нарушения развития потомства. Кроме того, витамины группы В обладают собственными эффектами, нейтрализующими негативное влияние гомоцистеина. Так, фолиевая кислота обладает антиоксидантными свойствами [14, 28, 52], а также является важным фактором поддержания стабильности ДНК [55]. Витамин B6 играет центральную роль в метаболизме аминокислот, являясь лимитирующим кофактором синтеза дофамина, серотонина, норадреналина, ГАМК [14, 51]. Дефицит витамина В12 приводит к окислительному стрессу и развитию нейропсихиатрических симптомов [14, 46, 50]. Однако надо отметить, что в нашем исследовании несмотря на эффективный антиоксидантный эффект, не все нарушения развития у потомства с пренатальной гГЦ предотвращались использованием витаминов группы В, а также уровень гомоцистеина не снижался до нормальных значений, что было отмечено и другими исследователями [26, 48, 49, 54]. По-видимому, важную роль при использовании витаминов играет их биодоступность и правильный подбор концентраций. Поэтому в последнее время активно ведется поиск соединений, в том числе обладающих антиоксидантными свойствами, которые бы предотвращали негативные последствия хронического влияния гомоцистеина, такие как окислительный стресс, эндотелиальные дисфункции, гиперактивация НМДА-рецепторов и гипометилирование ДНК [2, 5, 20, 23, 57].
Список литературы
Jeremic J., Turnic T.N., Zivkovic V., Jeremic N., Milosavljevic I., Srejovic I., Obrenovic R., Jancic S.A., Rakocevic M., Matic S., Djuric D., Jakovljevic V. Vitamin B complex mitigates cardiac dysfunction in high-methionine diet-induced hyperhomocysteinemia. Clin. Exp. Pharmacol. Physiol. 45(7): 683–693. 2018.
Petras M., Tatarkova Z., Kovalska M., Mokra D., Dobrota D., Lehotsky J., Drgova A. Hyperhomocysteinemia as a risk factor for the neuronal system disorders. J. Physiol. Pharmacol. 65(1): 15–23. 2014.
Blaise S.A., Nédélec E., Schroeder H. Gestational Vitamin B Deficiency Leads to Homocysteine-Associated Brain Apoptosis and Alters Neurobehavioral Development in Rats. Am. J. Pathol. 170(2): 667–679. 2007.
Мирошниченко И.И., Птицына С.Н., Кузнецова Н.Н., Калмыков Ю.М. Гомоцистеин – предиктор патологических изменений в организме человека. РМЖ. 4: 224. 2009. [Miroshnichenko I.I., Ptitsyna S.N., Kuznetsova N.N., Kalmykov YU.M. Homocysteine is a predictor of pathological changes in the human body. Russkiy meditsinskiy zhurnal. 4: 224. 2009. (In Russ.)].
Djuric D., Jakovljevic V., Zivkovic V., Srejovic I. Homocysteine and homocysteine-related compounds: An overview of the roles in the pathology of the cardiovascular and nervous systems. Can. J. Physiol. Pharmacol. 96(10): 991–1003. 2018.
Likogianni V., Janel N., Ledru A., Beaune Ph., Paul J.L., Demuth K. Thiol compounds metabolism in mice, rats and humans: Comparative study and potential explanation of rodents protection against vascular diseases. Clinica Chimica Acta 372: 140–146. 2006.
Martins P.J.F., Galdieri L.C., Souza F.G., Andersen M.L., Benedito-Silva A.A., Tufik S., D’Almeida V. Physiological variation in plasma total homocysteine concentrations in rats. Life Sciences 76: 2621–2629. 2005
Caffrey A., McNulty H., Irwin R.E., Walsh C.P., Pentieva K. Maternal folate nutrition and offspring health: evidence and current controversies. Proc. Nutr. Soc. 26: 1–13. 2018.
Naninck E.F.G., Stijger P.C., Brouwer-Brolsma E.M. The importance of maternal folate status for brain development and function of offspring. Adv. Nutr. 10(3): 502–519. 2019.
Sharma M., Tiwari M., Tiwari R.K. Hyperhomocysteinemia: Impact on neurodegenerative diseases. Basic Clin. Pharmacol. Toxicol. 117: 287–296. 2015.
Кобчикова А.В., Арутюнян А.В., Зайнулина М.С. Исследование уровня гомоцистеина и показателей наследственной тромбофилии у беременных с гестозом. Журнал акушерства и женских болезней. 61(2): 21–26. 2012. [Kobchikova A.V., Arutyunyan A.V., Zaynulina M.S. A study of homocysteine levels and indicators of hereditary thrombophilia in pregnant women with gestosis. J. Obstetrics and Women’s Dis. 61 (2): 21–26. 2012. (In Russ.)].
Aubarda Y., Darodes N., Cantaloube M. Hyperhomocysteinemia and pregnancy — review of our present understanding and therapeutic implications. Eur. J. Obstetrics Gynecol. Reproduct. Biol. 93: 157–165. 2000.
Арутюнян А.В., Козина Л.С., Арутюнов В.А. Токсическое влияние пренатальной гипергомоцистеинемии на потомство. Журнал акушерства и женский болезней. 4: 16–20. 2010. [Arutyunyan A.V., Kozina L.S., Arutyunov V.A. Toxic effect of prenatal hyperhomocysteinemia on the offspring. J. Obstetrics and Women’s Dis. 4: 16–20. 2010. (In Russ.)].
Kennedy D.O. B Vitamins and the Brain: Mechanisms, Dose and Efficacy. Nutrients. 8 (2): 68. 2016.
Baydas G., Koz S.T., Tuzcu M., Nedzvetsky V.S., Etem E. Effects of maternal hyperhomocysteinemia induced by high methionine diet on the learning and memory performance in offspring. Int. J. Dev. Neurosci. 25: 133–139. 2007.
Керкешко Г.О., Арутюнян А.В., Аржанова О.H., Милютина Ю.П. Оптимизация терапии фолатами при осложнениях беременности. Журнал акушерства и женских болезней. 6: 25–36. 2013. [Kerkeshko G.O., Arutyunyan A.V., Arzhanova O.H., Milyutina Yu.P. Optimization of folate therapy in pregnancy complications. J. Obstetrics and Women’s Dis. 6: 25–36. 2013. In Russ.)].
Geoffroy A., Saber-Cherif L., Pourié G., Helle D., Umoret R., Guéant J.L. Bossenmeyer-Pourié C., Daval J.L. Developmental Impairments in a Rat Model of Methyl Donor Deficiency: Effects of a Late Maternal Supplementation with Folic Acid. Int. J. Mol. Sci. 20(4): 1–14. 2019.
Roy S., Kale A., Dangat K., Sable P., Kulkarni A., Joshi S. Maternal micronutrients (folic acid and vitamin B(12)) and omega 3 fatty acids: Implications for neurodevelopmental risk in the rat offspring. Brain Dev. 34(1): 64–71. 2012.
Jadavji N.M., Emmerson J.T., MacFarlane A.J., Willmore W.G., Smith P.D. B-vitamin and choline supplementation increases neuroplasticity and recovery after stroke. Neurobiol. Dis. 103: 89–100. 2017.
Škovierová H., Vidomanová E., Mahmood S., Sopková J., Drgová A., Červeňová T., Halašová E., Lehotský J. The molecular and cellular effect of homocysteine metabolism imbalance on human health. Int. J. Mol. Sci. 17(10): E1733. 2016.
Lalonde R., Barraudc H., Raveyc J., Guéantc J.-L., Bronowickic J.-P., Straziellec C. Effects of a B-vitamin-deficient diet on exploratory activity, motor coordination, and spatial learning in young adult Balb/c mice. Brain Res. 11(88): 122–131. 2008.
Gerasimova E., Yakovleva O., Burkhanova G., Ziyatdinova G., Khaertdinov N., Sitdikova G. Effects of maternal hyperhomocysteinemia on the early physical development and neurobehavioral maturation of rat offspring. BioNanoScience. 7: 155–158. 2017.
Yakovleva O.V., Dmitrieva S., Ziganshina A.R., Arslanova A.N., Yakovlev A.V., Minibayeva F.V., Khaertdinov N.N., Ziyatdinova G.K., Giniatullin R.A., Sitdikova G.F. Hydrogen sulfide ameliorates developmental impairments of rat’s offspring with prenatal hyperhomocysteinemia. Oxid. Med. Cell. Longev. 2018: Art 2746873. 2018.
Khuzakhmetova V., Yakovleva O., Dmitrieva S., Khaertdinov N., Ziyatdinova G., Giniatullin R., Bukharaeva E., Yakovlev A., Sitdikova G. Prenatal hyperhomocysteinemia induces oxidative stress and accelerates ‘aging’ of mammalian neuromuscular synapses. Int. J. of Dev. Neurosci. 75: 1–12. 2019.
Yakovlev A.V., Kurmashova E., Zakharov A., Sitdikova G.F. Network-Driven Activity and Neuronal Excitability in Hippocampus of Neonatal Rats with Prenatal Hyperhomocysteinemia. B-ioNanoScience. 8(1): 304–309. 2018.
Matté C., Scherer E.B., Stefanello F.M., Barschak A.G., Vargas C.R., Netto C.A., Wyse A.T. Concurrent folate treatment prevents Na+,K+-ATPase activity inhibition and memory impairments caused by chronic hyperhomocysteinemia during rat development. Int. J. Dev. Neurosci. 25(8): 545–552. 2007.
Koohpeyma H., Goudarzi I., Elahdadi Salmani M., Lashkarbolouki T., Shabani M. Postnatal Administration of Homocysteine Induces Cerebellar Damage in Rats: Protective Effect of Folic Acid. Neurotox. Res. 35(3): 724–738. 2019.
Racek J., Rusnáková H., Trefil L., Siala K.K. The influence of folate and antioxidants on homocysteine levels and oxidative stress in patients with hyperlipidemia and hyperhomocysteinemia. Physiol. Res. 54(1): 87–95. 2005.
Selhub J., Rosenberg I.H. Excessive folic acid intake and relation to adverse health outcome. Biochimie. 126: 71–78. 2016.
Yajnik C.S., Deshpande S.S., Jackson A.A., Refsum H., Rao S., Fisher D.J., Bhat D.S., Naik S.S., Coyaji K.J., Joglekar C.V. Vitamin B12 and folate concentrations during pregnancy and insulin resistance in the offspring. Diabetologia. 51: 29–38. 2008.
Западнюк И.П. Западнюк В.И. Захария Е.А., Западнюк Б.В. Лабораторные животные Разведение, содержание, использование в эксперименте. Киев. Высшая школа. 1983. [Zapadnyuk I.P., Zapadnyuk V.I., Zakhariya Ye.A., Zapadnyuk B.V. Laboratornyye zhivotnyye Razvedeniye, soderzhaniye, ispol’zovaniye v eksperimente (Laboratory animals Breeding, keeping, use in experiment). Kiyev. Vysshaya shkola. 1983. In Russ.)].
Lee P.T., Lowinsohn D., Compton R.G. Simultaneous detection of homocysteine and cysteine in the presence of ascorbic acid and glutathione using a nanocarbon modified electrode. Electroanalysis. 26: 1488–1496. 2014.
Davies M.H., Birt D.F., Schnell R.C. Direct enzymatic assay for reduced and oxidized glutathione. J. Pharmacol. Methods. 12(3): 191–194. 1984.
Миронов А.Н., Бунатян Н.Д. Руководство по проведению доклинических исследований лекарственных средств. М. Гриф. и Ко. 2012. [Mironov A.N., Bunatyan N.D. Rukovodstvo po provedeniyu doklinicheskikh issledovaniy lekarstvennykh sredstv (Guidelines for preclinical studies of drugs). M. Grif. i Ko. 2012. In Russ.)].
Smart J.L., Dobbing J. Vulnerability of developing brain. VI Relative effects of fetal and early postnatal undernutrition on reflex ontogeny and development of behavior in the rat. Brain Res. 33: 303–314. 1971
Alton-Mackey M.G., Walker B.L. The physical and neuromotor development of progeny of female rats fed graded levels of pyridoxine during lactation. Am. J. Clinical. Nutrition. 31 (1): 76–81. 1978.
Lalonde R., Bensoula A.N., Filali M. Rotorod sensorimotor learning in cerebellar mutant mice. Neurosci. Res. 22(4): 423–426. 1995.
Markina N.V., Salimov R.M., Poletaeva I.I. Behavioral screening of two mouse lines selected for different brain weight. Prog. Neuropsychopharmacol. Bio. Psychiatry. 25: 2083–1109. 2001.
Weydt P., Hong S.Y., Kliot M. Assessing disease onset and progression in the SOD1 mouse model of ALS. Neuroreport. 14(7): 1051–1054. 2003.
Karl T., Pabst R., Von S. HÖrsten Behavioral phenotyping of mice in pharmacological and toxicological research. Exp. Toxic. Pathol. 55: 69–83. 2003.
Mikael L.G. Moderately high intake of folic acid has a negative impact on mouse embryonic development. Birth Defects Res. A Clin. Mol. Teratol. 97(1): 47–52. 2013.
Tyl R.W., Price C.J., Marr M.C., Kimmel C.A. Developmental toxicity evaluation of bendectin in CD rats. Teratology. 37: 539–552. 1988.
Snodgrass S.R. Vitamin neurotoxicity. Mol. Neurobiol. 6(1): 41–73. 1992.
Rydlewicz A.1., Simpson J.A., Taylor R.J., Bond C.M., Golden M.H. The effect of folic acid supplementation on plasma homocysteine in an elderly population. QJM. 95(1): 27–35. 2002.
Lamers Y.1., Prinz-Langenohl R., Moser R., Pietrzik K. Supplementation with [6S]-5-methyltetrahydrofolate or folic acid equally reduces plasma total homocysteine concentrations in healthy women. Am. J. Clin. Nutr. 79(3): 473–8. 2004.
Wilcken D.E., Wilcken B. The natural history of vascular disease in homocystinuria and the effects of treatment. J. Inherit. Metab. Dis. 20(2): 295–300. 1997.
Bernasconi A.R., Liste A., Del Pino N., Rosa Diez G.J., Heguilén R.M. Folic acid 5 or 15 mg/d similarly reduces plasma homocysteine in patients with moderate-advanced chronic renal failure. Nephrology (Carlton). 11(2): 137–41. 2006.
Achón M., Alonso-Aperte E., Reyes L., Ubeda N., Varela-Moreiras G. High-dose folic acid supplementation in rats: effects on gestation and the methionine cycle. Br. J. Nutr. 83(2): 177–83. 2000.
Matté C., Mackedanz V., Stefanello F.M., Scherer E.B., Andreazza A.C., Zanotto C., Moro A.M., Garcia S.C., Gonçalves C.A., Erdtmann B., Salvador M., Wyse A.T. Chronic hyperhomocysteinemia alters antioxidant defenses and increases DNA damage in brain and blood of rats: protective effect of folic acid. Neurochem. Int. 54(1): 7–13. 2009
Allen L.H., Miller J.W., Groot L., Rosenberg I.H., Smith A.D., Refsum H., Raiten D.J. The putative purpose of this regulation is to increase the synthesis of the antioxidant glutathione. J. Nutr. 148(4): 1995–2027. 2018.
Yamamoto K., Isa Y., Nakagawa T., Nakagawa T. Involvement of 5-methyltetrahyrofolate in the amelioration of hyperhomocysteinemia caused by vitamin B6 deficiency and l-methionine supplementation. Biosci. Biotechnol. Biochem. 77(2): 378–380. 2013.
Au-Yeung K.K., Yip J.C., Siow Y.L. Folic acid inhibits homocysteine-induced superoxide anion production and nuclear factor kappa B activation in macrophages. Can. J. Physiol. Pharmacol. 84(1): 141–7. 2006.
Mattson M.P., Shea T.B. Folate and homocysteine metabolism in neural plasticity and neurodegenerative disorders. TRENDS in Neurosci. 26(3): 137–146. 2003.
Metz J. Cobalamin deficiency and the pathogenesis of nervous system disease. Annu. Rev. Nutr. 12: 59–79. 1992.
Fenech M. The role of folic acid and Vitamin B12 in genomic stability of human cells. Mutat. Res. 475(1–2): 57–67. 2001.
Middaugh L.D., Grover T.A., Blackwell L.A., Zemp J.W. Neurochemical and behavioral effects of diet related perinatal folic acid restriction. Pharmacol. Biochem. Behav. 5(2): 129–134. 1976.
Kumar M., Modi M., Sandhir R. Hydrogen sulfide attenuates homocysteine-induced cognitive deficits and neurochemical alterations by improving endogenous hydrogen sulfide levels. Biofactors. 43(3): 434–450. 2017.
Ferguson S.A., Berry K.J., Hansen D.K., Wall K.S., White G., Antony A.C. Behavioral effects of prenatal folate deficiency in mice. Birth Defects Res. A Clin. Mol. Teratol. 73(4): 249–52. 2005.
Gospe S.M.Jr., Gietzen D.W., Summers P.J., Lunetta J.M., Miller J.W., Selhub J., Ellis W.G., Clifford A.J. Behavioral and neurochemical changes in folate-deficient mice. Physiol. Behav. 58(5): 935–941. 1995.
McCabe D., Lisy K., Lockwood C., Colbeck M. The impact of essential fatty acid, B vitamins, vitamin C, magnesium and zinc supplementation on stress levels in women: A systematic review. JBI Database System Rev. Implement Rep. 15(2): 402–453. 2017.
Morris M.S., Jacques P.F., Rosenberg I.H., Selhub J. Folate and vitamin B-12 status in relation to anemia, macrocytosis, and cognitive impairment in older americans in the age of folic acid fortification. Am. J.Clin. Nutr. 85: 193–200. 2007.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова