Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1271-1282
Вклад кальциевых каналов L-типа в секрецию ацетилхолина в нервно-мышечных соединениях лягушки и мыши при активных и инактивированных потенциал-зависимых калиевых каналах
А. Н. Ценцевицкий 1, 2, В. Ф. Хузахметова 1, 2, Э. Ф. Хазиев 1, 2, И. В. Ковязина 1, 2, 3, *
1 Казанский институт биохимии и биофизики ФИЦ КазНЦ РАН
Казань, Россия
2 Казанский федеральный университет
Казань, Россия
3 Казанский государственный медицинский университет
Казань, Россия
* E-mail: irina.kovyazina@list.ru
Поступила в редакцию 24.06.2019
После доработки 23.07.2019
Принята к публикации 03.08.2019
Аннотация
Исследование посвящено изучению вклада Са2+-каналов L-типа в вызванную секрецию ацетилхолина из двигательных нервных окончаний лягушки и мыши при активных и инактивированных потенциал-зависимых К+-каналах. Оценивали эффекты специфического блокатора Са2+-каналов L-типа нитрендипина на квантовый состав токов концевой пластинки и временной ход секреции квантов ацетилхолина в интактных препаратах и после предварительной блокады потенциал-активируемых К+-каналов 4-аминопиридином (4-АП) в условиях сниженного и физиологического уровня Са2+ в среде. Флуоресцентным методом измеряли кальциевый транзиент, отражающий интегральный вход Са2+ в нервное окончание, и осуществили компьютерное моделирование процессов, лежащих в основе экзоцитоза при наличии двух типов Са2+-каналов (N- и L-типов) и разной длительности потенциала действия нервного окончания. Показано, что в синапсах лягушки Са2+-каналы L-типа вносят вклад в вызванную секрецию ацетилхолина и при активных К+-каналах, но только в условиях сниженного уровня Са2+ в среде; при инактивации потенциал-зависимых К+-каналов вклад каналов L-типа в секреторный процесс становится менее существенным. При физиологическом уровне Са2+ участие каналов L-типа в вызванной секреции ацетилхолина проявляется, как и в синапсах мыши, лишь в условиях блокады потенциал-зависимых К+-каналов.
В нервно-мышечных синапсах основными пресинаптическими Са2+-каналами, инициирующими нейросекрецию, являются каналы N-типа (CaV2.2) у амфибий, а в синапсах млекопитающих – P/Q-типа (CaV2.1) [1, 2]. Ранее было показано, что вход Са2+ в нервное окончание через Са2+-каналы L-типа (CaV1.1) также вносит вклад в процесс вызванного квантового освобождения ацетилхолина (АХ) в моторных синапсах лягушки и мыши [3–7]. Иммуногистохимический анализ показал наличие Са2+-каналов L-типа в области нервно-мышечных контактов крысы (CaV1.2 подтипа) и лягушки (CaV1.3 и CaV1.4) [8, 9].
Особенностью Са2+-каналов L-типа является высокий порог активации, длительное время нахождения в открытом состоянии, Са2+-зависимая инактивация и то, что они расположены на удалении от зон, где происходит освобождение синаптических везикул [2]. Пролонгированный вход Са2+ через эти каналы может обусловливать более позднее высвобождение квантов медиатора, проявляющееся в увеличении фракции постсинаптических ответов с большими синаптическими задержками [8, 9].
Известно, что некоторые подтипы K+- и Са2+-каналов колокализованы в нервных окончаниях и их функционирование может быть взаимосвязано [10–15]. Увеличение длительности пресинаптического спайка, обусловленное инактивацией потенциал-зависимых K+-каналов, может активировать те Са2+-каналы, которые до этого не были задействованы в нейросекреции. То есть, фармакологическая инактивация потенциал-зависимых K+-каналов является удобным инструментом для изучения вклада Са2+-каналов в нейросекрецию [15–17]. В данном исследовании мы поставили задачу исследовать участие Са2+-каналов L-типа в вызванной секреции ацетилхолина (АХ) из двигательных нервных окончаний при активных и инактивированных потенциал-зависимых K+-каналах. Для этого оценивали эффекты специфического блокатора Са2+-каналов L-типа нитрендипина [18, 19] на интенсивность вызванной квантовой секреции АХ (квантовый состав ТКП) и временной ход нейросекреции в интактных препаратах и после предварительной блокады потенциал-активируемых K+-каналов 4-аминопиридином (4-АП) в условиях сниженного и физиологического уровня Са2+ в среде. Кроме того, флуоресцентным методом измеряли кальциевый транзиент, отражающий интегральный вход Са2+ в нервное окончание, и осуществили компьютерное моделирование процессов, лежащих в основе экзоцитоза при наличии двух типов Са2+-каналов (N- и L-типов) и разной длительности потенциала действия нервного окончания.
Показано, что существуют особенности участия Са2+-каналов L-типа в вызванной секреции АХ в синапсах лягушки. В этих синапсах каналы L-типа вносят вклад в процесс секреции АХ при активных K+-каналах, но только в условиях сниженного уровня Са2+ в среде; при инактивации потенциал-зависимых K+-каналов вклад каналов L-типа в секреторный процесс становится менее очевидным. При физиологическом уровне Са2+ вклад каналов L-типа в вызванную квантовую секрецию АХ проявляется лишь в условиях блокады потенциал-зависимых K+-каналов 4-АП, как и в синапсах мыши.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводилось в соответствии с принципами Хельсинской декларации и рекомендациями комиссии по биоэтике Казанского государственного медицинского университета.
Исследования проводили на изолированных нервно-мышечных препаратах лягушки (R. ridibunda, m. cutaneous pectoris,) и мыши (линия BALB/c, m. diaphragm). Нервно-мышечные препараты помещали в ванночку объемом 5 мл, через которую протекал один из растворов следующего состава, в мМ: 1-й для холоднокровных – 113 NaCl; 2.5 KCl; 5.0 HEPES; 1.5 NaHCO3; 1.8 CaCl2; 2-й для теплокровных –150 NaCl; 5 KCl; 5 HEPES; 11 глюкоза; 1.0 MgCl2; 2 CaCl2. При снижении концентрации Са2+ до 0.3 мМ в раствор добавлялся 4.0 мМ MgCl2. pH раствора составлял 7.2–7.4, а температура поддерживалась на уровне 20.0 ± 0.3°C.
Регистрировали вызванные и спонтанные (миниатюрные) токи концевой пластинки (ТКП и МТКП) с последующим расчетом количества освобождаемых квантов (квантовый состав ТКП) и оценкой временного хода секреции нейромедиатора. Регистрация и анализ синаптических сигналов осуществлялся с помощью комплекса, включающего в себя микроэлектродный усилитель (с полосой пропускания от 0.03 до 10 кГц), стимулятор A-M Systems 2100, быстродействующий аналого-цифровой преобразователь (с частотой дискретизации 3 мкс) и компьютер. Данный комплекс позволял измерять синаптические сигналы и анализировать их амплитудно-временные параметры в реальном масштабе времени.
Нерв раздражали прямоугольными стимулами длительностью 100 мкс супрамаксимальной амплитуды с частотой 0.5 имп/с.
При регистрации ТКП методом фиксации потенциала мышечного волокна мембранный потенциал поддерживался на уровне –60 мВ. Для оценки интенсивности секреции (квантового состава ТКП) в условиях нормального уровня Са2+ в среде использовали соотношение амплитуд вызванных и миниатюрных ТКП. Сокращения нервно-мышечного препарата лягушки блокировали путем добавления в омывающий раствор µ-конотоксина PIIIA (Peptide Institute Inc., Япония). В условиях сниженного уровня Са2+ квантовый состав ТКП оценивался по методу “выпадений” [20].
Для блокады потенциал-зависимых К+- и Са2+-каналов L-типа использовались специфические блокаторы – 4-аминопиридин (4-AП, 4-aminopyridine, Sigma-Aldrich, США) и нитрендипин (nitrendipine, Sigma-Aldrich, США).
Кинетика секреции нейромедиатора в отдельных активных зонах в условиях пониженного содержания Са2+ во внеклеточной среде оценивалась путем анализа кумулятивных гистограмм истинных синаптических задержек одноквантовых ТКП [21] и вычисления параметра Р90, характеризующего временной интервал, содержащий 90% всех синаптических задержек [4, 7].
Для регистрации относительного изменения уровня Са2+ в нервном окончании (Са2+-транзиент) использовалась фотометрическая система на базе микроскопа Olympys BX 51, оснащенная высокоскоростной чувствительной камерой Red Shirt Imaging Neuro CCD-smq camera (Red Shirt Imaging, США). Регистрация кальциевого транзиента осуществлялась с использованием специфического Са2+-чувствительного флуоресцентного красителя Oregon Green 488 Bapta 1 (Molecular Probes, США) при нормальном уровне Са2+ в среде.
Для компьютерного моделирования процесса экзоцитоза была адаптирована стохастическая модель (метод Монте-Карло) нейросекреторного процесса, описанная подробно в ряде работ [22–25].
В каждом эксперименте регистрировали 200–300 синаптических ответов. Экспериментальные данные представлены как среднее значение ± ошибка среднего.
Для статистической обработки результатов электрофизиологических и оптических экспериментов использовали двухсторонний критерий Стьюдента (для параметрических данных) либо непараметрический критерий Манна–Уитни. Различия считали статистически значимыми на уровне 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Влияние блокатора Са2+-каналов L-типа нитрендипина на секрецию АХ в синапсах лягушки и мыши при сниженном уровне Са2+ в среде
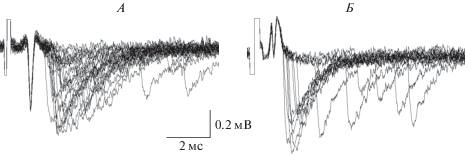
При сниженной до 0.3 мМ концентрации Са2+ средний квантовый состав ТКП составил 0.49 ± 0.07 в синапсах лягушки (n = 12) и 0.11 ± 0.02 (n = 7) в синапсах мыши. Длительность секреторного процесса (параметр P90) составила соответственно 1.43 ± 0.09 и 3.6 ± 0.6 мс. На рис. 1 представлены типичные токи нервного окончания и одноквантовые ТКП, зарегистрированные в синапсах лягушки и мыши в интактных препаратах.
Рис. 1.
Суперпозиция токов действия нервного окончания и одноквантовых токов концевой пластинки (ТКП) в ответ на стимуляцию двигательного нерва с частотой 0.5 имп/с, зарегистрированных экстраклеточно в одном из типичных экспериментов на нервно-мышечном препарате лягушки (А) и мыши (Б) в условиях сниженной до 0.3 мМ концентрации Са2+.
Как и в предыдущих наших работах [4, 7, 8], блокада Са2+-каналов L-типа нитрендипином (5 мкМ) в синапсах лягушки вызывала достоверное обратимое снижение интенсивности секреции АХ: на 24.5 ± 3.4% (p < 0.05, n = 12) и синхронизировала секреторный процесс, о чем свидетельствует уменьшение параметра P90 до 84.5 ± 5.3% (p < 0.05, n = 12) от контрольных значений. То есть вход Са2+ через каналы L-типа способствует освобождению квантов АХ с длительными синаптическими задержками.
В синапсах мыши аппликация нитрендипина даже в большей концентрации (10 мкМ) не вызывала достоверных изменений квантового состава ТКП, но приводила к небольшой синхронизации секреции на 12.1 ± 4.0% (p < 0.05, n = 7, рис. 2А), что согласуется с ранее полученными данными [7]. Аналогичные результаты об отсутствии эффектов блокады каналов L-типа на квантовый состав постсинаптических ответов в интактных препаратах теплокровных были получены и другими исследователями [6, 14, 26].
Рис. 2.
А–Б. Относительное изменение квантового состава ТКП (светло-серые столбцы) и параметра P90 (темно-серые столбцы) под действием нитрендипина в препаратах с интактными K+-каналами (А) и после их предварительной инактивации 4-АП (Б). n = 8–11 для каждой экспериментальной серии. * p < 0.05. За 100% приняты значения квантового состава ТКП и параметра P90 до аппликации нитрендипина. В–Г. Нормированные кумулятивные кривые истинных синаптических задержек ТКП, зарегистрированных в типичных экспериментах в синапсах лягушки (В) и мыши (Г). Показаны изменения распределений синаптических задержек в контроле (сплошные линии), в присутствии 4-АП (штриховые линии) и в присутствии 4-АП и нитрендипина (пунктирные линии). n = 200–300 ТКП, зарегистрированных в одной концевой пластинке.
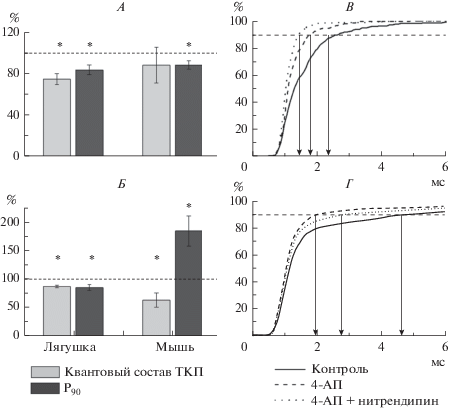
Блокатор потенциал-активируемых K+-каналов 4-АП (1 мкМ) в условиях сниженного уровня Са2+ вызывал увеличение квантового состава ТКП в синапсах лягушки (на 173 ± 34%), а также синхронизировал секрецию АХ – параметр P90 снижался в среднем на 24 ± 9% (n = 8, p < 0.05, рис. 2В). Аналогичные результаты были получены и для синапсов мыши (4-АП, 5 мкМ): квантовый состав ТКП увеличивался на 238 ± 66%, а параметр P90 снижался в среднем на 40 ± 19% (n = 7, p < 0.05, рис. 2Г). Увеличение квантового освобождения АХ связано, по-видимому, с повышенной вероятностью активации Са2+-каналов при продолжительной деполяризации нервного окончания в условиях блокады калиевых каналов [27]. Известно, что 4-АП может напрямую активировать высокопороговые Са2+-каналы [28], однако этот эффект проявляется явно лишь при высоких (0.1 мМ и выше) концентрациях этого соединения. Изменение синхронности секреции АХ в присутствии 4-АП можно объяснить увеличением входа в нервное окончание Са2+, что, как было показано ранее [29], синхронизирует процесс секреции нейромедиатора.
Блокада Са2+-каналов L-типа нитрендипином в присутствии 4-АП приводила к различным изменениям параметров секреции АХ в синапсах лягушки и мыши. Так, в синапсах мыши под воздействием нитрендипина наблюдалось существенное снижение квантовой секреции ацетилхолина (на 37 ± 12%, n = 8, p < 0.05), которого не было в препаратах с активными K+-каналами (рис. 2Б). То есть можно предположить, что в нервно-мышечных синапсах мыши увеличение квантового состава ТКП в присутствии 4-АП обусловлено в значительной степени вовлечением в секреторный процесс Са2+-каналов L-типа. Интересно отметить, что в нервно-мышечных контактах мыши аппликация нитрендипина после предварительной блокады К+-каналов приводила к десинхронизации секреции (увеличение параметра P90 на 84 ± 27% по сравнению с уровнем в 4-АП, n = 8, p < 0.05, рис. 2Г), вероятно обусловленную снижением входа Са2+ в нервное окончание через Са2+-каналы L-типа.
В синапсах лягушки аппликация нитрендипина в условиях блокады потенциал-чувствительных K+-каналов 4-АП также вызывала снижение квантового состава ТКП, однако это снижение было достоверно меньше, чем в препаратах с интактными K+-каналами (на 13.0 ± 2.1%, p < 0.05, критерий Манна–Уитни, df = 17). Изменение степени синхронности секреции АХ после блокады Са2+-каналов L-типа в синапсах лягушки было одинаковым при активных и инактивированных K+-каналах.
Влияние блокатора Са2+-каналов L-типа нитрендипина на секрецию АХ в синапсах лягушки при физиологическом уровне Са2+ в среде
Чтобы оценить вклад каналов L-типа в вызванную секрецию АХ в условиях физиологического уровня Са2+ в синапсах лягушки, были проведены эксперименты по регистрации многоквантовых ТКП и МТКП методом фиксации мембранного потенциала мышечного волокна.
Эксперименты показали, что при физиологическом уровне Ca2+ нитрендипин (5 мкМ) не оказывал достоверного влияния на параметры ТКП и МТКП. Так, амплитуда ТКП в контроле составила 354 ± 81 нА, а в присутствии нитрендипина – 353 ± 91 нА (p > 0.05, n = 6). Временные параметры ТКП тоже достоверно не менялись: время роста составило 265 ± 15 и 287 ± 31 мкс соответственно, а постоянная времени спада 1.29 ± 0.19 и 1.34 ± 0.18 мс. Амплитуда миниатюрных ТКП также не претерпевала достоверных изменений в присутствии нитрендипина: амплитуда МТКП составила, соответственно, 4.2 ± 0.3 и 4.4 ± 0.4 нА (p > 0.05, n = 6).
Аппликация 4-АП (1 мкМ) вызывала достоверное увеличение амплитуды ТКП (на 29 ± 9%, p < 0.05, n = 6), что согласуется с данными других авторов [16, 30–32], не оказывая влияния на временные параметры многоквантовых ответов и амплитудно-временные характеристики МТКП. Однако после предварительной блокады потенциал-зависимых K+-каналов 4-АП нитрендипин достоверно снижал квантовый состава ТКП (на 20 ± 4%, p < 0,05, n = 5). Временные параметры ТКП и амплитудно-временные характеристики МТКП при этом также достоверно не менялись.
Таким образом, в условиях, близким к физиологическим, участие Са2+-каналов L-типа в вызванной секреции квантов АХ в нервно-мышечных контактах лягушки проявлялось только при инактивированных потенциал-зависимых K+-каналах, как и в синапсах мыши.
Влияние блокады Са2+-каналов L-типа на амплитуду кальциевого транзиента в синапсах лягушки при активных и инактивированных потенциал-зависимых K+-каналах.
На рис. 3 представлены кальциевые сигналы, зарегистрированные флуоресцентным методом в одном из характерных экспериментов.
Рис. 3.
Нитрендипин снижает амплитуду кальциевого транзиента при интактных (А) и при инактивированных 4-АП (Б) потенциал-зависимых K+-каналах. Представлено усреднение 40 сигналов, зарегистрированных в одном из типичных экспериментов на нервно-мышечном препарате лягушки. За 100% приняты значения амплитуды транзиента в контроле (А) и при блокировании К+-каналов (Б).
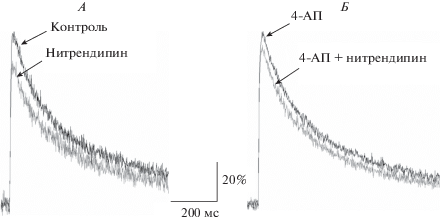
Измерение амплитуды кальциевого транзиента в нервном окончании лягушки в условиях нормального уровня Са2+ и при низкой частоте стимуляции нерва (0.5 имп/с) показало, что инактивация потенциал-чувствительных K+-каналов 4-АП (1 мкМ) приводит к увеличению величины кальциевого сигнала на 43 ± 15% (n = 8, p < 0.05) по сравнению с интактными препаратами.
Блокада Са2+-каналов L-типа нитрендипином (5 мкМ) после предварительной инкубации препарата с 4-АП приводила к достоверному снижению амплитуды кальциевого транзиента (на 15 ± 4%, p < 0.05, n = 11, рис. 3Б), но различие в действии нитрендипина при активных и инактивированных K+-каналах было недостоверным: при активных K+-каналах кальциевый транзиент также снижался на 19 ± 7% (p < 0.05, n = 12, рис. 3А), что согласуется с ранее полученными данными [33]. Следовательно, относительный вклад Са2+-каналов L-типа в общий кальциевый сигнал не зависит от активности потенциал-зависимых K+-каналов.
Различие между результатами электрофизиологических экспериментов и опытов по оптической регистрации кальциевых сигналов можно объяснить тем, что кальциевый транзиент отражает интегральное изменение уровня Са2+ во всем объеме нервного окончания в течение длительного периода времени (500–700 мс после стимуляции нерва). То есть Са2+-каналы L-типа могут вносить вклад в кальциевый метаболизм нервного окончания и при активных потенциал-зависимых K+-каналах, но их роль не ограничивается вкладом в вызванную квантовую секрецию, а может затрагивать и другие клеточные функции, такие как регуляция асинхронной и спонтанной секреции, выхода Са2+ из эндоплазматического ретикулума, экспрессии генов и т.д. [34–36].
Компьютерное моделирование процесса экзоцитоза в нервно-мышечном синапсе лягушки
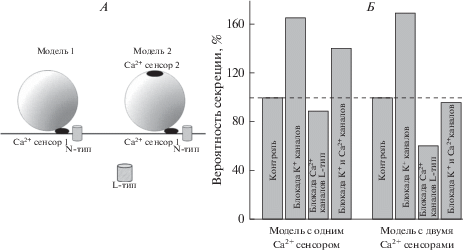
Особенностью Са2+-каналов L-типа является то, что они находятся в открытом состоянии существенно дольше, чем N- или P/Q-каналы, и расположены на удалении от активных зон, где происходит секреция квантов медиатора [37]. Для оценки возможного вклада такого типа каналов в вызванную секрецию медиатора в синапсе лягушки была адаптирована компьютерная модель по методу Монте-Карло, описанная ранее в ряде работ [22–25]. В модели рассматривается одна секреторная единица, состоящая из везикулы, готовой к освобождению медиатора, и двух Са2+-каналов, один из которых расположен в непосредственной близости от везикулы (20 нм, N‑тип), а другой – на значительном удалении (200 нм), и к тому же, дольше остается в открытом состоянии после активации (среднее время открытого состояния около 10 мс, L-тип). Потенциал нервного окончания симулировался в соответствии с модифицированной моделью Ходжкина–Хаксли [22]. Остальные параметры модели и геометрия активной зоны соответствуют используемым в работах [24, 25]. С помощью модели исследовали изменение концентрации ионов Са2+, поступающих в нервное окончание через оба Са2+-канала и их вклад в вероятность экзоцитоза при разной длительности деполяризации мембраны нервного окончания. В модели предусматривалось два варианта перехода везикулы к стадии экзоцитоза: (i) после связывания 4 ионов Са2+ с сенсором (со свойствами белка синаптотагмина 1, 2); (ii) при связывании 2 ионов Са2+ с дополнительным сенсором, расположенным на удалении (50 нМ) от Са2+-канала N-типа. Наличие нескольких Са2+-сенсоров с разными характеристиками, предположительно, разных изоформ белка синаптотагмина с разным сродством к Са2+, опосредующих разные формы секреции – синхронную и асинхронную, активно обсуждается в последнее десятилетие [38, 39]. В частности, предполагается, что в качестве Са2+-сенсора для асинхронного освобождения может выступать синаптотагмин 7 (SYT7), обладающий повышенным сродством к Са2+. Модель с двумя Са2+-сенсорами с разным количеством сайтов связывания Са2+ (соответственно, 5 и 2), описанная в работе [40], хорошо воспроизводила скорость освобождения медиатора в центральных синапсах при варьировании концентрации Ca2+.
В наших модельных экспериментах было показано, что при наличии только одного кальциевого сенсора, расположенного около канала N-типа, добавление еще одного Са2+-канала (L-типа) увеличивает вероятность секреции в одинаковой степени, независимо от длительности потенциала действия (на 12.7% и 14.8%, соответственно для активных и неактивных K+-каналов).
Симуляция процесса экзоцитоза с учетом дополнительного сенсора (рис. 4А, Б) более точно воспроизводит экспериментально полученные данные на синапсах лягушки в условиях сниженного уровня Са2+. Так, относительное изменение вероятности секреции при увеличении длительности пресинаптического спайка (симуляция блокады K+-каналов 4-АП) при отсутствии в модели Са2+-каналов L-типа оказалось меньше, чем при их учете в модели (на 56% по сравнению с 69%, рис. 4Б). То есть, наличие второго сенсора для Са2+, расположенного на удалении от основного Са2+-канала, наиболее значимо для секреторного процесса при наличии дополнительного источника Са2+ (например, вход ионов через Са2+-канал L-типа либо выход Са2+ из внутриклеточного кальциевого депо) и увеличении длительности деполяризации мембраны (то есть, при увеличении вероятности открывания Са2+-каналов).
Рис. 4.
Компьютерное моделирование процесса экзоцитоза в нервно-мышечном синапсе лягушки по методу Монте-Карло. А – Схематическое изображение взаимного расположения везикулы, Са2+-каналов разных типов (“N” и “L”) и кальциевых сенсоров (1 и 2) для двух использованных моделей. Б – Относительное изменение вероятности экзоцитоза при симуляции блокады K+- и Са2+-каналов L-типа. За 100% принята вероятность экзоцитоза для контрольного набора параметров.
Можно предположить, что в условиях сниженного уровня Са2+ экзоцитоз в синапсах лягушки может осуществляться с участием нескольких кальциевых сенсоров, расположенных на разных расстояниях от основного Са2+-канала (N-типа) и обладающих различной кальциевой чувствительностью.
Таким образом, результаты исследования свидетельствуют о том, что пресинаптические потенциал-зависимые Са2+-каналы L-типа могут регулировать освобождение АХ из двигательных нервных окончаний лягушки и мыши, однако существуют особенности их вклада в вызванную нейросекрецию в разных экспериментальных условиях. Так в синапсах мыши участие Са2+-каналов L-типа в регуляции вызванной секреции АХ из двигательных нервных окончаний очевидно лишь в специфических условиях, например, при снижении концентрации Ca2+ в среде до 0.2 мМ, при использовании быстрых кальциевых буферов, блокаде BK-каналов [5, 7, 14, 15] или, как показано в данном исследовании, при блокаде потенциал-зависимых K+-каналов с помощью 4-АП. При этом если квантовый состав ТКП в присутствии нитрендипина снижался, то степень синхронности освобождения квантов АХ либо увеличивалась, либо уменьшалась, в зависимости от активности K+-каналов.
Интересно отметить, что ранее для синапсов мыши было показано прямое взаимодействие каналов L-типа с другими K+-каналами – Са2+-зависимыми K+-каналами большой проводимости [5, 15]. Инактивация этого типа K+-каналов ибериотоксином растормаживала каналы L-типа, что проявлялось как увеличение квантового состава ПКП. Существует ли подобное взаимодействие с другими типами K+-каналов, еще предстоит выяснить.
В синапсах лягушки Са2+-каналы L-типа вносят вклад в вызванную секрецию АХ в условиях сниженного уровня Са2+ в среде, но при физиологическом уровне Са2+ их участие в нейросекреции при низкой частоте раздражения нерва было очевидным лишь при инактивации потенциал-зависимых K+-каналов. Возможное объяснение более выраженного эффекта блокады этих каналов в условиях сниженного уровня Са2+ в среде может быть связано с тем, что в этих условиях даже небольшие вариации концентрации Ca2+ в области активной зоны могут приводить к значительному изменению вероятности освобождения везикул. Интересно отметить, что наблюдаемое в присутствии нитрендипина уменьшение дисперсии истинных синаптических задержек, то есть синхронизация секреторного процесса [7], в полной мере сохранялась и при инактивации потенциал-зависимых K+-каналов.
В физиологических условиях, вход Са2+ в нервное окончание через каналы L-типа также имеет место, что подтверждается результатами экспериментов по оптической регистрации интегрального кальциевого сигнала в нервном окончании (кальциевого транзиента). Но, по-видимому, наибольшее изменение внутриклеточного Са2+ при открывании каналов L-типа происходит уже после завершения синхронной фазы нейросекреции, определяющей параметры многоквантовых постсинаптических ответов.
Возможное различие в эффектах блокады Са2+-каналов L-типа в синапсах лягушки и мыши может отчасти быть связано и с разным субъединичным составом каналов L-типа в синапсах животных разных классов (CaV1.2, CaV1.3 или CaV1.4), например, с разной выраженностью их кальциевой инактивации [41].
В наших экспериментах при сниженном уровне Са2+ в синапсах лягушки, блокада Са2+-каналов L-типа приводила к достоверному снижению квантового состава ТКП и при активных K+-каналах, а при их инактивации эффект нитрендипина был, наоборот, менее выражен. Компьютерное моделирование процесса экзоцитоза для одной секреторной единицы показало возможность такого эффекта при увеличении длительности пресинаптического спайка при наличии на везикуле двух кальциевых сенсоров с разной удаленностью от Са2+-каналов и различным количеством мест связывания Са2+. Известно, что длительность потенциала действия аксона зависит от ряда эндогенных факторов – паттерна активности нейрона, аккумуляции нейромедиаторов в околосинаптической области и т.д. [42, 43]. Можно предположить, что участие Са2+-каналов L-типа в секреторном процессе, не столь очевидное при низкочастотном раздражении нерва, будет усиливаться в случае повышенной синаптической активности.
Список литературы
Hong S.J., Chang C.C. Inhibition of acetylcholine release from mouse motor nerve by a P-type calcium channel blocker, omega-agatoxin IVA. J. Physiol. 482: 283–290. 1995.
Meir A., Ginsburg S., Butkevich A., Kachalsky S.G., Kaiserman I., Ahdut R., Demirgoren S., Rahamimoff R. Ion channels in presynaptic nerve terminals and control of transmitter release. Physiol. Rev. 79(3): 1019–1088. 1999.
Balezina O.P., Bogacheva P.O., Orlova T.Y. Effect of L-type calcium channel blockers on activity of newly formed synapses in mice. Bull. Exp. Biol. Med. 143(2): 171–174. 2007.
Tsentsevitsky A.N., Vasin A.L., Bukharaeva E.A., Nikolsky E.E. Participation of different types of voltage-dependent calcium channels in evoked quantal transmitter release in frog neuromuscular junction. Dokl. Biol. Sci. 423: 389–391. 2008.
Gaydukov A.E., Melnikova S.N., Balezina O.P. Facilitation of acetylcholine secretion in mouse motor synapses caused by calcium release from depots upon activation of L-type calcium channels. Bull. Exp. Biol. Med. 148(2): 163–166. 2009.
Tarasova E.O., Miteva A.S., Gaydukov A.E., Balezina O.P. The role of adenosine receptors and L-type calcium channels in the regulation of the mediator secretion in mouse motor synapses. Biochemistry. Suppl. Series A. 9(4): 318–328. 2015.
Tsentsevitsky A.N., Khuzakhmetova V.F., Vasin A.L., Samigullin D.V., Bukharaeva E.A. Calcium modulation of the kinetics of evoked quantum secretion in neuromuscular synapses of cold-and warm-blooded animals. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 9(4): 270–277. 2015.
Tsentsevitsky A.N., Samigullin D.V., Nurullin L.F., Khaziev E.F., Nikolsky E.E., Bukharaeva E.A. Frogs: genetic diversity, neural development and ecological implications. Ed. Lambert H. New York: NOVA Pupl. 2014.
Khuzakhmetova V.F., Nurullin L.F., Bukharaeva E.A., Nikolsky E.E. Involvement of dihydropyridine-sensitive calcium channels in high asynchrony of transmitter release in neuromuscular synapses of newborn rats. Dokl. Biol. Sci. 470(1): 220–223. 2016.
Roberts W.M., Jacobs R.A., Hudspeth A.J. Colocalization of ion channels involved in frequency selectivity and synaptic transmission at presynaptic active zones of hair cells. J. Neurosci. 10(11): 3664–3684. 1990.
Robitaille R., Garcia M.L., Kaczorowski G.J., Charlton M.P. Functional colocalization of calcium and calcium-gated potassium channels in control of transmitter release. Neuron. 11(4): 645–655. 1993.
Yazejian B., DiGregorio D.A., Vergara J.L., Poage R.E., Meriney S.D., Grinnell A.D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J. Neurosci. 17(9): 2990–3001. 1997.
Robitaille R., Charlton M.P. Presynaptic calcium signals and transmitter release are modulated by calcium-activated potassium channels. J. Neurosci. 12: 297–305. 1992.
Urbano F.J., Depetris R.S., Uchitel O.D. Coupling of L-type calcium channels to neurotransmitter release at mouse motor nerve terminals. Pflugers Arch. 441(6): 824–831. 2001.
Flink M.T., Atchison W.D. Iberiotoxin-induced block of Ca2+-activated K+ channels induces dihydropyridine sensitivity of ACh release from mammalian motor nerve terminals. J. Pharmacol. Exp. Ther. 305(2): 646–652. 2003.
Giovannini F., Sher E., Webster R., Boot J., Lang B. Calcium channel subtypes contributing to acetylcholine release from normal, 4-aminopyridine-treated and myasthenic syndrome auto-antibodies-affected neuromuscular junctions. Br. J. Pharmacol. 136(8): 1135–1145. 2002.
Allana T.N., Lin J-W. Effects of increasing Ca2+ channel-vesicle separation on facilitation at the crayfish inhibitory neuromuscular junction. Neuroscience. 154(4): 1242–1254. 2008.
Hockerman G.H., Peterson B.Z., Johnson B.D., Catterall W.A. Molecular determinants of drug binding and action on L-type calcium channels. Annu. Rev. Pharmacol. Toxicol. 37: 361–396. 1997.
Furukawa T., Yamakawa T., Midera T., Sagawa T., Mori Y., Nukada T. Selectivities of dihydropyridine derivatives in blocking Ca2+ channel subtypes expressed in Xenopus oocytes. J. Pharmacol. Exp. Ther. 291: 464–473. 1999.
Del Castillo J., Katz B. Quantal components of the end-plate potential. J. Physiol. 124: 560–573. 1954.
Katz B., Miledi R. The measurement of synaptic delay, and the time course of acetylcholine release at the neuromuscular junction. Proc. R. Soc. Lond. B. Biol. Sci. 161: 483–495. 1965.
Bennett M.R., Gibson W.G., Robinson J. Probabilistic secretion of quanta and the synaptosecretosome hypothesis: Evoked release at active zones of varicosities, boutons, and endplates. Biophys. J. 73(4): 1815–1829. 1997.
Bennett M.R., Farnell L., Gibson W.G. The probability of quantal secretion near a single calcium channel of an active zone. Biophys. J. 78(5): 2201–2221. 2000.
Shahrezaei V., Delaney K.R. Brevity of the Ca2+ microdomain and active zone geometry prevent Ca2+-sensor saturation for neurotransmitter release. J. Neurophysiol. 94(3): 1912–1919. 2005.
Shahrezaei V., Cao A., Delaney K.R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J. Neurosci. 26(51): 13240–13249. 2006.
Rosato Siri M.D., Uchitel O.D. Calcium channels coupled to neurotransmitter release at neonatal rat neuromuscular junctions. J. Physiol. 514(2): 533–540. 1999.
Muller D. Potentiation by 4-aminopyridine of quantal acetylcholine release at the Torpedo nerve-electroplaque junction. J. Physiol. 379: 479–493. 1986.
Li L., Li D.P., Chen S.R., Chen J., Hu H., Pan H.L. Potentiation of high voltage-activated calcium channels by 4-aminopyridine depends on subunit composition. Mol. Pharmacol. 86(6): 760–772. 2014.
Bukharaeva E.A., Samigullin D., Nikolsky E.E., Magazanik L.G. Modulation of the kinetics of evoked quantal release at mouse neuromuscular junctions by calcium and strontium. J. Neurochem. 100(4): 939–949. 2007.
Giniatullin R.A., Khazipov R.N. End plate currents with a physiological level of quantal secretion and after potentiation of the mediator release by 4-aminopyridine. Neirofiziologiia. 23(1): 48–56. 1991.
Provan S.D., Miyamoto M.D. Effect of the putative cognitive enhancer, linopirdine (DuP 996), on quantal parameters of acetylcholine release at the frog neuromuscular junction. Br. J. Pharmacol. 111(4): 1103–1110. 1994.
Ng F., Lee D.C., Schrumpf L.A., Mazurek M.E., Lee Lo V., Gill S.K., Maselli R.A. Effect of 3,4-diaminopyridine at the murine neuromuscular junction. Muscle Nerve. 55(2): 223–231. 2017.
Khaziev E.F., Samigullin D.V., Tsentsevitsky A.N., Bukharaeva E.A., Nikolsky E.E. ATP reduces the entry of calcium ions into the nerve ending by blocking L-type calcium channels. Acta Naturae. 10(2): 93–96. 2018.
Lozavio A., Muchnik S. Spontaneous acetylcholine release in mammalian neuromuscular junctions. Am. J. Physiol. 273(6): 1835–1841. 1997.
Zuccotti A.1., Clementi S., Reinbothe T., Torrente A., Vandael D.H., Pirone A. Structural and functional differences between L-type calcium channels: Crucial issues for future selective targeting. Trends Pharmacol. Sci. 32(6): 366–375. 2011.
Furukawa T. Types of voltage-gated calcium channels: Molecular and electrophysiological views. Curr. Hypertens. Rev. 9(3): 170–181. 2013.
Zamponi G.W., Striessnig J., Koschak A., Dolphin A.C. The physiology, pathology, and pharmacology of voltage-gated calcium channels and their future therapeutic potential. Pharmacol. Rev. 67(4): 821–870. 2015.
Luo F., Südhof T.C. Synaptotagmin-7-mediated asynchronous release boosts high-fidelity synchronous transmission at a central synapse. Neuron. 94(4): 826–839. 2017.
Rozov A., Bolshakov A.P., Valiullina-Rakhmatullina F. The ever-growing puzzle of asynchronous release. Front. Cell. Neurosci. 13: 28. 2019.
Sun J., Pang Z., Qin D., Fahim A.T., Adachi R., Südhof T.C. A two Ca2+-sensor model for neurotransmitter release in a central synapse. Nature. 450(7170): 676–682. 2007.
Pagani R., Song M., McEnery M., Qin N., Tsien R.W., Toro L., Stefani E., Uchitel O.D. Differential expression of alpha 1 and beta subunits of voltage dependent Ca2+ channel at the neuromuscular junction of normal and P/Q Ca2+ channel knockout mouse. Neuroscience. 123(1): 75–85. 2004.
Kirkpatrick K., Bourque C.W. Dual role for calcium in the control of spike duration in rat supraoptic neuroendocrine cells. Neurosci. Lett. 133(2): 271–274. 1991.
Sabatini B.L., Regehr W.G. Control of neurotransmitter release by presynaptic waveform at the granule cell to Purkinje cell synapse. J. Neurosci. 17(10): 3425–3435. 1997.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


