Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1236-1246
Влияние гомоцистеина и его производных на спонтанную сетевую активность в гиппокампе новорожденных крысят
Е. Д. Курмашова 1, Э. Д. Гатаулина 1, А. Л. Зефиров 2, Г. Ф. Ситдикова 1, А. В. Яковлев 1, *
1 Казанский федеральный университет
Казань, Россия
2 Институт нейронаук, Казанский государственный медицинский университет
Казань, Россия
* E-mail: alv.yakovlev@gmail.com
Поступила в редакцию 01.07.2019
После доработки 23.07.2019
Принята к публикации 23.07.2019
Аннотация
Гомоцистеин – серосодержащая аминокислота, в высоких концентрациях обладающая нейротоксическими эффектами и вызывающая нарушения развития нервной системы. Гомоцистеин в плазме крови быстро окисляется, образуя дисульфидные связи с белками и другими низкомолекулярными тиолами, а также преобразуется в гомоцистеин-тиолактон. Поэтому при хроническом воздействии нейротоксичность гомоцистеина опосредуется преимущественно его производными. Целью нашей работы было исследование влияния гомоцистеина и его производных – гомоцистина и гомоцистеин-тиолактона на спонтанную сетевую активность нейронов гиппокампа крыс в первую неделю после рождения. Гигантские деполяризующие потенциалы (ГДП) и множественные потенциалы действия (МПД) регистрировали с использованием внеклеточного электрода в СА3 зоне гиппокампа. Оказалось, что все три исследованных соединения вызывали увеличение частоты ГДП и МПД в концентрациях 100 и 500 мкМ, при этом гомоцистин оказывал наиболее значительное повышение сетевой активности нейронов. В условиях блокирования НМДА- и АМПА-рецепторов эффекты гомоцистеина, гомоцистина и гомоцистеин-тиолактона на спонтанную сетевую активность нейронов полностью снимались. Таким образом, гомоцистеин и его производные приводят к усилению спонтанной сетевой активность нейронов гиппокампа неонатальных крыс, что может вызывать нарушения формирования нейрональных сетей гиппокампа в условиях хронической гипергомоцистеинемии, а также вызывать гипервозбудимость и риск развития эпилепсии в постнатальный период.
Гомоцистеин представляет собой серосодержащую аминокислоту, синтезируемую из метионина [1, 2]. Нарушение метаболизма гомоцистеина приводит к его накоплению в крови и цереброспинальной жидкости, называемому гипергомоцистеинемией [3, 4]. В зависимости от концентрации гомоцистеина в крови гипергомоцистеинемия классифицируется как легкая (16–30 мкМ), средняя (30–100 мкМ) и тяжелая (>100 мкМ). При генетических нарушениях ферментов метаболизма гомоцистеина уровень этой аминокислоты может достигать 500 мкМ, что приводит к гомоцистеинурии [3]. В физиологических условиях менее 1% общего гомоцистеина присутствует в свободной восстановленной форме, около 10–20% – в различных окисленных формах, в том числе в виде димера – гомоцистина [5], и большая часть (80%) является связанной с γ-глобулинами и альбумином [6]. Кроме того, повышение концентрации гомоцистеина цитотоксично в силу его превращения в гомоцистеин-тиолактон в процессе синтеза белка [7]. Гомоцистеин-тиолактон –химически реактивная молекула, вызывающая N-гомоцистеинилирование белков путем формирования амидной связи с аминокислотой – лизин, что приводит к нарушению структуры и функциональной активности белков. Этот процесс вносит вклад в развитие различных патологий, включая атеросклероз, тромбоз, болезнь Альцгеймера [8]. Поэтому при хроническом воздействии нейротоксичность гомоцистеина опосредуется преимущественно его производными. Однако вопросы о том, какие формы гомоцистеина обуславливают развитие патологических процессов и являются их маркерами, остаются предметом исследований.
Даже небольшое повышение уровня гомоцистеина в плазме коррелирует с возрастными когнитивными нарушениями, нейродегенеративными и цереброваскулярными заболеваниями, развитием эпилепсии [9–11]. Повышение уровня гомоцистеина во время беременности приводит к токсическим эффектам на плод, так как гомоцистеин способен проникать через плаценту, что ведет к патологиям развития [12, 13]. Одним из механизмов нейротоксического действия гомоцистеина является активация ионотропных и метаботропных рецепторов глутамата в нейронах, избыточная стимуляция которых вызывает гипервозбудимость, а также повышение уровня кальция, вызывающего апоптоз [14–18].
Нервная система новорожденных животных обладает рядом функциональных особенностей. Во многих отделах мозга и, в том числе, в гиппокампе регистрируется особая форма сетевой активности – гигантские деполяризующие потенциалы (ГДП) [19], которые принимают участие в формировании нейрональной сети, обеспечивая синхронную активацию пре- и постсинаптических нейронов, что является одним из механизмов синаптической пластичности [20, 21].
Несмотря на интенсивные исследования механизмов нейротоксических эффектов гомоцистеина на развивающуюся нервную систему, отсутствуют данные о влиянии гомоцистеина и его производных на раннюю ритмическую активность нейронов гиппокампа. Целью настоящего исследования был анализ эффектов гомоцистеина и его производных – гомоцистина и гомоцистеин-тиолактона на спонтанную сетевую активность нейронов гиппокампа крысят в течение первой недели постнатального развития.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводились на новорожденных крысятах (P3–P7, где Р0 – день рождения). Все экспериментальные протоколы соответствовали этическим нормам по гуманному обращению с животными, принятым в Казанском федеральном университете (одобрены этической комиссией Казанского медицинского университета N9, 2013). Перед экспериментом животные анестезировались изофлураном (4%). После выделения, головной мозг крысят помещался в охлажденный оксигенированный искусственный цереброспинальный раствор (ИЦСР) следующего состава (в мМ): NaCl 126, KCl 3.5, CaCl2 2.0, MgCl2 1.3, NaHCO3 25, NaH2PO4 1.2, глюкоза 11 (pH 7.4, 310 мосмоль/л). Горизонтальные срезы мозга толщиной 400 мкм нарезались с использованием виброслайсера HM 650 V (Microm International, Германия). Срезы перемещались в оксигенированный ИЦСР и выдерживались не менее 1 ч при комнатной температуре до начала эксперимента. Во всех срезах, как в контрольной, так и в экспериментальной группах регистрировались спонтанные ГДП, которые характеризовались негативным отклонением (локальный полевой потенциал, ЛПП) и популяционной активностью нейронов гиппокампа – множественными потенциалами действия (МПД) (рис. 1А) [22]. Внеклеточная регистрация ЛПП и МПД выполнялась при помощи электрода, изготовленного из вольфрамовой проволоки (диаметром 50 мкм, California Fine Wire, США), располагаемого в СА3 области пирамидного слоя гиппокампа. Усиление и оцифровку регистрируемых сигналов осуществляли с помощью усилителя DAM-80 (WPI, США; ×1000, фильтр 0.1–3 кГц) с использованием АЦП Digidata 1440 (Axon Instruments, США). Сигналы анализировались с помощью программ Axon software package (Molecular device, США), Mini Analysis (Synaptsoft Inc, США), Origin 8.5 (Microcal Software, США) и пользовательских функций Matlab (MathWorks, США). Определяли частоту ГДП и МПД. МПД определялись с использованием высокочастотного фильтра (RC single pole; >400 Гц), где все негативные события, превышающие 2.5 стандартного отклонения шума считались потенциалами действия (рис. 1А2) [22]. Для анализа ЛПП нативные записи фильтровались низкочастотным фильтром 30 Гц (рис. 1А3), что позволяло оценивать амплитуду и длительность ЛПП [23].
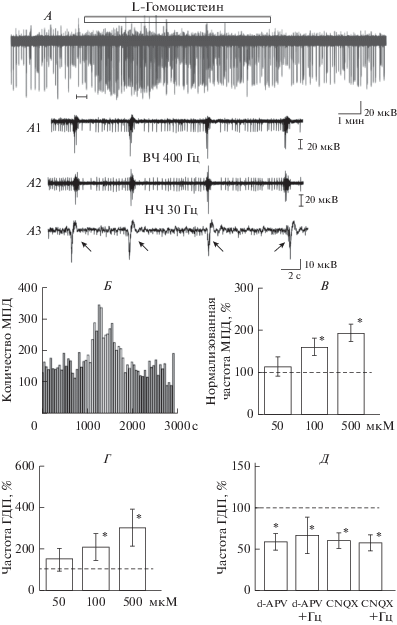
Рис. 1.
Влияние гомоцистеина на спонтанную сетевую активность нейронов в срезе гиппокампа крысы. А. Пример внеклеточной регистрации популяционной активности нейронов гиппокампа, которая организована в виде ГДП и МПД. Расширенный по времени участок записи (темный прямоугольник) с ГДП (указаны звездочками) (А1); МПД после фильтрации записи высокочастотным фильтром (>400 Гц) (А2); локальные полевые потенциалы (указаны стрелками) после обработки нативных записей низкочастотным фильтром (30 Гц) (А3). Аппликация 100 мкМ гомоцистеина (обозначена незакрашенным прямоугольником) приводит к увеличению частоты ГДП и потенциалов действия. Б. Изменение количества МПД в одном эксперименте (из записи А, шаг 50 с). Действие вещества обозначено незакрашенными столбиками. Гистограмма усредненных частот МПД (В) и ГДП (Г) при действии гомоцистеина в концентрациях 50, 100 и 500 мкМ. Д. Эффекты гомоцистеина (Гц, 100 мкМ) на частоту ГДП в условиях ингибирования НМДА-рецепторов (20 мкМ d-APV) и АМПА-рецепторов (10 мкМ CNQX). 100% – значения частот ГДП в контроле. * р < 0.05 относительно контроля.
В экспериментах использовались следующие вещества: L-гомоцистеин, L-гомоцистин, D,L-гомоцистеин-тиолактон, D-(-) амино-5-фосфонопентаноат (d-APV, селективный блокатор НМДА-рецепторов), 6-циано-7 нитрокиноксалин (CNQX, селективный блокатор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMПA)-рецепторов) (Sigma, США).
Групповые данные представлены как среднее значение ± стандартная ошибка. Достоверность различий в сравниваемых выборках оценивали с помощью непараметрического парного критерия или U-критерия Манна–Уитни. р < 0.05 принимался за достоверно значимый.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В гиппокампе новорожденных грызунов спонтанная синхронная активность пирамидных клеток и интернейронов выражается в генерации так называемых гигантских деполяризующих потенциалов (ГДП) – высокоамплитудных длительных сдвигах мембранного потенциала нервных клеток с наложением потенциалов действия группы нейронов (рис. 1А) [19–21, 23]. Гомоцистеин, гомоцистин и гомоцистеин-тиолактон использовались в концентрациях 50, 100, 500 мкМ. Использование концентраций 100 и 500 мкМ в наших экспериментах обусловлено тем, что в плазме такие концентрации могут определяться при тяжелых формах гипергомоцистеинемии у человека, а кроме того, при длительном воздействии происходит накопление эффектов низких концентраций гомоцистеина [24].
Гомоцистеин, гомоцистин и гомоцистеин-тиолактон в концентрации 50 мкМ не приводили к достоверным изменениям спонтанной сетевой активности нейронов (рис. 1–3). При использовании гомоцистеина в концентрации 100 и 500 мкМ наблюдали как повышение частоты ГДП, так и МПД (рис. 1А–Г). В концентрации 100 мкМ гомоцистеин вызывал усиление частоты спонтанных потенциалов действия до 155 ± 15% (с 14 ± 3 до 21 ± 3 с–1; n = 11, p < 0.05), а в концентрации 500 мкМ – до 24 ± 3 с–1 (до 183 ± 16%; n = 5, p < 0.05) относительно контроля (рис. 1В). Гомоцистеин также повышал частоту ГДП до 205 ± 45% (с 0.8 ± 0.2 до 1.3 ± 0.2 с-1; n = 15, p < 0.05) в концентрации 100 мкМ и до 306 ± 54% (до 3.3 ± 1.4 с–1; n = 6, p < 0.05) в концентрации 500 мкМ (рис. 1Г). При этом длительность и амплитуда ЛПП не изменялись. Эффект гомоцистеина наблюдался в течение 5–8 мин с начала аппликации вещества, а затем происходило восстановление спонтанной активности пирамидных нейронов. Смена раствора на ИЦСР приводила к восстановлению активности до исходных значений, однако, время восстановления зависело от используемой концентрации.
Рис. 2.
Влияние гомоцистина на спонтанную сетевую активность нейронов в срезе гиппокампа крысы. А. Пример внеклеточной регистрации популяционной активности нейронов гиппокампа. Аппликация 100 мкМ гомоцистина обозначена незакрашенным прямоугольником. Б. Изменение количества МПД в одном эксперименте (из записи А, шаг 50 с). Действие вещества обозначено незакрашенными столбиками. Гистограмма усредненных частот МПД (В) и ГДП (Г) при действии гомоцистина в концентрациях 50, 100 и 500 мкМ. Д. Эффекты гомоцистина (Гц-ин 100 мкМ) на частоту ГДП в условиях ингибирования НМДА-рецепторов (20 мкМ d-APV) и АМПА-рецепторов (10 мкМ CNQX). 100% – значения частот ГДП в контроле. *р < 0.05 относительно контроля.
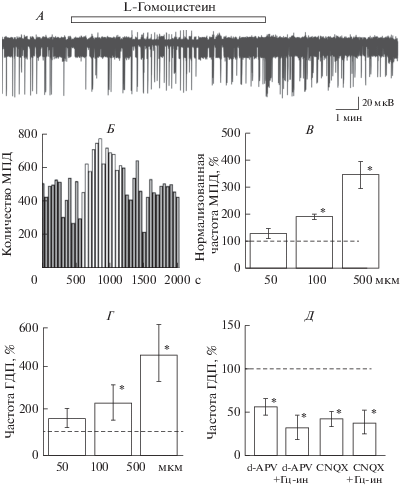
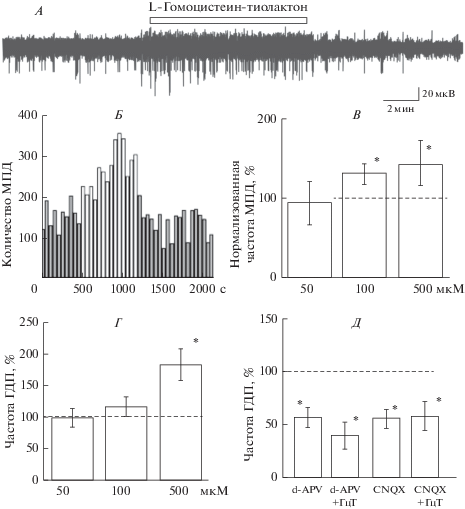
Рис. 3.
Влияние гомоцистеин-тиолактона на спонтанную сетевую активность нейронов в срезе гиппокампа крысы. А. Пример эффекта гомоцистеин-тиолактона (500 мкМ, незакрашенный прямоугольник) на популяционную активность нейронов гиппокампа. Б. Изменение количества МПД в одном эксперименте (из записи А, шаг 50 с). Действие вещества обозначено незакрашенными столбиками. Гистограмма усредненных частот МПД (В) и ГДП (Г) при действии гомоцистеин-тиолактона в концентрациях 50, 100 и 500 мкМ. Д. Эффекты гомоцистеин-тиолактона (ГцТ, 500 мкМ) на частоту ГДП в условиях ингибирования НМДА-рецепторов (20 мкМ d-APV) и АМПА-рецепторов (10 мкМ CNQX). 100% – значения частот ГДП в контроле. * р < 0.05.
Известно, что генерация ГДП контролируется коактивацией НМДА- и ГАМК-рецепторов нейронов гиппокампа [20]. Кроме того показано, что для синхронизации ГДП необходима активация АМПА-рецепторов [20, 25]. Поскольку L-гомоцистеин является слабым агонистом НМДА-рецепторов [16], в следующей серии экспериментов был проведен анализ эффектов гомоцистеина на фоне ингибирования ионотропных рецепторов глутамата. Предварительная аппликация селективного ингибитора НМДА-рецепторов d-APV в концентрации 20 мкМ приводила к снижению частоты ГДП до 56 ± 10% (с 1.9 ± 0.4 до 1.1 ± 0.2 с–1; n = 7, p < 0.05) без изменения частоты МПД (рис. 1Д). Блокирование АМПА-рецепторов при помощи селективного блокатора CNQX в концентрации 10 мкМ вызывало снижение частоты ГДП до 55 ± 4% (с 1.8 ± 0.6 до 0.8 ± 0.24 с–1; n = 7, p < 0.05) без изменения частоты МПД. Последующая аппликация гомоцистеина не приводила к усилению частоты МПД и ГДП (рис. 1Д). Смена раствора на ИЦСР приводила к постепенному увеличению частоты ГДП, и к 10–20 мин наблюдалось полное восстановление спонтанной сетевой активности нейронов.
Известно, что в физиологических условиях гомоцистеин в плазме крови присутствует в виде димера – гомоцистина [26, 27]. При использовании гомоцистина в концентрациях 100 и 500 мкМ мы наблюдали значительное повышение частоты МПД и ГДП (рис. 2А–Г). Так, при добавлении 100 мкМ гомоцистина частота МПД возрастала до 183 ± 9% (с 26 ± 9 до 36 ± 12 с–1; n = 11, p < 0.05), а при добавлении вещества в концентрации 500 мкМ – до 345 ± 57% (с 11 ± 6 до 32 ± 6 с–1; n = 11, p < 0.05) (рис. 2В). Мы также наблюдали повышение частоты ГДП при аппликации гомоцистина в концентрации 100 мкМ до 257 ± 54% (с 1.8 ± 0.6 до 3.1 ± 0.8 с–1; n = 12, p < 0.05) и в концентрации 500 мкМ до 463 ± 92% (до 5.5 ± 1.3 с–1; n = 12, p < 0.05) относительно контроля (рис. 2Г). При этом длительность и амплитуда ЛПП спонтанных сетевых событий гиппокампа не изменялись. Эффект вещества был обратим.
В следующей серии экспериментов был проведен анализ эффектов гомоцистина (100 мкМ) на фоне ингибирования НМДА- или АМПА-рецепторов. Как показано на риc. 2Д, аппликация гомоцистина на фоне d-APV или на фоне CNQX не приводила к повышению частоты ГДП или МПД.
Эффекты гомоцистеин-тиолактона на спонтанную сетевую активность нейронов были выражены в меньшей степени (рис. 3А–Г). В концентрациях 100 и 500 мкМ гомоцистеин-тиолактон повышал частоту МПД до 128 ± 9% (с 29 ± 8 до 35 ± 4 с–1; n = 14, p < 0.05) и до 143 ± 10% (с 22 ± 6 до 33 ± 7 с–1; n = 11, p < 0.05) относительно контроля соответственно (рис. 3Б, В). Эффекты на ГДП проявлялись только при использовании гомоцистеин-тиолактона в концентрации 500 мкМ, и частота ГДП возрастала до 183 ± 25% (с 2.3 ± 0.4 до 4.5 ± 1.2 с–1; n = 8, p < 0.05, рис. 3Г). Длительность и амплитуда ЛПП спонтанных сетевых событий гиппокампа не изменялись. Эффект вещества на частоту ГДП и МПД был обратим.
На фоне ингибирования НМДА- или АМПА-рецепторов аппликация гомоцистеин-тиолактона (500 мкМ) не приводила к повышению частоты ГДП или МПД (рис. 3Д).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашем исследовании на срезах гиппокампа крысы в первую неделю постнатальную развития было показано, что не только гомоцистеин, но также и его производные – гомоцистин и гомоцистеин-тиолактон оказывают активирующее действие на спонтанные сетевые разряды (ГДП), что связано с активацией ионотропных рецепторов глутамата. Эти эффекты гомоцистеина и его производных могут вносить вклад в возникновение патологий развития потомства при хроническом воздействии высоких концентраций гомоцистеина в пренатальный период.
Известно, что повышение уровня гомоцистеина в организме матери приводит к осложнениям беременности, в том числе, к дефектам нервной трубки плода и задержке роста [4, 15, 28, 29]. Наиболее чувствительны к токсическим эффектам L-гомоцистеина нервные клетки в пренатальном и раннем постнатальном периодах развития [1] вследствие эффективного переноса гомоцистеина в клетку в форме его димера – гомоцистина [30]. Накопление гомоцистеина приводит к окислительному стрессу, что вызывает серьезные повреждения нейронов в различных отделах мозга [12, 13, 31, 32].
Исследования механизмов действия гомоцистеина in vitro показали, что острая аппликация гомоцистеина изменяет процессы синаптической пластичности в гиппокампе 6–8 недельных крыс [33, 34]. Инкубация первичных и вторичных культур клеток в гомоцистеине приводила к изменению электрофизиологических свойств нейронов, к быстрой десенситизации GluN1/N2B-рецепторов, снижению секреции гормона роста в GH3 клетках [17, 18, 35, 36]. На срезах гиппокампа новорожденных крысят с пренатальной гипергомоцистеинемией нами показано изменение электрических свойств нейронов и нарушение спонтанной сетевой активности [37].
Гомоцистеин в плазме быстро окисляется с образованием ряда метаболитов, в том числе гомоцистина и гомоцистеиновой кислоты, а также связывается с белками плазмы [5]. Кроме того, гомоцистеин может образовывать еще более токсичный метаболит – гомоцистеин-тиолактон при участии фермента метионил-тРНК синтетазы [6, 7, 27, 38]. Поэтому при хронической гипергомоцистеинемии происходит накопление производных гомоцистеина, которые могут оказывать собственные эффекты. Однако исследований эффектов гомоцистеина и его производных на электрическую активность нейронов неонатального гиппокампа не проводилось. При этом надо отметить, что ранняя электрическая активность, регистрируемая в срезах гиппокампа новорожденных крысят – ГДП, играет важную роль в развитии нейрональных сетей и их синхронизации, формировании синаптических связей, влияет на пролиферацию, миграцию, дифференцировку клеток, секрецию факторов роста, таких как BDNF [39]. Механизм возникновения ГДП связан с активацией ГАМК- и НМДА-рецепторов [21], а АМПА-рецепторы участвуют в синхронизации ГДП в нейрональной сети [21, 25].
В нашем исследовании показано, что гомоцистеин и его производные в высоких концентрациях (100 и 500 мкМ) вызывают усиление частоты ГДП и МПД в гиппокампе неонатальных крыс. При этом не наблюдалось изменений амплитуды и длительности ГДП, что может указывать на отсутствие влияния веществ на синаптические связи и генерацию пейсмекерной активности интернейронов, определяющих форму ГДП [40]. Интересно, что наиболее значительное повышение спонтанной сетевой активности наблюдалось при действии гомоцистина, который является окисленной формой гомоцистеина и внутри клетки может быть вновь восстановлен до гомоцистеина [3]. Эффекты гомоцистеин-тиолактона на ГДП были менее выражены, а повышение частоты МПД проявлялось только при использовании концентрации 500 мкМ, что, по-видимому, свидетельствует о его меньшем сродстве к глутаматным рецепторам. Кроме того, проявление его эффектов требует более длительного времени, поскольку известным механизмом его действия является посттрансляционная модификация белков (N-гомоцистеинилирование), вызывающая их функциональные изменения [7].
Одним из механизмов токсического действия гомоцистеина является активация НМДА-, АМРА- и метаботропных (группы I и III) рецепторов глутамата [31, 41]. Действительно, в наших экспериментах аппликация селективных ингибиторов НМДА- и АМПА-рецепторов полностью устраняла возбуждающее действие гомоцистеина и его производных на спонтанную сетевую активность нейронов гиппокампа.
С учетом гипервозбудимости нервной сети в первую неделю после рождения вследствие деполяризующего действия ГАМК, активация рецепторов глутамата и усиление нейрональной активности может служить предпосылкой возникновения эпилептической активности в условиях хронического воздействия гомоцистеина [42, 43]. Действительно, в экспериментах на животных введение гомоцистеин-тиолактона in vivo приводило к возникновению эпилептической активности как у молодых, так и взрослых животных [3, 4, 7, 44, 45]. Поэтому усиление спонтанной сетевой активности нейронов при действии гомоцистеина и его производных может вносить свой вклад в нарушение формирования нейрональных сетей гиппокампа в условиях хронической гипергомоцистеинемии, а также вызывать гипервозбудимость и риск развития эпилепсии в постнатальный период.
Список литературы
Troen A.M. The central nervous system in animal models of hyperhomocysteinemia. Prog. Neuropsychopharmacol. Biol. Psychiatry. 29: 1140–1151. 2005.
Ansari R., Mahta A., Mallack E., Luo J.J. Hyperhomocysteinemia and neurologic disorders: A review J. Clin. Neurol. 10(4): 281–288. 2014.
Škovierová H., Vidomanová E., Mahmood S., Sopková J., Drgová A., Červeňová T., Lehotský J. The molecular and cellular effect of homocysteine metabolism imbalance on human health. Int. J. Mol. Sci. 17(10): 1733. 2016.
Moretti R., Caruso P. The controversial role of homocysteine in neurology: From labs to clinical practice. Int. J. Mol. Sci. 20(1): 231. 2019.
Hankey G.J., Eikelboom J.W. Homocysteine and vascular disease. Lancet. 354(9176): 407–13. 1999.
Jakubowski H. Homocysteine is a protein amino acid in humans: Implications for homocysteine-linked disease. J. Biol. Chem. 277: 30425–30428. 2002.
Jakubowski H., Głowacki R. Chemical biology of homocysteine thiolactone and related metabolites . Adv. Clin. Chem. 55: 81–103. 2011.
McCully K.S. Homocysteine metabolism, atherosclerosis and diseases of aging. Comp. Physiol. 6(1): 471–505. 2015.
Obeid R., Herrmann W. Mechanisms of homocysteine neurotoxicity in neurodegenerative diseases with special reference to dementia. FEBS Lett. 580: 2994–3005. 2006
Mudd S.H., Skovby F., Levy H.L., Pettigrew K.D., Wilcken B., Pyeritz R.E. The natural history of homocystinuria due to cystathionine beta-synthase deficiency. Am. J. Human Genetics. 37: 1–31. 1985.
Gorgone G., Caccamo D., Pisani L.R., Curro M., Parisi G., Oteri G. Hyperhomocysteinemia in patients with epilepsy: Does it play a role in the pathogenesis of brain atrophy? A preliminary report. Epilepsia. 50 (Suppl. 1): 33–36. 2009.
Арутюнян А.В., Козина Л.С., Арутюнов В.А. Токсическое влияние пренатальной гипергомоцистеинемии на потомство. Журн. акушерства и женск. болезн. 4: 16–20. 2010. [Arutyunyan A.V., Kozina L.S., Arutyunov V.A. Toxic effect of prenatal hyperhomocysteinemia on the offspring. Zhurnal akusherstva i zhenskikh bolezney. 4: 16–20. 2010. (In Russ.)].
Yakovleva O.V., Ziganshina A.R., Dmitrieva S.A., Arslanova A.N., Yakovlev A.V., Minibayeva F.V., Sitdikova G.F. Hydrogen sulfide ameliorates developmental impairments of rat offspring with prenatal hyperhomocysteinemia. Oxid. Med. Cel. Long. 2018: 2746873. 2018.
Lipton S.A., Kim W.-K., Choi Y.-B., Kumar S., D’Emilia D.M., Rayudu P.V., Stamler J.S. Neurotoxicity associated with dual actions of homocysteine at the N-methyl-D-aspartate receptor. Proc. Natl. Acad. Sci. U.S.A. 94(11): 5923–5928. 1997.
Boldyrev A.A., Vladychenskaya E.A., Tyulina O.V. Effect of homocysteine and homocysteic acid on glutamate receptors on rat lymphocytes. Bull. Exp. Biol. and Med. 142(7): 55–58. 2006.
Bolton A.D., Phillips M.A., Constantine-Paton M. Homocysteine reduces NMDAR desensitization and differentially modulates peak amplitude of NMDAR currents, depending on GluN2-subunit composition. J. Neurophysiol. 110: 1567–1582. 2013.
Sibarov D.A., Abushik P.A., Giniatullin R., Antonov S.A. GluN2A Subunit-containing NMDA receptors are the referential neuronal targets of homocysteine. Front. Cell. Neurosci. 10: 246. 2016.
Sibarov D.A., Giniatullin R., Antonov S.M. High sensitivity of cerebellar neurons to homocysteine is determined by expression of GluN2C and GluN2D subunits of NMDA receptors. Biochemical and biophysical research communications. 506(3): 648–652. 2018.
Ben-Ari Y., Cherubini E., Corradetti R., Gaiarsa J.-l. Giant synaptic potentials in immature rat CA3 hippocampal neurons. J. Physiology. 416: 303–325. 1989.
Ben-Ari Y. Excitatory actions of GABA during development: the nature of the nurture. Nat. Rev. Neurosci. 3(9): 728–739. 2002.
Ben-Ari Y., Gaiarsa J.-L., Tyzio R., Khazipov R. GABA: A pioneer transmitter that excites immature neurons and generates primitive oscillations. Physiol. Rev. 87(4): 1215–1284. 2007.
Zakharov A., Lotfullina N., Khazipov R. Impairments to the giant depolarizing potentials after the third trimester equivalent ethanol exposure in the neonatal rat. BioNanoScience. 6: 523–527. 2016.
Khalilov I., Minlibaev M., Mukhtarov M., Khazipov R. Dynamic changes from depolarizing to hyperpolarizing GABAergic actions during giant depolarizing potentials in the neonatal rat hippocampus. J. Neurosci. 35(37): 12635–12642. 2015.
Kang S.S., Wong P.W., Malinow M.R. Hyperhomocyst(e)inemia as a risk factor for occlusive vascular disease. Annu. Rev. Nutr. 12: 279–298. 1992.
Bolea S., Avignone E., Berretta N., Sanchez-Andres J.V., Cherubini E. Glutamate controls the induction of GABA-mediated giant depolarizing potentials through AMPA receptors in neonatal rat hippocampal slices. J. Neurophys. 81(5): 2095–2102. 1999.
Ueland P.M., Mansoor M.A., Guttormsen A.B., Muller D., Aukrust P., Refsum H., Svardal A.M. Reduced, oxidized andprotein-bound forms of homocysteine and other aminothiols in plasma comprise the redox thiol status: a possible element of the extracellular antioxidant defense system. J. Nutr. 126: 1281–1284. 1996.
Heydrick S.J., Weiss N., Thomas S.R., Cap A.P., Pimentel D.R., Loscalzo J., Keaney J.F. L-Homocysteine and L-homocystine stereospecifically induce endothelial nitric oxide synthase-dependent lipid peroxidation in endothelial cells. Free Radic. Biol. Med. 36(5): 632–640. 2004.
Gerasimova E., Yakovleva O., Burkhanova G., Ziyatdinova G., Khaertdinov N., Sitdikova G. Effects of maternal hyperhomocysteinemia on the early physical development and neurobehavioral maturation of rat offspring. BioNanoScience. 7: 155–158. 2017.
Djuric D., Jakovljevic V., Zivkovic V., Srejovic I. Homocysteine and homocysteine-related compounds: an overview of the roles in the pathology of the cardiovascular and nervous systems. Can. J. Physiol. Pharmacol. 96(10): 991–1003. 2018.
Grieve A., Butcher S.P., Griffiths R. Synaptosomal plasma membrane transport of excitatory sulphur amino acid transmitter candidates: Kinetic characterisation and analysis of carrier specificity. J. Neurosci. Res. 32: 60–68. 1992.
Folbergrová J. Anticonvulsant action of both NMDA and non-NMDA receptor antagonists against seizures induced by homocysteine in immature rats. Exp. Neurology. 145(2): 442–450. 1997.
Sergeeva I.A., Makhro A.V., Pegova A.N., Bulygina E.R. The effects of homocysteine and homocysteic acid on the metabotropic glutamate receptors of cerebellar neurons. Neurochem. J. 4(2): 116–121. 2010.
Christie L.A., Riedel G., Platt B. Bi-directional alterations of LTP after acute homocysteine exposure. Behav. Brain Res. 205: 559–563. 2009.
Ataie A., Sabetkasaei M., Haghparast A., Moghaddam A.H., Ataee R., Moghaddam S.N. Curcumin exerts neuroprotective effects against homocysteine intracerebroventricular injection-induced cognitive impairment and oxidative stress in rat brain. J. Med. Food. 13(4): 821–826. 2010.
Schaub C., Uebachs M., Beck H., Linnebank M. Chronic homocysteine exposure causes changes in the intrinsic electrophysiological properties of cultured hippocampal neurons. Exp. Brain Res. 225: 527–534. 2013.
Gaifullina A.S., Yakovlev A.V., Mustafina A.N., Weiger T.M., Hermann A., Sitdikova G.F. Homocysteine augments BK channel activity and decreases exocytosis of secretory granules in rat GH3 cells. FEBS Letters. 590(19): 3375–3384. 2016.
Yakovlev A.V., Kurmashova E., Zakharov A., Sitdikova G.F. Network-driven activity and neuronal excitability in hippocampus of neonatal rats with prenatal hyperhomocysteinemia. BioN-anoScience. 8(1): 304–309. 2017.
Jakubowski H. Protein homocysteinylation: possible mechanism underlying pathological consequences of elevated homocysteinelevels. FASEB J. 13(15): 2277–2283. 1999.
Kuczewski N., Porcher C., Ferrand N., Fiorentino H., Pellegrino C., Kolarow R., Gaiarsa J.-L. Backpropagating action potentials trigger dendritic release of BDNF during spontaneous network activity. J. Neurosci. 28(27): 7013–7023. 2008.
Сафиулина В.Ф., Касьянов A.M., Соколова Е.М., Мельник B.И., Эзрохи В.Л., Гиниатуллин Р.А. Модулирующее влияние аденозинтрифосфата на осцилляторные свойства гиппокампальных нейронов в раннем онтогенезе. Ж. Высш. Нервн. Деят., 53(4): 446–450. 2003. [Safiulina V.F., Kasyanov A.M., Sokolova E.M., Melnik V.I., Ezrokhi V.L., Giniatullin R.A. The modulating effect of adenosine triphosphate on the oscillatory properties of hippocampal neurons in early ontogenesis. Zh. Vyssh. Nerv. Deiat. Im. I. P. Pavlova. 53(4): 446–450. 2003. (In Russ.)].
Boldyrev A.A., Bryushkova E., Mashkina A., Vladychenskaya E. Why is homocysteine toxic for the nervous and immune systems? Curr. Aging Sci. 6: 29–36. 2013.
Payne J.A., Rivera C., Voipio J., Kaila K. Cation–chloride co-transporters in neuronal communication, development and trauma. Trends in Neurosci. 26(4): 199–206. 2003.
Khalilov I., Le Van Quyen M., Gozlan H., Ben-Ari Y. Epileptogenic actions of GABA and fast oscillations in the developing hippocampus. Neuron. 48(5): 787–796. 2005.
Kubová H., Folbergrová J., Mareš P. Seizures induced by homocysteine in rats during ontogenesis. Epilepsia. 36(8): 750–6. 1995.
Stanojlovic O., Hrncic D., Rasic-Markovic A., Djuric D. Homocysteine: neurotoxicity and mechanisms of induced hyperexcitability. Serb. J. Exp. Clin. Res. 12. 3–9. 2011.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


