Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1225-1235
Медиаторы тучных клеток как триггеры боли при мигрени: сравнение гистамина и серотонина в активации первичных афферентов в менингеальных оболочках крысы
Д. Ф. Нурхаметова 1, 2, К. С. Королёва 1, 2, О. Ш. Гафуров 1, Р. Р. Гиниатуллина 2, Г. Ф. Ситдикова 1, Р. А. Гиниатуллин 1, 2, *
1 Казанский федеральный университет
Казань, Россия
2 Университет Восточной Финляндии
Куопио, Финляндия
* E-mail: girashid13@gmail.ru
Поступила в редакцию 02.07.2019
После доработки 19.07.2019
Принята к публикации 19.07.2019
Аннотация
Менингеальные оболочки, окружающие мозг, отличаются обильным кровоснабжением, высокой плотностью сенсорных нервов и присутствием большого числа тучных клеток. При мигрени, наиболее частом неврологическом расстройстве, активация волокон тройничного нерва в мозговых оболочках является начальным пусковым механизмом для генерации болевого сигнала. Предложенная недавно концепция нервно-иммунного синапса предполагает, что медиаторы тучных клеток способны активировать белки-рецепторы в близлежащих нервных окончаниях, что приводит к генерации спайковой ноцицептивной активности. Серотонин и гистамин, предполагаемые триггеры мигрени, являются классическими медиаторами, выделяемыми при активации тучных клеток. Наши недавние исследования выявили мощную активацию первичных афферентов серотонином, реализуемую преимущественно через 5-НТ3-рецепторы. Однако роль гистамина в менингеальном нервно-иммунном синапсе остается малоизученной. Поэтому в данном исследовании с помощью отведения спайковой активности от первичных афферентов в менингах крысы, мы исследовали роль гистамина как возможного триггера боли при мигрени. Результаты тестирования широкого диапазона концентраций гистамина выявили только минимальный (около 12%) эффект 10 мкМ гистамина на ноцицептивную активность тройничного нерва. При более детальном кластерном анализе число волокон, реагирующих на гистамин, не превышало 29%, причем в этих волокнах усиление спайковой активности было значительно ниже, чем при действии серотонина. Более долговременное (4 ч) действие гистамина также достоверно не меняло активности тройничного нерва. Полученные результаты не исключают стимулирующей роли гистамина при мигрени, но предполагают иное, чем активация тройничного нерва, действие этого медиатора тучных клеток.
Возбуждение окончаний тройничного нерва, обширно представленных в твердой мозговой оболочке, является начальным этапом для формирования и передачи ноцицептивной информации от периферии в ЦНС во время приступов мигрени [1, 2]. Однако нейрохимические механизмы возбуждения менингеальных афферентов остаются малоизученными. В последнее время популярным является предположение о важной роли в этом процессе локальных тучных клеток, в большом количестве присутствующих в мозговых оболочках [3–6].
Серотонин, наряду с гистамином, накапливается в менингеальных тучных клетках и высвобождается в результате развития патологического процесса [7]. Наши недавние исследования выявили сильное про-ноцицептивное действие серотонина на терминали тройничного нерва у крыс и мышей, которое реализуется, в основном, через ионотропные 5-НТ3-рецепторы [4, 6]. Однако роль гистамина в формировании ноцицептивного сигнала в менингеальных афферентах осталась малоизученной.
Гистамин является классическим нейротрансмиттером из группы моноаминов и одним из самых известных эндогенных медиаторов боли и зуда [8]. Гистамин осуществляет биологические эффекты путем связывания с четырьмя подтипами метаботропных рецепторов (Н1–Н4) [9, 10]. В результате связывания активируются системы внутриклеточных посредников, в том числе, происходит высвобождение внутриклеточного кальция или увеличение уровня циклического АМФ [11]. При изучении механизмов зуда было показано, что активация Н1-рецепторов гистамина в ноцицептивных нейронах приводит к активации TRPV1-рецепторов через активацию PLA2 и образование 12-HPETE – метаболита 12-липоксигеназы, эндогенного TRPV1-рецептор активатора [12].
Гистамин, как и серотонин, были предложены как участники патологического процесса при мигрени [13, 14]. Однако в проведенных клинических исследованиях не были получены убедительные доказательства эффективности антагонистов Н1- и Н2-рецепторов при лечении мигрени [13, 14]. Следует отметить, что в патогенез мигрени могут быть вовлечены и другие гистаминовые рецепторы. Так, H3- и Н4-рецепторы гистамина имеют в три раза более высокое сродство к гистамину, чем H1/H2-рецепторы и обнаруживаются как в нейронах, так и в иммунных клетках. Причем, активация H3-рецепторов в тучных клетках ингибирует их дегрануляцию [15], что может служить механизмом анти-ноцицепции.
Основываясь на опыте предыдущих исследований, свидетельствующих об использовании гистамина в качестве средства, провоцирующего мигрень, и учитывая недостаточное количество данных об эффективности действия антигистаминных препаратов во время приступа мигрени [14], настоящее исследование посвящено анализу роли гистамина в ноцицептивной системе тройничного нерва в экспериментальной модели мигрени у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве метода исследования ноцицептивной активности тройничного нерва в твердой мозговой оболочке крысы, был использован электрофизиологический метод внеклеточной регистрации потенциалов действия. Экспериментальные протоколы соответствовали этическим нормам по гуманному обращению с животными, принятым в Казанском федеральном университете и одобрены этическим комитетом КФУ (протокол № 8 от 05.05.2015). Данная методика позволяет регистрировать ноцицептивные потенциалы действия (ПД), распространяющиеся в ортодромном направлении, а также регистрировать изменения частоты ПД (спайков) под влиянием химических агентов. Череп крысы рассекался в сагитальном направлении и очищался от экстракраниальных мышечных тканей. В полученном препарате половины черепа крысы под визуальным контролем из твердой оболочки мозга выделялся тройничный нерв, который затем фиксировался в стеклянном электроде. Подробное описание подготовки препарата для регистрации ПД в менингеальных оболочках представлено в нашей предыдущей публикации [16].
Полученные половины черепа находились в физиологическом растворе Кребса, следующего состава (в мМ): 120 NaCl, 2.5 KCl, 2 CaCl2, 1 MgCl2, 11 глюкоза, 24 NaHPO4, 30 NaHCO3. Кроме того, поддерживались условия постоянной оксигенации 95% O2/5% CO2, pH поддерживали на уровне 7.2–7.35. Сигналы записывали с использованием усилителя DAM 80 (полоса пропускания 0.1 Гц–1 кГц; коэффициент усиления 10 000; World Precision Instruments, США). Электрические сигналы были оцифрованы на ПК с использованием платы NIPCI6221 (National Instruments, США) и программного обеспечения WinEDRv.3.2.7. (Strathclyde University, Великобритания).
Экспериментальные данные записывались и проходили первоначальную фильтрацию на усилителе в полосе 100–3000 Гц. Оцифрованные данные фильтровались с помощью фильтра Чебышева типа II. Для обнаружения спонтанных и вызванных сигналов выбирался интервал 20 с без спайков в начале каждого эксперимента и рассчитывалась дисперсия шума. Поиск спайков осуществлялся по превышению амплитуды больше пяти стандартных отклонений базового шума. Амплитуда каждого найденного сигнала была нормализована по базовому шуму и выражена в относительных единицах [2]. Для каждого найденного спайка определялись амплитудно-временные параметры положительной и отрицательной фазы, такие как: время нарастания, длительность фаз спайка, время спада. Для анализа активности отдельных нервных волокон, опираясь на предположение, что амплитудно-временные параметры спайка определяются свойствами нервного волокна, проводили разделение спайков на группы – кластеризацию в соответствии с амплитудно-временными параметрами. Для кластеризации использовали метод KlustaKwik [17]. Проведения кластеризации, построение графиков и гистограмм были выполнены с помощью программного обеспечения MATLAB (MathWorks, США). Из анализа исключили небольшое число кластеров, имеющих нетипичную двухпиковую форму, которые в контроле до аппликации веществ демонстрировали кратковременную взрывную активность.
Электрофизиологические данные оценивали как среднее ± стандартная ошибка среднего с использованием программы MATLAB. Для количественного анализа временной период в 20 мин в контроле и 20 мин при действии вещества был разделен на отрезки по 5 мин, в которых измерялось число ПД. Контрольными значениями для оценки действия агонистов служили последние 5 мин контроля перед аппликацией веществ. Для каждого набора данных рассчитывали стандартное отклонение и ошибку стандартного отклонения. Для определения достоверности различий в параметрах при разных состояниях одного и того же препарата мы использовали парный t-критерий. При p < 0.05 различия считали статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Тестирование быстрых эффектов гистамина на общую активность тройничного нерва в менингеальных оболочках
В первой серии экспериментов мы тестировали возможность развития быстрого эффекта гистамина на спайковую активность тройничного нерва в менингеальных оболочках в тех же условиях, в которых ранее тестировали эффект серотонина. Хотя рецепторы гистамина относятся к группе метаботропных рецепторов, показано их сопряжение с ионотропными рецепторами семейства TRP (TRPV1 и TRPA1), которые обычно представлены в ноцицепторах [10, 18].
В ходе проведенного исследования было установлено, что гистамин не обладает выраженной проноцицептивной активностью в минутном диапазоне действия. Как показано на рис. 1Б, во время аппликации гистамина не происходило значительных изменений частоты ПД, что резко контрастировало с мощным эффектом серотонина, апплицированного вслед за гистамином. Так, к 20-й мин действия 1 мкМ гистамина, среднее число ПД, измеренных в течение 5 мин, составило 265 ± 108 в сравнении с 316 ± 155 ПД в контроле (рис. 1В; n = 6; p = 0.40). После отмывки гистамина число ПД составило 284 ± 117 и последующая аппликация 10 мкМ гистамина увеличила на 12% активность тройничного нерва до 317 ± 121 ПД (n = 6; p = 0.04; рис. 1В). Примечательно, что последующая аппликация серотонина в той же концентрации (10 мкМ) приводила к резкому увеличению электрической активности в тройничном нерве (рис. 1Б). В части экспериментов после действия гистамина, вместо серотонина, мы апплицировали капсаицин (1 мкМ), что также приводило к резкому скачку электрической активности в тройничном нерве (данные не показаны). Это свидетельствовало о высокой способности нервных окончаний в данном препарате реагировать на классические ноцицептивные стимулы через TRPV1 рецепторы. Увеличение концентрации гистамина до 100 мкМ не вызвало усиления эффекта. Так, к 20-й мин действия этого агента число ПД измеренных в течение 5 мин в контроле составило 220 ± 91, а после 20-й мин действия 100 мкМ гистамина этот показатель был 270 ± 71 ПД (n = 6; p = 0.66; рис. 1В).
Рис. 1.
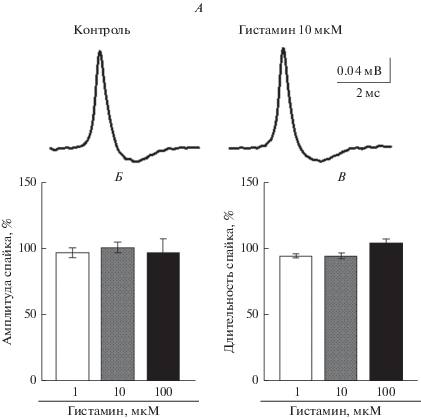
Влияние различных концентраций гистамина на электрическую активность тройничного нерва крысы. А. Пример оригинальных записей электрической активности тройничного нерва в контроле (слева), во время аппликации гистамина (10 мкМ, центр) и под действием серотонина (10 мкМ, справа). Б. Динамика изменений частоты потенциалов действия (ПД) в эксперименте с аппликацией гистамина (1 и 10 мкМ) и серотонина (10 мкМ). В. Усредненное количество спайков за каждые 5 мин в контроле (в течение 20 мин) и в течение 20 мин аппликации гистамина в концентрации 1 мкМ, 10 мкМ и 100 мкМ (n = 6, *p < 0.05).

Отсутствие выраженных эффектов гистамина не исключало, что эффект этого нейротрансмиттера реализуется через изменения амплитудно-временных характеристик ноцицептивных спайков. Однако анализ параметров ПД, таких как амплитуда и длительность положительных компонентов ПД, также свидетельствовал об отсутствии значительных изменений электрогенеза под влияем гистамина. На рис. 2Б отражены значения средних амплитуд ПД при 1 мкМ (99 ± 4%, n = 6, p = 0.87), 10 мкМ (102 ± 4%, n = 6, p = 0.65) и 100 мкМ (99 ± 11%, n = 6, p = 0.95) гистамина относительно контроля. Также под действием гистамина не было выявлено изменений и в длительности положительной фазы ПД. Так, при действии 1, 10 и 100 мкМ гистамина, средняя длительность ПД относительно контроля составляла 96.5 ± 1.4% (n = 6, р = 0.06); 97 ± 2% (n = 6, р = 0.27 ) и 101 ± 3% (n = 6, р = 0.59) соответственно.
Рис. 2.
Влияние гистамина на амплитудно-временные характеристики спайка тройничного нерва А. Пример усредненного спайка в контроле (слева) и после аппликации 10 мкМ гистамина (справа). Б. Усредненные значения амплитуды спайка, выраженных в процентах по отношению к контролю, под влиянием гистамина в концентрациях 1 мкМ (белые колонки), 10 мкМ (серые колонки) и 100 мкМ (черные колонки). В. Усредненные значения длительности основной положительной фазы спайка под влиянием гистамина в концентрациях 1 мкМ (белые колонки), 10 мкМ (серые колонки) и 100 мкМ (черные колонки) (n = 6).
Долговременные эффекты гистамина и серотонина на активность тройничного нерва
Известно, что во время дегрануляции тучных клеток происходит одновременное высвобождение нескольких медиаторов, в том числе гистамина и серотонина, которые, как предполагается, сенситизируют нервные окончания тройничного нерва в менингеальных оболочках. Поэтому мы провели серию экспериментов, в которой проверили действие гистамина на периферическом участке тройничного нерва после длительной инкубации в серотонине (в течение двух часов). Ранее мы показали, что окончания тройничного нерва высоко чувствительны к серотонину и даже низкие концентрации этого агента такие как 0.2 мкМ быстро увеличивают активность волокон нерва примерно в два раза [14].
Для исследования возможного усиления эффекта гистамина после предварительной сенситизации, мы измерили изменение числа спайков за 20 мин аппликации 100 мкМ гистамина после предварительной инкубации в серотонине (2 ч, 0.2 мкМ). При этом аппликация 100 мкМ гистамина практически не меняла число спайков (105 ± 31%; n = 3; р = 0.9), в то время как в контроле при действии такой же концентрации гистамина число спайков составило 151 ± 32% (n = 6, р = 0.21, рис. 3А). Таким образом, преинкубация в серотонине не способствовала увеличению чувствительности нервных окончаний тройничного нерва к гистамину.
Рис. 3.
Спайковая активность тройничного нерва при длительном действии серотонина и гистамина. А. Влияние предварительной инкубации препарата в растворе серотонина (0.2 мкМ) в течение 2-х часов (белая колонка) на эффекты гистамина (100 мкМ) в сравнении с контрольным действием гистамина (черная колонка). Б. Спайковая активность тройничного нерва (количество ПД за 20 мин) в контроле (инкубация 4 часа в базовом растворе, черная колонка) и после 4 часов инкубации в растворе гистамина (100 мкМ, белая колонка).
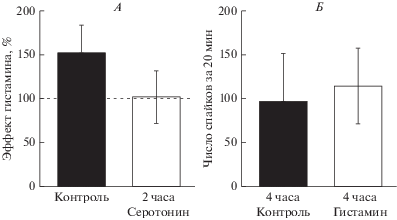
Особенностью мигрени является ее долговременный характер, что является даже одним из диагностических критериев этого расстройства. Поэтому далее мы исследовали возможность изменения спайковой активности после длительной аппликации самого гистамина. Оказалось, что и длительная (4 ч) инкубация в растворе, содержащем гистамин в концентрации 100 мкМ, не приводила к значительным изменениям частоты ПД (рис. 3Б). В контрольной группе, среднее число спайков в препарате, выдержанном в течение четырех часов в базовом растворе, составило за 20 мин 966 ± 547 ПД, тогда как после четырех часов инкубации менингеальных оболочек в растворе гистамина (100 мкМ) число спайков составило 1147 ± 431 (n = 3), что достоверно не отличалось от контроля (р = 0.8).
Кластерной анализ эффектов гистамина
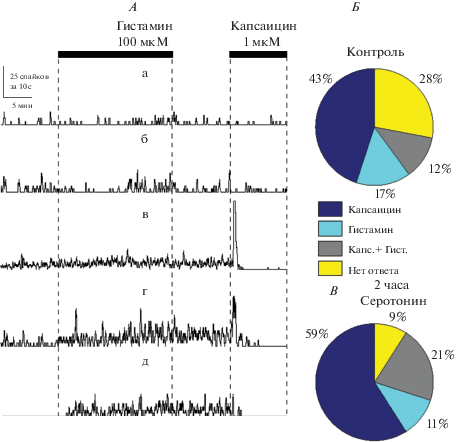
Кластерный анализ позволил выявить более детальную информацию об эффектах гистамина на электрическую активность в тройничном нерве крысы. Этот впервые предложенный нами метод сортировки волокон первичных афферентов позволяет выделить из общей активности и охарактеризовать рецепторный профиль одиночных волокон или малых групп волокон с совпадающими амплитудно-временными характеристиками [2]. На рис. 4А представлены примеры “нечувствительных” (рис. 4Аа–в) и “чувствительных” к гистамину (100 мкМ) (рис. 4Аг, д) кластеров. Последующая аппликация капсаицина (1 мкМ) позволила исследовать связь между экспрессией рецепторов к гистамину и TRPV1-рецепторов, которые экспрессируются в типичных ноцицепторах. На рис. 4А показаны примеры того, что как нечувствительные (рис. 4Ав), так и чувствительные к гистамину кластеры (рис. 4Аг) отвечают на капсаицин, что свидетельствует о коэкспрессии гистаминовых и TRPV1-рецепторов в части волокон тройничного нерва. Более подробно это видно на круговой диаграмме (рис. 4Б), где в контрольных условиях, без инкубации с сенситизирующими агентами, на аппликацию 100 мкМ гистамина ответило только 17% от общего числа кластеров, а 12% ответило одновременно на капсаицин и гистамин (рис. 4Б). Таким образом, общее число отвечающих кластеров составило 29%. После инкубации в серотонине число ответивших кластеров на гистамин составило 11%, тогда как 21% оказались чувствительными как к гистамину, так и к капсаицину (рис. 4В). Интересно, что общее число ответивших на капсаицин кластеров после обработки серотонином возросло с 55 до 80%, что свидетельствовало об сенситизирующем эффекте малых концентраций серотонина. Полученные на основе кластерного анализа результаты также согласуются с предыдущими данными о том, что гистамин не обладает выраженным проноцицептивным действием.
Рис. 4.
Кластерный анализ электрической активности тройничного нерва при действии гистамина в контроле и в условиях предварительной сенситизации серотонином. А. Примеры разной частотной активности кластеров при аппликации 100 мкМ гистамина и 1 мкМ капсаицина. Аа–в – кластеры без выраженного ответа на гистамин; Аг, д – кластеры с выраженным ответом на гистамин. Б. Круговая диаграмма распределения кластеров по типам ответов на гистамин и капсаицин (в процентах к общему количеству кластеров) в контроле. В. Аналогичная диаграмма, полученная в экспериментах с предварительной инкубацией препарата в растворе серотонина (0.2 мкМ) в течение двух часов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе мы показали, что предполагаемый медиатор мигрени гистамин, один из классических медиаторов, выделяющихся при дегрануляции тучных клеток, не проявляет существенного кратковременного или долговременного проноцицептивного действия на афферентные окончания тройничного нерва в менингеальных оболочках, в которых возникает начальный болевой сигнал при мигрени. Мы нашли только минимальный (около 12%) эффект 10 мкМ гистамина, при отсутствии достоверного эффекта на целый нерв более низких или более высоких концентраций этого моноамина. Также детальный кластерный анализ выявил малое число волокон тройничного нерва лишь слабо реагирующих на гистамин. Этот результат контрастирует с сильным возбуждающим нервные окончания эффектом другого медиатора тучных клеток, серотонина, который увеличивал активность тройничного нерва крыс в 6–7 раз [4].
Мигрень является распространенным неврологическим расстройством, механизмы которого до сих пор недостаточно изучены. Тем не менее, наиболее популярным является мнение, что специфическая длительная боль при мигрени генерируется в менингеальных оболочках, окружающих головной мозг [19, 20]. Наши и другие недавние исследования показали важную роль менингеальных тучных клеток как триггеров передачи ноцицептивных сигналов при мигрени [3, 16, 21]. Это согласуется с популярной концепцией нейро-иммунного синапса, когда медиаторы, выделяемые при дегрануляции из тучных клеток, активируют близлежащие нервные окончания [22–24]. Гистамин является одним из основных медиаторов, который содержится вместе с серотонином в секреторных гранулах тучных клеток и высвобождается при их дегрануляции [9, 25]. Дегрануляция может быть вызвана множеством химических раздражителей, таких как иммуноглобулин Е, ацетилхолин, или даже психологическим стрессом [26–30]. Гистамин также является основным компонентом “воспалительного супа” (inflammatory soup), обычно применяемого вместе с серотонином, брадикинином и простагландином Е2 для активации воспалительных реакций и сенситизации нервных окончаний в твердой мозговой оболочке [31, 32].
Предполагается, что как серотонин, так и гистамин, способствуют развитию мигрени [4, 13, 14, 33]. Действительно, наши детальные исследования роли серотонина показали выраженное про-ноцицептивное действие этого соединения в менингеальных оболочках, но действие гистамина оставалось малоизученным [4, 6].
Результаты данного исследования с использованием широкого диапазона концентраций гистамина в контроле и после сенситизации, и разных интервалов действия этого соединения показали, что только небольшая доля менингеальных нервных волокон реагирует на гистамин. Более того, даже в реагирующих волокнах интенсивность эффекта гистамина очень низкая, особенно по сравнению с другим медиатором тучных клеток, серотонином. Это может объясняться отсутствием ионотропных рецепторов для гистамина, тогда как мощный возбуждающий эффект серотонина на нервные терминали в менингеальных оболочках реализуется, главным образом, через ионотропные 5-HТ3-рецепторы [4, 6].
Следует отметить, что, в отличие от неопределенной роли гистамина при мигрени, хорошо известным фактом является то, что гистамин – это один из основных стимуляторов зуда [7, 34]. Этот эффект основан на его взаимодействии, через Н1-рецепторы, с TRPV1-рецепторами экспрессированными в нервных волокнах в коже [10, 18, 35]. Хотя TRPV1-рецепторы широко представлены в нервных окончаниях в мозговых оболочках [2], результаты данного исследования позволяют предположить, что сопряжение между метабототропными рецепторами гистамина и TRPV1, являются малоэффективными в менингеальных оболочках. Можно думать, что одной из эволюционных причин этого, может быть недоступность тканей твердой мозговой оболочки для чесания, которое является эффективным способом уменьшения зуда кожи [36]. Кроме того, некоторые данные указывают на то, что дегрануляция тучных клеток, вызываемая нейропептидами, высвобождаемыми из афферентных окончаний, ингибируется гистамином через Н3-рецепторы. Это может служить тормозным механизмом для активации терминалей не только гистамином, но и серотонином, который также содержится в гранулах тучных клеток. Существование таких обратных контуров регуляции указывает на сложные взаимодействия между ключевыми клеточными элементами и сигнальными системами в менингеальных оболочках, в результате которых формируется болевой сигнал при мигрени.
В заключение, наше исследование не отрицает потенциальной роли гистамина при мигрени, но предполагает, что нервные окончания не являются эффективной мишенью для прямого действия гистамина. Возможно, что гистамин действует на сосуды, экспрессирующие несколько подтипов гистаминовых рецепторов [37–39], либо способствует нейровоспалению [13], или, как указано выше, регулирует функцию тучных клеток [14]. Это соответствует представлению об участии в патогенезе мигрени не только нервов, но также менингеальных сосудов и тучных клеток, поддерживающих воспалительные и ноцицептивные процессы, лежащих в основе длительной боли при мигрени.
Список литературы
Moskowitz M.A. The neurobiology of vascular head pain. Ann. Neurol. 16: 157–168. 1984.
Zakharov A., Vitale C., Kilinc E., Koroleva K., Fayuk D., Shelukhina I., Naumenko N., Skorinkin A., Khazipov R., Giniatullin R. Hunting for origins of migraine pain: Cluster analysis of spontaneous and capsaicin-induced firing in meningeal trigeminal nerve fibers. Front. Cell. Neurosci. 9: 287. 2015.
Levy D., Burstein R., Kainz V., Jakubowski M., Strassman A.M. Mast cell degranulation activates a pain pathway underlying migraine headache. Pain. 130: 166–176. 2007.
Kilinc E., Guerrero-Toro C., Zakharov A., Vitale C., Gubert-Olive M. Serotonergic mechanisms of trigeminal meningeal nociception: Implications for migraine pain. Neuropharmacology. 116: 160–173. 2017.
Nurkhametova D., Kudryavtsev I., Guselnikova V., Serebryakova M., Giniatullina R., Wojciechowski S., Tore F., Rizvanov A., Koistinaho J., Malm T., Giniatullin R. Activation of P2X7 receptors in peritoneal and meningeal mast cells detected by uptake of organic dyes: Possible purinergic triggers of neuroinflammation in meninges. Front. Cell. Neurosci. 13: 45. 2019.
Koroleva K., Gafurov O., Guselnikova V., Nurkhametova D., Giniatullina R., Sitdikova G., Mattila O.S., Lindsberg P.J., Malm T.M., Giniatullin R. Meningeal mast cells contribute to ATP-Induced nociceptive firing in trigeminal nerve terminals: Direct and indirect purinergic mechanisms triggering migraine pain. Front. Cell. Neurosci. 13: 195. 2019.
Gupta K., Harvima I.T. Mast cell-neural interactions contribute to pain and itch. Immunol. Rev. 282: 168–187. 2018.
Moon T.C., Befus A.D., Kulka M. Mast cell mediators: Their differential release and the secretory pathways involved trigeminal nerve terminals: Direct and indirect purinergic mechanisms triggering migraine pain. Front. Immunol. 5: 569. 2014.
Thurmond R.L., Kazerouni K., Chaplan S.R., Greenspan A.J. Peripheral neuronal mechanism of itch: Histamine and itch. In: Carstens E., Akiyama T. (Eds.) Itch: mechanisms and treatment. Boca Raton. CRC Press. 2014.
Shim W.S., Oh U. Histamine-induced itch and its relationship with pain. Mol. Pain. 4: 29. 2008.
Alstadhaug K.B. Histamine in migraine and brain. Headache J. Head Face Pain 54: 246–259. 2014.
Won-Sik Shim and Uhtaek Oh. Histamine-induced itch and its relationship with pain Mol. Pain. 2008.
Yuan H., Silberstein S.D. Histamine and Migraine. Headache. 58: 184–193. 2018.
Worm J., Falkenberg K., Olesen J. Histamine and migraine revisited: Mechanisms and possible drug targets. J. Headache Pain. 20: 30. 2019.
Rozniecki J.J., Letourneau R., Sugiultzoglu M., Spanos C., Gorbach J., Theoharides T.C. Differential effect of histamine 3 receptor-active agents on brain, but not peritoneal, Mast Cell Activation. J. Pharmacol. Exp. Ther. 290: 1427–1435. 1999
Shatillo A., Koroleva K., Giniatullina R., Naumenko N., Slastnikova A.A., Aliev R.R., Bart G., Atalay M., Gu C., Khazipov R., Davletov B., Grohn O., Giniatullin R. Cortical spreading depression induces oxidative stress in the trigeminal nociceptive system. Neuroscience. 253: 341–349. 2013.
Kadir S., Goodman D., Harris K. High-dimensional cluster analysis with the Masked EM Algorithm. Neural. Comput. 26(11): 2379–2394. 2013
Schmelz M., Schmidt R., Weidner C., Hilliges M., Torebjork H.E., Handwerker H.O. Chemical response pattern of different classes of C-nociceptors to pruritogens and algogens. J. Neurophysiol. 89: 2441–2448. 2003.
Olesen J., Burstein R., Ashina M., Tfelt-Hansen P. Origin of pain in migraine: Evidence for peripheral sensitisation. Lancet Neurol. 8: 679–690. 2009.
Burgos-Vega C., Moy J., Dussor G. Meningeal afferent signaling and the pathophysiology of migraine. Prog. Mol. Biol. Transl. Sci. 131: 537–564. 2015.
Kilinc E., Dagistan Y., Kukner A., Yilmaz B., Agus S., Soyler G., Tore F. Salmon calcitonin ameliorates migraine pain through modulation of CGRP release and dural mast cell degranulation in rats. Clin. Exp. Pharmacol. Physiol. 45: 536–546. 2018.
Margolis K.G., Gershon M.D., Bogunovic M. Cellular Organization of Neuroimmune interactions in the gastrointestinal tract. Trends Immunol. 37: 487–501. 2016.
Suzuki A., Suzuki R., Furuno T., Teshima R., Nakanishi M. N-cadherin plays a role in the synapse-like structures between mast cells and neurites. Biol. Pharm. Bull. 27: 1891–1894. 2004.
Schemann M., Camilleri M. Functions and imaging of mast cell and neural axis of the gut. Gastroenterology. 144: 698–704.e4. 2013.
Wernersson S., Pejler G. Mast cell secretory granules: Armed for battle. Nat. Rev. Immunol. 14: 478–494. 2014.
Galli S.J., Tsai M. IgE and mast cells in allergic disease Nat. Med. 18: 693–704. 2012.
Căruntu C., Boda D., Musat S., Căruntu A., Mandache E. Stress-induced mast cell activation in glabrous and hairy skin. Mediators Inflamm. 2014: 105950. 2014.
Shelukhina I., Mikhailov N., Abushik P., Nurullin L., Nikolsky E.E., Giniatullin R. Cholinergic nociceptive mechanisms in rat meninges and trigeminal ganglia: Potential implications for migraine pain. Front. Neurol. 8: 163. 2017.
Ayyadurai S., Gibson A.J., D’Costa S., Overman E.L., Sommerville L.J., Poopal A.C., Mackey E., Li Y., Moeser A.J. Frontline Science: Corticotropin-releasing factor receptor subtype 1 is a critical modulator of mast cell degranulation and stress-induced pathophysiology. J. Leukoc. Biol. 102: 1299–1312. 2017.
Redegeld F.A., Yu Y., Kumari S., Charles N., Blank U. Non-IgE mediated mast cell activation. Immunol. Rev. 282: 87–113. 2018.
Katz E.J., Gold M.S. Inflammatory hyperalgesia: A role for the C-fiber sensory neuron cell body? J. Pain. 7: 170–178. 2006.
Becerra L., Bishop J., Barmettler G., Kainz V., Burstein R., Borsook D. Brain network alterations in the inflammatory soup animal model of migraine. Brain Res. 1660: 36–46. 2017.
Deen M., Christensen C.E., Hougaard A., Hansen H.D., Knudsen G.M., Ashina M. Serotonergic mechanisms in the migraine brain – a systematic review. Cephalalgia. 37: 251–264. 2017.
Charlesworth E.N., Beltrani V.S. Pruritic dermatoses: Overview of etiology and therapy. Am. J. Med. 113: 25S–33S. 2002.
Yang N.N., Shi H., Yu G., Wang C.M., Zhu C., Yang Y., Yuan X.L., Tang M., Wang Z.L., Gegen T., He Q., Tang K., Lan L., Wu G.Y., Tang Z.X. Osthole inhibits histamine-dependent itch via modulating TRPV1 activity. Sci. Rep. 6: 25657. 2016.
Holle H., Warne K., Seth A.K., Critchley H.D., Ward J. Neural basis of contagious itch and why some people are more prone to it. Proc. Natl. Acad. Sci. USA. 109: 19816–19821. 2012.
Marshall I. Characterization and distribution of histamine H1- and H2-receptors in precapillary vessels. J. Cardiovasc. Pharmacol. 6: S587–97. 1984.
Malinowska B., Godlewski G., Schlicker E. Histamine H3 receptors – general characterization and their function in the cardiovascular system. J. Physiol. Pharmacol. 49: 191–211. 1998.
Kyriakidis K., Zampeli E., Palaiologou M., Tiniakos D., Tiligada E. Histamine H3 and H4 receptor ligands modify vascular histamine levels in normal and arthritic large blood vessels in vivo. Inflammation. 38: 949–958. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


