Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 10, стр. 1283-1293
Температура модулирует инотропный эффект бета2-адренорецепторов через изменение продукции NO в изолированных левых предсердиях мыши
Ю. Г. Одношивкина 1, С. И. Гайфутдинов 1, А. Л. Зефиров 1, 2, А. М. Петров 2, 3, *
1 Казанский государственный медицинский университет
Казань, Россия
2 Институт нейронаук, Казанский государственный медицинский университет
Казань, Россия
3 Казанский институт биохимии и биофизики КазНЦ РАН
Казань, Россия
* E-mail: fysio@rambler.ru
Поступила в редакцию 28.06.2019
После доработки 23.07.2019
Принята к публикации 25.07.2019
Аннотация
Бета-адренорецепторы (АР) обеспечивают увеличение сократимости и частоты сердечных сокращений в ответ на активацию симпатоадреналовой системы. Бета1 и 2-АР – основные подтипы в кардиомиоцитах. В представленной работе, используя регистрацию сокращений и оптическую детекцию внутриклеточных уровней кальция и оксида азота (NO), исследовали эффекты активации бета2-АР изолированных левых предсерий мыши при двух температурных режимах (25 и 35°С). Показано, что увеличение температуры с 25 до 35°С подавляет положительный инотропный эффект стимуляции бета2-АР, что сопровождается снижением амплитуды кальциевого транзиента и увеличением продукции NO. Фармакологическое блокирование синтеза NO в этих условиях ведет к восстановлению эффектов активации бета2-АР на сократимость и кальциевый транзиент. Эксперименты с гидроксихолестерином, который способен вмешиваться в сопряжение активации бета2-АР с продукцией NO, также подтвердили чувствительность этой связи к температуре. Мы предполагаем, что температура играет роль в формировании сопряжения между бета2-АР и NO-зависимой сигнализацией, что может быть важно для адаптации работы сердца.
Бета-адренорецепторы (АР) – одни из основных регуляторов сердечной деятельности. Выделяют три подтипа АР, среди которых бета1 и бета2 доминируют в сердце, обеспечивая усиление сокращений и ускорение ритма сердца в ответ на активацию симпатоадреналовой системы во время стресса или активации регуляторных контуров, направленных на поддержание адекватного артериального давления и кровотока. Бета1-АР, составляющие около 70% от всех бета-АР сердца, сопряжены с сигнальным путем Gs-белок/аденилатциклаза/цАМФ/протеинкиназа А. Этот путь обеспечивает увеличение систолического внутриклеточного Са2+ (Са2+-транзиента) и частоты генерации потенциалов действия пейсмекерными кардиомиоцитами. В итоге стимуляция бета1-АР сердца вызывает позитивные инотропный и хронотропный эффекты [1, 2]. Бета2-АР в сердце составляют 20–30% от общего количества бета-АР и могут активировать как Gs-белок, так и Gi-белок. Последний ограничивает активацию аденилатциклазы и может запускать сигнализацию, связанную с бета-аррестином, Akt/NO-синтазой, участвующую в снижении стимулирующих эффектов бета-АР [3–5].
Температура, как неспецифический фактор, влияет на все аспекты клеточных процессов. Для теплокровных ускорение биологических/ферментативных реакций наблюдается при смещении температуры от комнатной в сторону физиологической. Однако температура может играть более специфичную роль, контролируя рецепторные процессы и внутриклеточную сигнализацию. Бета2-АР имеют возможность запускать разные сигнальные каскады и распределены в обогащенных холестерином микродоменах, кавеолярных липидных рафтах [6, 7]. Структура липидных рафтов и их формирование зависит от температуры и липидной композиции, в частности, содержания холестерина [8–10]. В свою очередь, конформация бета2-АР и сигнализация через них зависит от температуры, липидных рафтов и холестерина [5, 11–14]. Принимая это во внимание, предствляется интересным оценить влияние смещения температуры на эффекты активации бета2-АР в сердце. В качестве объекта исследования были выбраны предсердия. Несмотря на то, что предсердия играют вспомогательную роль в увеличении ударного объема в ответ на адренергическую стимуляцию, было показано, что именно в предсердных кардиомиоцитах содержится больше всего бета2-АР и липидных рафтов [2, 15, 16].
Многие эксперименты на кардиомиоцитах и изолированных препаратах сердца проводятся при комнатной температуре (22–25°С), что позволяет увеличить жизнеспособность препарата, но далеко от физиологического диапазона (36–38°С). В представленной работе мы решили сравнить результаты экспериментов, проведенных при близкой к комнатной температуре (25°С) и на 10°С выше (35°С). Было обнаружено, что повышение температуры усиливает зависимое от бета2-АР увеличение продукции NO, что может ограничивать амплитуду кальциевого транзиента и увеличение амлитуды сокращений предсердий. Кроме того, эффект гидроксихолестерина на бета2-адренергическую регуляцию синтеза NO также зависит от температуры. Эти результаты указывают, что NO-синтаза может выступать важным элементом системы, адаптирующей работу сердца к изменению температуры и, следовательно, метаболическим потребностям.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводились на изолированных препаратах левых предсердий белых нелинейных мышей, преимущественно на самцах массой тела 22–25 г. Мыши имели свободный доступ к еде и воде в течение всего дня. Эвтаназию осуществляли путем транскраниальной дислокации, грудную клетку немедленно вскрывали и быстро изолировали предсердия. Протокол эксперимента был одобрен комитетом по биоэтике Казанского государственного медицинского университета.
Растворы и реагенты. Использовали физиологический раствор для млекопитающих следующего состава (в мМ): NaCl 137; KCl 5; MgSO4 1; CaCl2 2; NaH2PO4 1.8; NaHCO3 13; D-глюкоза 11; раствор был насыщен карбогеном (95% O2, 5% CO2). рН поддерживался на уровне 7.4. Изолированные предсердия постоянно перфузировали физиологических раствором и на протяжении всего эксперимента поддерживалась постоянная температура за счет контроля температуры как перфузионной среды, так и термостатируемой ванночки, содержащей датчик температуры. Часть экспериментов была выполнена при 25°С, а другая часть (с использованием предсердий, полученных от разных животных) – при 35°С. Во время экспериментов предсердия стимулировали через платиновые электроды электрическими стимулами с напряжением на 10–15% выше порога стимуляции и продолжительностью 5 мс при частоте 1 Гц. Гидробромид фенотерола использовали в качестве агониста бета2-адренорецепторов и аппликация фенотерола длилась 3 мин. Концентрация фенотерола составляла 25 мкМ, что необходимо для того, чтобы вызвать быстрый положительный инотропный эффект с высокой амплитудой и повторяемостью [17–20]. Отдельное предсердие стимулировалось фенотеролом только один раз, чтобы избежать влияния десенситизации рецепторов при их повторной активации агонистом. Аппликация 5альфа-холестан-3-она (5Х3) (0.2 мкМ) продолжалась 15 мин, затем после 15-минутного промывания физиологическим раствором без 5Х3 в перфузионную среду добавлялся фенотерол. 5Х3 растворяли в диметилсульфоксиде (ДМСО), и конечная концентрация ДМСО в рабочем растворе не превышала 0.001%. [21]. При концентрации 0.001% ДМСО не изменял сокращения или флуоресценцию Fluo4 и DAF-FM и эффекты 25 мкМ фенотерола. L-NAME (100 мкМ, ингибитор NO-синтазы) добавляли к раствору за 30–40 мин до обработки фенотеролом, и L‑NAME оставалcя на протяжении всего эксперимента в перфузионной среде.
Регистрация сократимости предсердий. Изометрические сокращения левых предсердий регистрировали с использованием 4-х канальной установки Tissue Bath System (BIOPAC Systems, Inc). Один конец изолированного предсердия был привязан к фиксированному крючку, а другой конец был соединен с тензодатчиком с чувствительностью 0–25 г. Сигналы были записаны и обработаны с использованием оригинальной программы AcqKnowledge. Запись сокращений начиналась за 1 ч до добавления фенотерола и продолжалась в течение 30 мин после завершения аппликации агониста. Амплитуда сокращения первоначально определялась в граммах, а затем была представлена в процентах. Стимуляция подавалась через встроенные платиновые электроды с частотой 1 Гц [20, 21].
Флуоресцентная микроскопия. Флуоресцентные изображения получали с помощью микроскопа Olympus BX51WI с конфокальной насадкой Disk Speed Unit и объективами LMPlanFl 20x и UPLANSapo 60хw. Изображения были получены с помощью ПЗС-камер (DP71 Olympus и Orca R2 Hamamatsu). Анализ изображений проводился с использованием программного обеспечения Cell^P (Olympus) и ImagePro (Medi-a Cybernetics, США). Анализ интенсивности проводился в регионе интереса и определялись относительные единицы (о. е.) свечения, которые затем переводились в проценты.
Для детекции Са2+-транзиента использовали краситель Fluo-4AM (ThermoFisher). Предсердия инкубировали с 1 мкМ Fluo4-AM в течение 20 мин, затем 40 мин перфузировали физиологическим растором, не содержащим краситель. В ходе циклов сокращение–расслабление препарата наблюдались периодические изменения свечения Са2+-сенсора в виде вспышек (“Са2+-транзиент”), отражающие повышение цитозольной концентрации Са2+ во время систолы. Чтобы оценить амплитуду пика Ca2+-транзиента, минимальное значение флуоресценции, наблюдаемое во время диастолы, вычитали из максимального значения флуоресценции, наблюдаемого во время систолы. Значение амплитуды Ca2+-транзиента до добавления фенотерола принималось за 100%. Флуоресценцию регистрировали с помощью объектива ×20/0.40 и камеры Orca R2 (Hamamatsu) с частотой дискретизации 115 Гц [20, 21].
Детекция продукции NO и его производных осуществлялась с помощью мембран-проникающего маркера DAF-FM диацетата (ThermoFisher), который возбуждали при 488 ± 10 нм; для регистрации флуоресцентного сигнала использовался эмиссионный фильтр длиной 515 нм. Предсердия сначала инкубировались с 2 мкМ DAF-FM диацетата в течение 30 мин, затем перфузировались физиологическим раствором без красителя на протяжении 20 мин [17–20]. Этого времени было достаточно для деацетилирования проникшего внутрь клеток маркера [22]. DAF-FM практически не флуоресцирует до вступления в реакцию с NO и его производными (в частности, ${\text{NO}}_{2}^{ - }$), но при взаимодействии с NO и его производными флуоресценция значительно возрастает [22–24].
Статистический анализ проводили с использованием программного обеспечения Origin Pro 9.2. Данные приведены как среднее значение ± стандартная ошибка среднего, а n – количество независимых экспериментов на предсердиях, изолированных из разных животных. Статистическая значимость различий между средними значениями в группе оценивалась с помощью t-критерия Стьюдента или теста Манна–Уитни. Значения р < 0.05 считались достоверными.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Зависимость эффекта стимуляции бета2-адренорецепторов от температуры
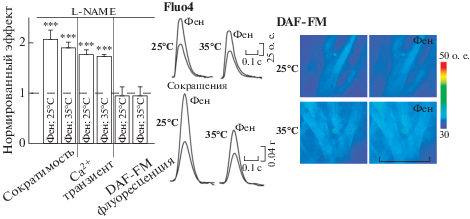
Сократимость. Агонист бета2-АР фенотерол (25 мкМ) увеличивал силу сокращения предсердий (при 25°С; рис. 1A). Эффект фенотерола предотвращался селективным антагонистом бета2-АР, 0.1 мкМ ICI118.511, тогда как полностью сохранялся на фоне ингибирования бета1- и бета3-АР с помощью 0.3 мкМ CGP20712 и 0.3 мкМ SR59230A соответственно (рис. 1А). Увеличение температуры до 35°С вызывало ослабление положительного инотропного эффекта фенотерола. Следовательно, увеличение температуры снижает стимулирующий эффект активации бета2-АР фенотеролом. Это согласуется с чувствительностью конформации бета2-АР к температуре в диапазоне от 20 до 40°С [25] и с данными о том, что гипотермия может влиять на чувствительность сердца к стимуляции бета-АР [26–28]. Механизм изменения ответа на фармакологическую стимуляцию бета2-АР при разных температурах может быть связан с изменениями внутриклеточной сигнализации.
Рис. 1.
Влияние температуры на эффекты фармакологической стимуляции бета2-АР. А. Сократимость предсердий. Показано изменение амлитуды сокращений предсердий в ответ на 3-мин аппликацию фенотерола (25 мкМ) в контроле, в присутствии селективных антагонистов бета2-АР (0.1 мкМ ICI118.511), бета3-АР (0.3 мкМ SR59230A), бета1-АР (0.3 мкМ CGP20712) при 25°С и в контроле при 35°С. Справа, оригинальные сократительные ответы до и после добавления фенотерола при 25 и 35°С. Б. Са2+ транзиент. В. Флуоресценция DAF-FM. Изменение амплитуды Са2+-транзиента (Б) и флуоресценции DAF-FM (В) в ответ на фенотерол (25 мкМ) в контроле и на фоне действия бета2-антагониста (0.1 мкМ ICI118.511) при 25°С и в контроле при 35°С. Б. С, справа, репрезентативные кривые Са2+-транзиента и микрофотографии флуоресценции DAF-FM (в псевдоцвете, шкала – 50 мкм) до и после добавления фенотерола при 25 и 35°С. А, Б, В – ось ординат показывает изменение в % относительно значения до добавления фенотерола. Предэкспозиция с ингибиторами бета1, 2, 3-АР – 20 мин до добавления фенотерола, ингибиторы присутствовали при аппликации фенотерола. n = 12–15 для каждой группы. Достоверность различий между значениями до и после добавления фенотерола (фен) *** р < 0.001, ** р < 0.01 (тест Стьюдента). Достоверность различий между эффектом фенотерола (при 25°С) в контроле и других условиях &&р < 0.01 (тест Манна–Уитни).

Сa2+-транзиент. Увеличение содержания цитозольного кальция запускает сокращение кардиомиоцитов (рис. 1Б). Величина Сa2+-транзиента определяет в значительной степени амплитуду сокращений. Фенотерол повышает амплитуду кальциевого транзиента, что блокируется антагонистом бета2-АР. Повышение температуры выраженно снижает стимулирующий эффект фенотерола на Сa2+-транзиент. Таким образом, при увеличении температуры ослабление инотропного действия активации бета2-АР может быть связано со снижением Сa2+-транзиента. Теоретически это может быть вызвано изменением активности кальциевых каналов L-типа и рианодиновых рецепторов, формирующих Са2+-транзиент [29]. Однако Ca2+-транзиент в кардиомиоцитах крысы относительно нечувствителен к изменению температуры в диапазоне 25–35°С [30]. Другой вариант: изменение продукции NO непосредственно или через путь гуанилатциклаза/цГМФ/протеин-киназа G может влиять на активность Сa2+-каналов кардиомиоцитов [31].
Продукция NO. Фенотерол может модулировать сократимость, влияя на продукцию NO, что связано с сопряжением бета2-АР с путем Gi-белок/Akt/NO-синтаза [5, 21]. При этом эффект фенотерола зависит от концентрации; в низких концентрациях 1–5 мкМ вызывает небольшое увеличение продукции NO, тогда как в высокой концентрации (25–50 мкМ) значительно не влияет на синтез NO [17, 20, 21]. Согласуясь с этими данными, аппликация 25 мкМ фенотерола не изменяла флуоресценцию DAF-FM (рис. 1В), широко используемого маркера, реагирующего на внутриклеточные уровни NO и его производных и позволяющего качественно оценить изменение продукции NO [22–24]. Однако в условиях повышенной температуры фенотерол увеличивал синтез NO. Увеличение уроня NO в предсердиях способно подавлять положительный инотропный эффект активации бета2-АР, снижая как Са2+-транзиент, так и чувствительность тропонинового комплекса к цитозольному Са2+ [5, 17, 20, 21, 32]. Возможно, усиление сопряжения бета2-АР с NO-сигнальным путем при повышении температуры отвечает за снижение амплитуды Са2+-транзиента и, следовательно, сократимости кардиомиоцитов. Для тестирования этой возможности мы применили ингибитор NO-синтазы, L-NAME, часто используемый для этих целей в исследованиях in vivo и in vitro.
Ингибитор синтеза NO имитирует эффект температуры 35°С. Прединкубация с L-NAME (0.1 мкМ) в течение 30 мин подавляет увеличение флуоресценции NO в ответ на фенотерол при температуре 35°С (рис. 2). В этих условиях увеличение температуры с 25 до 35°С теряло способность значительно ослаблять сократимость и амплитуду Са2+-транзиента (рис. 2). Вероятно, возрастание температуры с 25 до 35°С способно усиливать бета2-АР-зависимое увеличение синтеза NO, что подавляет увеличение Са2+-транзиента и сократимости. Маловероятно, что эффект температуры связан с влиянием температуры на каталитическую активность NO-синтазы, поскольку активность эндотелиальной NO-синтазы не зависит от температуры при физиологических уровнях субстрата [33]. Активность NO-синтаз зависит от ферментативных реакций фосфорилирования и дефосфорилирования [34, 35], которые ускоряются при увеличении температуры; однако баланс между этими процессами должен оставаться неизменным. Возможно, повышение температуры, действуя на мембранные свойства, влияет на сопряжение бета2-АР с сигнальными путем Gi-протеин/Akt/NO-синтаза. Частичное удаление мембранного холестерина с помощью метил-бета-циклодекстрина способно также ослаблять позитивный инотропный эффект активации бета2-АР через стимуляцию пути бета2-АР/Gi-белок/Akt/NO-синтаза [5].
Рис. 2.
Влияние температуры на эффекты активации бета2-АР в условиях блокирования синтеза NO. Показаны нормированные эффекты фенотерола (25 мкМ) на амплитуду сокращений и Са2+-транзиента, а также флуоресценцию DAF-FM в предсердиях прединкубированных с L-NAME (100 мкМ) в течение 30 мин. Значение до добавления фенотерола принято за 1. n = 12–14 для каждой группы. Достоверность различий между значениями до и после добавления фенотерола (фен) *** р < 0.001 (тест Стьюдента). Достоверных различий между эффектом фенотерола при 25 и 35°С не было обнаружено (тест Манна–Уитни). Справа, оригинальные кривые сокращений и Са2+-транзиента, а также изображения флуоресценции DAF-FM (в псевдоцвете, шкала – 50 мкм), иллюстрирующие изменения до и после добавления фенотерола при 25°С и 35°С.
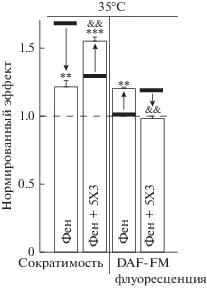
Зависимость депрессантного эффекта гидроксихолестерина от температуры. Для проверки гипотезы о том, что температура модулирует эффекты стимуляции бета2-АР через изменение взаимодействия с мембранными липидами, в частности, с холестерином, мы провели эксперименты с 5альфа-холестан-3-оном (0.2 мкМ), который способен усиливать вызванную активацией бета2-АР продукцию NO через путь Gi-белок/Akt. В итоге прединкубация с данным гидроксистерином ослабялет позитивный инотропный эффект фенотерола, несмотря на повышенный Са2+-транзиент [21]. Однако при повышении температуры до 35°С предэкспозиция с гидроксихолестерином усиливала положительный инотропный ответ на активацию бета2-АР, что сопровождалось блокированием усиления синтеза NO (рис. 3). В этом случае повышение температуры ослабляет сопряжение бета2-АР с системой, обеспечивающей синтез NO. Гипотетически эффект температуры зависит от связывания бета2-АР с холестерином и его производными. В условиях, когда эндогенный холестерин связан с бета2-АР, температура 35°С (по сравнению с 25°С) усиливает сопряжение с синтезом NO, но, когда окисленная форма холестерина связана с бета2-АР, то это инвертирует эффект температуры 35°С. Недавно нами было показано, что 24-гидроксихолестерин, уровень которого в плазме отражает метаболизм холестерина в мозге, может усиливать сопряжение бета-АР с продукцией NO, таким путем модулируя сократимость кардиомиоцитов [32]. Может ли температура влиять на этот эффект 24-гидроксихолестерина предстоит выяснить. Более того, 24-гидроксихолестрин способен модулировать синтез NO в скелетных мышечных волокнах при активации двигательного нерва, что зависит от целостности липидных рафтов [36, 37]. Все это указывает на тесную связь продукции NO в мышечных клетках и свойств мембран, которые могут модулироваться холестерин-зависимыми путями.
Рис. 3.
Влияние 5альфа-холестан-3-она (5Х3) на сократимость и продукцию NO при 25 и 35°С. Показаны нормированные эффекты фенотерола на амплитуду сокращений и флуоресценцию DAF-FM в предсердиях прединкубированных с 5X3 (0.2 мкМ) в течение 15 мин. Значение до добавления фенотерола принято за 1. n = 11–13 для каждой группы. Достоверность различий между значениями до и после добавления фенотерола (фен) *** р < 0.001, ** р < 0.01 (тест Стьюдента). Достовреность различий между эффектом фенотерола (при 25°С и после предикубации с 5Х3) в контроле и других условиях &&р < 0.01 (тест Манна–Уитни). Эффект фенотерола на амплитуду сокращений и флуоресценцию DAF-FM в контрольных условиях (без прединкубации с 5Х3) при 25 и 35°С показан черным прямоугольником (из рис. 1А и В). Стрелки иллюстрируют влияние 5Х3: потенцирующее (острие вверх) или угнетающее (острие вниз).
Температура имеет фундаментальное значение в определении скорости биологических реакций, но, более того, может влиять на формирование взаимодействия между сигнальными путями, в конечном итоге, определяющими эффект активации рецепторов. В представленном исследовании впервые показано, что изменение температуры на 10°С способно модулировать эффекты активации бета2-АР предсердий, действуя на сопряжение бета2-АР с NO-зависимым сигнальным механизмом. Это может иметь значение при изменении работы сердца в условиях гипотермии. С другой стороны, повышение температуры ведет к усилению метаболизма и возможному дефициту АТФ, что тяжело скомпенсировать в условиях ex vivo (в изолированном препарате), в отсутствие кровотока. Поэтому проведение экспериментов при близкой к физиологической температуре может запускать в клетках NO-зависимый адаптивный ответ для приспособления к энергетическому дефициту. In vivo усиленная продукция NO способна расширять расположенные рядом сосуды в условиях гипоксии [38]. Транслировать влияние температуры на сигнальные процессы могут мембранные липиды, в частности, холестерин, который взаимодействует со многими рецепторами и сигнальными молекулами [39–41]. Частичное удаление холестерина имеет схожий эффект при активации бета2-АР в предсердиях [5]. Возможно, повышение температуры, увеличивая подвижность холестерина в мембране, может влиять на конформацию бета2-АР и его взаимодействие с сигнальными молекулами. Согласуется с этим то, что более подвижные гидроксихолестерины (5Х3, 24-гидроксихолеcтерин) также могут потенцировать зависимую от бета-АР продукцию NO [21, 32]. Более того, повышение температуры способно блокировать подобный эффект 5Х3, возможно, за счет облегчения диффузии гидроксиформы холестерина из мембран.
Таким образом, температура может влиять на зависимый от бета2-АР сократительный ответ предсердий, что, по крайней мере, частично связано с изменением продукции NO, который способен влиять на величину Са2+-транзиента.
Список литературы
Xiang Y.K. Compartmentalization of beta-adrenergic signals in cardiomyocytes. Circ. Res. 10(2): 231–244. 2011. https://doi.org/10.1161/CIRCRESAHA.110.231340
Bhogal N.K., Hasan A., Gorelik J. The development of compartmentation of cAMP signaling in cardiomyocytes: The role of T-tubules and caveolae microdomains. J. Cardiovasc. Dev. Dis. 5(2): 25. 2018. https://doi.org/10.3390/jcdd5020025
Xiao R.P., Avdonin P., Zhou Y.Y., Cheng H., Akhter S.A., Eschenhagen T., Lefkowitz R.J., Koch W.J., Lakatta E.G. Coupling of beta2-adrenoceptor to Gi proteins and its physiological relevance in murine cardiac myocytes. Circ. Res. 84(1): 43–52. 1999. https://doi.org/10.1161/01.RES.84.1.43
Woo A.Y., Song Y., Xiao R.P., Zhu W. Biased β2-adrenoceptor signalling in heart failure: Pathophysiology and drug discovery. Br. J. Pharmacol. 172(23): 5444–5456. 2015. https://doi.org/10.1111/bph.12965
Odnoshivkina Y.G., Sytchev V.I., Petrov A.M. Cholesterol regulates contractility and inotropic response to β2-adrenoceptor agonist in the mouse atria: Involvement of Gi-protein-Akt-NO-pathway. J. Mol. Cell. Cardiol. 107: 27–40. 2017. https://doi.org/10.1016/j.yjmcc.2016.05.001
Rybin V.O., Pak E., Alcott S., Steinberg S.F. Developmental changes in beta2-adrenergic receptor signaling in ventricular myocytes: The role of Gi proteins and caveolae microdomains. Mol. Pharmacol. 63 (6): 1338–1348. 2003. https://doi.org/10.1124/mol.63.6.1338
Calaghan S., White E. Caveolae modulate excitation-contraction coupling and beta2-adrenergic signalling in adult rat ventricular myocytes. Cardiovasc. Res. 69(4): 816–824. 2006. https://doi.org/10.1016/j.cardiores.2005.10.006
Ayuyan A.G., Cohen F.S. Raft composition at physiological temperature and pH in the absence of detergents. Biophys. J. 94 (7): 2654–2666. 2008. https://doi.org/10.1529/biophysj.107.118596
Simons K., Sampaio J.L. Membrane organization and lipid rafts. Cold. Spring. Harb. Perspect. Biol. 3(10): a004697. 2011. https://doi.org/10.1101/cshperspect.a004697
Petrov A.M., Zefirov A.L. Cholesterol and lipid rafts in the biological membranes. Role in the release, reception and ion channel functions. Usp. Fiziol. Nauk. 44(1): 17–38. 2013.
Tsujikawa H., Song Y., Watanabe M., Masumiya H., Gupte S.A., Ochi R., Okada T. Cholesterol depletion modulates basal L-type Ca2+ current and abolishes its -adrenergic enhancement in ventricular myocytes. Am. J. Physiol. Heart Circ. Physiol. 294(1): 285–292. 2008. https://doi.org/10.1152/ajpheart.00824.2007
Macdougall D.A., Agarwal S.R., Stopford E.A., Chu H., Collins J.A., Longster A.L., Colyer J., Harvey R.D., Calaghan S. Caveolae compartmentalise β2-adrenoceptor signals by curtailing cAMP production and maintaining phosphatase activity in the sarcoplasmic reticulum of the adult ventricular myocyte. J. Mol. Cell. Cardiol. 52 (2): 388–400. 2012. https://doi.org/10.1016/j.yjmcc.2011.06.014
Manna M., Niemelä M., Tynkkynen J., Javanainen M., Kulig W., Müller D.J., Rog T., Vattulainen I. Mechanism of allosteric regulation of β2-adrenergic receptor by cholesterol. Elife. 29(5). 2016. https://doi.org/10.7554/eLife.18432.001
Genheden S., Essex J.W., Lee A.G. G protein coupled receptor interactions with cholesterol deep in the membrane. Biochim. Biophys. Acta Biomembr. 1859(2): 268–281. 2017. https://doi.org/10.1016/j.bbamem.2016.12.001
Buxton B.F., Jones C.R., Molenaar P., Summers R.J. Characterization and autoradiographic localization of beta-adrenoceptor subtypes in human cardiac tissues. Br. J. Pharmacol. 92(2): 299–310. 1987. https://doi.org/10.1111/j.1476-5381.1987.tb11324.x
Glukhov A.V., Balycheva M., Sanchez-Alonso J.L., Ilkan Z., Alvarez-Laviada A., Bhogal N., Diakonov I., Schobesberger S., Sikkel M.B., Bhargava A., Faggian G., Punjabi P.P., Houser S.R., Gorelik J. Direct evidence for microdomain-specific localization and remodeling of functional L-type calcium channels in rat and human atrial myocytes. Circulation. 132(25): 2372–2384. 2015. https://doi.org/10.1161/CIRCULATIONAHA.115.018131
Одношивкина Ю.Г., Петров А.М., Зефиров А.Л. Механизм опосредуемой β2-адренорецепторами медленно развивающейся положительной инотропной реакции предсердий мыши. Рос. физиол. журн. им. И.М. Сеченова. 97(11): 1223–1236. 2011. [Odnoshivkina U.G., Petrov A.M., Zefirov A.L. The mechanism mediated by β2-adrenergic receptors of a slowly developing positive inotropic reaction of the mouse atria. Russ. J. Physiol. 97(11): 1223–1236. 2011. (In Russ.)].
Odnoshivkina U.G., Petrov A.M., Zefirov A.L. Mechanisms of delayed inotropic response of mouse atria to activation of β2-adrenoreceptors. Dokl. Biol. Sci. 446 (6): 700–702. 2012.
Odnoshivkina Yu.G., Petrov A.M., Zefirov A.L. The effects of β2-adrenoreceptor activation on the contractility, Ca-signals and nitrix oxide production in the mouse atria. Acta Naturae. 3(2): 103–112. 2011.
Odnoshivkina U.G., Sytchev V.I., Nurullin L.F., Giniatullin A.R., Zefirov A.L., Petrov A.M. β2-adrenoceptor agonist-evoked reactive oxygen species generation in mouse atria: Implication in delayed inotropic effect. Eur J. Pharmacol. 765: 140–153. 2015. https://doi.org/10.1016/j.ejphar.2015.08.020
Sytchev V.I., Odnoshivkina Y.G., Ursan R.V., Petrov A.M. Oxysterol, 5α-cholestan-3-one, modulates a contractile response to β2-adrenoceptor stimulation in the mouse atria: Involvement of NO signaling. Life Sci. 188: 131–140. 2017. https://doi.org/10.1016/j.lfs.2017.09.006
Kojima H., Urano Y., Kikuchi K., Higuchi T., Hirata Y., Nagano T. Fluorescent Indicators for Imaging Nitric Oxide Production. Angew. Chem. Int. Ed. Engl. 38(21): 3209–3212. 1999. https://doi.org/10.1002/(SICI)1521-3773(19991102)38:21
Namin S.M., Nofallah S., Joshi M.S., Kavallieratos K., Tsoukias N.M. Kinetic analysis of DAF-FM activation by NO: Toward calibration of a NO-sensitive fluorescent dye. Nitric Oxide. 28: 39–46. 2013. https://doi.org/10.1016/j.niox.2012.10.001
St Laurent C.D., Moon T.C., Befus A.D. Measurement of nitric oxide in mast cells with the fluorescent indicator DAF-FM diacetate. Methods Mol. Biol. 1220: 339–345. 2015. https://doi.org/10.1007/978-1-4939-1568-2_21
Gao X., Yang L., Li Q., An Y., Liao S., Gao H., Zhao X., Bian L., Zheng X. Investigation on temperature-induce conformational change of immobilized β2 adrenergic receptor. Biochem. Biophys. Res. Commun. 494 (3–4): 634–640. 2017. https://doi.org/10.1016/j.bbrc.2017.08.105
Chess-Williams R.G., Broadley K.J., Duncan C. A fundamental temperature-dependent difference between beta-adrenoceptor agonists and antagonists. Life Sci. 35(10): 1091–1099. 1984. https://doi.org/10.1016/0024-3205(84)90074-2
Chess-Williams R.G., Broadley K.J. Temperature dependence of beta 1-adrenoceptor-mediated responses examined by use of partial agonists. Eur. J. Pharmacol. 108 (1): 25–32. 1985. https://doi.org/10.1016/0014-2999(85)90279-1
Nakae Y., Fujita S., Namiki A. Isoproterenol enhances myofilament Ca(2+) sensitivity during hypothermia in isolated guinea pig beating hearts. Anesth. Analg. 93 (4): 846–852. 2001.
Shiels H.A., Vornanen M., Farrell A.P. Effects of temperature on intracellular Ca2+ in trout atrial myocytes. J. Exp. Biol. 205 (23): 3641–3650. 2002.
Fu Y., Zhang G.Q., Hao X.M., Wu C.H., Chai Z., Wang S.Q. Temperature dependence and thermodynamic properties of Ca2+ sparks in rat cardiomyocytes. Biophys. J. 89(4): 2533–2541. 2005. https://doi.org/10.1529/biophysj.105.067074
Sears C.E., Ashley E.A., Casadei B. Nitric oxide control of cardiac function: Is neuronal nitric oxide synthase a key component? Philos. Trans. R. Soc. Lond. B. Biol. Sci. 359(1446): 1021–1044. 2004. https://doi.org/10.1098/rstb.2004.1477
Odnoshivkina U.G., Sytchev V.I., Starostin O., Petrov A.M. Brain cholesterol metabolite 24-hydroxycholesterol modulates inotropic responses to β-adrenoceptor stimulation: The role of NO and phosphodiesterase. Life Sci. 220: 117–126. 2019. https://doi.org/10.1016/j.lfs.2019.01.054
Venturini G., Colasanti M., Fioravanti E., Bianchini A., Ascenzi P. Direct effect of temperature on the catalytic activity of nitric oxide synthases types I, II, and III. Nitric Oxide. 3(5): 375–382. 1999. https://doi.org/10.1006/niox.1999.0250
Keeley T.P., Siow R.C.M., Jacob R., Mann G.E. A PP2A-mediated feedback mechanism controls Ca2+-dependent NO synthesis under physiological oxygen. FASEB J. 31(12): 5172–5183. 2017. https://doi.org/10.1096/fj.201700211R
Ghimire K., Altmann H.M., Straub A.C. Isenberg J.S. Nitric oxide: What’s new to NO? Am. J. Physiol. Cell. Physiol. 312(3): 254–262. 2017. doi . 2016.https://doi.org/10.1152/ajpcell.00315
Kasimov M.R., Fatkhrakhmanova M.R., Mukhutdinova K.A., Petrov A.M. 24S-Hydroxycholesterol enhances synaptic vesicle cycling in the mouse neuromuscular junction: Implication of glutamate NMDA receptors and nitric oxide. Neuropharmacology. 117: 61–73. 2017. https://doi.org/10.1016/j.neuropharm.2017.01.030
Mukhutdinova K.A., Kasimov M.R., Giniatullin A.R., Zakyrjanova G.F., Petrov A.M. 24S-hydroxycholesterol suppresses neuromuscular transmission in SOD1(G93A) mice: A possible role of NO and lipid rafts. Mol. Cell. Neurosci. 88: 308–318. 2018. https://doi.org/10.1016/j.mcn.2018.03.006
Umbrello M., Dyson A., Feelisch M., Singer M. The key role of nitric oxide in hypoxia: Hypoxic vasodilation and energy supply-demand matching. Antioxid Redox Signal. 19 (14): 1690–16710. 2013. https://doi.org/10.1089/ars.2012.4979
Debetto P., Cusinato F., Luciani S. Temperature dependence of Na+/Ca2+ exchange activity in beef-heart sarcolemmal vesicles and proteoliposomes. Arch. Biochem. Biophys. 278 (1): 205–210. 1990.
Ortega A., Santiago-García J., Mas-Oliva J., Lepock J.R. Cholesterol increases the thermal stability of the Ca2+/Mg2+-ATPase of cardiac microsomes. Biochim. Biophys. Acta. 1283 (1): 45–50. 1996.
Haque M.Z., McIntosh V.J., Abou Samra A.B., Mohammad R.M., Lasley R.D. Cholesterol Depletion Alters Cardiomyocyte Subcellular Signaling and Increases Contractility. PLoS One. 11(7): e0154151. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


