Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 11, стр. 1373-1380
Трансгенные животные в экспериментальной фармакологии: фокус на рецепторах следовых аминов
Р. З. Муртазина 1, Р. Р. Гайнетдинов 1, *
1 Институт трансляционной биомедицины Санкт-Петербургского государственного
университета
Санкт-Петербург, Россия
* E-mail: gainetdinov.raul@gmail.com
Поступила в редакцию 31.08.2019
После доработки 04.09.2019
Принята к публикации 04.09.2019
Аннотация
Открытые двадцать лет назад рецепторы следовых аминов (Trace Amine-Associated Receptors; TAARs) позволили наметить новые пути лечения психоневрологических расстройств. Важным оказался тот факт, что через сравнительно короткий промежуток времени после открытия рецепторов была создана линия трансгенных животных с нокаутом гена рецептора TAAR1. Данные, полученные с помощью нокаутных животных, дали возможность понимания не только функции рецепторов, но и механизмов действия психотропных веществ, взаимодействий нейротрансмиттеров со следовыми аминами, механизмов патологии, в которых следовые амины играют не последнюю роль. В этом кратком обзоре будут рассмотрены функции рецепторов следовых аминов и роль трансгенных животных в их изучении.
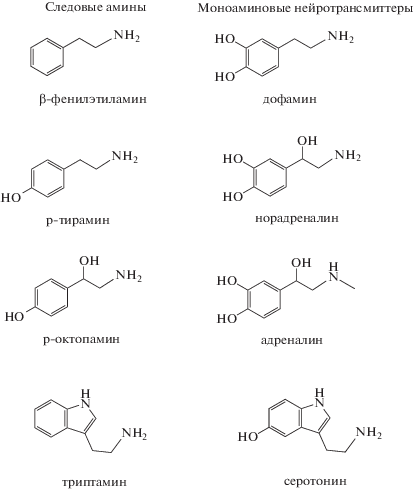
Следовые амины структурно сходны с классическими моноаминовыми нейротрансмиттерами, однако их концентрация в тканях мозга на порядок ниже, отсюда и их название [1]. Несмотря на то, что они известны более 100 лет, их функция и распределение в тканях изучены гораздо хуже, чем у дофамина, норадреналина и серотонина, хотя они, так же, как и эти нейротрансмиттеры, являются продуктами метаболизма аминокислот, и обнаруживаются, в основном, в тканях мозга [2, 3] (рис. 1). Более того, известно, что ферменты, отвечающие за синтез, и сама скорость синтеза следовых аминов и классических нейротрансмиттеров примерно одинаковы, но причина их низкой концентрации в том, что они не накапливаются в синаптических везикулах, и быстро деградируют под воздействием ферментов моноаминооксидаз, которые также участвуют в катаболизме остальных моноаминов [1]. Помимо структурного сходства с нейротрансмиттерами, следовые амины имеют схожее строение с некоторыми наркотическими веществами, такими, как амфетамин, экстази и их производные. У человека наиболее распространенными следовыми аминами являются тирамин, триптамин, октопамин, β-фенилэтиламин [4–7]. Изменения в метаболизме следовых аминов оказывают влияние на принцип действия и эффективность лечения антидепрессантами и подобными лекарствами. Известно, что при некоторых заболеваниях, особенно нейропсихиатрического характера, уровень следовых аминов возрастает, что может свидетельствовать об их важной роли, которую еще предстоит расшифровать до конца. При этих болезнях изменения в метаболизме аминокислот и сигнальных путей нарушаются, моноамины не катаболизируются, как это происходит в норме, их концентрация возрастает [2, 3, 8]. Вопрос о физиологической роли следовых аминов оставался открытым до обнаружения рецепторов следовых аминов в 2001 г.
Рецепторы следовых аминов (trace amine-associated receptors, TAARs) – это большое семейство белков, принадлежащих к типу рецепторов, сопряженных с G-белком (GPCRs). Рецептор первого подтипа (TAAR1) был открыт двумя независимыми группами в 2001 г. с помощью метода ПЦР с использованием дегенеративных праймеров к известным на тот момент последовательностям серотониновых и дофаминовых рецепторов [2, 9]. При экспрессии в гетерологичных клеточных системах новый рецептор вызывал продукцию циклического аденозинмонофосфата (цАМФ, cAMP) после взаимодействия с p-тирамином, β-фенилэтиламином, тогда как классические биогенные амины (дофамин, норадреналин, серотонин) такого эффекта не оказывали или давали намного меньший ответ. У человека обнаружено 9 генов рецепторов следовых аминов (TAAR1–TAAR9), три из которых (TAAR3, TAA-R4, TAAR7) являются псевдогенами и не кодируют функциональный белок [10]. Наиболее изученным членом этого семейства на сегодняшний день является TAAR1.
Первые данные о функциональной роли рецептора TAAR1 в физиологических условиях были получены до появления селективных лигандов к нему благодаря трансгенным мышам с нокаутом гена TAAR1 (TAAR1-KO) (табл. 1). Многие известные эндогенные агонисты TAAR1 действуют и на другие мишени в ЦНС, например, на дофаминовый транспортер (DAT) или на везикулярный транспортер моноаминов 2 (VMAT2). В отсутствие селективного лиганда TAAR1, мышь с нокаутом этого гена представляла собой единственно возможный вариант исследования возможных физиологических последствий дисфункции TAAR1 и роли TAAR1 в действии фармакологических агентов [5]. В первой работе линия TAAR1-KO, созданная на основе двух линий C57Bl/6J × 129S1/Sv, не отличалась ярко выраженным фенотипом от дикого типа (wild type, WT), мутанты успешно размножались и не показали отличий от WT в большинстве поведенческих тестов. Тем не менее, было обнаружено, что у мышей линии TAAR1-KO наблюдается значительное снижение реакции в тесте преимпульсного ингибирования, которое указывает на нарушения в механизмах сенсомоторной фильтрации, что характерно для пациентов с шизофренией и рядом других заболеваний мозга. Более того, линия TAAR1-KO обладает повышенной чувствительностью к действию психостимулятора d-амфетамина, стимулирующего двигательную активность, а в ответ на введение d-амфетамина показывает значительное увеличение уровня внеклеточных моноаминов при использовании метода микродиализа in vivo [11]. Все те же самые наблюдения были сделаны на независимо созданной линии TAAR1-KO в работе группы из Hoffmann La-Roche [12]. Мутанты также были более чувствительны к действию амфетамина на двигательную активность, а уровень внеклеточного дофамина после введения амфетамина в стриатуме повышался сильнее. В нормальных условиях у нокаутов уровень влеклеточного дофамина и двигательная активность не отличались от дикого типа, однако, электрофизиологические записи вентральной области покрышки выявили увеличение числа спонтанных импульсов дофаминергических нейронов [12]. Далее было показано, что фармакологическая блокада TAAR1 вызывает увеличение активности дофаминергических нейронов у мышей дикого типа (но не у TAAR1-KO мышей), тогда как активация TAAR1 приводит к ингибированию их активности. Таким образом, TAAR1 выступает негативным модулятором моноаминовой передачи [11, 13]. Стоит отметить, что экспрессия TAAR1 была обнаружена в нескольких областях мозга, в том числе, в вентральной области покрышки, черной субстанции и дорзальных ядрах шва. Все перечисленные ядра являются ключевыми для моноаминовой передачи [3, 9, 14]. Данные по экспрессии TAAR1 в мозге были подтверждены на трансгенных мышах, у которых в ген TAAR1 была вставлена последовательность гена LacZ с целью определения специфической экспрессии β-галактозидазы с промотора TAAR1 [12]. Помимо этих изменений, у TAAR1-KO мышей были найдены отличия в эффекте некоторых антипсихотических лекарств, в частности, галоперидола и клозапина [15]. Также нокауты отличались в поведенческих тестах на предпочтение этанола: из двух бутылок нокаутные животные чаще выбирали этанол, седативный эффект этанола у них был выражен сильнее, двигательная активность после употребления этанола была снижена по сравнению с диким типом [16]. В экспериментах с использованием 3,4-метилендиокси-N-метамфетамин (MDMA или “экстази”) у животных дикого типа наблюдалась время- и дозозависимая гипотермия и гипертермия, тогда как у TAAR1-KO развивалась только гипертермия. MDMA также повышал уровень внеклеточного дофамина и серотонина в дорсальной части стриатума в большей степени у нокаутов, чем у дикого типа [14].
Таблица 1.
Характеристика линий трансгенных животных
| Линия | Вид | Характеристика | Источник |
|---|---|---|---|
| TAAR1-KO, TAAR1-KO со вставкой LacZ |
Мышь | Изменение поведения при действии амфетамина, снижение реакции в тесте преимпульсного ингибирования, увеличение числа спонтанных импульсов дофаминергических нейронов в вентральной области покрышки | [11, 12] |
| TAAR1-OE | Мышь | Поведение не изменено, после введения амфетамина снижена двигательная активность, увеличено число спонтанных импульсов дофаминергических нейронов в вентральной области покрышки | [20] |
| DAT/TAAR1-KO | Мышь | Увеличена спонтанная двигательная активность, амфетамин и β-фенилэтиламин, которые уменьшали активность DAT-KO, у двойного нокаута оказывали гораздо меньший эффект | [5] |
| TAAR2–TAAR9-KO | Мышь | Изменен порог обонятельной чувствительности к летучим аминам | [23] |
| TAAR5-KO | Мышь | Снижено влечение к триметиламину | [25] |
| TAAR1-KO | Крыса | Обнаружена связь между TAAR1 и рецептором дофамина D2R in vivo и открыт β-аррестин2/AKT/GSK3 каскад при активации TAAR1 |
[17] |
| TAAR1-OE | Крыса |
Помимо трансгенных мышей, были созданы нокаутная линия крыс TAAR1-KO и линия крыс TAAR1-OE с повышенной экспрессией. В этой работе была проанализирована связь между TAAR1 и рецептором дофамина D2R. В экспериментах по коиммунопреципитации были получены доказательства функционального взаимодействия между двумя рецепторами как в гетерологичных клеточных системах, так и в тканях мозга. Также в этой работе впервые было описано, что внутриклеточный сигнальный механизм TAAR1 может происходить по пути сигнального каскада β-аррестин2/AKT/GSK3 [17]. Так как TAAR1 относится к GPCR, классически рассматривался только один сигнальный путь, при котором после активации рецептор связывается с Gs-белком, и далее происходит накопление вторичного мессенджера цАМФ [2, 9, 18]. Таким образом, новый сигнальный путь TAAR1 представляет собой особенный интерес, но многие группы в последние несколько лет столкнулись с проблемой изучения фармакологии TAAR1 in vitro из-за сложностей с их экспрессией на клеточной мембране, по крайней мере, в гетерологичных клеточных системах. Вопрос, экспрессируется ли TAAR1 в естественных условиях, например, в нейроне, на поверхности клетки или же он находится на внутриклеточных мембранах, остается открытым. Многие группы модифицируют рецептор различными эпитопами для того, чтобы он экспрессировался на поверхность клетки [2, 18, 19]. Существуют также технические сложности определения расположения рецептора в клетке из-за недостаточной специфичности антител к TAAR. Все эти сложности существенно затрудняют оценку внутриклеточных биохимических механизмов, вызываемых активацией TAAR1.
В 2012 г. была также охарактеризована линия мышей с повышенной экспрессией TAAR1 (TAAR1-OE) [20]. Данная линия не отличалась по поведению и двигательной активности от дикого типа. Было замечено, что самки данной линии весили немного больше, и их температура слегка повышена. Как и ожидалось, после введения амфетамина у TAAR1-OE была снижена двигательная активность, хотя уровень внеклеточного дофамина и норадреналина в прилежащем ядре не изменялся. Неожиданными стали данные электрофизиологии – так же, как у TAAR1-KO, в линии TAAR1-OE наблюдалось увеличение числа спонтанных импульсов дофаминергических нейронов в вентральной области покрышки. Одно из объяснений данного факта заключается в сниженной активности популяции ГАМКергических нейронов, которые в норме должны ингибировать дофаминергические нейроны [20].
До получения селективных TAAR1 агонистов в исследованиях использовались эндогенные агонисты TAAR1, но они опосредованно через DAT и другие моноаминовые транспортеры действовали на моноаминовые (в частности, дофаминовую) системы, что затрудняло изучение функции рецептора. Например, самый изученный эндогенный агонист TAAR1, β-фенилэтиламин, так же, как и амфетамин, ингибировал дофамин-зависимую гиперактивность у животных с нокаутом гена DAT [21]. Поэтому была создана еще одна линия мышей с двойным нокаутом генов DAT и TAAR1 – DAT/TAAR1-KO мыши. Мутанты этой линий были жизнеспособны, но по спонтанной двигательной активности существенно превосходили DAT-KO мышей. Однако и амфетамин, и β-фенилэтиламин, которые уменьшали активность DAT-KO, у двойного нокаута оказывали гораздо меньший эффект. Эти данные показывают, что TAAR1 оказывает ингибирующее действие по отношению к дофамин-зависимой двигательной активности, и отсюда можно сделать вывод, что недостаток функции TAAR1 или его антагонизм может усиливать дофамин-зависимые поведение и функции, тогда как агонист TAAR1 будет ослаблять их [5]. На данный момент описано несколько специфичных агонистов TAAR1 и известно, что компанией Sunovion Pharmaceuticals (США) and F. Hoffmann La-Roche (Швейцария) проводятся клинические исследования агонистов TAAR1 для лечения больных шизофренией [22].
Что касается остальных пяти членов семейства TAAR, стоит отметить, что их экспрессия была обнаружена в обонятельном эпителии, и было показано, что они участвуют в распознавании запахов, регулирующих инстинктивное поведение (запах хищника, гниющих тканей, сексуально-значимых запахов) [10, 19]. Они были отнесены к новому классу обонятельных рецепторов, регулирующих инстинктивное поведение. В то время как большая часть исследований трансгенных животных была сконцентрирована на TAAR1-KO мышах, была также создана линия мышей с полностью выключенной, за исключением TAAR1, линейкой TAAR (TAAR2–TAAR9-KO мышей) [23]. Выключение сразу нескольких генов стало возможным ввиду кластеризации генов TAARs на одной хромосоме. Эта модель была использована для изучения значимости ряда запахов, распознающихся TAAR, и их влияние на поведение. Помимо изменений в обонянии, TAAR2–TAAR9-KO не показала значимых отличий по массе, двигательной активности от дикого типа [23]. В то же время было показано изменения сексуального поведения и выбора партнера нокаутных животных, что предполагает роль этих рецепторов в распознавании сексуально-значимых запахов [24]. Есть данные, что у TAAR5-KO мышей снижено влечение к триметиламину. Триметиламин присутствует в моче мышей, причем в высоких концентрациях вызывает аверсивное поведение, а в низких, которые соответствуют физиологической концентрации, действует как аттрактант [25]. В целом, роль этих TAAR в ЦНС остается неизученной, хотя существуют данные об их экспрессии в тканях мозга [1]. Например, при помощи метода гибридизации in situ мРНК TAAR5 была найдена в области миндалевидного тела, дугообразном ядре, вентромедиальном гипоталамусе мыши, причем локализация в гипоталамусе и миндалевидном теле совпадала с TAAR1 [26]. Методом RT-PCR была обнаружена экспрессия TAAR6 во фронтальной коре, черной субстанции, миндалевидном теле, базальных ядрах и гиппокампе человека, причем самая высокая экспрессия была в гиппокампе [9, 27]. мРНК TAAR8 была найдена в миндалевидном теле [9]. Поэтому для более точного определения функции этих рецепторов требуются развернутые работы по оценке поведения, электрофизиологии и нейрохимии у животных, нокаутных по рецепторам индивидуальных следовых аминов TAAR2–TAAR9. В связи с этим стоит отметить, что в лаборатории нейробиологии и молекулярной фармакологии ИТБМ СПбГУ на данный момент собрана коллекция линий трансгенных мышей и крыс с нокаутом каждого члена семейства TAAR, представленного у человека, и ведется активная работа по их изучению. На мышах линии TAAR5-KO со вставкой LacZ нами была показана экспрессия в миндалевидном теле, энторинальной коре и обонятельной луковице. Эти данные были подтверждены с помощью метода RT-PCR. Экспрессия TAAR5 была также найдена в миндалевидном теле у человека, что может говорить о консервативности экспрессии у мыши и человека. Нокауты по TAAR5 жизнеспособны и не показывают сильных отклонений в большинстве поведенческих тестов, однако, у них были изменения в тестах на депрессивно-подобное поведение и тревожность. У нокаута по TAAR5 был также изменен уровень серотонина и повышена активность серотонинового рецептора 5-HT1A, что было показано по гипотермии, вызванной его агонистом 8-OH-DPAT. Таким образом, TAAR5 играет функциональную роль не только в обонянии, но может быть вовлечен в контроль эмоционального поведения. У мышей линии TAAR2-KO были снижены показатели тревожности, а также повышен уровень дофамина в стриатуме. Такие же изменения в поведении были обнаружены у мышей TAAR6-KO, у которых уровень внеклеточного дофамина в стриатуме и префронтальной коре был не изменен, но был повышен уровень серотонина в префронтальной коре (данные не опубликованы). Таким образом, полученные данные говорят о том, что не только TAAR1, но и остальные члены семейства TAAR играют роль в функционировании ЦНС и требуют дальнейшего изучения, в том числе с помощью трансгенных моделей животных.
Список литературы
Gainetdinov R.R., Hoener M.C., Berry M.D. Trace Amines and Their Receptors. Pharmacol. Rev. 70(3): 549–620. 2018.
Bunzow J.R., Sonders M.S., Arttamangkul S., Harrison L.M., Zhang G., Quigley D.I., Darland T., Suchland K.L., Pasumamula S., Kennedy J.L., Olson S.B., Magenis R.E., Amara S.G., Grandy D.K. Amphetamine, 3,4-methylenedioxymethamphetamine, lysergic acid diethylamide, and metabolites of the catecholamine neurotransmitters are agonists of a rat trace amine receptor. Mol. Pharmacol. 60(6): 1181–1188. 2001.
Lindemann L., Ebeling M., Kratochwil N.A., Bunzow J.R., Grandy D.K., Hoener M.C. Trace amine-associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics. 85(3): 372–385. 2005.
Zucchi R., Chiellini G., Scanlan T.S., Grandy D.K. Trace amine-associated receptors and their ligands. Br. J. Pharmacol.149(8): 967–978. 2006.
Sotnikova T.D., Caron M.G., Gainetdinov R.R. Trace amine-associated receptors as emerging therapeutic targets. Mol. Pharmacol. 76(2): 229–235. 2009.
Berry M.D. Mammalian central nervous system trace amines. Pharmacologic amphetamines, physiologic neuromodulators. J. Neurochem. 90(2): 257–271. 2004.
Premont R.T., Gainetdinov R.R., Caron M.G. Following the trace of elusive amines. Proc. Natl. Acad. Sci. U. S. A. 98(17): 9474–9475. 2001.
Saltiel P.F., Silvershein D.I. Major depressive disorder: Mechanism-based prescribing for personalized medicine. Neuropsychiatr. Dis. Treat. 11: 875–888. 2015.
Borowsky B. Adham N., Jones K.A., Raddatz R., Artymyshyn R., Ogozalek K.L., Durkin M.M., Lakhlani P.P., Bonini J.A., Pathirana S., Boyle N., Pu X., Kouranova E., Lichtblau H., Ochoa F.Y., Branchek T.A., Gerald C. Trace amines: Identification of a family of mammalian G protein-coupled receptors. Proc. Natl. Acad. Sci. U. S. A. 98(16): 8966–8971. 2001.
Liberles S.D. Trace amine-associated receptors: Ligands, neural circuits, and behaviors. Curr. Opin. Neurobiol. 34: 1–7. 2015.
Wolinsky T.D., Swanson C.J., Smith K.E., Zhong H., Borowsky B., Seeman P., Branchek T., Gerald C.P. The Trace Amine 1 receptor knockout mouse: An animal model with relevance to schizophrenia. Genes, Brain Behav. 6(7): 628–639. 2007.
Lindemann L., Meyer C.A., Jeanneau K., Bradaia A., Ozmen L., Bluethmann H., Bettler B., Wettstein J.G., Borroni E., Moreau J.L., Hoener M.C. Trace amine-associated receptor 1 modulates dopaminergic activity. J. Pharmacol. Exp. Ther. 324(3): 948–956. 2008.
Revel F.G., Moreau J.L., Gainetdinov R.R., Bradaia A., Sotnikova T.D., Mory R., Durkin S., Zbinden K.G., Norcross R., Meyer C.A., Metzler V., Chaboz S., Ozmen L., Trube G., Pouzet B., Bettler B., Caron M.G., Wettstein J.G., Hoener M.C. TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity. Proc. Natl. Acad. Sci. U. S. A. 108(20): 8485–8490. 2011.
Di Cara B., Maggio R., Aloisi G., Rivet J.M., Lundius E.G., Yoshitake T., Svenningsson P., Brocco M., Gobert A., De Groote L., Cistarelli L., Veiga S., De Montrion C., Rodriguez M., Galizzi J.P., Lockhart B.P., Cogé F., Boutin J.A., Vayer P., Verdouw P.M., Groenink L., Millan M.J. Genetic Deletion of Trace Amine 1 Receptors Reveals Their Role in Auto-Inhibiting the Actions of Ecstasy (MDMA). J Neurosci. 31(47): 16928–16940. 2011.
Espinoza S., Salahpour A., Masri B., Sotnikova T.D., Messa M., Barak L.S., Caron M.G., Gainetdinov R.R. Functional Interaction between Trace Amine-Associated Receptor 1 and Dopamine D2 Receptor. Mol. Pharmacol. 80(3): 416–425. 2011.
Lynch L.J., Sullivan K.A., Vallender E.J., Rowlett J.K., Platt D.M., Miller G.M. Trace Amine Associate-d Receptor 1 Modulates Behavioral Effects of Ethanol. J. Subst. Abuse Treat. 7: 117–126. 2013.
Harmeier A., Obermueller S., Meyer C.A., Revel F.G., Buchy D., Chaboz S., Dernick G., Wettstein J.G., Iglesias A., Rolink A., Bettler B., Hoener M.C. Trace amine-associated receptor 1 activation silences GSK3β signaling of TAAR1 and D2R heteromers. Eur. Neuropsychopharmacol. 25(11): 2049–2061. 2015.
Barak L.S., Salahpour A., Zhang X., Masri B., Sotnikova T.D., Ramsey A.J., Violin J.D., Lefkowitz R.J., Caron M.G., Gainetdinov R.R. Pharmacological Characterization of Membrane-Expressed Human Trace Amine-Associated Receptor 1 (TAAR1) by a Bioluminescence Resonance Energy Transfer cAMP Biosensor. Mol. Pharmacol. 74(3): 585–594. 2008.
Liberles S.D., Buck. L.B. A second class of chemosensory receptors in the olfactory epithelium. Nature. 442(7103): 645–650. 2006.
Revel F.G., Meyer C.A., Bradaia A., Jeanneau K., Calcagno E. Brain-Specific Overexpression of Trace Amine-Associated Receptor 1 Alters Monoaminergic Neurotransmission and Decreases Sensitivity to Amphetamine. Neuropsychopharmacology. 37(12): 2580–2592. 2012.
Sotnikova T.D., Budygin E.A., Jones S.R., Dykstra L.A., Caron M.G., Gainetdinov R.R. Dopamine transporter-dependent and -independent actions of trace amine β –phenylethylamine. J. Neurochem. 91: 362–373. 2004.
Berry M.D., Gainetdinov R.R., Hoener M.C., Shahid M. Pharmacology of human trace amine-associated receptors: Therapeutic opportunities and challenges. Pharmacol. and Therapeut. 180: 161–180. 2017.
Dewan A., Pacifico R., Zhan R., Rinberg D., Bozza T. Non-redundant coding of aversive odours in the main olfactory pathway. Nature. 497(7450): 486–489. 2013.
Harmeier A., Meyer C. A., Staempfli A., Casagrande F., Petrinovic M.M., Zhang Y.-P., Künnecke B., Iglesias A., Höner O.P., Hoener M.C. How female mice attract males: A urinary volatile amine activates a trace amine-associated receptor that induces male sexual interest. Front. Pharmacol.9: 1–18. 2018.
Li Q., Korzan W.J., Ferrero D.M., Chang R.B., Roy D.S., Buchi M., Lemon J.K., Kaur A.W., Stowers L., Fendt M., Liberles S.D. Synchronous evolution of an odor biosynthesis pathway and behavioral response. Curr. Biol. 23(1): 11–20. 2013.
Dinter J., Mühlhaus J., Wienchol C.L., Yi C.X., Nürnberg D., Morin S., Grüters A., Köhrle J., Schöneberg T., Tschöp M., Krude H., Kleinau G., Biebermann H.Inverse agonistic action of 3-iodothyronamine at the human trace amine-associated receptor 5. PLoS One. 10 (2): 1–19. 2015.
Duan J., Martinez M., Sanders A.R., Hou C., Saitou N., Kitano T., Mowry B.J., Crowe R.R., Silverman J.M., Levinson D.F., Gejman P.V. Polymorphisms in the trace amine receptor 4 (TRAR4) gene on chromosome 6q23.2 are associated with susceptibility to schizophrenia. Am. J. Hum. Genet. 75 (4): 624–638. 2004.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова