Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 12, стр. 1535-1545
Йодсодержащие гормоны щитовидной железы и защитный эффект глюкокортикоидов при стрессе
Е. А. Гусакова 1, *, И. В. Городецкая 1
1 Витебский государственный ордена Дружбы народов медицинский университет
Витебск, Беларусь
* E-mail: elena-gusakova83@mail.ru
Поступила в редакцию 03.06.2019
После доработки 07.08.2019
Принята к публикации 13.08.2019
Аннотация
Известны функциональная связь гипоталамо-гипофизарно-адреналовой и тиреоидной систем и защитный эффект гормонов их эффекторного звена при стрессе. Однако их взаимодействие в этих условиях не исследовано. Цель работы – установить значение йодсодержащих тиреоидных гормонов для реализации стресс-протекторного эффекта гидрокортизона при эмоциональном стрессе. Эксперименты были выполнены на 300 белых беспородных крысах-самцах массой 220–240 г. Стресс создавали путем “дефицита времени”. Тиреоидный статус изменяли путем введения тиреостатика мерказолила (внутрижелудочно, 25 мг/кг, 20 дней), снижающего уровень йодсодержащих тиреоидных гормонов в крови, или L-тироксина в малых дозах (таким же образом, 1.5–3 мкг/кг, 28 дней). Гидрокортизон (внутрибрюшинно, 50 мг/кг) вводили за 1 ч до формирования состояния стресса. Интенсивность стресс-реакции исследовали по: 1) изменению относительной массы надпочечников, тимуса и селезенки; 2) уровню кортикостероидов и инсулина в крови; 3) поражению слизистой оболочки желудка через 1 ч после стресса. Результаты обработаны непараметрическими методами с использованием U-критерия Манна–Уитни, Statistica 10.0. Найдено, что малые дозы L-тироксина ограничивают изменения относительной массы стресс-сенситивных органов, содержания кортикостероидов и инсулина в крови, повреждение слизистой оболочки желудка при стрессе. Гидрокортизон лимитирует вызванные стрессом сдвиги относительной массы надпочечников и тимуса, предупреждает падение концентрации инсулина в крови и оказывает гастропротективный эффект при стрессе. Экспериментальный гипотиреоз достоверно снижает выраженность защитного действия гидрокортизона при стрессе. Вывод: для осуществления стресс-протекторного эффекта гидрокортизона необходимы йодсодержащие гормоны щитовидной железы.
Высокая доля заболеваний, имеющих стрессорную этиологию, определяет необходимость поиска новых способов повышения устойчивости организма к действию стрессорных факторов. Перспективное направление таких исследований – изучение антистрессорного потенциала эндогенных факторов, в частности, гормонов, обеспечивающих пролонгированные реакции на действие экстремальных раздражителей. Еще Г. Селье была описана роль глюкокортикоидов [1], заключающаяся в срочной мобилизации глюкозы [2], что формирует энергетическую базу для осуществления адаптационных реакций.
Введение экзогенных аналогов глюкокортикоидов минимизирует интенсивность стрессорного ответа. Аналогичное действие продемонстрировано для йодсодержащих тиреоидных гормонов (ЙТГ) при воздействии стрессоров различной природы: иммобилизационного [4], температурного, физического и химического [5], эмоционального [6], нейрогенного и радиционного [7].
Имеются данные, доказывающие функциональную взаимосвязь гипоталамо-гипофизарно-адреналовой системы и тиреоидной систем. Глюкокортикоиды участвуют в регуляции метаболизма йода в щитовидной железе [8]: у адреналэктомированых крыс отсутствует ингибирующий эффект высоких доз йодида калия на захват йода тиреоцитами и синтез тиреоидных гормонов при однократном введении (1000 суточных доз), и развивается гипертиреоз при многократном введении (от 1 до 500 суточных доз в течение 14 дней). С другой стороны, йод-индуцированная блокада щитовидной железы (8 мкг йодида калия /100 г массы тела в течение 5 дней) приводит к кратковременному повышению концентрации кортизола в крови крыс, что указывает на стимуляцию функции надпочечников в этих условиях [9]. Подобная связь обнаружена и при стрессе. Экспериментальный гипотиреоз (2.5 мг/100 г массы тела тирозола, 28 дней) обусловливает более низкую концентрацию кортизола в крови крыс при температурном воздействии (облучение инфракрасной лампой в течение 5 ч) [10]. Повышение сывороточного уровня кортикостероидов после эмоционально-болевого стресса коррелирует со снижением содержания йода в щитовидной железе крыс [8].
Однако значение ЙТГ для осуществления биологического действия глюкокортикоидов в условиях стресса не изучено.
Цель исследования: установить значение йодсодержащих тиреоидных гормонов для реализации стресс-протекторного эффекта гидрокортизона при эмоциональном стрессе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 300 белых половозрелых беспородных крысах-самцах. В опыт брали 3-месячных животных, полученных из питомника “Рапполово” (РФ). К концу эксперимента их масса составляла 220–240 г. При проведении экспериментов соблюдены требования гуманного обращения с экспериментальными животными, содержащиеся в методических указаниях “Положение о порядке использования лабораторных животных в научно-исследовательских работах и педагогическом процессе учреждении образования “Витебский государственный ордена Дружбы народов медицинский университет” и мерах по реализации требований биомедицинской этики”. Эмоциональный стресс вызывали путем моделирования “дефицита времени” [11]. Для этого крыс (по одной особи) помещали в нижнюю часть спирального лабиринта, который быстро заполняли водой. Стараясь избежать контакта с ней, животное вынуждено было перемещаться вверх и никак не могло повлиять на обстановку в которой оказалось.
Было сформировано 10 экспериментальных групп: “Контроль”, “Стресс”, “Мерказолил”, “Мерказолил + стресс”, “L-тироксин”, “L-тироксин + стресс”, “Гидрокортизон”, “Гидрокортизон + стресс”, “Мерказолил + гидрокортизон”, “Мерказолил + гидрокортизон + стресс”.
Для снижения уровня тиреоидных гормонов в крови использовали мерказолил (внутрижелудочно в 1%-ном крахмальном клейстере в дозе 25 мг/кг в течение 20 дней), для его повышения до верхних границ физиологической нормы – L-тироксин в малых дозах (таким же способом 1.5–3 мкг/кг в течение 28 дней). Гидрокортизон вводили за 1 ч до создания стресса (внутрибрюшинно в виде раствора в пропиленгликоле в дозе 50 мг/кг). Всем остальным группам крыс внутрижелудочно вводили 1%-ный крахмальный клейстер в течение 28 дней. Интенсивность общего адаптационного синдрома характеризовали по классической “триаде”: 1) относительная масса надпочечников, тимуса и селезенки (мг/г); 2) уровень кортикостероидов и инсулина в крови; 3) состояние слизистой оболочки желудка (СОЖ). Концентрацию гормонов определяли иммуноферментным методом, после чего рассчитывали кортикостероид-инсулиновый (К/И) коэффициент: чем он выше, тем интенсивнее напряженность компенсаторных механизмов и меньше резервные возможности организма [12]. В эксперимент животных забирали через 1 ч после воздействия.
Для исследования состояния СОЖ крыс за 24 ч до эксперимента лишали пищи, сохраняя свободный доступ к воде. Поражение СОЖ изучали по частоте (отношениe числа животных, имевших кровоизлияния в слизистой оболочки желудка, к общему количеству крыс в группе, выраженное в %), тяжести (в баллах: 0 – отсутствие кровоизлияний; 0.5 – гиперемия; 1 – единичные (1 или 2) точечные кровоизлияния; 2 – множественные (более 3) незначительные (площадью около 1 мм2) кровоизлияния; 3 – множественные значительные (площадью более 1 мм2) кровоизлияния; 4 – массивные кровоизлияния, охватывающие практически всю поверхность слизистой [13, в нашей модификации]. Рассчитывали индекс поражения СОЖ, как произведение частоты и средней тяжести поражения в группе, деленное на 100. Частоту поражения СОЖ изучали у 30 крыс, тяжесть – у 10, остальные показатели стресс-реакции – у 6 животных, выбранных случайным образом из каждой экспериментальной группы.
Статистическую обработку результатов проводили с помощью программы Statistica 10.0” (StatSoftinc., STA999K347156-W), используя непараметрические методы. При межгрупповом сравнении для анализа различий по количественным параметрам использовали U-критерий Манна–Уитни. Данные по частоте поражения СОЖ обрабатывали с использованием модулей Непараметрические статистики, Таблицы 2 × 2 (использовали точный критерий Фишера), данные по тяжести повреждения СОЖ – с использованием модулей: “Основные статистики и таблицы”, “Таблицы и заголовки”, “Подробные двухвходовые таблицы” (модификации критерия χ2 – метод Пирсона и метод максимального правдоподобия). Критическим уровнем значимости был принят p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Через 1 ч после стрессирующего воздействия наблюдалось повышение относительной массы надпочечников на 31% (p < 0.01) и уменьшение таковой тимуса и селезенки на 26 и 14% (p < 0.01). Содержание кортикостероидов в сыворотке крови увеличивалось на 43% (p < 0.01), инсулина – падало на 19% (p < 0.01), в результате чего К/И коэффициент возрастал в 1.82 раза (рис. 1). У 80% животных, подвергнутых стрессу, развивалось поражение СОЖ (табл. 1).
Рис. 1.
Влияние введения L-тироксина, гидрокортизона и мерказолила на изменение относительной массы надпочечников, тимуса и селезенки, концентрации кортикостероидов и инсулина в крови при стрессе. Примечание. ◻ – медиана; ◻ – верхняя граница нижнего квартиля и нижняя граница верхнего квартиля (LQ; UQ); $\overline \bot $ – минимальное и максимальное значения показателя; р < 0.05 по отношению: * – к контролю; # – к стрессу; + – к контролю и стрессу; группы животных: К – контроль; С – стресс; М – мерказолил; МС – мерказолил + стресс; Т – L-тироксин; ТС – L-тироксин+стресс; Г – гидрокортизон; ГС – гидрокортизон + стресс; МГ – мерказолил + гидрокортизон; МС – мерказолил + гидрокортизон + стресс.
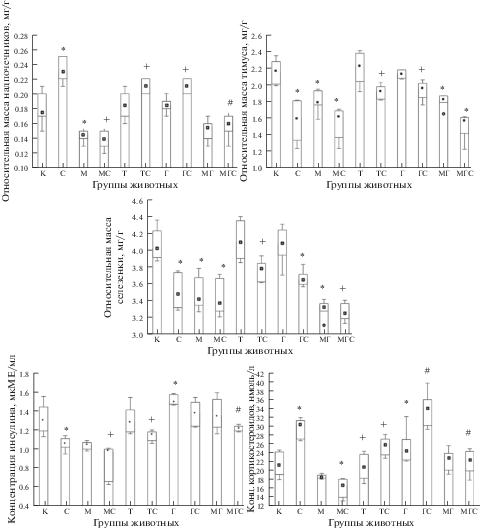
Таблица 1.
Влияние введения L-тироксина, гидрокортизона и мерказолила на состояние слизистой оболочки желудка крыс в условиях стресса
| Группы животных | Частота
поражения, % (n = 30) |
Тяжесть поражения,
баллы (n = 10) |
Индекс
поражения (n = 10) |
|---|---|---|---|
| 1. Контроль | 10 | 1 у 10% | 0.01 |
| 2. Cтресс | 80 | 1 у 20%; 2 у 30%; 3 у 30% | 1.36 |
| p 1-2 | р < 0.01 | p < 0.01 | |
| 3. L-тироксин | 10 | 1 у 10% | 0.01 |
| p 1-3 | p > 0.05 | p > 0.05 | |
| 4. Тироксин + стресс | 30 | 1 у 20%; 2 у 10% | 0.12 |
| p 3-4 | p > 0.05 | p > 0.05 | |
| p 2-4 | p < 0.01 | p < 0.05 | |
| 5. Гидрокортизон | – | – | 0 |
| p 1-5 | p > 0.05 | p > 0.05 | |
| 6. Гидрокортизон + стресс | 60 | 1 у 60% | 0.36 |
| p 5-6 | p < 0.01 | p < 0.05 | |
| p 2-6 | p > 0.05 | p < 0.05 | |
| p 4-6 | p < 0.05 | p > 0.05 | |
| 7. Мерказолил | 20 | 1 у 20% | 0.04 |
| p 1-7 | p > 0.05 | p > 0.05 | |
| 8. Мерказолил + стресс | 100 | 2 у 20%, 3 у 80% | 2.8 |
| p 7-8 | p < 0.05 | p < 0.001 | |
| p 2-8 | p > 0.05 | p < 0.05 | |
| 9. Мерказолил + гидрокортизон | 20 | 1 у 20% | 0.04 |
| p 7-9 | p > 0.05 | p > 0.05 | |
| p 5-9 | p > 0.05 | P > 0.05 | |
| 10. Мерказолил + гидрокортизон + + стресс | 100 | 2 у 30%; 3 у 70% | 2.7 |
| p 9-10 | p < 0.001 | p < 0.001 | |
| p 2-10 | p > 0.05 | p < 0.05 | |
| p 6-10 | p < 0.05 | p < 0.05 | |
| p 8-10 | p > 0.05 | p > 0.05 |
Введение L-тироксина в малых дозах, которое, как показано ранее [14], не изменяло прирост массы тела, частоту сердечных сокращений, уровень ЙТГ в крови, не оказало влияния на изученные нами показатели стресс-реакции.
После стресса у животных, которым вводили L-тироксин, относительная масса стресс-сенситивных органов изменялась в меньшей степени, чем у перенесших такое же воздействие эутиреоидных животных: по сравнению с группой “L-тироксин” таковая надпочечников увеличивалась на 14% (p < 0.05), тимуса и селезенки – падала на 13 и 8% (p < 0.05). Возможно, это объясняется тем, что уровень вызывающих их гормонов – кортикостероидов – повышался лишь на 19% (p < 0.05). Содержание инсулина снижалось только на 9% (p < 0.05). По отношению к их величине в группе “Стресс” относительная масса надпочечников была меньше на 11% (p < 0.05), тимуса и селезенки, напротив, больше – на 16% (p < 0.01) и 8% (p < 0.05). Сывороточный уровень кортикостероидов был ниже на 22% (p < 0.05), тогда как инсулина – выше на 8% (p < 0.05). Поэтому величина К/И коэффициента была меньше в 1.3 раза. Тяжесть повреждения СОЖ также была меньшей (p < 0.05), как и частота – на 50% (p < 0.01), и индекс поражения – в 11.3 раза. Следовательно, введение малых доз L-тироксина ограничивает вызванные стрессом изменения относительной массы надпочечников, селезенки и тимуса, уровня кортикостероидов и инсулина в крови, возрастание К/И коэффициента, поражение СОЖ, что указывает на снижение под его влиянием напряженности стресс-реакции.
Введение гидрокортизона вызвало повышение сывороточного уровня инсулина на 15% (p < 0.05) и не повлияло на другие изученные нами параметры (p > 0.05).
После стресса у животных, получавших гидрокортизон, относительная масса надпочечников и тимуса изменялась в меньшей степени, чем у подвергнутых стрессу без него: по отношению к группе “Гидрокортизон” относительная масса надпочечников возрастала на 17%, тимуса – падала на 8% (p < 0.01). Относительная масса селезенки снижалась в такой же мере – на 10% (p < 0.01). Уровень кортикостероидов в крови повышался в такой же степени, как у крыс, перенесших стресс без введения гидрокортизона, – на 46% (p < 0.05), инсулина – не уменьшался, как у них, а имел лишь тенденцию к снижению. По отношению к аналогичным показателям у животных, перенесших стресс и не получавших гидрокортизон, относительная масса надпочечников была меньше на 8% (p < 0.05), тимуса – выше на 16% (p < 0.05). Концентрация кортикостероидов в крови была такой же, а инсулина – больше на 25% (p < 0.01). Вследствие этого значение К/И коэффициента было меньше в 1.13 раза. Поражение СОЖ развивалось у 60% крыс, при этом по сравнению с группой “Стресс” его тяжесть была меньше (p < 0.05), как и индекс – в 3.77 раза. Следовательно, введение гидрокортизона, как и L-тироксина, ограничивает вызванные стрессом изменения относительной массы стресс-сенситивных органов, предупреждает сдвиг уровня инсулина в крови, минимизирует поражение СОЖ, однако не влияет на рост концентрации кортикостероидов в крови. По нашему мнению, это свидетельствует о том, что стресс-протекторный эффект глюкокортикоидов выражен в несколько меньшей степени. Это доказывается и тем, что в группе “Гидрокортизон + стресс” были бóльшими, чем в группе “L-тироксин + + стресс”, частота поражения СОЖ (на 30%, p < 0.05), индекс поражения (в 3 раза), сывороточное содержание кортикостероидов (на 39%, p < 0.01).
Введение мерказолила вызвало падение относительной массы надпочечников на 17% (p < 0.05), таковой тимуса и селезенки на 18 и 15% (p < 0.01), концентрации инсулина в крови на 20% (p < 0.01). У 20% гипотиреоидных животных развивалось поражение СОЖ.
После стресса у крыс, получавших мерказолил, в отличие от эутиреоидных животных, подвергнутых такому же воздействию, относительная масса надпочечников и селезенки не изменялась, а тимуса снижалась – по отношению к группе “Мерказолил” на 7% (p < 0.05). Концентрация кортикостероидов в крови не увеличивалась, как после стресса у эутиреоидных крыс, а уменьшалась – на 8% (p < 0.05). Содержание инсулина в крови падало, как и в группе “Стресс”, однако в меньшей степени – на 5% (p < 0.05), что, вероятно, связано с его исходно более низким уровнем. Вследствие практически одинаковых и однонаправленных сдвигов концентрации кортикостероидов и инсулина в крови К/И коэффициент был близок к единице. Поражение СОЖ развивалось у всех гипотиреоидных животных, перенесших стресс. По сравнению со значениями аналогичных показателей у эутиреоидных крыс, подвергнутых стрессу, относительная масса надпочечников была меньше на 51% (p < 0.01), тимуса и селезенки – такой же. Содержание кортикостероидов и инсулина в крови было ниже на 65% (p < 0.01) и 6% (p < 0.05), как и величина К/И коэффициента – в 1.70 раза. Тяжесть поражения СОЖ, напротив, была большей (p < 0.05), как и индекс поражения – в 2.1 раза. Следовательно, экспериментальный гипотиреоз препятствует возрастанию относительной массы надпочечников и уровня кортикостероидов в крови, определяет более низкую сывороточную концентрацию инсулина и отягощает поражение СОЖ в условиях стресса.
Для того, чтобы выяснить значение ЙТГ в реализации стресс-протекторного эффекта гидрокортизона, далее исследовали возможность его осуществления у гипотиреоидных животных. Введение гидрокортизона крысам со сниженным уровнем йодсодержащих тиреоидных гормонов (группа № 9 в табл. 1) повысило концентрацию кортикостероидов и инсулина в крови: по сравнению с группой “Мерказолил” (группа № 7 в табл. 1) на 22 и 24% (p < 0.01).
После стресса у таких крыс относительная масса надпочечников и селезенки не изменялась в отличие от эутиреоидных животных, подвергнутых стрессу после получения гидрокортизона, а тимуса – падала практически в такой же степени (на 11%) (p < 0.01). Тот факт, что относительная масса надпочечников не возрастала, по нашему мнению, определил отсутствие увеличения уровня кортикостероидов в крови (р > 0.05 по сравнению с группой “Мерказолил + гидрокортизон”), наблюдавшееся после стресса у животных, которым вводили гидрокортизон. Содержание инсулина, как и в указанной группе сравнения, не изменялось. В результате этого значение К/И коэффициента практически не изменилось. Поражение СОЖ развивалось у всех животных.
Вследствие описанных изменений по отношению к их величине в группах “Стресс” и “Гидрокортизон + стресс” относительная масса надпочечников была меньше на 40 и 32% (p < 0.01), селезенки – на 5 и 10% ( p < 0.05), тимуса – на 17% (p < 0.01) только по сравнению с группой “Гидрокортизон + стресс”. Сывороточное содержание кортикостероидов было ниже на 38 и 44% (p < 0.01) по отношению к его значению в обоих группах сравнения, тогда как инсулина – отличалось от них по-разному: было большим, чем в группе “Стресс”, на 12% (p < 0.05), и, напротив, меньшим, чем в группе “Гидрокортизон + стресс”, на 13% (p < 0.05). К/И коэффициент был ниже (в 1.63 и 1.44 раза), чем в обоих указанных группах. Поражение СОЖ отмечалось на 40% чаще по отношению к группе “Гидрокортизон + стресс”, индекс поражения был в 1.99 и 7.50 раза выше, как и его тяжесть (p < 0.05 по сравнению с двумя группами). Следовательно, при стрессе у гипотиреоидных животных, получавших гидрокортизон, не произошло повышения относительной массы надпочечников и уровня кортикостероидов в крови, снижения относительной массы селезенки и не выявилось гастропротективное действие гидрокортизона – поражение СОЖ было практически таким же, как в группе “Мерказолил + стресс”.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Обнаруженные в нашем исследовании изменения относительной массы надпочечников, тимуса и селезенки, уровня кортикостероидов и инсулина в крови, поражение СОЖ были установлены и другими авторами при стрессах различной природы: холодовом [15], тепловом [16], иммобилизационном [17], психологическом [18] и др., что доказывает их неспецифический характер.
Нами установлено, что малые дозы L-тироксина и гидрокортизон снижают интенсивность общего адаптационного синдрома при эмоциональном стрессе, моделируемом “дефицитом времени”, – ограничивают изменения относительной массы надпочечников, селезенки и тимуса, уровня стресс-гормонов в крови и возрастание К/И коэффициента, повреждение СОЖ. Такое действие указанных гормонов отмечали и другие авторы. Так, введение тиреоидина новорожденным поросятам (10 мг/кг массы тела в течение 32-х дней) предупреждало развитие стресса при отъеме их от матери [6]; малые дозы тироксина (5.2 мкг/г массы тела в течение 6-ти дней) ограничивали изменения активности митохондриальных ферментов во многих тканях крыс при нейрогенном (плавание в воде с T 30°С в течение 60 мин) и радиационном (гамма-облучение в дозе 6 Гр) стрессах [7].
Введение дексаметазона или гидрокортизона ограничивало изменение концентрации адренокортикотропного гормона, кортизола, кортикостерона и инсулина в крови при стрессе, вызванном введением катетера [3], электрокожным раздражением и “новизной обстановки” [19], а также поражение СОЖ при его индукции нестероидным противовоспалительным препаратом индометацином [20].
Мы полагаем, что защитный эффект L-тироксина связан прежде всего с геномным действием: взаимодействие Т3 с локализованным в ядре рецептором TRβ активирует фосфатидилинозитол-3-киназу (PI3K); связывание и Т3, и Т4 с интегрином αvβ3 активирует ферменты внутриклеточных сигнальных путей митоген-активируемой протеинкиназы. Результат – стимуляция транскрипции генов, кодирующих синтез специфических клеточных белков. Кроме того, связывание Т3 с ανβ3 активирует PI3K посредством формирования белок-белковых комплексов с участием р85а регуляторной субъединицы фермента [21]. Помимо ЙТГ стресс-протекторный эффект может оказывать и тиролиберин, после связывания которого с рецепторами происходит активация аденилатциклазы с последующим образованием цАМФ – универсального регулятора внутриклеточных процессов [22]. Имеют значение и стимуляция тирелиберином энергетического обмена, регуляция перекисного окисления липидов, опиоидной и ГАМК-ергической систем, его нейропротекторные и антигипоксические свойства, защитное действие на мембраны клеток [23]. Отметим, что число рецепторов тиролиберина и количество его мРНК увеличиваются глюкокортикоидами.
Их действие в примененной нами дозе (12.5 мг в преднизолоновом эквиваленте) также опосредовано геномными эффектами: после связывания глюкортикоидов с рецепторами происходит ремоделирование шаперонного комплекса (Hsp23, 70, 90) и ядерная транслокация комплекса глюкортикоидный гормон–рецептор с участием импортинов (α-7 и α-8), позволяющих ему взаимодействовать с элементами цитоскелета и передвигаться вдоль микротрубочек в ядро [24].
Введение гидрокортизона, как и L-тироксина, минимизирует вызванные стрессом изменения относительной массы стресс-сенситивных органов и поражение СОЖ, предупреждает падение уровня инсулина в крови, ограничивает рост К/И коэффициента.
Нами установлено, что стресс-протекторный эффект глюкокортикоидов выражен в меньшей степени, чем таковой малых доз L-тироксина: частота поражения слизистой оболочки желудка после стресса у животных, получавших L-тироксин, была меньше на 30% (p < 0.05), индекс поражения – в 3 раза. Более значительное по отношению к таковому у животных, перенесших стресс после введения L-тироксина (1.4), возрастание К/И коэффициента у крыс, подвергнутых стрессу после получения гидрокортизона (1.6), доказывает то, что адаптация в этих условиях осуществлялась за счет бóльшего напряжения компенсаторных механизмов, т.е. “цена” ее была выше. Это указывает на разные механизмы участия йодсодержащих тиреоидных гормонов и глюкокортикоидов в формировании адаптационной модификации организма.
Также в работе обнаружено, что у гипотиреоидных животных не происходит повышения относительной массы надпочечников и уровня кортикостероидов в крови при развитии стресса. Вероятно, это определяется снижением скорости белкового синтеза при гипотиреозе [25], вследствие чего не происходит стимуляции секреции АКТГ – гормона пептидной природы. Падение его уровня у гипотиреоидных крыс было показано в работе [26]. В совокупности с этими результатами меньшее изменение относительной массы тимуса и отсутствие снижения относительной массы селезенки, которые вызываются глюкокортикоидами, могут свидетельствовать о подавлении реакции гипоталамо-гипофизарно-адренокортикальной системы в ответ на стрессовое воздействие при дефиците ЙТГ. Следует подчеркнуть, что введение L-тироксина не исключило реализацию реакций общего адаптационного синдрома, а только снизило их интенсивность, т.е. минимизировало негативное действие избытка стресс-гормонов.
При экспериментальном гипотиреозе не выявляется защитный эффект экзогенных глюкокортикоидов (у таких животных не происходит увеличения относительной массы надпочечников, наблюдается меньшая масса тимуса и селезенки, более низкая концентрация кортикостероидов и инсулина в крови), бóльшее поражение СОЖ, что свидетельствует о том, что для осуществления такого эффекта гидрокортизона во многом необходимы ЙТГ.
Список литературы
Селье Г. Очерки об адаптационном синдроме. М. Медгиз. 1960. [Selye G. Ocherki ob adaptatsionnom sindrome [Essays on the adaptation syndrome]. Moscow. Medgiz. 1960].
Fang J., Sukumaran S., DuBois D.C., Almon R.R., Jusko W.J. Meta-Modeling of methylprednisolone effects on glucose regulation in rats. PLoS One. 8(12): 81679. 2013.
Удут В.В. Попова Г.А., Бородулина Е.В. Адаптивные эффекты дексаметазона при стрессирующих воздействиях. Бюлл. эксперим. биол. и мед. 142(11): 528–531. 2006. [Udut V.V., Popova G.A., Borodulina E.V. Adaptive effects of dexamethasone under stress. Bull. Exp. Biol. Med. 142(11): 528–531. 2006. (In Russ.)].
Городецкая И.В. Повышение малыми дозами тиреоидных гормонов устойчивости организма к стрессорным воздействиям различной интенсивности и сложности. Вестн. ВГМУ. 3(2): 13–18. 2004. [Gorodetskaya I.V. Increase in small doses of thyroid hormones of the body’s resistance to stressors of varying intensity and complexity. Bulletin of VSMU. 3 (2): 13–18. 2004. (In Russ.)].
Евдокимова О.В. Зависимость изменения экспрессии ранних генов c-fos и c-jun в миокарде крыс при кратковременном действии стрессоров от тиреоидного статуса организма. Журн. ГрГМУ. 2(46): 32–36. 2014. [Evdokimova O.V. Dependence of changes in the expression of early c-fos and c-jun genes in the myocardium of rats with a short-term effect of stressors on the thyroid status of the organism. J. Grodno State Med. Univer. 2(46): 32–36. 2014. (In Russ.)].
Самсонович В.А., Гусаков В.К., Солодков А.П. Роль тиреоидина в предупреждении развития стресса у поросят при отъеме. Изв. акад. аграр. наук Респ. Беларусь. Животноводство и ветеринар. медицина. 4: 78–80. 1998. [Samsonovich V.A., Gusakov V.K., Solodkov A.P. The role of thyroidin in preventing the development of stress in piglets at weaning. News Acad. Agr. Sci. Rep. Belarus. Livestock and Vet. Med. 4: 78–80. 1998 (In Russ.)].
Тапбергенов С.О., Ганн В. Сравнительная оценка эффектов физиологических доз тироксина на активность некоторых ферментов митохондрий при нейрогенном и радиационном стрессе. Успехи соврем. естествознания. 5: 51–53. 2013. [Tapbergenov S.O., Gann V. Comparative evaluation of the effects of physiological doses of thyroxin on the activity of certain mitochondrial enzymes under neurogenic and radiation stress. Succes. Modern Sci. 5: 51–53. 2013. (In Russ.)].
Надольник Л.И. Cтресс и щитовидная железа. Биомед. химия. 56(4): 443–456. 2010. [Nadolnik L.I. Stress and the thyroid gland. Biomed. Chem. 56(4): 443–456. 2010. (In Russ.)].
Басалаева Н.Л., Стрижиков В.К., Кузнецова Ю.М., Эрлих В.В. Влияние йод-индуцированной блокады щитовидной железы на уровень кортизола у самок крыс. Вестник ЮУрГУ. Серия “Образование, здравоохранение, физическая культура”. 15(4): 59–63. 2015. [Basalaeva N.L., Strizhikov V.K., Kuznetsova Yu.M., Erlikh V.V. The effect of iodine-induced thyroid gland blockade on cortisol levels in female rats. Bul. SUSU. Series “Education, health, physical education.” 15(4): 59–63. 2015. (In Russ.)].
Бильжанова Г.Ж., Чекуров И.В., Вишневская Т.Я. Морфофункциональный профиль щитовидной железы самцов крыс Wistar в рамках экспериментальной модели “Гипотиреоз-стресс”. Известия ОГАУ. 2: 177–180. 2016. [Bilzhanova G.J., Chekurov I.V., Vishnevskaya T.Ya. Morphofunctional profile of the thyroid gland of male Wistar rats in the experimental model “Hypothyroidism-stress”. News OGAU. 2: 177–180. 2016 (In Russ.)].
Гусакова Е.А., Городецкая И.В. Способ моделирования эмоционального стресса “дефицита времени”. Рос. физиол. журн. им. И.М. Сеченова. 105 (4): 520–530. 2019. [Gusakova Ye.A., Gorodetskaya I.V. A method of modeling the emotional stress of “time deficiency”. Russ. J. Physiol. 105(4): 520–530. 2019. (In Russ.)].
Панин Л.Е. Биохимические механизмы стресса. Новосибирск. Наука. 1983. [Panin L. Biohimicheskie mehanizmyi stressa [Biochemical mechanisms of stress]. Novosibirsk. Science. 1983].
Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. М. Гриф и К. 2012. [Mironov A.N. Rukovodstvo po provedeniyu doklinicheskih issledovanij lekarstvennyh sredstv [Guidelines for the Pre-Clinical Studies of Drugs]. Moscow. Grief and K. Science. 2012].
Городецкая И.В., Гусакова Е.А., Евдокимова О.В. Периферические механизмы стресс-протекторного эффекта йодсодержащих гормонов щитовидной железы. Вестник ВГМУ. 15(6): 41–53. 2016. [Gorodetskaya I.V., Gusakova Ye.A., Evdokimova O.V. Peripheral mechanisms of the stress-protective effect of iodine-containing thyroid hormones. Bull. VSMU. 15(6): 41–53. 2016. (In Russ.)].
Солодкова О.А., Зенкина В.Г. Холодовой стресс и его коррекция гидролизатом кукумарии японской. Междунар. журн. прикладных и фундаментальных исследований. 3–4: 591–594. 2016. [Solodkova O.A., Zenkina V.G. Сold stress and its correction with a Japanese cucumaria hydrolyzate. Internat. J. Appl. Fundament. Res. 3–4: 591–594. 2016. (In Russ.)].
Wang L.I., Liu F., Luo Y., Zhu L., Li G. Effect of acute heat stress on adrenocorticotropic hormone, cortisol, interleukin-2, interleukin-12 and apoptosis gene expression in rats. Biomed. Rep. 3(3): 425–429. 2015.
Gong S., Yi-Long M., Guang-Zhong J., Ming-Ju S., Li H., Lin J., Luo M., Tan J. Dynamics and correlation of serum cortisol and corticosterone under different physiological or stressful conditions in mice. PLoS One. 10(2): e0117503. 2015.
Zardooz H., Zahedi Asl.S., Naseri M.G. Effect of psychological stress on insulin release from rat isolated pancreatic islets. Life Sci. 79(1): 57–62. 2006.
Ордян Н.Э., Пивина С.Г., Акулова В.К., Галеева А.Ю. Роль глюкокортикоидных рецепторов мозга в изменении активности гипофиз-адренокортикальной системы и поведения пренатально стрессированных крыс. Психофармакол. биол. наркол. 8(1-2-2): 2373. 2008. [Ordyan N.E., Pivina S.G., Akulova V.K., Galeeva A.Yu. The role of glucocorticoid receptors in the brain in changing the activity of the pituitary-adrenocortical system and the behavior of prenatally stressed rats. Psychopharmacol. Biol. Narcol. 8 (1-2-2): 2373. 2008. (In Russ.)].
Подвигина Т.Т., Багаева Т.Р., Морозова О.Ю., Филаретова Л.П. Сравнительный анализ влияния кортикостерона, гидрокортизона и дексаметазона на образование эрозий в желудке крыс. Рос. физиол. журн. 98 (7): 879–889. 2012. [Podvigina T.T., Bagaeva T.R., Morozova O.Yu., Filaretova L.P. Comparative analysis of the effect of corticosterone, hydrocortisone and dexamethasone on the formation of erosions in the stomach of rats. Rus. J. Physiol. 98 (7): 879–889. 2012. (In Russ.)].
Mendoza A., Hollenberg A.N. New insights into thyroid hormone action. Pharmacol. Ther. 173: 135–145. 2017.
Колесников С.С. Быстрова М.Ф. Циклический АМФ: вторичный медиатор в роли первичного. Успехи физиол. наук. 47(3): 3–16. 2016. [Kolesnikov S.S. Bystrova M.F. Cyclic сАMP: the secondary mediator as the primary one. Advanc. Physiol. Sci. 47 (3): 3–16. 2016. (In Russ.)].
Голубева М.Г. Тиролиберин: структура, синтез, рецепторы и основные эффекты. Нейрохимия. 30(2): 103–108. 2013. [Golubeva M.G. Tyroliberin: Structure, Synthesis, Receptors, and Main Effects. Neurochemistry. 30(2): 103–108. 2013. (In Russ.)].
Тодосенко Н.М., Королева Ю.А., Хазиахматова О.Г., Юрова К.А., Литвинова Л.С. Геномные и негеномные эффекты глюкокортикоидов. Гены и клетки. 1: 27–33. 2017. [Todosenko N.M., Koroleva Yu.A., Khaziakhmatova O.G., Yurova K.A., Litvinova L.S. Genomic and non-genomic effects of glucocorticoids. Genes and cells. 1: 27–33. 2017].
Cerit E.T., Akturk M. Atherosclerotic and metabolic effects of hypothyroidism due to chronic thyroiditis. Med. Sci. Discov. 3(5): 213–218. 2016.
Lo M.J., Wang S.W., Kau M.M., Chen J.J., Chen Y.H., Fang V.S., Ho L.T., Wang P.S. Pharmacological effects of propylthiouracil on corticosterone secretion in male rats. J. Investig. Med. 46(9): 444–452. 1998.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


