Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 12, стр. 1526-1534
Роль индуцибельной NO-синтазы в развитии церебральной гиперемии после ишемии/реперфузии
И. Б. Соколова 1, *, О. П. Горшкова 1, Г. И. Лобов 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: SokolovaIB@infran.ru
Поступила в редакцию 23.05.2019
После доработки 08.08.2019
Принята к публикации 08.08.2019
Аннотация
Цель работы заключалась в изучении роли iNOS в регуляции тонуса пиальных артериальных сосудов и тканевой перфузии в постишемическом периоде в первые 7 дней после ишемии/реперфузии (И/Р). Эксперименты проведены на крысах Вистар (n = 33). Ишемию головного мозга моделировали пережатием двух сонных артерий и снижением и строгим поддержанием среднего артериального давления на уровне 45 ± 2 мм рт. ст. на 12 мин. Визуализацию пиальных сосудов и регистрацию изменения их диаметров проводили методом прижизненной микроскопии. Исследовались реакции на воздействие селективного ингибитора iNOS аминогуанидина (AG) и неселективного ингибитора NO-синтаз L-NAME. Одновременно у тех же животных определяли тканевую перфузию и гематокрит. Эксперименты проведены на 5 отдельных группах крыс: интактные (контроль) и 1 ч, 1, 3, 7 сут после И/Р. Показано, что максимальное (в 1.6 раза) повышение тканевой перфузии отмечено через 1 ч после И/Р, через 1 сутки значение тканевой перфузии вернулось к уровню контроля. Через 1 ч после И/Р увеличивался тканевой гематокрит и достигал максимума к 3-им суткам (на 40%). К 7-ым суткам гематокрит оставался примерно на 20% выше, чем в контроле. У контрольных крыс L-NAME уменьшал диаметр сосудов в среднем на 10–14%, а AG не приводил к значимым изменениям диаметра. Влияние AG на сосуды отмечалось только в период от 1 до 3 суток после И/Р. В это время реакции на AG практически не отличались от реакций на L-NAME. На 7-е сутки реакции пиальных артерий на AG и L-NAME уменьшились до уровня контроля. Заключается, что в возникновении гиперемии головного мозга в период первых 7 суток после И/Р значительную роль играет дилатация пиальных артериальных сосудов, вызванная избыточным количеством NO, продуцируемым iNOS.
Нарушение мозгового кровообращения продолжает оставаться одной из основных причин утраты трудоспособности и смертности [1]. Церебральная сосудистая сеть играет центральную роль при формировании ишемического инсульта: размеры ядра инфаркта определяются глубиной и продолжительностью снижения тканевого кровотока. Слабая эффективность применения нейропротекторов у пациентов с ишемическим инсультом заставляет пересмотреть ранее существовавшие представления о механизмах повреждения и восстановления ткани мозга [2, 3]. Эффективность нейропротекторной терапии напрямую зависит от наличия открытой и функционирующей сосудистой сети. Поскольку ишемические изменения развиваются не только в нервной ткани, но и в сосудистой системе мозга, нервную ткань и сосудистую сеть мозга следует рассматривать как равнозначные мишени [4]. Известно, что ишемия–реперфузия (И/Р) влияет на состояние церебральных артерий и артериол, которые контролируют как степень ишемии, так и степень реперфузии [5]. Ишемия и постишемическая реперфузия нарушают механизмы регуляции мозгового кровотока, что усугубляет ишемическое повреждение ткани мозга [6]. Тонус пиальных артерий непосредственным образом влияет на кровоток в коре головного мозга [7], что в конечном итоге определяет степень ишемического повреждения мозговой ткани [5]. Однако механизмы регуляции тонуса пиальных микрососудов в первые сутки после И/Р к настоящему времени остаются до конца не выясненными.
Одной из причин недостаточной эффективности лечебных процедур при ишемических поражениях головного мозга является неполное понимание клеточных механизмов повреждений, вызванных ишемией [4]. В частности, не полностью изучена роль оксида азота (NO), синтезируемого различными NO-синтазами и выполняющего в физиологических условиях функции вазодилататора, нейротрансмиттера и медиатора иммунитета. В физиологических условиях эндотелиальная NO-синтаза (еNOS) продуцирует строго контролируемое количество NO, который существенно снижает тонус церебральных сосудов и повышает мозговой кровоток в соответствии с потребностями ткани мозга [8]. При ишемии в ткани мозга экспрессируется индуцибельная NO-синтаза (iNOS), которая производит значительное количество NO, оказывая негативные эффекты на нейроны (эксайтотоксичность, активация апоптоза и др.) [9]. Известно, что iNOS является важнейшим участником постишемического воспалительного каскада, продуцируя большое количество NO, повреждающего различные клетки [10, 11]. Большинство исследований, проводящихся в настоящее время, направлены на изучение нейродегенеративного воздействия iNOS после ишемического повреждения головного мозга и на разработку нейропротекторных препаратов [12, 13]. Только единичные работы указывают на негативное влияние повышенной экспрессии iNOS на функцию эндотелиальных клеток церебральных микрососудов после И/Р [14]. Развитие эндотелиальной дисфункции, в свою очередь, нарушает баланс выработки вазоконстрикторов и вазодилататоров, ухудшая реагирование мозговых артерий на экзогенные и эндогенные воздействия [15].
Цель представленного исследования – изучение роли iNOS в регуляции тонуса пиальных артериальных сосудов, тканевой перфузии и гиперемии на протяжении первых 7 дней после ишемии/реперфузии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на крысах-самцах Вистар (n = 32) из ЦКП Биоколлекция ИФ РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище. Исследование было проведено в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, принятых Европейской конвенцией 19.07.2014, приказом МЗ России от 01.04. 2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики” и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
Транзиторную ишемию головного мозга моделировали под наркозом (золетил, 20 мг/кг, интраперитонеально) посредством пережатия двух сонных артерий и снижения и строгого поддержания среднего АД на уровне 45 ± 2 мм рт. ст. на 12 мин (n = 25) [16]. Прямое измерение АД производилось через катетер в бедренной артерии, соединенный с датчиком ПДП-400К (ВНИИМП, Москва), подключенным через стандартный усилитель к АЦП PCI 6023E (National Instruments, США) в компьютере с программой ввода данных. Надежность и стабильность этой модели обусловлена точным контролем системного АД и продолжительности ишемии. После прекращения ишемии проводили полную реинфузию забранной крови. Затем у животных из бедренной артерии удаляли катетер, а раны на бедре и шее послойно ушивали. Группой сравнения служили интактные животные той же возрастной категории (n = 8). Постишемические изменения оценивали в 4-х отдельных группах крыс: через 1 ч (n = 5), на 1-е (n = 5), 3-и (n = 10) и 7-е сутки (n = 5) после ишемии-реперфузии (И/Р).
Для исследования пиальных артериальных сосудов и измерения тканевой перфузии и гематокрита в теменной области черепа наркотозированных крыс (золетил, 20 мг/кг, интраперитонеально) удаляли кость и твердую мозговую оболочку. Визуализацию пиальных артерий (при общем увеличении оптической системы 160 крат) проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (“Микромед”, Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии “Photo M” (авторская разработка А. Черниговского, http://www.t_lambda. chat.ru) измеряли диаметры пиальных артерий и артериол. У каждого животного диаметры сосудов фиксировали в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса. Затем на поверхность головного мозга наносили раствор аминогуанидина, (AG, Aminoguanidine hydrochloride, Sigma-Aldrich), 10–3 М – селективного ингибитора iNOS, и через 15 мин проводили измерения диаметров сосудов в тех же точках. Далее мозг орошали раствором L-NAME (N(ω)-nitro-l-arginine methyl ester, Sigma-Aldrich) 10–4 М, который является неселективным ингибитором NO-синтаз. Измерения диаметров пиальных артерий и артериол повторяли через 15 мин после начала орошения поверхности головного мозга раствором L-NAME. В ходе эксперимента у каждого животного было исследовано более 20 пиальных микрососудов. Из всех исследованных пиальных артериальных микрососудов мы выделили 2 группы: группа мелких артерий и артериол диаметром 15–25 мкм и группа артерий диаметром более 60 мкм (табл. 1).
Таблица 1.
Количество исследованных сосудов в каждой группе на отдельных этапах постишемического периода
| Длительность постишемического периода | Сосуды с исходным диаметром 15–25 мкм | Сосуды с исходным диаметром более 60 мкм |
|---|---|---|
| Контрольные крысы | 40 | 39 |
| 1 час | 22 | 17 |
| 1 сутки | 23 | 15 |
| 3 суток | 45 | 42 |
| 7 суток | 21 | 19 |
Поскольку оценка степени дилатации пиальных артерий после И/Р у одного и того же животного даже в течение первых суток постишемического периода при использовании нашей методики технически невозможна, то для интерпретации полученных результатов мы применили следующий методический подход. Считая, что именно iNOS ответственна за дилатацию церебральных сосудов после ишемического повреждения [17], о величине постишемического расширения микрососудов мы судили, определяя разницу между диаметрами сосуда до и после воздействия AG.
У тех же экспериментальных животных измеряли состояние микроциркуляции в коре головного мозга с использованием многофункционального лазерного диагностического комплекса ЛАКК-М (НПП “Лазма”, Россия), совмещающего методы лазерной допплеровской флоуметрии (ЛДФ) и оптической тканевой оксиметрии (ОТО). Методом ЛДФ определяли статистические характеристики показателя микроциркуляции крови – изменение потока крови (перфузии ткани кровью) в единицу времени в объеме ткани около 1 мм3, измеряемое в относительных перфузинных единицах. Методом ОТО оценивали показатель объемного кровенаполнения ткани – уровень тканевого гематокрита.
Датчик прибора размещали в трех точках над сенсомоторной корой с приблизительными координатами АР = 1, 2, 3 мм от брегмы; SD = 1.0 мм латерально от сагиттального шва. Общая продолжительность экспериментальных процедур составляла примерно 60 мин, после чего животных усыпляли передозировкой препарата для наркоза.
Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи t-критерия Стьюдента. При распределении вариант в выборке, отличном от нормального, при сравнении двух групп применяли U-критерий Манна–Уитни. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Через 1 ч после И/Р величина тканевой перфузии в сенсомоторной коре повысилась в среднем в 1.6 раза относительно показателей у животных контрольной группы (р = 0.031, U = 11.0, n = 5, критерий Манна–Уитни). Через 1 сутки тканевая перфузия достигла исходного уровня и в период с 3-их по 7-е сутки после ишемии статистически значимо не отличалась от аналогичного показателя у контрольных крыс (рис. 1).
Рис. 1.
Величина перфузии и гематокрита в ткани головного мозга на протяжение 7 сут после ишемии/реперфузии. По оси абсцисс: время после ишемии/реперфузии; по оси ординат: тканевая перфузия, перф. ед.; по второй оси ординат: тканевой гематокрит, %. Темные столбики – величина тканевой перфузии, перфузионные единицы; кривая – тканевой гематокрит, %. Изменения значимы относительно значений у контрольных крыс, * – p < 0.05.
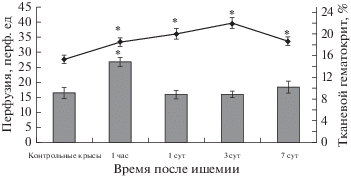
Тканевой гематокрит, который в контроле составлял 15.4 ± 1.1%, через 1 ч после И/Р увеличился до 18.5 ± 1.5% и достиг максимума к 3-м суткам. К 7-м суткам гематокрит понижался, но его величина была примерно на 20% выше, чем у контрольных крыс (рис. 1).
Исследование реакции пиальных сосудов у контрольных животных показало, что при аппликации L-NAME их диаметр уменьшился относительно диаметра до воздействия блокатора (исходного значения), принятого за 100%, в среднем на 14% и 10% (р < 0.05, t-критерий Стьюдента) соответственно в группах мелких и крупных сосудов (рис. 2). AG не приводил к значимым изменениям диаметра артерий всех исследованных диаметров (рис. 2).
Рис. 2.
Изменение диаметра пиальных артериальных сосудов при воздействии L-NAME и аминогуанидина на протяжение 7 суток после ишемии/реперфузии. По оси абсцисс: время после ишемии/реперфузии; по оси ординат: диаметр пиальных артерий, выраженный в % относительно исходного значения (до применения ингибитора), который принят за 100%. Светлая заливка – мелкие пиальные сосуды (15–25 мкм); темная заливка – крупные пиальные сосуды (более 60 мкм); сплошная светлая и темная заливка – воздействие L-NAME; точечная штриховка – воздействие аминогуанидина. Изменения значимы относительно значений у контрольных крыс, * – p < 0.05. Изменения значимы относительно реакций мелких сосудов в данный отрезок постишемического периода, # – p < 0.05.
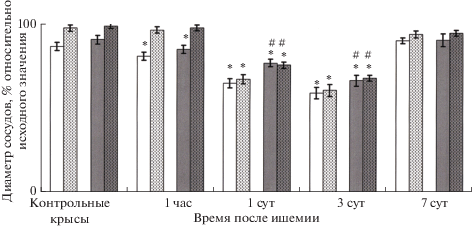
Через 1 ч после И/Р применение L-NAME вызвало уменьшение диаметра крупных и мелких пиальных артерий относительно исходного значения в среднем на 20% (р < 0.05, t-критерий Стьюдента) (рис. 2). В этот же отрезок постишемического периода AG не оказывал влияния на диаметр пиальных артериальных сосудов (рис. 2).
Через 1 сутки после И/Р констрикция пиальных артерий на аппликацию L-NAME усилилась в среднем в 2.5 раза по сравнению со степенью уменьшения диаметра сосудов у контрольных животных. У животных, перенесших ишемию, также наблюдали достоверные различия в реакции мелких и крупных сосудов. Мелкие сосуды сильнее реагировали на L-NAME. Их констрикция в среднем на 12% (р = 0.02, U = 27, критерий Манна–Уитни) превышала констрикцию крупных артерий (рис. 2). Реакция всех групп исследованных сосудов на действие AG через 1 сутки после И/Р достоверно не отличалась от реакции на L-NAME.
Через 3-е суток после И/Р изменения диаметра в ответ на действие L-NAME достигли максимума. Диаметр артерий при аппликации L-NAME уменьшался в среднем на 37% (р < 0.05, t-критерий Стьюдента). Констрикция мелких сосудов в среднем на 8% (р = 0.017, U = 192, критерий Манна-Уитни) превышала аналогичный показатель у крупных артерий (рис. 2). Реакции всех групп сосудов в ответ на применение AG достоверно не отличались от реакций на L-NAME.
На 7-е сутки после И/Р реакция церебральных артерий на AG и L-NAME значительно уменьшилась и по амплитуде приблизилась к реакции на L-NAME у контрольных животных. Пиальные сосуды всех диаметров в этот период одинаково реагировали на L-NAME и на AG.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К настоящему времени показано, что при ишемии в ткани головного мозга повышается экспрессия всех изоформ NO-синтаз (эндотелиальной eNOS, нейрональной nNOS и индуцибельной iNOS) [18, 19]. При этом выброс NO происходит уже на первых минутах после ишемии и это перепроизводство NO вызвано активацией eNOS. Позднее (через 20–30 мин [19], 6 ч [18]) в ишемизированной ткани повышается активность nNOS; через сутки – iNOS. Эта изоформа продуцирует в 100–1000 раз больше NO, чем конститутивные изоформы фермента [17]. Следовательно, именно она должна определять выделение NO и степень дилатации церебральных микрососудов в несколько первых суток после ишемического повреждения ткани головного мозга.
Действительно, наши эксперименты показали, что в контрольной группе интактных животных отсутствовала реакция пиальных сосудов всех исследованных диаметров при воздействии AG. Это доказывает, что в физиологических условиях iNOS не принимает участия в регуляции тонуса пиальных артерий и артериол. В нашем исследовании мы не применяли селективных ингибиторов eNOS и nNOS, однако с учетом данных литературы, есть основания полагать, что в физиологических условиях в артериях источником NO является именно eNOS [20]. Через 1 ч после И/Р AG также не приводил к достоверному изменению диаметра пиальных артериальных сосудов. В этот период констрикция как мелких, так и крупных пиальных артериальных сосудов была отмечена только при воздействии на поверхность коры головного мозга неселективного ингибитора NO-синтаз L-NAME, что свидетельствовало об активации в этот постишемический период конститутивных NO-синтез. Через 1 ч после И/Р было отмечено самое значимое за весь период наблюдения (7 сут) – в среднем в 1.6 раза повышение тканевой перфузии в сенсомоторной коре головного мозга. Возрастание церебрального кровотока после И/Р, возможно, связано со снижением сопротивления в системе резистивных сосудов мозга. В то же время, через 1 ч после И/Р было отмечено статистически значимое (в среднем в 1.2 раза), но не максимальное повышение уровня тканевого гематокрита.
Через 1 сутки после И/Р реакция пиальных артерий и артериол на воздействие AG была значительно выражена. Диаметр мелких артериальных сосудов уменьшился в среднем на 35%, крупных – на 23%. К 3-м суткам реакция пиальных артерий и артериол на AG достигла максимума: диаметр мелких артериальных сосудов уменьшился в среднем на 41%, крупных – на 34%. Таким образом, крупные пиальные артерии (диаметром более 60 мкм) в наших экспериментах в период от 1 до 3-х суток после ишемии слабее реагировали на AG. Это может свидетельствовать о меньшей значимости iNOS в регуляции их тонуса по сравнению с артериями меньшего диаметра в этот отрезок постишемического периода. Напомним, что по констрикторной реакции на AG мы судили об iNOS – опосредованной дилатации пиальных сосудов: чем больше степень сужения, тем более была расширена артерия до воздействия блокатора iNOS. В период с 1-ых по 3-и сутки после ишемии также было отмечено максимальное кровенаполнение мозговой ткани: уровень гематокрита увеличился в среднем в 1.3 раза (1-е сутки) и в 1.4 раза (3-и сутки) по сравнению с контрольными значениями (рис. 1). Тканевая перфузия вернулась к уровню П у контрольных животных. Принципиально важным является то, что в 1-е–3-и сутки после И/Р реакции пиальных артерий и артериол на действие AG были такими же, как и реакции на L-NAME (нет статистически значимых различий). Это указывает на значительную роль iNOS в регуляции тонуса пиальных сосудов в данный отрезок исследованного нами постишемического периода. Следовательно, повышение тканевого гематокрита (увеличение кровенаполнения ткани) более чем на 40% во многом определяется выраженной дилатацией пиальных сосудов, регулируемой iNOS.
К 7-ым суткам постишемического периода дилатация пиальных артерий, зависимая от NO, продуцируемого индуцибельной изоформой, составляла 6–7%, что находится на границе физиологического изменения диаметра сосудов. Уровень тканевой перфузии достоверно не отличался от показателей у контрольных крыс, хотя гематокрит оставался на 10% выше исходного уровня. Вероятно участие iNOS в регуляции тонуса пиальных артериальных сосудов практически прекращается к 7-м суткам после И/Р.
Значительное повышение тканевого гематокрита при пониженном уровне перфузии свидетельствует о том, что ткань коры головного мозга в течение нескольких дней после И/Р находится в состоянии выраженного вазогенного отека и гиперемии, которые в последующем медленно уменьшаются, сохраняясь по меньшей мере на протяжении недели.
Уникальность примененного методического подхода одновременной прижизненной регистрации состояния пиальных артерий и артериол и кровоснабжения ткани мозга после И/Р, позволило нам показать, что:
1. В период первых 7 суток после перенесенной транзиторной ишемии ткань головного мозга у крыс находится в гиперемированном состоянии.
2. В возникновении гиперемии головного мозга одну из основных ролей играют пиальные артериальные микрососуды, находящиеся в состоянии дилатации, которая вызвана избыточным количеством NO, продуцируемым iNOS.
3. Влияние iNOS на состояние пиальных артериальных сосудов ограничивается 7-ю сутками после И/Р.
Впервые показав, что дилатация церебральных сосудов и гиперемия мозговой ткани после ишемического повреждения во многом опосредована экспрессией iNOS, мы полагаем, что именно iNOS может быть важной терапевтической мишенью, воздействуя на которую можно уменьшить тяжесть ишемическо-реперфузионного повреждения ткани мозга.
Список литературы
Шляхто Е.В., Баранцевич Е.Р., Щербак Н.С., Галагудза М.М. Молекулярные механизмы формирования ишемической толерантности головного мозга. Часть 1. Вестник РАМН. 6: 42–50. 2012. [Shlyakhto E.V., Barantsevich E.R., Shcherbak N.S., Galagudza M.M. Molecular mechanisms of formation of ischemic tolerance of the brain. Part 1. Rams messenger. 6: 42–50. 2012 (In Russ.)].
Auriel E., Bornstein N. Neuroprotection in acute ischemic stroke–current status. J. Cell. Mol. Med. 14(9): 2200–2202. 2010.
Patel R., McMullen P. Neuroprotection in the Treatment of Acute Ischemic Stroke. Prog. Cardiovasc. Dis. 59(6): 542–548. 2017.
Palomares S., Cipolla M. Vascular protection following ischemia and reperfusion. J Neurol. Neurophysiol. 20: S1–S4. 2011.
Cipolla M., Bullinger L. Reactivity of brain parenchymal arterioles after ischemia and reperfusion. Microcirculation. 15(6): 495–501. 2008.
Nour M., Scalzo F., Liebeskind D. Ischemia-reperfusion injury in stroke. Interv. Neurol. 3–4: 185–199. 2013.
Александрин В.В. Вейвлет-анализ мозгового кровотока у крыс. Регионарное кровообращение и микроциркуляция. 9(4): 63–66. 2010. [Alexandrin V.V. Wavelet analysis of cerebral blood flow in rats. Regional blood circulation and microcirculation. 9(4): 63–66. 2010 (In Russ.)].
Манухина Е.Б., Малышев И.Ю. Роль оксида азота в развитии и предупреждении дисфункции эндотелия. Вестник ВГМУ. 2(2): 5–17. 2003. [Manukhina E.B., Malyshev I. Yu. Role of nitric oxide in the development and prevention of endothelial dysfunction. Vestnik VUMU. 2(2): 5–17. 2003. (In Russ.)].
Zhang Y., Ding N., Zeng Y., Xiang Y., Yang M., Hong F., Yang S. New progress in roles of nitric oxide during hepatic ischemia reperfusion injury. World. J. Gastroent. 23(14): 2505–2510. 2017.
Vexler Z., Tang X., Yenari M. Inflammation in adult and neonatal stroke. Clin. Neurosci. Res. 6(5): 293–313. 2006.
Zheng L., Ging J., Wang J., Zhou C., Zhang W. Effect and mechanism of action of inducible nitric oxide synthase of apoptosis in a rat model of cerebral ischemia-reperfusion injury. Anatom. Rec. 299: 246–255. 2016.
Крушинский А.Л., Кузенков В.С., Дьяконова В.Е., Реутов В.П. Влияние ингибиторов нейрональной и индуцибельной NO-синтаз на развитие геморрагического инсульта в эксперименте. Журн. неврологии и психиатрии. 8: 21–27. 2014. [Krushinsky A.L., Kuzenkov V.S., Dyakonova V.E., Reutov V.P. The effect of neuronal and inducible NO-synthase inhibitors on the development of hemorrhagic stroke in the experiment. J. Neurol. Psychiatry. 8: 21–27. 2014. (In Russ.)].
Pannu R., Sing I. Pharmacological strategies for the regulation of inducible nitric oxide synthase: neurodegenerative versus neuroprotective mechanisms. Neurochem. Int. 49(2): 170–182. 2006.
Garcia-Bonilla L., Moore J., Racchumi G., Zhou P., Butler J., Iadecola C., Anrather J. Inducible nitric oxide synthase in neutrophils and endothelium contributes to ischemic brain injury in mice. J. Immunol. 193(5): 2531–2537. 2014.
Andresen J., Shaft N., Bryan R. Endothelial influences on cerebrovascular tone. J. Appl. Physiol. 100: 318–327. 2006.
Горшкова О.П., Ленцман М.В., Артемьева А.Н., Дворецкий Д.П. Постишемическая реактивность пиальных сосудов на гиперкапнию. Бюл. эксперим. биол. мед. 159(1): 7–11. 2015. [Gorshkova O.P., Lencman M.V., Artem’eva A.N., Dvoreckij D.P. Postishemicheskaya reaktivnost' pial’nyh sosudov na giperkapniyu. Bull. Eksperim. Biol. Med. 159(1): 7–11. 2015. (In Russ.)].
del Zoppo G., Ginis I., Hallenbeck J., Iadecola C., Wang X., Feuerstein G. Inflammation and stroke: putative role for cytokines, adhesion molecules and iNOS in brain response to ischemia. Brain Pathol. 10(1): 95–112. 2000.
Niwa M., Inao S., Takayasu M., Kawai T., Kajita Y., Nihashi T., Kabeya R., Sugimoto T., Yoshida J. Time course of expression of three nitric oxide synthase isoforms after transient middle cerebral artery occlusion in rats. Neuron Med. Chir. 41: 63–73. 2001.
Jiang Z., Li C., Arrick D., Yang S., Baluna A., Sun H. Role of nitric oxide synthases in early blood-brain barrier disruption following transient focal cerebral ischemia.et al. PloS One. 9(3): e93134. 2014.https://doi.org/10.1371/journal.pone.0093134
Toda N., Ayajiki K., Okamura T. Cerebral blood flow regulation by nitric oxide: recent advances. Pharmacol. Rev. 61(1): 62–97. 2009.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


