Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 191-197
Видовые особенности негеномной реакции главных клеток собирательных трубок почек крыс и мышей на альдостерон
Н. С. Логвиненко 1, *, Л. Е. Каткова 1, Г. С. Батурина 1, Е. И. Соленов 1, 2, 3, Л. Н. Иванова 1, 2
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
3 Новосибирский государственный технический университет
Новосибирск, Россия
* E-mail: ninlo@bionet.nsc.ru
Поступила в редакцию 14.11.2018
После доработки 12.12.2018
Принята к публикации 12.12.2018
Аннотация
Ранее нами было показано наличие быстрой негеномной реакции на альдостерон главных клеток кортикального отдела собирательных трубок (CCD) почек крыс при резком изменении уровня натрия в омывающей среде (с 137 до 14 мМ NaCl). Целью данной работы было изучение видовых особенностей быстрой негеномной реакции на альдостерон главных клеток CCD почек крыс и мышей. В работе использовали метод флуоресцентной микроскопии с внутриклеточным красителем Sodium Green. В присутствии альдостерона (10 нМ) уровень внутриклеточного натрия в главных клетках почек крыс линии Вистар в гипонатриевой среде (14 мМ NaCl) оказался на более высоком уровне по сравнению с контролем (р < 0.05). У мышей линии C57bl/6 ответ главных клеток CCD на резкое изменение уровня натрия в омывающей среде был значительно быстрее, а негеномная реакция на альдостерон (1 нМ) оказалась слабее, чем у крыс (р < 0.05). Полученные данные впервые свидетельствуют о видовых различиях быстрых негеномных эффектов альдостерона главных клеток CCD почек крыс и мышей линии C57bl/6 в ответ на изменение электролитного состава канальцевой жидкости.
Основным фактором, регулирующим баланс натрия в организме, является стероидный гормон коры надпочечников альдостерон. Он регулирует реабсорбцию натрия в главных клетках эпителия кортикального отдела собирательных трубок (CCD) почки. Альдостерон связывается с минералокортикоидными рецепторами (МР) и активирует экспрессию основных мембранных транспортных белков: апикально локализованного натриевого канала (ENaC), пропускающего натрий внутрь клетки, и натриевого насоса, или Nа+-K+-АТФазу, который расположен на базолатеральной стороне мембраны и отправляет натрий из клетки в околоклеточное пространство и далее в кровь. В настоящее время известно, что альдостерон, помимо этой классической долговременной геномной регуляции реабсорбции ионов натрия, оказывает быстрые, негеномные эффекты [1–5]. Негеномные эффекты альдостерона обнаружены не только в клетках почек, но также и в кардиомиоцитах, эпителиальных клетках сосудистой системы, мозге, адипоцитах и других тканях. Однако молекулярный механизм, лежащий в их основе у других видов животных, исследован недостаточно. Ранее нами было впервые обнаружено влияние альдостерона на уровень внутриклеточного натрия в главных клетках CCD почек крыс в течение первых 10–15 с после его добавления в инкубационную среду. Кроме того, оказалось, что альдостерон в физиологических концентрациях (1–10 нМ) влияет на объем главных клеток собирательных трубок почек крыс [2, 6]. Известно, что различные виды лабораторных животных обладают разными характеристиками экскреторной функции почки, которые зависят от особенностей гормональной регуляции функции основных транспортных белков [7–9]. В связи с большим генетическим разнообразием мыши, наряду с крысами, все шире используются в исследованиях молекулярных механизмов почечных функций. Поэтому представляется весьма актуальным исследование особенностей негеномной регуляции альдостероном натриевой проницаемости в главных клетках СCD не только у крыс, но и у мышей. В экспериментальных исследованиях в этой области в основном используются линия крыс Вистар и линия мышей C57bl/6, однако негеномные эффекты альдостерона у последних практически не изучены. Поэтому целью данного исследования явилось сравнительное исследование быстрых негеномных эффектов альдостерона на кинетику уровня натрия в главных клетках CCD почек крыс линии Вистар и мышей линии C57bl/6.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями межинститутской комиссии по биоэтике при Институте цитологии и генетики СО РАН. В экспериментах использовали почки взрослых самцов крыс линии Вистар и мышей линии C57bl/6 из вивария ИЦиГ СО РАН (RFMEFI61914X0005 и RFMEFI61914X0010). В работе использовали фрагменты CCD почек, полученные методом микродиссекции, как это описано ранее [1].
Изменение внутриклеточной концентрации натрия в главных клетках CCD проводили с помощью непрерывной регистрации флуоресценции Sodium Green при резком изменении содержания натрия в омывающей среде (137 и 14 мМ NaCl), как это нами описано ранее [1, 3]. Гипонатриевый раствор (14 мМ NaCl) готовили на основе PBS (Na+ 137 мМ), в котором часть натрия замещали 123 мM n-methyl-D-glucamine (NMDG). Альдостерон добавляли в омывающий раствор в концентрации 10 нM, смена омывающего раствора происходила в течение 100 мс. Изменения содержания внутриклеточного натрия выражали в относительных величинах флуоресценции внутриклеточного красителя Sodium Green. Непрерывную регистрацию флуоресценции Sodium Green производили с помощью флуоресцентного микроскопа Axiovert 40 CFL (filter set #09, Zeiss, Германия). Измерения производили с помощью аналого-цифрового преобразователя Актаком АСК-3102 с записью на компьютер. Профили величин относительной флуоресценции (F/F0), отражающие процесс входа/выхода ионов натрия в клетку, аппроксимировали функцией экспоненциального распада первого порядка. Для оценки скорости изменения использовали параметр A1/t1, где A1 – амплитуда, t1 – характерное время. Статистическую обработку результатов проводили с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
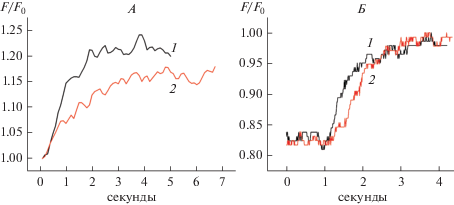
На рис. 1 представлена типичная кривая флуоресценции, которая отражает изменение внутриклеточного уровня ионов натрия ([Na+]i) в главных клетках CCD почки крысы в ответ на резкое изменение содержания натрия в омывающей среде ([Na+]out). Снижение [Na+]out с 137 до 14 мМ приводило к уменьшению относительного уровня флуоресценции в течение первых секунд, что хорошо совпадает с полученными нами ранее данными и соответствуют снижению уровня внутриклеточного натрия. Увеличение [Na+]out с 14 до 137 мМ вызвало повышение внутриклеточного натрия практически к исходному уровню. В присутствии альдостерона (10 нМ) уровень внутриклеточного натрия падал не столь резко, как в контроле, что также подтверждает раннее полученные результаты [1–3, 6]. Нами было показано, что амилорид (10–5 М), ингибитор эпителиального натриевого канала (ENaC), а также ингибиторы основных киназных каскадов, принимающих участие в регуляции активности ENaC, нивелируют данный негеномный эффект альдостерона в почках крыс [3, 6]. Эти данные свидетельствуют о важной роли эпителиального натриевого канала в реализации негеномного эффекта альдостерона у крыс. На рис. 2 представлена характерная кривая изменения относительной флуоресценции, отражающей содержание внутриклеточного натрия в главных клетках CCD почки мыши линии C57bl/6 в тех же условиях. Как видно из рисунка, в целом реакция главных клеток мышей похожа на таковую у крыс. Резкое падение уровня внеклеточного натрия в омывающей среде ведет к снижению его содержания в клетке, а повышение – к увеличению его уровня. Из сравнения профилей флуоресценции, отражающих вход натрия в клетку, можно видеть, что главные клетки мышей быстрее отвечают на изменение свойств омывающей жидкости и реакция на альдостерон в той же физиологической дозе 10нМ отличается от таковой у крыс (рис. 1 и 2). Поэтому мы более подробно исследовали сравнительную динамику роста уровня внутриклеточного натрия в главных клетках CCD крыс и мышей при резком изменении [Na+]out в омывающей среде с 14 до 137 мМ. На рис. 3А и 3Б представлены характерные кривые изменения относительной флуоресценции Sodium Green в контроле и в присутствии альдостерона (10 нМ) у исследуемых видов животных. У крыс повышение [Na+]i как в контроле, так и в присутствии альдостерона происходит более медленными темпами, чем у мышей. У мышей негеномный эффект на альдостерон требует на свою реализацию гораздо меньше времени и также выражен некоторым снижением скорости роста внутриклеточного натрия при его резком увеличении во внешней среде (с 14 до 137 мМ NaCl).
Рис. 1.
Характерные профили относительной флуоресценции внутриклеточного красителя Sodium Green в главных клетках CCD почек крыс при резком изменении уровня натрия в омывающей среде со 137 до 14 мМ NaCl и со 14 до 137 мМ NaCl. Здесь и далее: по оси ординат – относительная флуоресценция (F/F0); по оси абсцисс – время в секундах.
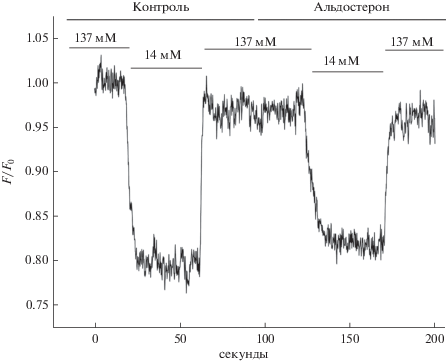
Рис. 2.
Характерный профиль относительной флуоресценции внутриклеточного красителя Sodium Green в главных клетках CCD почек мышей линии C57bl/6 при резком изменении уровня натрия в омывающей среде со 137 до 14 мМ NaCl и с 14 до 137 мМ NaCl.
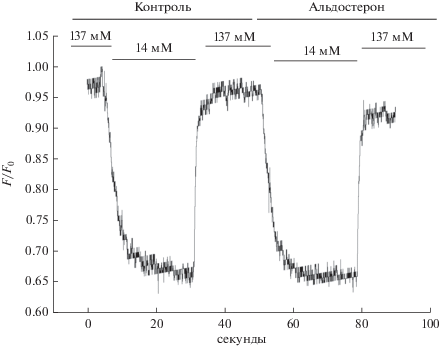
Рис. 3.
Характерные кривые изменения уровня [Na+]i в главных клетках крыс (А) и мышей (Б) при резком изменении содержания натрия в омывающей среде с 14 до 137 мМ. 1 – контроль; 2 – альдостерон (10 нМ).
В табл. 1 представлены обобщающие средние данные по кинетике входа ионов натрия в главные клетки крыс и мышей при резком его повышении в омывающей среде (14–137 мМ). Из представленных данных видно, что скорость входа натрия у мышей оказалась в 3 раза больше в контроле, а в присутствии альдостерона – почти в 10 раз выше чем у крыс (р < 0.001). Альдостерон (10 нМ) у мышей достоверно снижал скорость изменения внутриклеточного натрия, хотя и не так существенно, как у крыс (на 20 и 50% соответственно, р < 0.05). Полученные в настоящем исследовании данные свидетельствуют о значительных межвидовых различиях скорости изменения концентрации натрия в главных клетках эпителия собирательных трубок почки крыс и мышей при резком изменении уровня натрия в инкубационной среде как в контрольных условиях, так и при добавлении альдостерона.
Сопоставление полученных результатов с литературными сведениями в настоящее время позволяет высказать лишь некоторые гипотетические предположения о механизмах, лежащих в основе выявленных межвидовых различий. Так, большая скорость изменений внутриклеточного натрия у мышей может быть связана с более быстрым переходом натриевых каналов апикальной мембраны в открытое состояние под влиянием концентрационного градиента натрия или каскада киназ, реализующих негеномный эффект альдостерона. Известно, что для мелких животных характерна повышенная возбудимость и более быстрые реакции нейрогормональных механизмов регуляции клеточных функций по сравнению с крупными особями. Кроме того, установлено, что почки мышей и крыс с разной скоростью выводят органические осмолиты, что свидетельствует о различиях гормональной регуляции почечных транспортеров у этих двух видов [7, 9]. Обнаружены также межвидовые различия почечной кинетики гомологов органического катионного транспортера (OCT1) у мыши, крысы, кролика и человека. Предполагается, что они могут способствовать межвидовым особенностям метаболизма органических катионов, а также служить объяснением особенностей развития нефропатии у различных видов экспериментальных животных и человека [10–13].
Полученные в нашем исследовании данные свидетельствуют о значительных видовых различиях скорости реакции главных клеток CCD почек крыс и мышей в ответ на резкое изменение уровня натрия в омывающей среде. Можно предположить, что более быстрая негеномная реакция на альдостерон у мышей может иметь важное приспособительное значение при резких изменениях состава канальцевой среды и, в частности, может играть важную роль в видовых особенностях формирования почечных патологий.
Таким образом, нами впервые обнаружены видовые различия в кинетике реакции главных клеток CCD почек мышей и крыс на резкое изменение уровня натрия в омывающей среде и более выраженный негеномный эффект альдостерона на уровень внутриклеточного натрия у крыс. Возможно обнаруженная нами разница в реактивности главных клеток СCD у крыс и мышей свидетельствует о видовых различиях молекулярных механизмов реализации негеномных эффектов альдостерона. Полученные данные могут иметь важное значение для понимания видовых особенностей молекулярных механизмов развития почечных патологий при таких системных заболеваниях как гипертония, ожирение, метаболический синдром.
Таблица 1.
Изменение флуоресценции Sodium Green (A1/t1 с) в главных клетках CCD крыс Вистар и мышей C57bl/6 при изменении уровня натрия в омывающей среде с 14 мМ до 137 мМ. Влияние альдостерона (10 нМ)
| A1/t1 с | Контроль | Альдостерон | ||
|---|---|---|---|---|
| крысы | мыши | крысы | мыши | |
| 0.11 ± 0.02 (5) |
0.36 ± 0.03§ (8) |
0.04 ± 0.01* (5) |
0.29 ± 0.06*§ (8) |
|
Условные обозначения: А1 – амплитуда изменения флуоресценции; t1 – характерное время экспоненциальной функции аппроксимирующей его изменения в секундах. Приведенные в таблице данные представлены в виде: среднее ± ошибка среднего (M ± SEM). В круглых скобках указано число животных. * – достоверные различия по сравнению с соответствующим контролем (р < 0.05); § – достоверные различия между крысами и мышами (р < 0.05).
Список литературы
Logvinenko N.S., Solenov E.I., Ivanova L.N. A rapid nongenomic effect of aldosterone on intracellular sodium concentration in the distal nephron segment of the rat. Dokl. Biochem. Biophys. 406(2): 7–10. 2006.
Logvinenko N.S., Solenov E.I., Ivanova L.N. Effect of aldosterone on the regulation of the volume of principal cells of rat cortical collecting duct epithelium in early postnatal development. Dokl. Biochem. Biophys. 423(5): 385–388. 2006.
Logvinenko N.S., Solenov E.I., Ivanova L.N. Effect of aldosterone on kinetics of intracellular sodium in cortical portion of collecting ducts in rat kidney. Bull. Exp. Biol. Med. 146(2): 192–195. 2008.
Wehling M. Looking beyond the dogma of genomic steroid action: insights and facts of the 1990. J. Mol. Med. 73(9): 439–447. 1995.
Wehling M. Rapid actions of aldosterone revisited: Receptors in the limelight. J. Steroid Biochem. Mol. Biol. 176: 94–98. 2018.
Logvinenko N.S., Solenov E.I., Ivanova L.N. Role of epithelial sodium channel in the realization of homeostatic effects of aldosterone on the volume of principal cells of cortical collecting ducts in rats after hypoosmotic stress. Bull. Exp. Biol. Med. 155(5): 615–617. 2013.
Borghoff S.J., Lagarde W.H. Assessment of binding of 2,4,4-trimethyl-2-pentanol to low-molecular-weight proteins isolated from kidneys of male rats and humans. Toxicol. Appl. Pharmacol. 119(2): 228–235. 1993.
Cunningham M.L. A Mouse is not a rat is not a human: Species differences. Exist. Toxicol. Sci. 70(2): 157–158. 2002.
Buist S.C., Klaassen C.D. Rat and mouse differences in gender-predominant expression of organic anion transporter (Oat1-3; Slc22a6-8) mRNA levels. Drug. Metab. Dispos. 32(6): 620–625. 2004.
Dresser M.J., Andrew T.G., Giacomini K.M. Kinetic and selectivity differences between rodent, rabbit, and human organic cation transporters (OCT1). J. Pharmacol. Exp. Ther. 292(3): 1146–1152. 2000.
Seki G., Nakamura M., Suzuki M., Satoh N., Horita S. Species differences in regulation of renal proximal tubule transport by certain molecules. World J. Nephrol. 4(2): 307–312. 2015.
Declèves A.E., Sharma K. Obesity and kidney disease: differential effects of obesity on adipose tissue and kidney inflammation and fibrosis. Curr. Opin. Nephrol. Hypertens. 24(1): 28–36. 2015.
Sowers J.R., Whaley-Connell A., Epstein M. Narrative review: The emerging clinical implications of the role of aldosterone in the metabolic syndrome and resistant hypertension. Ann. Intern. Med. 150: 776–783. 2009.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


