Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 198-206
Участие эндотелиального гликокаликса в подавлении активности ангиотензин-превращающего фермента при действии напряжения сдвига
И. Л. Соколов 1, 2, *, А. М. Мелькумянц 1, 2, О. А. Антонова 1
1 ФГБУ НМИЦ кардиологии МЗ РФ
Москва, Россия
2 Московский физико-технический институт (государственный университет)
Моск. обл., г. Долгопрудный, Россия
* E-mail: artmelk@gmail.com
Поступила в редакцию 20.08.2018
После доработки 12.12.2018
Принята к публикации 12.12.2018
Аннотация
В опытах на культуре эндотелиальных клеток пупочной вены человека выясняли роль гликокаликса в уменьшении активности ангиотензин-превращающего фермента (АПФ) в клетках, подвергающихся действию напряжения сдвига. Клетки с интактным и ферментативно поврежденным гликокаликсом, культивированные на пластиковых пластинах, перфузировали при низком (<1 дин/см2) и относительно высоком (20–25 дин/см2) напряжении сдвига в течение 24 ч, после чего измеряли активность АПФ в клеточных лизатах. Показано, что в клетках с интактным гликокаликсом, подвергавшихся действию высокого напряжения сдвига, активность АПФ уменьшалась в течение суточной перфузии на 32 ± 19% по сравнению с клетками, перфузируемыми при низком напряжении сдвига. В клетках с поврежденным гликокаликсом зависимость активности АПФ от напряжения сдвига отсутствовала. Этот результат доказывает, что рецепция эндотелиоцитами напряжения сдвига, приводящая к снижению активности АПФ, опосредуется волокнами эндотелиального гликокаликса.
Артериальные сосуды расширяются при увеличении в них кровотока. Многочисленные исследования показали, что этот феномен, впервые обнаруженный еще во второй половине прошлого века [1], определяется способностью клеток эндотелия расслаблять сосудистые гладкие мышцы в ответ на повышение напряжения сдвига на стенке. Долгое время механорецептором, воспринимающим действующее на сосудистую стенку напряжение сдвига, считали волокна альфа-актина кортикального слоя эндотелиоцитов [2, 3]. Однако исследования последних полутора десятилетий привели к выводу о том, что рецептором напряжения сдвига являются волокна эндотелиального гликокаликса, слоя макромолекул, заякоренных в мембране эндотелиальных клеток и обращенных в просвет сосуда [4, 5]. Согласно современным представлениям эти волокна, деформируясь под действием напряжения сдвига, передают усилие на мембрану эндотелиоцитов, что приводит, в конечном счете, к выделению клетками эндотелия медиатора, снижающего гладкомышечный тонус.
Многочисленные исследования показали, что основной медиатор, продуцируемый эндотелиоцитами в ответ на повышение напряжения сдвига и расслабляющий гладкие мышцы сосудов, представляет собой образующийся из аминокислоты L-аргинина оксид азота (NO) [6]. Однако в ряде работ, осуществленных на артериальных сосудах животных разных видов, было показано, что ингибирование фермента NO-синтазы, обеспечивающего синтез оксида азота, не всегда подавляет эндотелий-зависимую вазодилатацию при повышении кровотока [7–9]. Эти данные свидетельствовали о том, что NO не является единственным медиатором, опосредующим расслабление сосудистых гладких мышц при увеличении кровотока в артериях, но существуют и другие дилататоры, обусловливающие снижение гладкомышечного тонуса в ответ на повышение напряжения сдвига.
В некоторых работах [10, 11] было обнаружено, что увеличенное напряжение сдвига, действующее на культуру эндотелиальных клеток в течение нескольких часов, приводит к снижению активности ангиотензин-превращающего фермента (АПФ). АПФ катализирует расщепление ангиотензина I до столь мощного констриктора как ангиотензин II и одновременно инактивирует брадикинин, являющийся вазодилататором, действие которого на тонус гладких мышц опосредуется эндотелием. Естественно полагать, что снижение активности АПФ должно оказывать сосудорасширяющее действие на кровеносные сосуды, что позволяет считать его отличным от NO эндотелий-зависимым медиатором дилатации артерий в ответ на повышение напряжения сдвига. Роль гликокаликса в снижении активности АПФ при действии на эндотелиоциты напряжения сдвига пока остается не исследованной.
Цель настоящей работы состояла в том, чтобы выяснить, участвует ли эндотелиальный гликокаликс в уменьшении активности АПФ, происходящем при действии напряжения сдвига на клетки эндотелия.
МЕТОДЫ ИССЛЕДОВАНИЯ
Культивированные эндотелиальные клетки пупочной вены человека с интактным и поврежденным гликокаликсом подвергали 24-часовой перфузии при различных напряжениях сдвига. После суточной перфузии клеточную культуру лизировали, и в лизатах измеряли активность АПФ.
Клеточная культура
Первичную культуру эндотелиальных клеток получали из пупочной вены человека в соответствии с ранее описанным методом [12]. Согласно принципам Хельсинской декларации, все роженицы давали информированное согласие на использование взятых у них пупочных вен для научных исследований. Клетки высаживали в чашки Петри, покрытые 0.2%-ным раствором желатина, и культивировали при температуре 37°С в среде DMEM с фетальной бычьей сывороткой (10%), фактором роста эндотелия (200 мкг/мл), пенициллином (50 ед/мл), стрептомицином (50 мкг/мл) и гепарином (5 ед/мл) (все ингредиенты фирмы Sigma, США). После достижения первичной культурой конфлуентного состояния (7–9 сут) проводили ее пассирование с помощью 0.05%-ного раствора трипсина в 0.02%-ном растворе ЭДТА и культивировали два пассажа. Опыты ставили на клетках второго пассажа культуры, которые растили в среде DMEM с добавлением 5% бычьей фетальной сыворотки в атмосфере 5% CO2 и 95% О2. на покрытых желатином пластинах поликарбоната размером 1.5 × 2.5 см до образования конфлуентного монослоя. Перед каждым экспериментом плотность клеток отслеживали с помощью инвертированного фазоконтрастного микроскопа (Nikon, Япония).
Схема установки
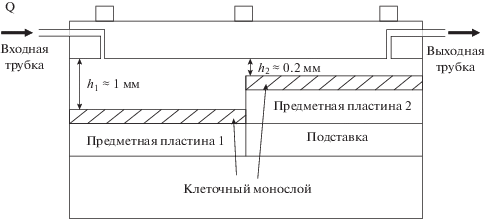
Для организации щелевого течения перфузионной жидкости над монослоем клеток эндотелия при различных напряжениях сдвига использовали выполненную из плексигласа самодельную проточную камеру с регулируемым зазором h (рис. 1).
Напряжение сдвига τ, действующее на эндотелиоциты в проточной камере, оценивали по формуле $\tau = \frac{{6\eta Q}}{{l{{h}^{2}}}},$ где Q – объемный расход перфузата, η – вязкость перфузата, l – ширина пластины поликарбоната (1.5 см), на которой культивировались эндотелиальные клетки, h – ширина зазора, по которому течет перфузионная жидкость. Пластины с клетками устанавливали в камеру таким образом, чтобы величины зазоров над ними различались. Это достигалось с помощью подставки, помещенной под одно из стекол. Выбранные параметры зазоров (h1 и h2) различались примерно в 5 раз, что, как видно из формулы, должно было обеспечивать 25-кратное различие величины напряжения сдвига, которому подвергались клетки на пластинах 1 и 2.
Клетки в камере перфузировались культуральной средой DMEM, содержащей 5% бычьей фетальной сыворотки, с помощью перистальтического насоса Rainin (Франция). Находившаяся в термостатируемой (37°С) колбе жидкость, использовавшаяся для перфузии, сначала протекала над пластиной 1 (по широкому зазору), а затем над пластиной 2 (по узкому зазору), после чего возвращалась в колбу. Таким образом, была реализована замкнутая система перфузии. Объемный расход перфузионной жидкости составлял 20 мл/мин. В ходе эксперимента камера находилась в водяном термостате с установленным значением температуры 37°С, перфузионная среда аэрировалась карбогеном (95% О2 и 5% СО2). Напряжение сдвига на пластине 1 (щель с широким зазором) не превышало 1 дин/см2. Зазор камеры со стеклом 2 (щель с узким зазором) обеспечивал напряжение сдвига порядка 20 дин/см2. Для контроля герметичности камеры в ходе всего времени перфузии на входе в камеру водяным манометром измеряли давление перфузии. Эксперимент считали технически успешным, если в течение 24 ч давление уменьшалось не более, чем на 5%.
В части экспериментов в среду, используемую для перфузии, добавляли ферменты, разрушающие структуру гликокаликса.
Ферментативное разрушение гликокаликса
Для деградации гликокаликса в перфузионную жидкость добавляли гиалуронидазу (Sigma), концентрация которой в перфузионной жидкости составляла 1.5 Ед/мл, или гепариназу III (Sigma, концентрация в перфузионной жидкости – 15 мЕд/мл). В опытах как на культуре эндотелиоцитов [4, 13, 14], так и на изолированных артериях [15] показано, что оба эти фермента, разрушая структуру гликокаликса, подавляют вызываемые повышением напряжения сдвига высвобождение оксида азота и расширение артерий в ответ на увеличение кровотока.
Лизирование клеток
После 24 ч перфузии культуральные пластины помещали в чашку Петри диаметром 30 мм, промывали два раза в фосфатном буфере объемом 5 мл, после чего инкубировали в течение 15 мин в 2 мл фосфатного буфера, содержащего 1% детергента Triton-X100 (Sigma). По истечении 15 мин с пластин с помощью скребка счищали в ту же чашку Петри остатки клеток, разрушенных под действием детергента, после чего лизат хранили пробирке Eppendorf объемом 1 мл при температуре 4°С до измерения в нем активности АПФ.
Измерение активности АПФ
Определение активности АПФ производили спектрофотометрически с использованием фуриакрилоид-замещенного субстрата FA-Phe-Gly-Gly (N α-3-(2-фурил)-акрилоил-L-фенилаланил-L-глицил-L-глицин). За единицу активности принимали количество АПФ, гидролизующее 1 мкМ субстрата за 1 мин. Подробно метод измерения активности АПФ описан в работе [16].
Статистическая обработка результатов
В каждом опыте активность АПФ в лизате клеток, подвергавшихся действию низкого напряжения сдвига, принимали за единицу, и на эту величину нормировали активность АПФ в лизате клеток, подвергавшихся высокому напряжению сдвига. Достоверность различий активности АПФ при высоком и низком напряжении сдвига определяли, пользуясь непараметрическим тестом Краскела–Уоллеса, считая достоверным различие при p < 0.05. Данные серии измерений представлены в виде среднего ± средняя ошибка среднего (m ± se).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Перфузия клеток в течение 24 ч как средой DMEM, не содержащей ферментов, так и средой, содержащей гиалуронидазу или гепариназу III, не приводила ни к нарушению целостности эндотелиоцитов, ни к нарушению конфлуентности слоя эндотелиальных клеток на пластинах. Единственным различием между этими двумя ситуациями было то, что клетки с неповрежденным гликокаликсом, подвергавшиеся действию высокого напряжения сдвига, после двадцатичетырехчасовой перфузии ориентировались вдоль линий тока жидкости, в то время как действие высокого напряжения сдвига на клетки, гликокаликс которых повреждали ферментами, не приводило к изменению их ориентации и вытягиванию по направлению потока.
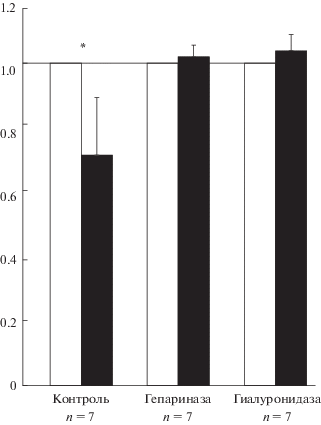
В лизатах эндотелиоцитов с интактным гликокаликсом активность АПФ при высоком (20 дин/см2) напряжении сдвига была достоверно (p < 0.05) ниже (0.68 ± 0.19, n = 7) активности, регистрируемой при низком (<1 дин/см2) напряжении сдвига.
В клетках эндотелия, гликокаликс которых был поврежден гепариназой III (n = 7), активность АПФ при высоком напряжении сдвига практически не отличалась от таковой, регистрируемой при низком напряжении сдвига (1.03 ± 0.09; p > 0.1). Аналогично, если гликокаликс эндотелиоцитов повреждали гиалуронидазой (n = 7), активность АПФ при высоком напряжении сдвига достоверно не отличалась от активности, наблюдавшейся при низком напряжении сдвига (1.05 ± 0.09; p > 0.1).
Результаты измерений активности АПФ в лизатах эндотелиальных клеток, подвергавшихся в течение 24 ч действию высокого и низкого напряжения сдвига в контрольных условиях (при интактном гликокаликсе) и при повреждении гликокаликса гепариназой III и гиалуронидазой, представлены на рис. 2.
Рис. 2.
Зависимость активности АПФ в лизатах эндотелиальных клеток от напряжения сдвига. Белые столбики – низкое напряжение сдвига (менее 1 дин/см2); активность АПФ принята равной 1; черные столбики – высокое напряжение сдвига (20 дин/см2). Контроль – клетки с интактным гликокаликсом. * – достоверное различие (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Напряжение сдвига, представляющее собой силу вязкого трения, действующую со стороны текущей крови на сосудистую стенку, является важным фактором, регулирующим гладкомышечный тонус. Эта регуляция определяется способностью клеток эндотелия в ответ на повышение напряжения сдвига синтезировать и выделять в медиальный слой сосудистой стенки факторы, расслабляющие гладкие мышцы. Механочувствительность эндотелия не только обеспечивает постоянное приспособление гидравлического сопротивления артериальных сосудов к величине протекающего по ним кровотока [17, 18], но и, что очень важно, ослабляет реакцию артерий на сосудосуживающие стимулы [19, 20], что позволяет рассматривать способность эндотелия регулировать гладкомышечный тонус при изменениях напряжения сдвига на стенке как антиконстрикторный, и даже как антигипертензивный фактор [21, 22].
В подавляющем большинстве работ, в которых изучалась обусловленная механочувствительностью эндотелия реакция сосудов на изменения напряжения сдвига, рассматривался только кратковременный, длящийся в течение нескольких минут, ответ артерий на повышение скорости кровотока. Лишь в небольшом числе работ исследовалось действие на эндотелиоциты долговременного, длящегося десятки часов и более, повышения напряжения сдвига [10, 11, 23–25]. Опыты показали, что в ответ на кратковременное повышение напряжения сдвига происходит расслабление сосудистых гладких мышц, обусловленное выделением эндотелиоцитами оксида азота или простациклина [8]. Восстановление исходного напряжения сдвига приводит в течение нескольких минут к возвращению гладкомышечного тонуса к исходному уровню. Что касается долговременного повышения напряжения сдвига на эндотелии, то оно сопровождается ориентацией и удлинением эндотелиальных клеток параллельно вектору напряжения сдвига [23, 24] и ремоделированием сосудов [25, 26].
В 1997 г. было впервые показано, что действие в течение нескольких часов на культуру клеток эндотелия бычьей легочной артерии достаточно высокого напряжения сдвига приводит к зависящему от времени воздействия уменьшению активности АПФ [10]. В клетках, которые в течение 18 ч подвергались действию напряжения сдвига равного 20 дин/см2, активность АПФ снижалась практически вдвое. При этом экспрессия мРНК АПФ снижалась на 82%. Эти результаты позволили авторам заключить, что увеличенное напряжение сдвига меняет функцию эндотелия, подавляя экспрессию гена и белка АПФ. Позднее этот результат нашел подтверждение в опытах на культуре эндотелиоцитов пупочной вены и коронарной артерии человека [11], активность АПФ в которых уменьшалась под действием напряжения сдвига равного 12 дин/см2 в течение 24 ч на 28%, а в течение 72 ч почти на 50%. Авторы этой работы выяснили, что увеличение действующего на клетки напряжения сдвига сопровождается уменьшением активности АМФ-активируемой киназы альфа два, что приводит к фосфорилированию и активации белка р53, что, в свою очередь, активирует микроРНК 143/145, увеличение экспрессии которой обусловливает снижение как экспрессии белка АПФ, так и активности этого фермента [11].
Поскольку АПФ обусловливает образование вазоконстриктора ангиотензина II и подавление синтеза вазодилататора брадикинина, результаты работ [10] и [11] подтверждали высказанное ранее предположение о том, что чувствительность эндотелия к напряжению сдвига является не просто фактором, ослабляющим ответы сосудов на констрикторные стимулы, но и обеспечивает постоянно реализующееся некоторое расслабление гладких мышц в условиях нормального (не увеличенного) кровотока.
В течение последних полутора десятилетий было получено достаточное число данных, доказывающих, что первичным механорецептором, воспринимающим действующее на стенку напряжение сдвига, являются волокна эндотелиального гликокаликса. В исследованиях, проведенных на культуре эндотелиальных клеток, было показано, что ферментативное повреждение или разрушение гликокаликса подавляет выделение оксида азота в ответ на повышение напряжение сдвига [13, 14]. В опытах на изолированных сонных артериях кролика мы установили, что артерии, эндотелиальный гликокаликс которых был поврежден гепариназой III или гиалуронидазой, утрачивают способность реагировать расширением на повышение скорости кровотока [15]. Все эти результаты свидетельствуют о том, что “острый”, развивающийся в течение нескольких секунд ответ эндотелиоцитов на повышение напряжения сдвига, состоящий в активации NO-синтазы и выделении оксида азота, опосредуется интактным гликокаликсом. Волокна гликокаликса деформируются под действием напряжения сдвига, передают возникающее в них усилие на актиновые волокна кортикального слоя эндотелиоцитов, деформация которых, в свою очередь, активирует NO-синтазу, что приводит к снижению гладкомышечного тонуса.
Что касается ответа эндотелия на долговременное, измеряющееся часами или сутками, повышение напряжения сдвига, то здесь можно выделить два эффекта. Во-первых, ориентацию эндотелиоцитов и их удлинение вдоль линий тока [24] и, во-вторых, изменение активности АПФ [10, 11]. Рецепция напряжения сдвига при реализации обоих этих эффектов или любого одного из них может, вообще говоря, осуществляться как непосредственно волокнами актина кортикального слоя эндотелиоцитов, так и гликокаликсом. В работе [23] было показано, что изменение формы и ориентации клеток эндотелия, подвергающихся в течение нескольких суток действию увеличенного напряжения сдвига, происходит только при сохранении интактного гликокаликса. Вопрос о роли гликокаликса в изменении активности АПФ до настоящего времени не исследовался.
Опыты, результаты которых представлены в настоящей работе, были призваны выяснить, является ли ответ на долговременное повышение напряжения сдвига на эндотелии, выражающийся в уменьшении активности АПФ, также зависящим от сохранности интактного гликокаликса. Приведенные на рис. 2 результаты показывают, что в эндотелиальных клетках с интактным гликокаликсом, подвергавшихся в течение 24 ч действию напряжения сдвига порядка 20 дин/см2, активность АПФ снижается на 32 ± 19%, что вполне соответствует данным работ [10] и [11]. В то же время, повреждение важнейших структур эндотелиального гликокаликса либо гиалуронидазой, разрушающей стержни гиалуронана, либо гепариназой III, повреждающей волокна гепаран-сульфата, приводило к тому, что эндотелиальные клетки переставали отвечать уменьшением активности АПФ на длительное (24 ч) действие такого же, как в контроле (20 дин/см2), напряжения сдвига. Эти данные свидетельствуют о том, что подавление активности АПФ при длительном воздействии на эндотелиоциты высоким напряжением сдвига опосредуется гликокаликсом.
Результаты, представленные в настоящей работе, подтверждают сложившееся на сегодняшний день представление о том, что волокна гликокаликса являются единственным эндотелиальным механорецептором и именно их способность деформироваться под действием напряжения сдвига определяет все механочувствительные эндотелий-зависимые регуляторные реакции артериальных сосудов.
Список литературы
Смиешко В., Хаютин В.М., Герова М., Геро Я., Рогоза А.Н. Чувствительность малой артерии мышечного типа к скорости кровотока: реакция самоприспособления просвета артерий. Физиол. журн. СССР. 65: 291–298. 1979. [Smiesko V., Khayutin V.M., Gerova M., Gero J., Rogoza A.N. Sensitivity of small muscular-type artery to blood flow rate: reaction of arterial lumen self-adaptation. Russ. J. Physiol. 65: 291–298. 1979. (In Russ.)].
Мелькумянц А.М., Балашов С.А., Смиешко В., Хаютин В.М. Избирательное подавление чувствительности артерий к скорости кровотока глутаровым альдегидом. Бюлл. экспер. биол. мед. 102: 568–570. 1986. [Melkumyants A.M., Balashov S.A., Smiesko V., Khayutin V.M. Selective blockade of arterial sensitivity to blood flow using glutaraldehyde. Bull. Exper. Biol. Med. 102: 568–570. 1986. (In Russ.)].
Мелькумянц А.М., Балашов С.А. Роль деформируемости эндотелиальных клеток в реакциях артерий на изменения напряжения сдвига. Рос. физиол. журн. им. Сеченова. 85: 910–917. 1999. [Melkumyants A.M., Balashov S.A. The role of endothelial cell deformability in response of arteries to changes in shear stress. Russ. J. Physiol. 85: 910–917. 1999. (In Russ.)] .
Florian J.A., Kosky J.A., Ainslie K., Pang Z., Dull R.O., Tarbell J.M. Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ. Res. 93: 136–142. 2003.
Weinbaum S., Zhang X., Han Y., Vink H., Cowin S.C. Mechanotransduction and flow across the endothelial glycocalyx. Proc. Natl. Acad. Sci. USA. 100: 7988–7995. 2003.
Palmer R.M.J., Ferrige A.G., Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 237: 524–526. 1987.
Dube S., Canty J.M. Flow-mediated vasodilation is not dependent upon nitric oxide production in isolated porcine coronary conduit arteries. Circulation. 92(8) (suppl.1): 768. 1995.
Koller A., Kaley G. Prostaglandins mediate arteriolar dilation to increased blood flow velocity in skeletal muscle microcirculation. Circ. Res. 67: 529–534. 1990.
Melkumyants A.M., Balashov S.A., Klimachev A.N., Kartamyshev S.P., Khayutin V.M. Nitric oxide does not mediate flow induced endothelium dependent arterial dilatation in the cat. Cardiovasc. Res. 26(3): 256–260. 1992.
Rieder M., Carmona R., Krieger J., Pritchard K., Greene A. Suppression of angiotensin-converting enzyme expression and activity by shear stress. Circ. Res. 80: 312–319. 1997.
Kohlstedt K., Trouvain C., Boettger T., Shi L., Fisslthaler B., Fleming I. The AMP-activated protein kinase regulates endothelial cell angiotensin-converting enzyme expression via p53 and the post-transcriptional regulation of microRNA-143/145. Circ. Res. 112(8): 1150–1158. 2013.
Antonov A.S., Nikolaeva M.A., Klueva T.S., Romanov Y.A., Babaev V.R., Bystrevskaya V.B., Perov N.A., Repin V.S., Smirnov V.N. Primary culture of endothelial cells from atherosclerotic human aorta: Part 1. Identification, morphological and ultrastructural characteristics of two endothelial cell subpopulations. Atherosclerosis. 59: 1–19. 1986.
Pahakis M.Y., Kosky J.R., Tarbell J.M. The role of endothelial glycocalyx components in mechanotrasduction of fluid shear stress. Biochem. Biophys. Res. Comm. 355(1): 228–233. 2007.
Mochizuki S., Vink H., Hiramatsu O., Kajita T., Shigeto F., Spaan J.A., Kajiya F. Role of hyaluronic acid glycosaminoglycans in shear-induced endothelium-derived nitric oxide release. Am. J. Physiol. 285(2): H722–H726. 2003.
Мелькумянц А.М., Балашов С.А., Гончар И.В. Влияние повреждения эндотелиального гликокаликса на способность артерий регулировать свой просвет при изменениях скорости кровотока. Рос. физиол. журн. им. И.М. Сеченова. 103: 1370–1376. 2017. [Melkumyants A.M., Balashov S.A., Gonchar I.V. The influence of endothelial glycocalyx injury on the ability of arteries to control their lumen under changes in blood flow. Russ. J. Physiol. 103(12): 1370–1376. 2017. (In Russ.)].
Piquilloud Y., Reinharz A., Roth M. Studies on the angiotensin converting enzyme with different substrates. Biochim. Biophys. Acta. 206: 136–142. 1970.
Мелькумянц А.М., Балашов С.А. Механочувствительность артериального эндотелия. М. Триада. 2005. [Melkumyants A.M., Balashov S.A. Mekhanochuchuvstitelnost arterialnogo endoteliya [Mechanosensitivity of arterial endothelium]. Moscow. Triada. 2005.].
Melkumyants A.M., Balashov S.A., Khayutin V.M. Control of arterial lumen by shear stress on endothelium. News in Physiol. Sci. 10: 204–210. 1995.
Melkumyants A.M., Balashov S.A., Kartamyshev S.P. Anticonstrictor effect of endothelium sensitivity to shear stress. Pflugers Arch. 427: 264–269. 1994.
Kartamyshev S.P., Balashov S.A., Melkumyants A.M. Role of endothelium sensitivity to shear stress in noradrenaline-induced constriction of feline femoral arterial bed under constant flow and constant pressure perfusions. J. Vasc. Res. 44: 1–10. 2007.
Khayutin V.M., Lukoshkova E.V., Rogoza A.N., Nikolsky V.P. Negative feedbacks in pathogenesis of primary arterial hypertension: mechanosensitivity of the endothelium. Blood Pressure. 4(2): 70–76. 1995.
Хаютин В.М. Механорецепция артериальных сосудов и механизмы защиты от развития гипертонической болезни. Кардиология. 7: 27–35. 1996. [Khayutin V.M. Mechanoreception of arterial vessels and the mechanisms of antihypertensive defence. Cardiology. 7: 27–35. 1996. (In Russ.)].
Yao Y., Rabodzey A., Dewey C.F. Glycocalyx modulates the motility and proliferative response of vascular endothelium to fluid shear stress. Am. J. Physiol. 293: H1023–H1030. 2007.
Remuzzi A., Dewey C.F., jr., Davies P.F., Gimbrone M.A., Jr. Orientation of endothelial cells in shear fields in vitro. Biorheology. 21(4): 617–630. 1984.
Languille L., O’Donnell F. Reductions in arterial diameter produced by chronic decreases in blood flow are endothelium dependent. Science. 231: 405–407. 1986.
Kamiya A., Togawa T. Adaptive regulation of wall shear stress to flow change in the canine carotid artery. Am. J. Physiol. 239: H14–H21. 1980.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова