Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 207-215
Системные гемостатические и гемостазиологические эффекты фибрин-мономера при прямом ингибировании тромбина в эксперименте
В. М. Вдовин 1, 3, *, А. П. Момот 2, 3, В. О. Красюкова 1, И. Г. Толстокоров 5, Д. А. Орехов 4, В. О. Шевченко 5, И. И. Шахматов 1, 3, Н. А. Лычева 1, 3
1 Алтайский государственный медицинский университет
Барнаул, Россия
2 Алтайский филиал ФГБУ “Национальный медицинский исследовательский
центр гематологии” Минздрава России
Барнаул, Россия
3 Научно-исследовательский институт физиологии и фундаментальной медицины СО РАН
Новосибирск, Россия
4 Алтайский краевой кардиологический диспансер
Барнаул, Россия
5 ООО КДЦ “Добрый доктор”
Барнаул, Россия
* E-mail: erytrab@gmail.com
Поступила в редакцию 03.09.2018
После доработки 24.09.2018
Принята к публикации 26.09.2018
Аннотация
Исследованы системные гемостатические и гемостазиологические эффекты фибрин-мономера (ФМ; 0.25 мг/кг) при его внтуривенном введении на фоне приема дабигатрана этексилата (15–20 мг/кг) по сравнению с плацебо, концентратом факторов протромбинового комплекса (40 ед/кг) и эптакогом альфа (активированным) (270 мкг/кг) в модели дозированной травмы печени на 62-х кроликах породы Шиншилла. Установлено, что ФМ в сравнении с плацебо в 2.9 раза уменьшал объем и в 1.7 раза темп кровопотери, несмотря на индуцированную дабигатраном гипокоагуляцию. Препараты сравнения гемостатической эффективности не показали. ФМ не влиял на параметры коагулограммы (отсутствие видимого гемостазиологического эффекта), в то время как сравниваемые с ним препараты проявляли признаки усиления гемостатического потенциала. Предполагается, что гемостатические эффекты низких, физиологических доз ФМ могут быть реализованы помимо тромбина (фактора IIa), что определяет необходимость дальнейших исследований.
Фибрин-мономер или дез-ААВВ-фибриноген представляет собой гликопротеид – продукт протеолитического действия тромбина на фибриноген. Функция фибрин-мономера направлена на полимеризацию (самосборку) и формирование основы тромба [1]. Проведенные более 50-лет назад исследования в лаборатории Б.А. Кудряшова и соавт. [2] показали, что внутривенное введение крысам фибрин-мономера в сравнительно больших дозах (25 мг/кг и более) приводит к массивному внутрисосудистому тромбообразованию и гибели животных, что, с большей долей вероятности, является следствием полимеризации вводимого препарата. Понимая значимость фибрин-мономера в обеспечении гемостатических реакций, нами совместно с коллективом лаборатории фармакологии гемостаза Гематологического научного центра (Москва) эксперименты в данном направлении были продолжены, в результате чего было установлено, что сравнительно меньшие, физиологические дозы [3, 4] в/в вводимого фибрин-мономера не только совместимы с жизнью животных, но и обладают системным гемостатическим действием в условиях дозированной травмы. Механизм данного явления не вполне ясен, поскольку столь мизерного количества вводимого в кровоток фибрин-мономера недостаточно для формирования фибринового сгустка в местах повреждения сосудов. Учитывая то, что тромбин (фактор IIa) является ключевым ферментом свертывания крови, для объяснения системного гемостатического действия фибрин-мономера нами была выдвинута гипотеза, согласно которой дез-ААВВ-фибриноген способен оказывать гемостатическое действие in vivo при непосредственной блокаде тромбина. Для ее проверки был использован прямой конкурентный ингибитор тромбина – дабигатрана этексилат. Отметим также, что несмотря на одобрение в 2015 г. Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration, FDA) антидота к дабигатрану – идаруцизумаба (Праксбайнд®, фирма “Берингер Ингельхайм ГмбХ”) [5–7] в широком доступе нет надежного и доступного средства, минимизирующего кровотечение, развившегося на фоне терапии дабигатрана этексилатом [8, 9]. В то же время отмечается, что при отсутствии специфического антидота в случаях кровотечения у пациентов, принимающих дабигатрана этексилат, терапевтическим эффектом могут обладать концентрат протромбинового комплекса и эптаког альфа (активированный) [10–14].
Целью исследования явилось изучение системных гемостатических и гемостазиологических эффектов фибрин-мономера при его внутривенном введении на фоне прямого ингибирования тромбина дабигатраном.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на 62-х здоровых половозрелых кроликах-самцах породы Шиншилла массой 3.0–4.0 кг. Животные содержались в стандартных условиях в соответствии с СП 2.2.1.3218-14 “Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)” в индивидуальных клетках с решетчатым полом без подстила, с зоной для отдыха (общей площадь пола не менее 0.28 м2), со свободным доступом к пище и воде. Световой режим составлял 12 ч света и 12 ч темноты. Животные были получены из вивария ФГБНУ “Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук” (ИЦиГ СО РАН) (г. Новосибирск).
При помощи генератора случайных чисел из животных были сформированы 5 экспериментальных групп (дизайн исследования см. рис. 1).
Рис. 1.
Дизайн исследования. Примечание. ФМ – фибрин-мономер, КФПК – концентрат факторов протромбинового комплекса, ЭА – эптаког альфа.
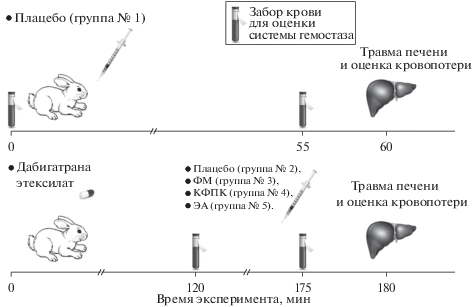
Животным группы № 1 (n = 11) в краевую вену уха при помощи иглы-катетера “Cathy” (фирма “HMD”) вводили плацебо (4.0 М раствор мочевины, соответствующий ее концентрации в растворе фибрин-мономера) объемом 0.5 мл. Для подавления активности тромбина всем животным групп со 2-й по 5-ю в начале эксперимента перорально вводился растворенный в воде дабигатрана этексилат (“Прадакса®”, фирма “Берингер Ингельхайм Фарма ГмбХ и Ко.КГ”) в дозе 15–20 мг/кг. Спустя два часа этим животным осуществляли в/в введение (в краевую вену уха) гемостатического препарата, обладающего системным действием, или плацебо. В качестве опытного препарата выступал фибрин-мономер, произведенный фирмой “Технология-Стандарт” (Россия). Препаратами сравнения, применяемыми в лечебной практике, явились концентрат факторов протромбинового комплекса (КФПК) (“Протромплекс 600”, фирма “Бакстер”) и эптаког альфа (активированный) (“НовоСэвен®”, фирма “Ново Нордиск А/С”). Введение плацебо (в объеме 0.5 мл) на фоне действия дабигатрана осуществлялось животным группы № 2 (n = 10). Системные гемостатики применялись в группах животных № 3–5, также предварительно получивших перорально дабигатрана этексилат. В группе № 3 (n = 13) использовался раствор фибрин-мономера в дозе 0.25 мг/кг массы тела, в группе № 4 (n = 14) – раствор препарата “Протромплекс 600” в дозе 40 ед/кг и в группе № 5 (n = 14) – раствор препарата “НовоСэвен®” в дозе 270 мкг/кг.
Спустя один час после в/в введения системного гемостатика или плацебо предварительно наркотизированным экспериментальным животным наносилась дозированная травма печени в соответствии с имеющимися рекомендациями [15]. Затем с помощью стерильных марлевых салфеток оценивался характер паренхиматозного кровотечения – по объему кровопотери в % от объема циркулирующей крови (% ОЦК) с учетом массы тела животного и темпу кровопотери в единицу времени (мг/с) [16, 17].
Эксперимент заканчивали в момент прекращения кровотечения из раны, либо после остановки сердечно-легочной деятельности у животного (летальный исход).
Для исследования системы гемостаза кровь получали из краевой вены уха (самотеком) в соответствии с имеющимся рекомендациям [15]. Эту процедуру проводили дважды: непосредственно перед в/в введением препаратов, а также спустя 1 час после инъекции гемостатического препарата или плацебо – перед нанесением дозированной травмы печени (рис.1). Кровь помещали в пробирки с соответствующими стабилизаторами: для подсчета числа тромбоцитов – с калиевой солью этилендиаминтетрауксусной кислоты (ЭДТА) (AQUISEL® K3Е/EDTA 3K, фирма “Aquisel S.L.”, Испания) в объеме 0.25 мл, для изучения других параметров – в полистироловые центрифужные градуированные с полихлорвиниловыми крышками, содержащими 0.11 М (3.8%-ный) раствор цитрата натрия (соотношение крови и стабилизатора 9 : 1), в объеме 5.0 мл, при этом первые 3–4 капли крови после надреза отбрасывали. Далее стабилизированную цитратом натрия кровь центрифугировали при 1200 g в течение 15 мин для получения обедненной тромбоцитами плазмы крови.
Эксперименты на животных проводили в соответствии с принципами Базельской декларации, Европейской конвенцией и директивами по охране позвоночных животных, используемых в эксперименте 86/609/ЕЕС, а также Хельсинской декларацией и “Правилами проведения работа с использованием экспериментальных животных” [18]. Работа была одобрена локальным этическим комитетом ФГБОУ ВО “Алтайский государственный медицинский университет” МЗ РФ (протокол № 12 от 12.11.2015 г.).
Исследование системы гемостаза включало в себя оценку числа тромбоцитов в крови (с помощью гематологического анализатора “Drew3” фирмы “Drew Scientific Inc.”, Англия), протромбинового (ПВ), тромбинового (ТВ) и эхитоксового (ЭВ) времени свертывания, а также концентрации фибриногена – на коагулометре “Thrombostat 2” (фирма “Behnk Electronik”, Германия). Кроме того, определяли уровень растворимых фибрин-мономерных комплексов (РФМК) и активность антитромбина (на спектрофотометре “Photometer 5010 v5+” фирмы “Robert Riele GmbH Co & KG”, Германия). Результаты оценки ПВ, ТВ и ЭВ были представлены в виде отношения, рассчитанного по формуле:
Для изучения показателей коагулограммы использовали наборы реагентов фирмы “Технология-Стандарт” (Россия) с учетом имеющихся рекомендаций [19]. При определении уровня D-димера в плазме крови применяли тест-систему “NycoCard® D-Dimer” (фирма “Axis-Shield PoC AS”, Норвегия) и анализатор-рефлектометр “NycoCard Rader II”.
Распределение признаков в выборках оценивали по критерию Шапиро–Уилки. В зависимости от распределения признаков применяли t-критерий Стьюдента, U-критерий Манна–Уитни или W-критерий Вилкоксона. Качественные показатели оценивали с помощью точного критерия Фишера. Корреляционную взаимосвязь между изучаемыми признаками определяли при помощи коэффициента ранговой корреляции Спирмена (rS). Различия считали достоверными при уровне статистической значимости p ≤ 0.05. Обработка экспериментальных данных проводили в статистической программе Statistica 10 (StatSoft, США). Экспериментальные данные представлены в виде медианы (Ме) и перцентилей (25–75).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Объем кровопотери в группе животных, получивших дабигатрана этексилат и плацебо (группа № 2) был в 1.8 раза выше, в сравнении с аналогичным показателем в группе животных с плацебо (группа № 1), в частности, по медиане: 10.1 (4.1–13.5)% ОЦК и 18.1 (14.3–24.4)% ОЦК соответственно (рис. 2). При этом темп кровопотери после нанесения дозированной травмы печени в указанных группах животных не различался. Полученные результаты в группах № 1 и 2 явились отправной точкой для изучения эффектов гемостатических препаратов на фоне повышенной кровоточивости, обусловленной действием дабигатрана.
Рис. 2.
Сравнительный анализ параметров кровопотери у экспериментальных животных после дозированной травмы печени на фоне ингибирования тромбина дабигатраном. А – объем кровопотери, Б – темп кровопотери; значения представлены в виде медианы – горизонтальной линии внутри прямоугольника, включающего 50% полученных значений и значений, соответствующих 2.5 и 97.5 перцентилей – нижний и верхний вертикальные бары.
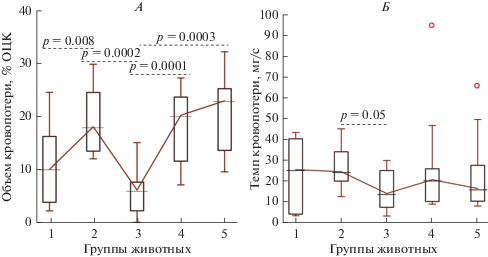
Далее было установлено, что предварительное (перед нанесением травмы) введение фибрин-мономера на фоне антикоагулянтного действия дабигатрана (группа № 3), приводит к значительному снижению объема посттравматической кровопотери в сравнении с таковой у животных, получивших дабигатрана этексилат и плацебо (группа № 2). В частности, объем кровопотери в группе № 3 был меньше в 2.9 раза по сравнению с аналогичным показателем в группе № 2 (по медиане: 6.2 (2.4–7.6)% ОЦК против 18.1 (14.3–24.4)% ОЦК соответственно). Наряду с этим, темп кровопотери после применения фибрин-мономера в группе № 3 уменьшался в 1.7 раза в сравнении с группой № 2 (по медиане: 14.3 (8.3–24.3) мг/с против 24.6 (20.7–32.7) мг/с соответственно).
Эксперименты также показали, что применение системных гемостатических препаратов – КФПК (группа № 4) и эптакога альфа (группа № 5) в отличие от фибрин-мономера (группа № 3) не приводило к уменьшению объема и темпа кровопотери на фоне действия дибагатрана.
Наряду со сказанным выявлена взаимная зависимость между объемом и темпом кровопотери у животных, получивших фибрин-мономер (группа № 3), rS = 0.63, p = 0.02, которая отсутствовала в других наблюдаемых группах.
В ходе исследования регистрировалось количество животных, у которых наступал летальный исход на фоне продолжающегося паренхиматозного кровотечения ( табл. 1).
Таблица 1.
Летальность животных в различных экспериментальных группах
| Показатель | Группа № 1 (n = 11) |
Группа № 2 (n = 10) |
Группа № 3 (n = 13) |
Группа № 4 (n = 14) |
Группа № 5 (n = 14) |
|---|---|---|---|---|---|
| Летальность, количество особей/% |
0/0 | 6/60 | 2/15 | 12/85 | 11/79 |
| р1–2 < 0.005 | р1–3 > 0.05 | р1–4 < 0.001 | р1–5 < 0.001 | ||
| р2–3 < 0.05 | р2–4 > 0.05 | р2–5 > 0.05 | |||
| р3–4 < 0.001 | р3–5 < 0.002 | ||||
| р4–5 > 0.05 |
Показано, что при связанной с приемом дабигатрана этексилата повышенной кровоточивости, применение фибрин-мономера сопровождалось меньшей летальностью (15%), в сравнении с использованием эптакога альфа (79%) или КФПК (85%).
Наряду с вышеизложенным были проанализированы изменения показателей системы гемостаза после двукратного забора крови с целью оценки как исходного (базового) антикоагулянтного действия дабигатрана, так и гемостазиологических последствий применения фибрин-мономера или отмеченных выше системных гемостатических препаратов (табл. 2).
Таблица 2.
Изменения в системе гемостаза у групп животных на фоне введения антикоагулянта, гемостатических препаратов и плацебо
| Показатели | Группа № 1 | Группа № 2 | Группа № 3 | Группа № 4 | Группа № 5 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| до (0) | после (1) | до (2) | после (3) | до (4) | после (5) | до (6) | после (7) | до (8) | после (9) | |
| Число тромбоцитов, ×109/л | 617.0 | 524.0 | 541.5 | 501.0 | 559.0 | 550.5 | 521.0 | 432.5 | 638.5 | 638.0 |
| [456.0–760.5] | [480.5–686.5] | [481.3–553.0] | [421.5–517.5] | [528.3–566.5] | [499.8–565.3] | [458.0–601.8] | [379.8–501.5] | [535.3–709.5] | [523.8–717.5] | |
| р0–1 > 0.05 | р2–3 > 0.05 | р4–5 > 0.05 | р6–7 = 0.05 | р8–9 > 0.05 | ||||||
| ПВ, отношение | 0.9 | 0.9 | 1.7 | 1.8 | 1.9 | 1.3 | 2.0 | 2.2 | 1.9 | 1.0 |
| [0.9–1.4] | [0.9–1.3] | [1.4–2.6] | [1.6–2.0] | [1.2–2.0] | [1.2–1.5] | [1.9–2.1] | [2.1–2.5] | [1.5–2.4] | [0.9–1.3] | |
| р0–1 > 0.05 | р2–3 > 0.05 | р4–5 > 0.05 | р6–7 = 0.02 | р8–9 = 0.003 | ||||||
| ТВ, отношение | 1.0 | 0.9 | н.с. в 8 случаях из 10 | н.с. в 8 случаях из 10 | н.с. в 11 случаях из 13 | н.с. в 11 случаях из 13 | н.с. в 4 случаях из 14 | н.с. в 3 случаях из 14 | н.с. в 10 случаях из 14 | н.с. в 11 случаях из 14 |
| [0.9–1.0] | [0.9–1.0] | |||||||||
| р0–1 > 0.05 | ||||||||||
| ЭВ, отношение | 1.0 | 1.0 | 3.4 | 3.5 | 2.6 | 2.5 | 2.1 | 2.5 | 2,5 | 3.0 |
| [1.0–1.1] | [1.0–1.1] | [3.1–3.8] | [3.1–4.1] | [2.2–2.9] | [2.2–2.7] | [1.8–2.5] | [2.0–3.3] | [2.13.7–] | [2.2–3.6] | |
| р0–1 > 0.05 | р2–3 > 0.05 | р4–5 > 0.05 | р6–7 = 0.01 | р8–9 > 0.05 | ||||||
| Фибриноген, г/л | 3.30 | 3.70 | 2.9 | 2.9 | 3.2 | 3.1 | 4.1 | 3.6 | 2.9 | 2.8 |
| [2.80–4.40] | [2.80–4.50] | [2.3–4.2] | [2.4–3.1] | [2.9–3.5] | [2.9–3.5] | [3.4–5.0] | [3.0–4.7] | [2.4–3.2] | [2.4–3.4] | |
| р0–1 > 0.05 | р2–3 > 0.05 | р4–5 > 0.05 | р6–7 = 0.03 | р8–9 > 0.05 | ||||||
| РФМК, мг/100 мл | 3.0 | 3.0 | 3.0 | 3.0 | 3.0 | 5.5 | 3.0 | 12.5 | 3.0 | 3.5 |
| [3.0–6.0] | [3.0–3.5] | [3.0–3.0] | [3.0–3.0] | [3.0–8.9] | [3.0–11.3] | [3.0–4.0] | [3.5–18.0] | [3.0–3.0] | [3.0–7.8] | |
| р0–1 > 0.05 | р2–3 > 0.05 | р4–5 > 0.05 | р6–7 = 0.02 | р8–9 > 0.05 | ||||||
| D-димер, нг/мл | 100.0 | 100.0 | 100.0 | 100.0 | 100.0 | 200.0 | 200.0 | 550.0 | 100.0 | 300.0 |
| [100.0–100.0] | [100.0–175.0] | [100.0–200.0] | [100.0–200.0] | [100.0–200.0] | [100.0–300.0] | [200.0–300.0] | [400.0–800.0] | [100.0–200.0] | [225.0–300.0] | |
| р0–1 > 0.05 | р2–3 > 0.05 | р4–5 > 0.05 | р6–7 = 0.003 | р8–9 > 0.05 | ||||||
Примечание. Результаты представлены в виде Ме [25–75], где Ме – медиана в выборочной совокупности, [25–75] – 25-й и 75-й перцентили; р – уровень статистической значимости различий сравниваемых показателей; “до” – показатели до в/в введения гемостатических препаратов или плацебо, “после” – показатели через час после введения гемостатических препаратов или плацебо; ПВ – протромбиновое время, ТВ – тромбиновое время, ЭВ – эхитоксовое время, РФМК – растворимые фибрин-мономерные комплексы; н.с. – нет свертывания.
В соответствии с полученными данными изменений параметров коагулограммы до и после введения плацебо (группа № 1) не найдено.
В то же время отмечалась выраженная гипокоагуляция, обусловленная приемом дабигатрана этексилата, в группе № 2, иллюстрированная гипокоагуляцией по ПВ, часто наблюдаемой несвертываемостью плазмы крови по ТВ и 3.4–3.5 кратным увеличением отношения ЭВ (табл. 2). Эти результаты обследования вполне объясняют отмеченную ранее повышенную посттравматическую кровопотерю и летальность в данной группе животных (рис. 2).
Применение фибрин-мономера (группа № 3) и системных гемостатических препаратов (группы № 4 и 5) на фоне действия дабигатрана не приводило к коррекции гипокоагуляционного сдвига, что находилось в противоречии с наблюдаемыми гемостатическими эффектами (рис. 2).
Обращало на себя внимание, что использование КФПК сопровождалось протромбогенными сдвигами в виде снижения числа тромбоцитов в крови, концентрации фибриногена и нарастания уровней РФМК и D-димера, что, однако, не привело к уменьшению кровопотери. В случае введения эптакога альфа отмечена коррекция гипокоагуляционного сдвига (по данным ПВ), которая не сочеталась с потреблением тромбоцитов и фибриногена.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные эксперименты, направленные на проверку гипотезы о наличии гемостатического эффекта фибрин-мономера на фоне прямой блокады действия тромбина, продемонстрировали значительное снижение кровопотери при системном введении данного производного фибриногена перед дозированной травмой печени. Примечательно, что использование фибрин-мономера в дозе 0.25 мг/кг снижало не только объем (в 2.9 раза), но и темп кровотечения (в 1.7 раза), несмотря на индуцированную гипокоагуляцию, обусловленную приемом дабигатрана этексилата. При этом установлено, что фибрин-мономер не влиял на параметры коагулограммы (отсутствие видимого гемостазиологического эффекта) в то время как сравниваемые с ним лекарственные гемостатические препараты проявляли признаки усиления гемостатического потенциала в виде протромбогенного сдвига (у КФПК) и реверсии ПВ (у эптакога альфа). Кроме того, в отличие от фибрин-мономера системные гемостатические препараты не влияли на параметры кровопотери и оказались неэффективными, на что указывает сравнительно более высокий уровень летальности в группах животных № 4 и 5 (79–85%), в сопоставлении с группой № 3 (15%).
Представленные данные соответствуют позиции ряда авторов в том, что сведения о клинической эффективности препаратов КФПК и рекомбинантного фактора VIIa при кровотечениях, спровоцированных приемом дабигатрана этексилата, не вполне доказано [20], в том числе и в экспериментах на животных [21]. Однако на этом фоне примечательно, что системное введение фибрин-мономера показало бесспорное его преимущество по кровоостанавливающему действию.
ЗАКЛЮЧЕНИЕ
Учитывая сказанное, можно сделать вывод о том, что гемостатические эффекты низких доз фибрин-мономера реализуются в обход тромбина (фактора IIа) и без видимой коррекции гипокоагуляции. Данный феномен в настоящее время не имеет своего объяснения и нуждается в расшифровке соответствующих механизмов.
Список литературы
Зубаиров Д.М. Молекулярные основы свертывания крови и тромбообразования. Казань. Фэн. 2000. [Zubairov D.M. Molekulyarnie osnovi svertivaniya krovi i tromboobrazovaniya [Molecular basis of blood clotting and thrombus formation]. Kazan. Fen. 2000].
Кудряшов Б.А., Молчанова Л.В., Калишевская Т.М., Базазьян Г.Г., Пасторова В.Е., Сытина Н.П. О функциональном состоянии противосвертывающей системы при внутривенном введении фибрин мономера. Вопр. мед. химии. XV (5): 483–486. 1969. [Kudryashov B. A. On the functional state of the anticoagulant system with intravenous fibrin monomer. Questions Med. Chem. XV (5): 483–486. 1969. (In Russ.)].
Kyoung-Jin P., Eui-Hoon K., Hee-Jin K., Sun-Hee K. Evaluation of the Diagnostic Performance of Fibrin Monomer in Disseminated Intravascular Coagulation. Korean J. Lab. Med. 31(3): 143–147. 2011.
Shaz B.H., Winkler A.M., James A.B., Hillyer C.D., MacLeod J.B. Pathophysiology of early trauma induced coagulopathy: Emerging evidence for hemodilution and coagulation factor depletion. J. Trauma. 70(6): 1401–1407. 2011.
Boehringer Ingelheim. Boehringer ingelheim’s investigational antidote for Pradaxa® (dabigatran etexilate mesylate) receives FDA breakthrough therapy designation. 2014.
Glund S., Stangier J., Schmohl M., Gansser D., Norris S., van Ryn J., Lang B., Ramael S., Moschetti V., Gruenenfelder F., Reilly P., Kreuzer J. Safety, tolerability, and efficacy of idarucizumab for the reversal of the anticoagulant effect of dabigatran in healthy male volunteers: a randomised, placebo-controlled, double-blind phase 1 trial. Lancet. 386 (9994): 680–690. 2015.
Pollack C.V.Jr., Reilly P.A., van Ryn J., Eikelboom J.W., Glund S., Bernstein R.A., Dubiel R., Huisman M.V., Hylek E. M., Kam C.W., Kamphuisen P.W., Kreuzer J., Levy J.H., Royle G., Sellke F. W., Stangier J., Steiner T., Verhamme P., Wang B., Young L., Weitz J.I. Idarucizumab for dabigatran reversal – full cohort analysis. N. Engl. J. Med. 377(5): 431–441. 2017.
Eerenberg E.S., Kamphuisen P.W., Sijpkens M.K., Meijers J.C., Buller H.R., Levi M. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation. 124 (14): 1573–1579. 2011.
Levi M. Management of bleeding in patients treated with direct oral anticoagulants. Crit. Care. 20: 249. 2016.
Шахматова О.О. Специфические антидоты к новым пероральным антикоагулянтом. Атеротромбоз. (1): 81–94. 2016. [Shakhmatova O.O. Specific antidotes to new oral anticoagulants. Atherothrombosis. (1): 81–94. 2016. (In Russ.)].
Nowak H., Unterberg M. Oral anticoagulants: Management of elective and emergency surger. Anasthesiol. Intensivmed. Notfallmed. Schmerzther. 53 (7–8): 543–550. 2018.
Rossaint R., Bouillon B., Cerny V., Coats T.J., Duranteau J., Fernández-Mondéjar E., Filipescu D., Hunt B.J., Komadina R., Nardi G., Neugebauer E.A., Ozier Y., Riddez L., Schultz A., Vincent J.L., Spahn D.R. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Crit Care. 20: 100. 2016.
van Ryn J., Stangier J., Haertter S., Liesenfeld K.-H., Wienen W., Feuring M., Clemens A. Dabigatran etexilate – a novel, reversible, oral direct thrombin inhibitor: Interpretation of coagulation assays and reversal of anticoagulant activity. Thrombosis and Haemostasis. 103(6): 1116–1127. 2010.
Damage Control Resuscitation at Level IIb/III Treatment Facilities. Joint Theater Trauma System Clinical Practice Guideline. 2013.
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Ред. Хабриев Р.Ю. М. Медицина. 2005. [Rukovodstvo po eksperimentalnomu (doklinicheskomu) izucheniyu niovih farmakologicheskih veshchestv [Guidelines for experimental (preclinical) study of new pharmacological substances]. Red. Habriev R.U. Moscow. Meditsina. 2005].
Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Ред. Миронов А.Н. М. Гриф и К. 2012. [Rukovodstvo po provedeniu doklinicheskih issledovaniy lekarstvenih sredstv [Guidelines for preclinical drug trial]. Part 1. Red. Mironov A.N. Moscow. Grif and K. 2012].
Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. Ред. Макаров В.Г. СПБ. “ЛЕМА”. 2013. [Spravochnik. Fiziologicheskie, biohimicheskie i biometricheskie pokazateli normi experimentalnih givotnih [Resource guide. Normal physiological, biochemical and biometric parameters in experimental animals]. Red. Makarov V. G. St. Petersburg. “LEMA”. 2013].
European convention for the protection of vertebrate animals used for experimental and other scientific purposes. Strasburg. Council of Europe. 1986.
Баркаган З.С., Момот А.П. Диагностика и контролируемая терапия системы гемостаза. М. Ньюдиамед. 2008. [Barkagan Z.S., Momot A.P. Diagnostika i kontroliruemaya terapiya sistemi gemostaza [Diagnostics and controlled therapy of the hemostatic system]. Moscow. Newdiamed. 2008].
Hayes B.D., Winters M.E., Rosenbaum S.B., Allehyani M.F., Vilke G.M. What is the role of reversal agents in the management of emergency department patients with dabigatran-associated hemorrhage? J. Emerg. Med. 54 (4): 571–575. 2018.
Lambourne M.D., Eltringham-Smith L.J., Gataiance S., Arnold D.M., Crowther M.A., Sheffield W.P. Prothrombin complex concentrates reduce blood loss in murine coagulopathy induced by warfarin, but not in that induced by dabigatran etexilate. J. Thromb. Haemost. 10(9) : 1830–1840. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


