Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 4, стр. 437-446
Влияние антагонистов NMDA рецепторов разных типов на вызванные ответы пирамидных нейронов в срезах коры мозга крысы
М. В. Николаев *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: fmedfstud@gmail.com
Поступила в редакцию 09.01.2019
После доработки 19.02.2019
Принята к публикации 20.02.2019
Аннотация
Несмотря на обширную фармакологию NMDA рецепторов, применение препаратов, способных снижать их чрезмерную активацию при патологиях ЦНС, ограничено. Одной из причин может быть недостаточное знание об эффектах антагонистов NMDA рецепторов на функциональные свойства нейронов, поскольку значительное количество данных получено на моделях in vitro, которые не полностью воспроизводят реальные патофизиологические процессы. В данной работе были изучены эффекты разных по механизму действия антагонистов NMDA рецепторов на свойства ответов пирамидных нейронов в префронтальной коре мозга крысы. Конкурентный антагонист APV (50 мкM) и блокатор ионных каналов мемантин (100 мкM) были не активны в отношении вызванных ВПСП. При подавлении тормозной передачи пикротоксином (50 мкM) экстраклеточная стимуляция вызывала эпилептоподобные ответы с длительной деполяризацией мембраны и генерацией серии потенциалов действия. APV ограничивал длительность и амплитуду таких ответов. Мемантин приобретал активность лишь в случае исключения магния из внеклеточной среды. Отсутствие эффектов мемантина можно объяснить с позиции конкуренции за сайт связывания с ионами магния в полости канала. Данная работа показывает, что для предсказания системных эффектов блокаторов на функции нейронов и их возбудимость необходимо использовать in vitro модели, в которых активация NMDA рецепторов происходит в присутствии физиологических концентраций магния и без фиксации потенциала на мембране.
Глутаматные ионотропные рецепторы NMDA типа играют важную роль в физиологии ЦНС, участвуя в процессах синаптической пластичности, памяти и обучения. Исследования последних лет свидетельствуют о вовлеченности NMDA рецепторов в патогенез многих заболеваний ЦНС (эпилепсий, нейродегенеративных процессов, болевых синдромов, ишемии) [1]. Чрезмерное поступление кальция внутрь клетки через NMDA рецепторы при гиперактивации глутаматергической системы приводит к повреждению и гибели нейронов (эксайтотоксичность), разрушению межнейронных связей, изменению физиологического баланса возбуждения и торможения [1, 2]. Для предотвращения или коррекции тяжелых психических и функциональных нарушений привлекательной является идея применения антагонистов – веществ, способных снизить патологический уровень активации NMDA рецепторов [3]. К настоящему времени фармакология NMDA рецепторов обширна, включает антагонисты, связывающиеся по глициновому или глутаматному сайту связывания, неконкурентные антагонисты – блокаторы ионных каналов, а также аллостерические модуляторы [4].
Однако даже самые перспективные с точки зрения избирательности и механизма действия препараты могут обладать сильными побочными эффектами [5]. Примером успешного применения антагонистов NMDA рецепторов является мемантин [6], однако, причины, обуславливающие его эффективность и безопасность по сравнению с другими антагонистами, до сих пор являются предметом дискуссий [3, 7, 8]. Так, например, при лечении деменций, мемантин улучшает восприятие информации и память, коммуникативность и замедляет развитие болезни. Напротив, кетамин, который обладает схожей активностью, даже у здоровых людей вызывает симптомы шизофрении [9]. Однако стоит отметить, что кетамин в меньших дозах в настоящее время рассматривается как антидепрессант быстрого типа действия [10]. Таким образом, возможность медицинского применения NMDA антагонистов остается во многом нерешенной актуальной проблемой.
NMDA рецепторы обладают характерными биофизическими свойствами: высокая проницаемость для ионов кальция и потенциалозависимый блок ионами магния [2]. В результате активация NMDA рецепторов при потенциале покоя нейронов не приводит к существенному входу кальция, поскольку каналы блокированы эндогенными ионами магния. Только значительная деполяризация снимает блок магния и позволяет кальцию входить через NMDA рецепторы. Этот эффект лежит в основе классических представлений о долговременной синаптической пластичности [11].
Метод локальной фиксации потенциала пэтч-кламп является мощным инструментом для определения молекулярных механизмов действия антагонистов in vitro. В режиме фиксации потенциала действие соединений оценивается по изменению трансмембранных токов, протекающих через ионные каналы рецепторов. Поскольку мембранный потенциал искусственно поддерживается на заданном уровне, данный метод не позволяет оценить функциональные характеристики клеток, такие как возбудимость, способность генерировать потенциалы действия (ПД) при фармакологическом воздействии на исследуемый рецептор. Другой важной особенностью большинства фармакологических исследований блокаторов NMDA каналов является то, что их действие обычно изучается в безмагниевых растворах. Это существенно облегчает изучение сродства и механизмов действия блокаторов, но определяемые величины активностей существенно отличаются от тех, которые наблюдаются в присутствии магния [12, 13]. Кроме того, в моделях эпилептоподобных состояний часто используются безмагниевые условия для повышения общего уровня возбуждения [14]. Надо отметить ограниченную применимость подобных моделей для анализа действий NMDA антагонистов, поскольку рецепторы работают в условиях, далеких от нормальных, что сказывается и на действии анти-NMDA препаратов.
Для анализа действия антагонистов на функциональные свойства нейронов необходима экспериментальная модель, в которых NMDA рецепторы активны. Использование безмагниевых растворов не позволяет сделать однозначных выводов, так как NMDA рецепторы активируются нефизиологичным образом и проводят ток при потенциалах, близких к потенциалам покоя. Для изучения действия конкуретных антагонистов и каналоблокаторов в данной работе применялся метод пэтч-кламп в режиме фиксации тока с использованием магний-содержащих растворов. Исследовалось действие на вызванные одиночные ВПСП и на вызванные эпилептоподобные разряды в срезах коры мозга крысы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на крысах (возраст 16–21 дней) линии Вистар. Это исследование проводилось в соответствии с принципами Базельской декларации c соблюдением биоэтических правил обращения с экспериментальными животными.
Животных декапитировали под уретановым наркозом, после чего быстро извлекали мозг и с помощью вибратома 7000-SMZ (Campden Instruments, Великобритания) приготавливали поперечные срезы медиальной префронтальной коры (толщина 300 мкм). Для пригототовления срезов и последующей инкубации использовался раствор следующего состава (мМ): NaCl 126, KCl 2.5, NaH2PO4 1.25, MgSO4 1, CaCl2 2, NaHCO3 24, глюкоза 10, температура 22–24°С. Растворы аэрировали карбогеном (95% O2 и 5% CO2). Электрофизиологические эксперименты проводились через 60 мин после приготовления срезов. Срез переносили в экспериментальную ванночку (объем 1.5 мл). С помощью перистальтического насоса BT100-2J (Longerpump, Китай) обеспечивалась подача и отток кондиционирующего раствора или растворов, содержащих исследуемые вещества, с интенсивностью 5 мл/мин. Регистрация проводилась после достижения нового равновесного уровня ответов при подаче раствора, содержащего вещество (3–10 мин). Для равноэффективной аэрации растворов использовались трубчатые стеклянные фильтры VitraPOR (Robu Glass, Германия), которые параллельно подсоединяли к источнику карбогена. Дополнительная аэрация растворов в экспериментальной ванночке не производилась.
Пэтч-кламп электроды (3–4 MОм) изготавливали из боросиликатного стекла с помощью микрокузницы P-97 (Sutter Instruments, США) и заполняли раствором следующего состава (мМ): K-глюконат 135, NaCl 10, EGTA 5, HEPES 10, ATP-Mg 4, and GTP 0.3 (pH подводили до значения 7.3 с помощью KOH). Запись электрических сигналов (фильтрация: 0–10 кГц, оцифровка: 20 кГц) производили с помощью усилителя EPC-10 (HEKA Elektronik, Германия) и фирменного программного обеспечения Patch Master (HEKA Elektronik, Германия). После формирования конфигурации “целая клетка”, последовательное сопротивление не превышало 20 MОм. При обработке данных учитывались клетки, в которых этот параметр на протяжении эксперимента увеличивался не более чем на 20%.
Для визуализации нейронов использовался прямой микроскоп Olympus BX51WI, оборудованный системой дифференциального интерференционного контраста (ДИК). Водно-иммерсионный 40x объектив обеспечивал рабочее расстояние 3.3 мм. Подведение пэтч-пипетки и стимулирующего электрода осуществлялось с помощью моторизированных микроманипуляторов MC1000e (Siskiyou, США). Пирамидные нейроны L2/L3 слоя определялись по типичным морфологическим признакам: треугольная форма сомы и апикальные дендриты. Электрофизиологические свойства нейронов определялись по характерным ответам на гипер- и деполяризующие ступеньки тока с шагом 10 или 20 пА и длительностью 1000 мс [15]. Входное сопротивление определялось как наклон линейного участка вольт-амперной характеристики нейрона (от –60 до 0 пА). Постоянная времени определялась по ответу клетки на ступеньку гиперполяризирующего тока –20 пA (аппроксимация одноэкспоненциальной функцией). Возбуждающие постсинаптические потенциалы (ВПСП) и разряды в присутствии антагониста ГАМК-А рецепторов пикротоксина (50 мкМ) регистрировались в ответ на электрическую стимуляцию. Стимулирующий монополярный стеклянный электрод располагался на расстоянии примерно 100–150 мкм от тела нейрона. Длительность стимула была фиксирована (100 мкс), интенсивность подбиралась во время проведения опыта и обычно составляла 50–100 мкА.
Мемантин был синтезирован В.Е. Гмиро в ФГБНУ Институте экспериментальной медицины, Санкт-Петербург. APV ((2R)-amino-5-phosphonopentanoate) и другие реактивы, использованные в экспериментах, закуплены в фирме Tocris.
Данные представлены как среднее ± стандартное отклонение на основе минимум 5 экспериментов. Для выяснения статистической значимости эффекта использовался парный t-тест Стьюдента (сравнивали ответы в присутствии вещества относительно контрольных). Тест Колмогорова–Смирнова использовался для проверки нормальности распределения данных.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эффекты антагонистов NMDA рецепторов на вызванные ВПСП
Пирамидные нейроны, находящиеся в условиях потенциала покоя (–70 ± 2 мВ, n = 21) не генерировали ПД, входящее сопротивление и постоянная времени составляли 138 ± 15 МОм (n = 21) и 20 ± 2 мс (n = 21). В ответ на деполяризующие ступеньки тока нейроны генерировали серию одиночных ПД с небольшой частотной адаптацией (рис. 1А).
Рис. 1.
Сравнение эффектов мемантина и APV на синаптическую передачу в условиях фиксации потенциала и фиксации тока на пирамидных клетках слоя L2/3. А – ответы пирамидных клеток на гиперполяризующие и деполяризующие ступеньки тока. Б – ответы клеток на электрическую стимуляцию парой стимулов в режиме фиксации тока. При физиологической концентрации ионов магния (1 мМ) мемантин не оказывает влияния на ВПСП. Конкурентный антагонист NMDA рецепторов APV (50 мкМ) также не активен. В – мемантин эффективно подавляет ВПСТ, опосредованный активацией NMDA рецепторов в отсутствие магния в среде (режим фиксации потенциала, –70 мВ). Ответы в контроле выделены серым цветом.
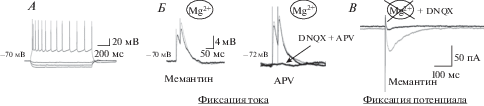
При электрической стимуляции синаптических входов в режиме фиксации тока регистрировались вызванные возбуждающие постсинаптические потенциалы (ВПСП). На (рис. 1Б) приведен пример ответов на парную экстраклеточную стимуляцию пирамидной клетки, находящейся в условиях потенциала покоя. При межстимульном интервале 50 мс ответ на второй стимул (ВПСП2) был несколько больше ответа на первый (ВПСП1) – проявление суммации ответов, поскольку первый не затухает к началу второго (1.12 ± 0.15; n = 10).
Мы использовали конкурентный антагонист APV в концентрации 50 мкМ, которая вызывает сильное угнетение функционально активных NMDA рецепторов (не блокированных ионами магния) [16] и стандартно используется в электрофизиологических экспериментах для подавления NMDA компонента синаптического ответа. Ответы на первый и второй стимул статистически значимо не изменялись (n = 5, p > 0.1) в присутствии APV (рис. 1Б). Далее было исследовано действие каналоблокатора NMDA рецепторов, мемантина в концентрации 100 мкМ, которая в условиях отсутствия магния обеспечивает практически полную блокаду NMDA рецепторов, ИК50 = 1.04 ± 0.26 мкM (ИК50 – концентрация полумаксимального ингибирования) [17]. Мемантин также не оказывал достоверного влияния на синаптические ответы и на соотношение ВПСП2/ВПСП1 (n = 5, p > 0.1). Таким образом, оба типа антагонистов NMDA рецепторов не влияли на характеристики ВПСП. Напротив, добавление конкурентного антагониста AMPA рецепторов (DNQX 15 мкМ) в наших условиях полностью исключало генерацию постсинаптического ответа (рис. 1Б).
Можно предположить, что функциональные NMDA рецепторы вообще не активируются в данном эксперименте. Поэтому мы провели контрольный эксперимент в режиме фиксации потенциала и без магния во внеклеточной среде – стандартный экспериментальный подход для определения эффектов антагонистов на NMDA рецепторы. При потенциале фиксации –70 мВ и добавлении антагониста AMPA рецепторов (DNQX 15 мкM) регистрировался NMDA компонент ВПСТ (возбуждающий постсинаптический ток), который практически полностью подавлялся мемантином (рис. 2В). То есть, отсутствие эффектов антагонистов NMDA рецепторов на ВПСП объясняется тем, что при потенциале –70 мВ ионные каналы NMDA рецепторов блокированы ионами магния, что исключает вклад NMDA рецепторов в генерацию ВПСП.
Рис. 2.
Влияние антагонистов NMDA рецепторов на вызванные разряды при подавлении тормозной передачи в срезе. А – в присутствии пикротоксина (50 мкМ) околопороговые в контрольных условиях стимулы вызывают пароксизмальный деполяризующий сдвиг (ПДС). Редко возникающие спонтанные ПДС (выделены серым) были схожи с вызванными ПДС. Б – эффекты мемантина (100 мкМ), APV (50 мкМ) и DNQX (10 мкМ) на вызванные ПДС в присутствии ионов магния. Контрольные ответы выделены серым цветом. DNQX полностью подавляет вызванный ПДС, стрелка указывает на ответ на 4-й минуте инкубации в DNQX.

Эффекты антагонистов NMDA рецепторов в условиях подавления тормозной передачи
Приведенные выше данные показывают, что малые смещения мембранного потенциала при генерации ВПСП недостаточны, чтобы избавить NMDA рецепторы от блока ионами магния и сделать вклад NMDA рецепторов существенным. Очевидно, что для изучения эффектов антагонистов NMDA рецепторов в условиях физиологической концентрации магния необходима более сильная деполяризация нейрона. Поэтому мы использовали экспериментальную модель, часто применяемую для изучения эпилептоподобной активности in vitro [14]. Инкубация срезов в среде, содержащей антагонист ГАМК-А рецепторов (пикротоксин) в течение 15–20 мин, приводила к возникновению сильной продолжительной деполяризации нейрона, сопровождающейся залпом ПД при внеклеточной стимуляции. Рис. 2A иллюстрирует, как стимул околопороговой интенсивности вызывает одиночный ВПСП в контрольных условиях и залповый ответ в условиях подавления тормозной передачи.
Измеренный относительно потенциала покоя такой ответ имел амплитуду 45 ± 8 мВ (n = 15), при этом нейроны деполяризовались до уровня 24 ± 8 мВ (n = 15). Длительность разрядов, измеренная относительно уровня потенциала покоя, варьировала и составляла 254 ± 61 мс (n = 15), а количество сопутствующих ПД варьировало от 3 до 10. Усиление стимуляции в 2–3 раза относительно пороговой не оказывало существенного влияния на форму, продолжительность ответа и количество генерируемых ПД. Время задержки возникновения разряда, а также скорость нарастания переднего фронта сильно варьировали при околопороговой стимуляции, однако быстро стабилизировались при увеличении интенсивности. В работе использовалась величина стимуляции, в 1.5 раза превышающая пороговую, что давало минимальный разброс по переднему фронту и по задержке возникновения ответа.
В моделях эпилептоподобной активности in vitro при внутриклеточной регистрации подобный спонтанно возникающий залповый разряд называют пароксизмальным деполяризирующим сдвигом (ПДС) [14]. В наших условиях спонтанные ПДС наблюдались, но крайне редко. Отметим, что вызванный экстраклеточной стимуляцией разряд выглядит так же, как спонтанный ПДС (рис. 2A). Подобное сходство отмечено и в других работах, например, в работе M. de Curtis с соавт. [18]. Увеличить частоту спонтанных разрядов можно, дополнительно повысив уровень возбуждения в срезе (например, повышая концентрацию внеклеточного калия, снижая концентрацию магния и пр.). Однако такие изменения влияют на функционирование NMDA рецепторов и их антагонистов. Поэтому эксперименты были проведены на вызванных разрядах (вызванных ПДС).
Действия соединений оценивали по изменению двух параметров: суммарная площадь, ограниченная вызванным ПДС над уровнем мембранного потенциала, и максимальная амплитуда (огибающая кривая, рис. 2Б). В наших экспериментах антагонист АМPA рецепторов DNQX (15 мкМ) в большей степени влиял на начальные этапы генерации вызванных ПДС (рис. 2Б). При развитии действия DNQX наблюдалось замедление фронта нарастания и, соответственно, задержка генерации ПД. Через 5 мин инкубации ответ практически полностью исчезал.
Конкурентный антагонист NMDA рецепторов APV оказывал влияние на поздние фазы вызванного ПДС, резко сокращая его длительность (рис. 2Б). Площадь ответа уменьшалась на 62 ± 5% (n = 6, p < 0.05), а амплитуда на 30 ± 6% (n = 6, p < 0.05).
В отличие от конкурентного антагониста, блокатор NMDA каналов, мемантин, не оказывал статистически значимого влияния на характеристики вызванных ПДС (n = 7, p > 0.05). Таким образом, вклад NMDA рецепторов выражен и значим для поддержания вызванных ПДС, но каналоблокатор в отличие от конкурентного антагониста не оказывал на NMDA компонент существенного действия. Следует напомнить, что в условиях фиксации потенциала и отсутствия магния та же самая концентрация мемантина вызывала полную блокаду ВПСТ, опосредованного NMDA рецепторами (рис. 1В). Мемантин и магний связываются с одним сайтом в полости канала. Вследствие конкуренции с магнием активность мемантина значительно снижена [13], этим может объясняться отсутствие эффектов мемантина на вызванные ПДС.
Эффекты антагонистов NMDA рецепторов на вызванные разряды в отсутствие ионов магния
Известно, что эпилептоподобные разряды в срезах коры мозга крысы могут возникать при низких концентрациях магния (или его отсутствии) во внеклеточной среде [19, 20]. В следующей серии экспериментов мы использовали безмагниевую внеклеточную среду без добавления пикротоксина. В этих условиях нейроны генерировали разряды, которые отличались от вызванных ПДС, полученных при подавлении тормозной передачи, формой ответа (что, скорее всего, связано с дополнительным вкладом NMDA рецепторов) и большей длительностью деполяризации (1–2 с). В отличие от ПДС, в которых наблюдалась устойчивость изучаемых характеристик ответов при разной силе стимуляции в некотором диапазоне, в безмагниевой среде характеристики вызванных разрядов определялись силой стимуляции, поэтому мы не проводили их количественное описание.
Магний в физиологической концентрации 1 мМ эффективно подавлял данный тип ответа: при добавлении магния в течение 2–3 мин длительный разряд сменялся одиночным ВПСП, либо одиночным ПД (n = 5, рис. 3А). Мемантин проявлял аналогичную активность в этой модели. Эффект мемантина развивался в течение 10 мин инкубации и “отмывался” практически полностью в среднем за 30–40 мин (n = 5, рис. 3Б). Таким образом, именно присутствие магния в предыдущей серии экспериментов (при подавлении тормозной передачи) было причиной неэффективности мемантина.
Рис. 3.
Вызванные разряды в отсутствие ионов магния во внеклеточеной среде. А, Б – ответы нейронов в безмагниевой внеклеточной среде. В, Г – ответы нейронов в безмагниевой среде, содержащей пикротоксин. Во всех случаях добавление магния или мемантина приводит к уменьшению длительности (В, Г), или подавлению вызванных разрядов (А, Б). Контрольные ответы и ответы после “отмыва” вещества (стрелка) выделены серым.
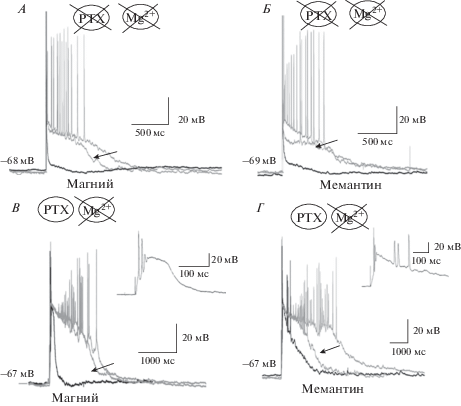
Чтобы проверить эту гипотезу, в дополнительной серии экспериментов мы вернулись к модели ПДС с пикротоксином и исключили магний из внеклеточной среды. В таких условиях нейроны отвечали на стимуляцию наиболее длительным деполяризующим сдвигом мембранного потенциала (от 2 до 5 с). Это неудивительно, поскольку одновременно работали оба фактора: отсутствие магния и блокада тормозной передачи. В этой модели магний в физиологической концентрации (1 мМ) эффективно подавлял длительную деполяризацию и возвращал нейрон к генерации вызванного ПДС (рис. 3В), уменьшая площадь ответа на 80 ± 6% (n = 5, p < 0.05). Таким образом, естественный блокатор NMDA рецепторов магний, играет важную роль в ограничении длительности вызванного ПДС. Схожим образом мемантин эффективно подавлял длительные эпилептоподобные ответы нейронов (рис. 3Г), площадь которых уменьшалась на 74 ± 13% (n = 6, p < 0.05). Эффекты магния и мемантина были обратимы. Таким образом, мы показали, что оба каналоблокатора NMDA рецепторов, магний и мемантин, действуют аналогично, а в присутствии одного из них (магний) второй (мемантин) становится неэффективным.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мемантин используется в медицине на протяжении нескольких десятилетий для лечения нейродегенеративных заболеваний (болезнь Альцгеймера и другие варианты деменции). Хотя мемантин может связываться с некоторыми типами рецепторов (например, 5-HT3 или никотиновые рецепторы), предполагается, что терапевтические эффекты мемантина в основном связаны с его способностью блокировать ионные каналы NMDA рецепторов. Нейропротекторное действие достигается за счет снижения чрезмерной активации NMDA и поступления кальция внутрь клетки [21]. В нашей работе мы исследовали ответы нейронов, в которых NMDA рецепторы принимают непосредственное участие. Мемантин был слабо активен в подавлении NMDA компонента ПДС даже в концентрации 100 мкМ, превышающей терапевтическую на два порядка [6]. Значительная активность мемантина наблюдалась только в отсутствие ионов магния во внеклеточной среде, что приводило к возникновению длительных эпилептоподобных ответов на экстраклеточную стимуляцию.
Природа возникновения, распространения и терминирования эпилептоподобных разрядов не до конца изучена и зависит как от собственных свойств нейронов, так и от эффектов синхронизации нейронов, находящихся в условиях повышенной возбудимости [14]. В разных моделях эпилептогенеза вклад и динамика вовлечения синаптических AMPA, NMDA и ГАМК рецепторов различна [22]. В данной работе мы не ставили перед собой задачу определения эпилептогенных механизмов, в которые вовлечены NMDA рецепторы, поскольку не изучали свойства ответов в модели эпилепсии на срезе, а спонтанные эпилептоподобные разряды были редкими. Однако, изучая вызванные разряды, схожие с эпилептоподобными разрядами, мы выяснили, что причиной отсутствия значимых эффектов мемантина на NMDA рецепторы являются ионы магния внеклеточной среды. Полученные данные можно объяснить с позиции конкуренции за сайт связывания в ионном канале. Поэтому представляется важным исследовать эффекты блокаторов, характеризующихся другими механизмами действия на NMDA рецепторы: кинетикой, особенностями взаимодействия с воротным механизмом, зависимостью блокады от мембранного потенциала.
Все эксперименты в данной работе выполнены на пирамидных нейронах коры. Можно предположить, что эффекты мемантина в модели ПДС могут быть более выражены на других типах клеток. С этой точки зрения можно рассмотреть парвальбумин-положительные интернейроны коры. В свете основной идеи данной работы, а именно, сопоставления молекулярного механизма действия антагонистов NMDA рецепторов с функциональными ответами нейронов, эти клетки интересны тем, что экспрессируют другой набор синаптических NMDA рецепторов, содержащих субъединицу GluN2D [23]. Согласно данным, полученным на рекомбинантных рецепторах, при физиологической концентрации магния мемантин более эффективно угнетает GluN2D-содержащие рецепторы по сравнению с GluN2A- и GluN2B- содержащими рецепторами, которые экспрессируются пирамидными клетками [12]. Более выраженное действие мемантина на возбуждающие входы интернейронов коры, по сравнению с пирамидными клетками, было показано в недавней работе N.V. Povysheva с соавт. [24]. Такие же эффекты проявляет кетамин в срезах гиппокампа – другой блокатор NMDA рецепторов, применяющийся в медицине [25]. В обоих случаях это приводит к угнетению тормозных входов в пирамидные клетки и к усилению синаптически опосредованной возбудимости пирамидных клеток.
Наша работа иллюстрирует, что в экспериментах in vitro эффекты NMDA антагонистов зависят от конкретных условий. Поэтому требуется дальнейшее систематическое сопоставления блокаторов, отличающихся механизмами молекулярного действия, на функциональные свойства нейронов и нейронных сетей в условиях, приближенных к физиологическим. Эти знания помогут более точно предсказать действие антагонистов NMDA рецепторов in vivo и откроют новые перспективы создания лекарственных препаратов для лечения тяжелых заболеваний ЦНС.
Список литературы
Furukawa H., Singh S.K., Mancusso R., Gouaux E. Subunit arrangement and function in NMDA receptors. Nature. 438(7065): 185–192. 2005.
Traynelis S.F., Wollmuth L.P., McBain C.J., Menniti F.S., Vance K.M., Ogden K.K., Hansen K.B., Yuan H., Myers S.J., Dingledine R. Glutamate receptor ion channels: Structure, regulation, and function. Pharmacol. Rev. 62(3): 405–96. 2010.
Lipton S.A. Pathologically activated therapeutics for neuroprotection. Nat. Rev. Neurosci. 8: 803–808. 2007.
Lodge D., Watkins J.C., Bortolotto Z.A., Jane D.E., Volianskis A. The 1980s: D-AP5, LTP and a decade of NMDA receptor discoveries. Neurochem. Res. 2018.
Lau A., Tymianski M. Glutamate receptors, neurotoxicity and neurodegeneration. Pflugers Arch. 460(2): 525–542. 2010.
Parsons C.G., Gilling K. Memantine as an example of a fast, voltage-dependent, open channel N-methyl-D-aspartate receptor blocker. Methods Mol. Biol. 403: 15–36. 2007.
Kotermanski S.E., Wood, J.T., Johnson, J.W. Memantine binding to a superficial site on NMDA receptors contributes to partial trapping. J. Physiol. 587: 4589–4603. 2009.
Glasgow N.G., Wilcox M.R., Johnson J.W. Effects of Mg2+ on recovery of NMDA receptors from inhibition by memantine and ketamine reveal properties of a second site. Neuropharmacology. 137: 344–358. 2018.
Krystal J.H., D’Souza D.C., Mathalon D., Perry E., Belger A., Hoffman R. NMDA receptor antagonist effects, cortical glutamatergic function, and schizophrenia: Toward a paradigm shift in medication development. Psychopharmacology (Berl). 169(3–4): 215–233. 2003.
Widman A.J., McMahon L.L. Disinhibition of CA1 pyramidal cells by low-dose ketamine and other antagonists with rapid antidepressant efficacy. Proc. Natl. Acad. Sci. USA. 115(13): E3007–E3016. 2018.
Loescher C., Malenka R.C. NMDA receptor-dependent long-term potentiation and long-term depression (LTP/LTD). Cold Spring Harb. Perspect. Biol. 4: a005710. 2012.
Kotermanski S.E., Johnson J.W. Mg2+ imparts NMDA receptor subtype selectivity to the Alzheimer’s drug memantine. J. Neurosci. 29: 2774–2779. 2009.
Nikolaev M.V., Magazanik L.G., Tikhonov D.B. Influence of external magnesium ions on the NMDA receptor channel block by different types of organic cations. Neuropharmacology. 62(5–6): 2078–2085. 2012.
de Curtis M., Avanzini G. Interictal spikes in focal epileptogenesis. Prog Neurobiol. 63(5): 541–567. 2001.
Zaitsev A.V., Povysheva N.V., Gonzalez-Burgos G., Lewis D.A. Electrophysiological classes of layer 2/3 pyramidal cells in monkey prefrontal cortex. J. Neurophysiol. 108(2): 595–609. 2012.
Ambert N., Greget R., Haeberlé O., Bischoff S., Berger T.W., Bouteiller J.M., Baudry M. Computational studies of NMDA receptors: differential effects of neuronal activity on efficacy of competitive and non-competitive antagonists. Open Access Bioinformatics. 2: 113–125. 2010.
Parsons C.G., Panchenko V.A., Pinchenko V.O., Tsyndrenko A.Y., Krishtal O.A. Comparative patch-clamp studies with freshly dissociated rat hippocampal and striatal neurons on the NMDA receptor antagonistic effects of amantadine and memantine. Eur. J. Neurosci. 8(3): 446–454. 1996.
de Curtis M., Radici C., Forti M. Cellular mechanisms underlying spontaneous interictal spikes in an acute model of focal cortical epileptogenesis. Neuroscience. 88(1): 107–117. 1999.
Dreier J.P., Heinemann U. Regional and time dependent variations of low Mg2+ induced epileptiform activity in rat temporal cortex slices. Exp. Brain Res. 87(3): 581–596. 1991.
Tancredi V., Hwa G.G., Zona C., Brancati A., Avoli M. Low magnesium epileptogenesis in the rat hippocampal slice: Electrophysiological and pharmacological features. Brain Res. 11(2): 280–290. 1990.
Johnson J.W., Glasgow N.G., Povysheva N.V. Recent insights into the mode of action of memantine and ketamine. Curr. Opin. Pharmacol. 20: 54–63. 2015.
Amakhin D.V., Ergina J.L., Chizhov A.V., Zaitsev A.V. Synaptic conductances during interictal discharges in pyramidal neurons of rat entorhinal cortex. Front Cell Neurosci. 10: 233. 2016.
Standaert D.G., Landwehrmeyer G.B., Kerner J.A., Penney J.B. Jr, Young A.B. Expression of NMDAR2D glutamate receptor subunit mRNA in neurochemically identified interneurons in the rat neostriatum, neocortex and hippocampus. Brain. Res. Mol. Brain Res. 42(1): 89–102. 1996.
Povysheva N.V., Johnson J.W. Effects of memantine on the excitation-inhibition balance in prefrontal cortex. Neurobiol. Dis. 96: 75-83. 2016.
[Widman A.J., McMahon L.L. Disinhibition of CA1 pyramidal cells by low-dose ketamine and other antagonists with rapid antidepressant efficacy. Proc. Natl. Acad. Sci. USA. 115(13): E3007–E3016. 2018.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


