Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 1, стр. 55-65
Характеристика жизнеспособности сперматозоидов у потомства самок крыс с экспериментальным сахарным диабетом 1 типа при действии иммобилизационного стресса
Г. В. Брюхин 1, С. Д. Антонов 1, *
1 Южно-Уральский государственный медицинский университет
Челябинск, Россия
* E-mail: s.d.antonov@mail.ru
Поступила в редакцию 07.09.2019
После доработки 18.10.2019
Принята к публикации 22.10.2019
Аннотация
Одним из основных факторов, обусловливающих развитие пренатального стресса, является сахарный диабет 1 типа матери, влияние которого на становление мужской репродуктивной системы потомства практически не изучено. В связи с этим целью настоящего исследования явился анализ особенностей двигательной активности сперматозоидов половозрелого потомства матерей с экспериментальным сахарным диабетом 1 типа, подвергшегося воздействию иммобилизационного стресса. Работа выполнена на самках крыс линии Вистар, на которых моделировали сахарный диабет 1 типа, и их половозрелом потомстве. Сперматозоиды получали из придатка семенника, определяли их содержание в единице объема с учетом подвижности. С целью изучения антистрессорной резистентности сперматозоидов у подопытных животных моделировали иммобилизационный стресс. Установлено, что у потомства крыс с экспериментальным диабетом наблюдается снижение концентрации сперматозоидов. Под влиянием иммобилизационного стресса у экспериментальных животных интактной и опытной групп происходит снижение уровня концентрации сперматозоидов, наблюдается нарушение соотношения фертильных и нефертильных половых клеток. Установлено, что у подопытных животных снижены как число клеток Лейдига, так и индекс их активности. Анализ результатов позволяет сделать заключение о снижении фертильности и антистрессорной резистентности сперматогенеза потомства самок крыс с экспериментальным диабетом. Гипоталамо-гипофизарно-гонадная система обеспечивает контроль репродуктивной системы прежде всего за счет тестостерона, который вырабатывается клетками Лейдига и участвует в регуляции сперматогенеза. При этом активация гипоталамо-гипофизарно-адреналовой системы в условиях гипогликемии ведет к подавлению активности гипоталамо-гипофизарно-гонадной системы. Можно предположить, что при иммобилизационном стрессе создается высокий уровень кортикостероидов, что еще сильнее угнетает секреторную активность клеток Лейдига, а в конечном итоге приводит к нарушению процесса сперматогенеза, проявляющемуся в снижении концентрации сперматозоидов и их двигательной активности.
Отличительной особенностью 21 века стала высокая частота бесплодия среди супружеских пар репродуктивного возраста. По данным отечественных и зарубежных авторов частота бесплодных пар составляет 10–20% и не имеет тенденции к снижению. Ежегодно в мире регистрируется до 2.5 миллионов случаев мужского и женского бесплодия [1, 2]. При этом на долю мужского фактора в бесплодном браке приходится до 50–55 [3].
Вместе с тем, многочисленными экспериментальными исследованиями и клиническими наблюдениями установлена высокая вероятность унаследования от матери разнообразных изменений, возникших в результате пренатального стресса. Так, показано, что пренатальный стресс приводит к развитию у потомства разнообразных ультраструктурных морфологических, нейрохимических, эндокринных и метаболических изменений, которые могут закрепляться в постнатальной жизни (явление внутриутробного программирования болезней) [4, 5]. Одним из основных факторов, обусловливающих развитие пренатального стресса, являются экстрагенитальные заболевания матери, среди которых особое место, в силу своей распространенности, занимает сахарный диабет, в том числе сахарный диабет 1 типа. По данным Госрегистра больных сахарным диабетом, в России на 01.01.2010 г. зарегистрировано более 3 млн человек, страдающих этой патологией [6]. Многочисленными клиническими наблюдениями показано, что сахарный диабет матери оказывает неблагоприятное влияние на развитие и состояние плода. У таких женщин часто рождаются дети с диабетической фетопатией [6]. Вместе с тем влияние сахарного диабета матери на морфофункциональное становление мужской репродуктивной системы потомства мало изучено. Результаты немногочисленных исследований имеют неоднозначный характер. Так, G. Jelodar и соавт. установили, что у половозрелого потомства самок крыс с экспериментальным диабетом имеет место увеличение массы семенников, сопровождающееся увеличением числа семенных извитых канальцев и их диаметра, а также снижением числа клеток Лейдига, клеток Сертоли и концентрации зрелых сперматозоидов на фоне гипергликемии [7]. В то же время E.M. Amorim с соавт. выявили снижение массы семенников потомства самок крыс с экспериментальным сахарным диабетом, протекающее на фоне снижения концентрации глюкозы крови. Вместе с тем, эти исследователи также выявили снижение концентрации сперматозоидов и их двигательной активности [8].
В связи с этим целью настоящего исследования явился анализ особенностей двигательной активности сперматозоидов половозрелого потомства матерей с экспериментальным сахарным диабетом 1 типа, подвергшегося воздействию иммобилизационного стресса.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на крысах линии Вистар. Для достижения поставленной цели у половозрелых самок до беременности моделировали сахарный диабет 1 типа по общепринятой методике с использованием стрептозотоцина (Streptozotocin; MP Biomedicals, LLC; США) [9], который вводился животным внутрибрюшинно трижды с интервалом 7 дней (по 2.5 мг на 100 г массы в первую и в третью недели и по 2 мг на 100 г массы во вторую неделю). Всего за весь курс 10 животных с массой от 230 до 256 г получали по 17 мг стрептозотоцина, под влиянием которого у них развивался сахарный диабет, о чем свидетельствовал постоянный повышенный уровень содержания глюкозы в крови (32.56 ± 2.44 ммоль/л). Такой уровень глюкозы сохранялся на протяжении, как минимум, трех месяцев (у интактных самок показатели гликемии составляли 6.25 ± 0.22 ммоль/л). Концентрацию глюкозы в крови у экспериментальных животных определяли на базе ЦНИЛ ЮУГМУ при помощи “Комбинированного автоматического биохимического и иммуноферментного анализатора BIOCHEM ANALETTE (HTI)”. Забор крови осуществляли из хвостовой вены по общепринятой методике. Уровень глюкозы определяли в венозной сыворотке.
Подсадка к интактным самцам для спаривания проводилась через 1 неделю после последнего введения стрептозотоцина. В результате рождались подопытные крысята, эту группу составили 19 крысят из 10 пометов, 10 крысят из которых представили группу “опыт”, а оставшиеся 9 животных были подвергнуты действию иммобилизационного стресса и составили группу “опыт-стресс”. В контрольную группу входили 18 крысят из 14 пометов, из которых 10 крысят составили интактную группу, 8 крысят – группу “контроль-стресс”. В каждой группе определял весовые параметры экспериментальных животных.
Работа с лабораторными животными осуществлялась в соответствии с “Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях” от 18.03.1986 г. Все экспериментальные животные содержались в стандартных условиях вивария ЮУГМУ. Эвтаназия животных проводилась методом декапитации под эфирным наркозом.
Зрелые сперматозоиды получали из придатка семенника, разрезая его вдоль в среде дозированного количества 5%-ного раствора глюкозы (в объеме 1 мл), предварительно подогретой до 37°С. Затем отрезком отмытой резиновой трубки сперматозоиды из эпидидимиса активно перемещали в раствор в течение 2 мин [10]. Далее в камере Горяева подсчитывали количество сперматозоидов с учетом характера их подвижности. Подвижность оценивали по общепринятой 4-х балльной системе: 0 – неподвижные (погибшие), 1 – “дергающиеся” (колебательное, местное движение, когда имеется движение хвоста, но не происходит перемещение сперматозоида), 2 – слабоподвижные (манежное или круговое движение, при котором сперматозоиды вращаются вокруг своей головки или по небольшому кругу), 3 – прогрессивно подвижные (прямолинейное поступательное движение со спиральным вращением вокруг своей оси) сперматозоиды. Неподвижные и дергающиеся сперматозоиды принимали за нефертильную фракцию, а слабоподвижные и прогрессивно подвижные относили к фертильной фракции мужских половых клеток. Подсчет проводился в течение 1 ч через каждые 15 мин, а затем через 30 мин до 240-й мин включительно [11]. Наряду с этим рассчитывали индекс фертильности, который представляет собой отношение суммарного числа прогрессивноподвижных и слабоподвижных к содержанию дергающихся и неподвижных половых клеток.
Кроме того, определяли суммарное содержание сперматозоидов в единице объема (1 мл) эпидидимальной суспензии [12], а также индекс супрессии, который показывает степень снижения данного показателя в процентах относительно контрольной группы.
Проводили оценку мофофункционального состояния клеток Лейдига у животных интактной и опытной групп на серийных гистологических препаратах семенников, окрашенных гематоксилином и эозином по общепринятой методике. Определяли суммарное содержание интерстициальных эндокриноцитов (клеток Лейдига), а также число активных и неактивных эндокриноцитов [13].
С целью изучения особенностей антистрессорной резистентности половых клеток семенников у потомства самок крыс с экспериментальным сахарным диабетом нами моделировался иммобилизационный стресс, который вызывали путем иммобилизации животных на спине в камере Когана. Первоначально иммобилизация продолжалась с 10.00 до 15.00 ч. Затем после 2 ч отдыха животных вновь помещали в камеру на ночь. На следующее утро иммобилизацию прекращали до вечера. В 17.00 того же дня животных вновь подвергали иммобилизации до утра [14].
Полученные результаты обрабатывали с использованием программы Statustica v.6.0 (“Statsoft Inc.”), данные представлены в виде средней арифметической и стандартной ошибки. Учитывая небольшой количественный состав групп экспериментальных животных, для оценки достоверности использовались непараметрические методы анализа: порядковые признаки между двумя группами – критерий Манна–Уитни. Статистически значимыми изменения считали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела подопытных животных из группы “опыт” и “опыт-стресс” составила 163.8 ± 7.3 и 146.0 ± 6.2 г соответственно, и оказалась ниже, чем в контроле и в группе контроль-стресс (199.3 ± 10.9 и 160.5 ± 11.1 г соответственно).
Одним из важнейших показателей качества спермы является концентрация сперматозоидов. Нами установлено, что у половозрелого потомства самок крыс с экспериментальным сахарным диабетом наблюдается снижение концентрации половых клеток в 1 мл эпидидимальной суспензии (98.5 ± 6.4 × 106) по сравнению с контрольными животными (137.5 ± 6.2 × 106). Под влиянием иммобилизационного стресса у экспериментальных животных интактной и опытной групп происходит снижение уровня концентрации сперматозоидов. Так, если у интактных крысят исследуемый показатель составил 115.9 ± 3.8 × 106 (индекс супрессии составил 15.7%), то у подопытных животных этот показатель снизился до уровня 70.2 ±3.2 × 106 (индекс супрессии составил 28.73%).
Среди сперматозоидов интактных животных на долю фертильной фракции приходится 84.1 ± 1.0% половых клеток, в том числе 52.3 ± 2.4% прогрессивноподвижных и 31.8 ± 2.0% слабоподвижных сперматозоидов. Под влиянием иммобилизационного стресса у интактных крысят фертильная фракция половых клеток уменьшилась на 22.4% и составила 65.3 ± 2.5%, в том числе фракция прогрессивноподвижных уменьшилась на 35.6% и составила 33.6 ± 1.7%, а фракция слабоподвижных сперматозоидов практически не изменилась и составила 31.7 ± 1.7%. Аналогичная закономерность выявлена и у подопытных животных. Так, фертильная фракция половых клеток у подопытных крысят оказалась уменьшенной на 14.5% по сравнению с группой контроля и составила 71.9 ± 1.8%. При этом у подопытных крысят фракция прогрессивноподвижных сперматозоидов составила 42.6 ± 1.5%, а фракция слабоподвижных клеток – 29.3 ± 1.5%. Под влиянием иммобилизационного стресса у подопытных животных произошло уменьшение содержания фертильной фракции сперматозоидов на 49.5% по сравнению с исходным уровнем и составило 36.3 ± 4.5%. При этом произошло снижение фракции прогрессивноподвижных клеток на 62%, что составило 16.2 ± 2.9%, и слабоподвижных сперматозоидов на 31.3%, что образовало 20.1 ± 2.0%.
Одним из ведущих показателей фертильности человека является жизнеспособность сперматозоидов. Для оценки жизнеспособности половых клеток нами проводился анализ субпопуляционного состава сперматозоидов с учетом их двигательной активности. Прежде всего, установлено, что у экспериментальных животных интактной и опытной групп содержание прогрессивноподвижных сперматозоидов постепенно уменьшалось (табл. 1). При этом у контрольных животных прогрессивноподвижные сперматозоиды обнаруживались в эпидидимальной взвеси до 90-ой минуты наблюдения, а у подопытных крысят только до 45-ой минуты. Аналогичная закономерность выявлена нами и при анализе жизнеспособности фракции слабоподвижных половых клеток (табл. 2). Как видно из табл. 2, у интактных животных слабоподвижные сперматозоиды обнаруживаются до 120-ой минуты, а у подопытных – только до 60-ой минуты. Обращает на себя внимание, что на всех сроках наблюдения у подопытных животных содержание прогрессивноподвижных и слабоподвижных сперматозоидов снижено по сравнению с контролем.
Таблица 1.
Динамика изменения доли прогрессивноподвижных сперматозоидов в контрольной и экспериментальных группах под влиянием иммобилизационного стресса, (%) (M ± m) Table 1. Dynamics of changes in the proportion of progressively motile spermatozoa in the control and experimental groups under the influence of immobilization stress, (%) (M ± m)
| Эксперим. группа Experimental group |
Время исследования, мин Research time, min | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 15 | 30 | 45 | 60 | 90 | 120 | |
| К Control | 52.3 ± 2.4 | 40.1 ± 0.8 | 25.5 ± 0.7 | 20.4 ± 1.6 | 5.42 ± 1.17 | 1.31 ± 0.27 | – |
| К стресс Control-stress | 33.6 ± 1.7х | 26.8 ± 0.9х | 5.1 ± 0.9х | 1.9 ± 0.3х | – | – | – |
| О Experiment | 42.6 ± 1.5хх | 26.3 ± 2.1хх | 9.4 ± 1.2хх | 5.6 ± 1.1хх | – | – | – |
| О стресс Experiment-stress | 16.2 ± 2.9х, хх | 5.5 ± 1.1х, хх | – | – | – | – | – |
Примечание. х – результаты статистически значимы между группами К и К стресс, О и О стресс (р < 0.05); хх – результаты статистически значимы между группами К и О, К и О стресс (р < 0.05). x – the results are statistically significant between groups Control and Control-stress, Experiment and Experiment-stress (p < 0.05); xx – the results are statistically significant between groups Control and Experiment, Control and Experiment-stress (p < 0.05).
Таблица 2.
Динамика изменения доли слабоподвижных сперматозоидов в контрольной и экспериментальных группах под влиянием иммобилизационного стресса, (%) (M ± m) Table 2. The dynamics of changes in the proportion of weak motile sperm in the control and experimental groups under the influence of immobilization stress, (%) (M ± m)
| Эксперим.
группа Experimental group |
Время исследования, мин Research time, min | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 15 | 30 | 45 | 60 | 90 | 120 | |
| К Control | 31.9 ± 2.0 | 37.6 ± 0.6 | 34.4 ± 1.1 | 25.7 ± 1.7 | 21.3 ± 1.2 | 2.0 ± 0.4 | 1.6 ± 0.3 |
| К стресс Control-stress | 31.7 ± 1.7 | 20.9 ± 0.7х | 13.0 ± 1.1х | 6.2 ± 0.8х | – | – | – |
| О Experiment | 29.3 ± 1.5 | 35.3 ± 0.8хх | 26.4 ± 0.9хх | 22.6 ± 1.5 | 4.0 ± 1.0хх | – | – |
| О стресс Experiment-stress | 20.1 ± 2.0х, хх | 9.2 ± 1.5х, хх | 1.8 ± 0.5х, хх | – | – | – | – |
Примечание. х – результаты статистически значимы между группами К и К стресс, О и О стресс (р < 0.05); хх – результаты статистически значимы между группами К и О, К и О стресс (р < 0.05). x – the results are statistically significant between groups Control and Control-stress, Experiment and Experiment-stress (p < 0.05); xx – the results are statistically significant between groups Control and Experiment, Control and Experiment-stress (p < 0.05).
Воздействие иммобилизационного стресса вызывает у подопытных крысят более выраженное угнетение содержания фертильной фракции сперматозоидов как за счет прогрессивноподвижных, так и за счет слабоподвижных клеток. При этом, если у интактных животных сперматозоиды фертильной фракции обнаруживаются в суспензии до 60-ой минуты наблюдения, то у подопытных крысят – только до 30-ой минуты.
Нефертильную фракцию сперматозоидов представляют дергающиеся и неподвижные клетки, в контрольной группе они составляют 15.9 ±1.0% от общего числа сперматозоидов. У подопытных животных нефертильная фракция сперматозоидов составляет 28.1 ± 1.8%, что на 77.1% превышает таковую в контроле. Под влиянием иммобилизационного стресса у интактных крысят суммарное содержание половых клеток нефертильной фракции увеличивается в 2.18 раза и достигает уровня 34.7 ± 2.5%, у подопытных животных в 2.26 раза и составляет 63.7 ± 4.5%. У интактных животных, подвергшихся иммобилизационному стрессу содержание нефертильных сперматозоидов (дергающихся и неподвижных) постепенно увеличивается и достигает максимального значения (100%) на 60-ой минуте наблюдения, а у подопытных крысят этот показатель уже на 45-ой минуте достигает 100% (табл. 3 и 4).
Таблица 3.
Динамика изменения доли дергающихся сперматозоидов в контрольной и экспериментальных группах под влиянием иммобилизационного стресса, (%) (M ± m) Table 3. The dynamics of changes in the proportion of twitching sperm in the control and experimental groups under the influence of immobilization stress, (%) (M ± m)
| Эксперим.
группа Experimental group |
Время исследования, мин Research time, min | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 15 | 30 | 45 | 60 | 90 | 120 | 150 | |
| К Control | 11.9 ± 0.9 | 10.0 ± 0.6 | 14.6 ± 0.6 | 27.9 ± 1.4 | 24.2 ± 1.3 | 8.0 ± 1.0 | 7.4 ± 1.2 | 2.4 ± 0.6 |
| К стресс Control-stress | 15.8 ± 1.3х | 22.2 ± 0.5х | 37.7 ± 1.3х | 30.2 ± 1.3 | 7.1 ± 1.1х | – | – | – |
| О Experiment | 13.0 ± 1.8 | 21.5 ± 1.9хх | 26.7 ± 1.6хх | 27.7 ± 1.8 | 42.5 ± 1.5хх | 15.5 ± 2.3хх | – | – |
| О стресс Experiment-stress | 27.8 ± 1.8х, хх | 22.2 ± 1.5хх | 30.8 ± 1.6хх | – | – | – | – | – |
Примечание. х – результаты статистически значимы между группами К и К стресс, О и О стресс (р < 0.05); хх – результаты статистически значимы между группами К и О, К и О стресс (р < 0.05). x – the results are statistically significant between groups Control and Control-stress, Experiment and Experiment-stress (p < 0.05); xx – the results are statistically significant between groups Control and Experiment, Control and Experiment-stress (p < 0.05).
Таблица 4.
Динамика изменения доли неподвижных сперматозоидов в контрольной и экспериментальных группах под влиянием иммобилизационного стресса, (%) (M ± m) Table 4. The dynamics of changes in the proportion of motionless sperm in the control and experimental groups under the influence of immobilization stress, (%) (M ± m)
| Эксперим.
группа Experimental group |
Время исследования, мин Research time, min | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 15 | 30 | 45 | 60 | 90 | 120 | 150 | 180 | |
| К Control | 4.0 ± 0.6 | 12.3 ± 0.4 | 25.5 ± 0.9 | 25.9 ± 1.5 | 49.2 ± 1.6 | 88.7 ± 1.0 | 91.1 ± 1.2 | 97.6 ± 0.6 | 100.0 |
| К стресс Control-stress | 18.9 ± 1.7х, | 30.1 ± 0.8х | 44.2 ±2.1х | 61.6 ± 1.4х | 92.9 ± 1.1х | 100.0х | – | – | – |
| О Experiment | 14.9 ± 1.2хх | 16.9 ± 0.9хх | 37.4 ± 1.6хх | 44.1 ± 1.5хх | 53.5 ± 1.5 | 84.5 ± 2.3 | 100.0х | – | – |
| О стресс Experiment-stress | 35.8 ± 3.1х,хх | 63.0 ± 2.4х,хх | 67.4 ± 1.8х,хх | 100.0х, хх | – | – | – | – | – |
Примечание. х – результаты статистически значимы между группами К и К стресс, О и О стресс (р < 0.05); хх – результаты статистически значимы между группами К и О, К и О стресс (р < 0.05). x – the results are statistically significant between groups Control and Control-stress, Experiment and Experiment-stress (p < 0.05); xx – the results are statistically significant between groups Control and Experiment, Control and Experiment-stress (p < 0.05).
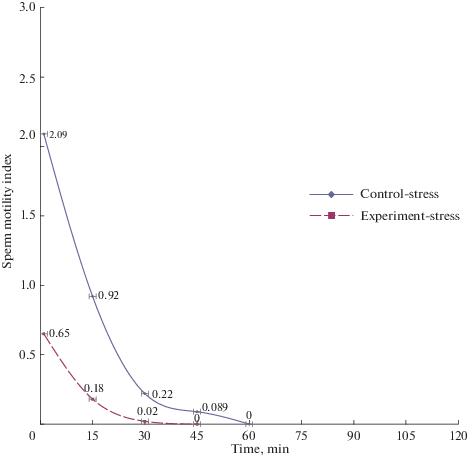
Нарушение соотношения фертильных и нефертильных половых клеток у экспериментальных животных интактной и опытной групп обусловило изменение индекса подвижности сперматозоидов, представляющего собой отношение суммарного числа прогрессивноподвижных и слабоподвижных к содержанию дергающихся и неподвижных половых клеток (рис. 1 и 2). Как видно из рисунков, индекс двигательной активности сперматозоидов у подопытных животных снижен на всех сроках наблюдения под влиянием стресса.
Рис. 1.
Индекс двигательной активности сперматозоидов экспериментальных животных. Различия между группами достоверны (р < 0.001) во всех временных точках. Fig. 1. Sperm motility index of the experimental animals. Differences between the groups are significant (p < 0.001) at all time points.
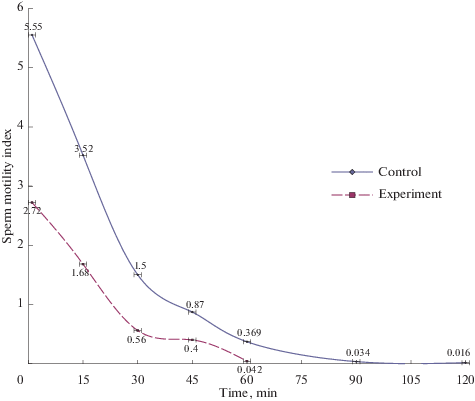
Рис. 2.
Индекс двигательной активности сперматозоидов экспериментальных животных при действии иммобилизационного стресса. Различия между группами достоверны (р < 0.001) во всех временных точках. Fig. 2. Sperm motility index in the experimental animals under the immobilization stress. The differences between the groups are significant (p < 0.001) at all time points.
Кроме того, нами установлено, что у потомства самок крыс с экспериментальным сахарным диабетом имеет место снижение числа клеток Лейдига семенников и их субпопуляционного состава. В частности, показано, что если у интактных животных содержание эндокриноцитов семенников составляет 31.76 ± 1.51, то у подопытных крысят этот показатель оказался равным всего 21.40 ± 1.25 (р < 0.001). При этом индекс активности клеток Лейдига, представляющий собой отношение числа активных эндокриноцитов к содержанию неактивных клеток, у интактных животных составил 5.26 ± 0.49 в то время как у подопытных животных исследуемый показатель оказался равным всего 2.35 ± 0.18 (р < 0.001).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, анализ полученных результатов позволяет сделать заключение о снижении фертильности потомства самок крыс с экспериментальным сахарным диабетом, о чем свидетельствует как уменьшение суммарного числа сперматозоидов, в том числе их фертильной фракции, так и угнетение их двигательной активности. Вместе с тем, полученные данные указывают на снижение у подопытных животных от матерей с сахарным диабетом антистрессорной резистентности сперматогенеза.
В то же время известно, что клетки Лейдига являются основными структурными элементами, продуцирующими тестостерон, который затем диффундирует через базальную мембрану в клетки Сертоли [13, 15]. В клетках Сертоли тестостерон подвергается ароматизации и превращается в более активный дигидротестостерон, который затем поступает в просвет семенных извитых канальцев и участвует в регуляции сперматогенеза и спермиогенеза [16, 17]. Вместе с тем известно, что тестостеронпродуцирующая активность эндокриноцитов семенников угнетается под действием кортикостероидов [18, 19].
Анализируя полученные результаты, нужно учитывать, что одним из ведущих компонентом эндокринной системы является гипоталамо-гипофизарно-гонадная система, обеспечивающая контроль репродуктивной системы.
Так как сахарный диабет сопровождается развитием в организме гипергликемии и гиперкетонемии, то можно предположить, что в силу повышения проницаемости плаценты [20], глюкоза и кетоновые тела в избытке проникают в кровь плода. Избыточная концентрация сахара в крови обусловливает транзиторную гиперплазию бета-клеток островков Лангерганса плода и, как следствие, гиперинсулинизм плода, который, в конечном итоге, приводит к развитию гипогликемии, являющейся одним из наиболее серьезных осложнений антенатального развития. Вместе с тем, получены убедительные данные, свидетельствующие о том, что не только недостаток, но и избыток инсулина может приводить к нарушениям функционирования гипоталамических структур, секретирующих рилизинг фактор лютеинизирующего гормона (ЛГРФ), что в свою очередь обусловливает нарушение выработки лютеинизирующего гормона гипофиза, и, как следствие, приводит к снижению уровня андрогенов [21]. Интересно, что нарушения секреции ЛГРФ гипоталамическими структурами и лютеинизирующего гормона гипофизом выявлены у животных с гипогликемией, обусловленной введением инсулина [22, 23]. Так, P.N. Cates и K.T. Byrne в условиях эксперимента показали, что индуцированный инсулином гипогликемический стресс оказывает стимулирующее влияние на освобождение гипоталамусом гонадотропин-рилизинг-гормона и, как следствие, снижение пульсирующего освобождения лютеинизирующего гормона гипофизом [22].
Другим механизмом, обусловливающим снижение уровня ЛГРФ, лютеинизирующего гормона и тестостерона в условиях гипогликемии, является изменение активности гипоталамо-гипофизарно-адреналовой системы [21]. В частности, установлено, что кортиколиберин в условиях in vitro и in vivo ингибирует секрецию ЛГРФ [21]. Таким образом, активация гипоталамо-гипофизарно-адреналовой системы в условиях стресса, вызванного снижением уровня глюкозы, ведет к подавлению активности гипоталамо-гипофизарно-гонадной системы.
Можно предположить, что при иммобилизационном стрессе создается высокий уровень концентрации кортикостероидов, что еще в большей степени угнетает секреторную активность клеток Лейдига, это, в конечном итоге, приводит к нарушению процесса сперматогенеза, наиболее выраженного у подопытных животных, и проявляющегося в снижении концентрации сперматозоидов и их двигательной активности.
Список литературы
Боголюбов С.В., Витязева И.И., Макарова Н.П., Львова А.Г. Клиническое ведение пациентов с тератозооспермией в циклах вспомогательных репродуктивных технологий. Доктор Ру. 6(50): 34–38. 2009. [Bogolubov S.V., Vityazeva I.I., Makarova N.P., Lvova A.G. Clinical management of teratozoospermic patients in infertility treatment with assisted reproductive technologies. Doctor Ru. 6(50): 34–38. 2009. (In Russ)].
Кулаков В.И., Леонова Б.В., Кузьмичёва Л.Н. Лечение женского и мужского бесплодия. Вспомогательные репродуктивные технологии. М. Мед. информац. агентство. 2005. [Kulakov V.I., Leonova B.V., Kuz’micheva L.N. Lechenie zhenskogo i muzhskogo besplodiya. Vspomogatel’nye reproduktivnye tekhnologii [Treatment of female and male infertility. Assisted reproductive technology]. Moscow. Meditsinskoe informatsionnoe agentstvo. 2005.
Сафина Н.Ю., Яманди Т.А., Черных В.Б., Акуленко Л.В., Боголюбов С.В., Витязева И.И., Рыжкова О.П., Степанова А.А., Адян Т.А., Близнец Е.А., Поляков А.В. Генетические факторы мужского бесплодия, их сочетания и спермиологическая характеристика мужчин с нарушением фертильности. Андрология и генитальная хирургия. 19(2): 40–51. 2018. [Safina N.Yu., Yamandi T.A., Chernykh V.B., Akulenko L.V., Bogolyubov S.V., Vityazeva I.I., Ryzhkova O.P., Stepanova A.A., Adyan T.A., Bliznets E.A., Polyakov A.V. Genetic factors of male infertility, their combinations and the spermatological characteristics of men with fertility failures. Andrology and Genital Surgery. 19(2): 40–51. 2018. (In Russ)].
Резников А.Г., Пишак В.П., Носенко Н.Д., Ткачук С.С., Мыслицкий В.Ф. Пренатальный стресс и нейроэндокринная патология. Черновцы. Медакадемия. 2014. [Reznikov A.G., Pishak V.P., Nosenko N.D., Tkachuk S.S., Myslitskiy V.F. Prenatal’nyy stress i neyroendokrinnaya patologiya [Prenatal stress and neuroendocrine pathology]. Chernovtsy. Medakademiya. 2014.
Бадалян Б.Ю., Сарксян Дж., Худовердян А.Д., Амбарцумян Г.Р., Сароян М.Ю., Худовердян Д.Н. Пренатальный стресс – как фактор морфофункциональных нарушений цнс в пре- и постнатальном онтогенезе. Вопр. теоретич. клин. медицины. (9): 7–20. 2012. [Badalyan B.Yu., Sarksyan Dzh., Khudoverdyan A.D., Ambartsumyan G.R., Saroyan M.Yu., Khudoverdyan D.N. Prenatal stress as a factor in morphological and functional abnormalities of the Central nervous system in pre – and postnatal ontogenesis. Issues Theoret. Clin. Medicine. (9): 7–20. 2012.
Дедов И.И., Шестакова М.В. Сахарный диабет: острые и хронические осложнения. М. ООО “Издательство "Медицинское информационное агентство”. 2011. [Dedov I.I., Shestakovа M.V., eds. Sakharnyy diabet: ostrye i khronicheskie oslozhneniya [Diabetes mellitus: acute and chronic complications]. Moscow. OOO “Izdatel’stvo "Meditsinskoe informatsionnoe agentstvo”. 2011.
Jelodar G., Khaksar Z., Pourahmadi M. Endocrine profile and testicular histomorphometry in adult rat offspring of diabetic mothers. J. Physiol. Sci. 59(5): 377–382. 2009. https://doi.org/10.1007/s12576-009-0045-7
Amorim E.M., Damasceno D.C., Perobelli J.E., Spadotto R., Fernandez C.D., Volpato G.T., Kempinas W.D. Short- and long-term reproductive effects of prenatal and lactational growth restriction caused by maternal diabetes in male rats. Reprod. Biol. Endocrinol. 9: 154. 2011. https://doi.org/10.1186/1477-7827-9-154
Закирьянов А.Р., Плахотний М.А., Онищенко Н.А., Володина А.В., Клименко Е.Д., Кобозева Л.П., Мичунская А.Б., Поздняков О.М. Диабетические осложнения у крыс при длительных сроках моделирования сахарного диабета 1-го типа. Патол. физиол. эксперим. терапия. 4: 21–25. 2007. [Zakirianov A.R., Plakhotny M.A., Onischenko N.A., Volodina A.V., Klimenko E.D., Kobozeva L.P., Michunskaya А.В., Pozdnyakov О.М. Diabetic complications in rats in long-term modeling of type I diabetes mellitus. Patol. fiziologiya i eksperiment. terapiya. 4: 21–25. 2007. (In Russ)].
Луцкий Д.Л., Николаев А.А. Морфологическое исследование эякулята: методическое пособие. Астрахань. 1999. [Lutskiy D.L., Nikolaev A.A. Morfologicheskoe issledovanie eyakulyata [Morphological examination of ejaculate]: metodical instruction. Astrakhan’. 1999.
Молнар Е. Общая сперматология. Будапешт. 1969. [Molnar E. Obshchaya spermatologiya [The total spermatology]. Budapesht. 1969.
Тиктинский О.Л. Андрология. СПб.1999. [Tiktinskiy O.L. Andrologiya [Andrology]. Saint-Petersburg.1999.
Шевлюк Н.Н., Стадников А.А. Клетки Лейдига семенников позвоночных (онтогенез, ультраструктура, цитофизиология, факторы и механизмы регуляции). Оренбург. Изд-во ОрГМА. 2010. [Shevlyuk N.N., Stadnikov A.A. Kletki Leydiga semennikov pozvonochnykh (ontogenez, ul’trastruktura, tsitofiziologiya, faktory i mekhanizmy regulyatsii) [Leydig cells of vertebrate testes (ontogenesis, ultrastructure, cytophysiology, factors and mechanisms of regulation)]. Orenburg. Izdatel’stvo OrGMA. 2010.
Лобанова Н.Н., Панушева Н.И., Белова Т.И. Изменения содержания катехоламинов в структурах мозга крыс, перенесших иммобилизационный стресс. Бюл. эксперим. биологии и медицины. (11): 526–527. 1986. [Lobanova N.N., Panusheva N.I., Belova T.I. Changes in the content of catecholamines in the brain structures of rats undergoing immobilization stress. Bull. Exper. Biol. Med. (11): 526–527. 1986. (In Russ)].
Alves M.G., Martins A.D., Cavaco J.E., Socorro S., Oliveira P.F. Diabetes, insulin-mediated glucose metabolism and Sertoli/blood-testis barrier function. Tissue Barriers. 1(2): e23992. 2013.
Hutson J.C., Stocco D.M., Campbell G.T., Wagoner J. Sertoli cell function in diabetic, insulin-treated diabetic and semi-starved rats. Diabetes. 32(2): 112–116. 1983.
Shinohara T., Orwig K.E., Avarbock M.R., Brinster R.L. Restoration of Spermatogenesis in Infertile Mice by Sertoli Cell Transplantation. Biol. Reprod. 68(3): 1064–1071. 2003.
Потемкина Т.Е., Кузнецова С.В., Ляляев В.А. Изменение параметров семенной жидкости самцов белых крыс при различных видах экспериментального стресса. Совр. технологии в медицине. (2): 23–26. 2009. [Potemkina T.E., Kuznetsova S.V., Lyalyaev V.A. Alteration of the white rat male seminal fluid parameters at different types of experimental stress. Modern technologies in medicine. (2): 23–26. 2009. (In Russ)].
Стадников А.А., Шевлюк Н.Н. Морфофункциональная характеристика гипоталамо-гипофизарно-гонадной системы крыс-самцов в условиях эмоционально-болевого стресса. Морфология. 110(5): 38–42. 1996. [Stadnikov A.A., Shevlyuk N.N. Morphological characteristics of hypothalamo-hypophyseal gonadal system in conditions of emotional pain stress. Morphology. 110(5): 38–42. 1996. (In Russ)].
Капустин Р.В., Оноприйчук А.Р., Аржанова О.Н. Патофизиология плаценты и плода при сахарном диабете. Журн. акушерства и женских болезней. 67(6): 79–92. 2018. [Kapustin R.V., Onopriychuk A.R., Arzhanova O.N. Pathophysiology of the placenta and fetus in diabetes mellitus. J. Obstetrics Women’s diseases. 67(6): 79–92. 2018. (In Russ)]. https://doi.org/10.17816/JOWD67679-92
Шпаков А.О. Функциональное состояние гипотало-гипофизарно-гонадной системы при сахарном диабете. Пробл. эндокринол. 5: 23–29. 2010. [Shpakov A.O. Functional state of the hypothalamic-pituitary-gonadal axis in diabetes mellitus. Probl. Endocrinol. 5: 23–29. 2010. (In Russ)].
Cates P.N., O Byrne R.T. The area postrema mediates insulin hypoglycemia-induced suppression of pulsatile LH secretion in the female rat. Brain Res. 853: 151–155. 2000. https://doi.org/10.1016/s0006-8993(99)02301-x
Chen M.D., Ordög T., O’Byrne K.T., Goldsmith J.R., Connaughton M.A., Knobil E. The insulin hypoglycemia-induced inhibition of gonadotropin-releasing hormone pulse generator activity in the rhesus monkey: roles of vasopressin and corticotropin-releasing factor. Endocrinology. 137(5): 2012–2021. 1996. https://doi.org/10.1210/endo.137.5.8612542
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


