Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1524-1540
Эффекты стимуляции инфралимбической коры на реакции нейронов каудальной вентролатеральной ретикулярной формации, вызванные ноцицептивным раздражением толстой кишки крысы
С. С. Пантелеев 1, *, И. Б. Сиваченко 1, И. И. Бусыгина 1, О. А Любашина 1, 2
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Институт фармакологии им. А.В. Вальдмана Первого Санкт-Петербургского
государственного медицинского университета им. акад. И.П. Павлова
Санкт-Петербург, Россия
* E-mail: panteleev0@gmail.com
Поступила в редакцию 17.09.2020
После доработки 15.10.2020
Принята к публикации 16.10.2020
Аннотация
Инфралимбическая кора больших полушарий головного мозга характеризуется обширной системой афферентных и эфферентных связей с кортикальными, субкортикальными, стволовыми структурами и спинным мозгом, обеспечивающими ее участие в высших механизмах регуляции функций висцеральной сферы. Вместе с тем, участие инфралимбической коры в нейрональных механизмах модуляции висцеральной ноцицепции как острой, так и хронической представляется недостаточно ясным. В работе с использованием модели абдоминальной боли на двух группах наркотизированных уретаном крыс (нормальные крысы и крысы с экспериментальным колитом) изучались эффекты электрической стимуляции инфралимбической коры на реакции нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга и изменения артериального давления, вызванные ноцицептивным растяжением колоректальной области толстой кишки. Установлено, что у крыс обеих групп ноцицептивное колоректальное растяжение сопровождается как возбудительными, так и тормозными реакциями нейронов каудальной вентролатеральной ретикулярной формации, а также депрессорными изменениями артериального давления. Впервые показано, что электрическая стимуляция инфралимбической коры усиливает возбудительные и уменьшает тормозные реакции нейронов на висцеральное болевое раздражение, а также усиливает депрессорные реакции как у нормальных крыс, так и у крыс с колитом. Этот эффект был более выражен в группе нормальных животных. В целом влияние инфралимбической коры на ноцицептивные нейроны вентролатеральной ретикулярной формации и васкулярные реакции на висцеральную боль можно рассматривать как облегчающие висцеральную ноцицепцию. Количественные различия в эффектах кортикальной стимуляции у нормальных крыс и крыс с колитом, возможно, связаны с различиями в обработке мозгом острой висцеральной боли и боли, осложненной хроническим воспалением. Одним из возможных механизмов кортикального влияния на висцеральную ноцицепцию может быть модуляция текущей активности ноцицептивных нейронов каудальной вентролатеральной ретикулярной формации, прямо или косвенно участвующих в нисходящем контроле висцеральной боли.
Известно, что некоторые области коры больших полушарий головного мозга имеют прямое отношение к высшим механизмам регуляции функций висцеральной сферы [1]. В частности, это относится к расположенной на медиальной поверхности ростральной части больших полушарий головного мозга медиальной префронтальной коре. В дорсо-вентральном направлении медиальная префронтальная кора крысы подразделяется на переднюю поясную (ACC), прелимбическую (PLC) и инфралимбическую кору (ILC) [2, 3], последнюю принято рассматривать в качестве “висцеромоторного” поля коры больших полушарий головного мозга, так как электрическое или химическое раздражение этой кортикальной области сопровождается значительными изменениями артериального давления крови, частоты сердечных сокращений, дыхательной функции, а также моторной и секреторной деятельности желудочно-кишечного тракта [4–8]. Инфралимбическая кора характеризуется обширной системой афферентных и эфферентных связей с кортикальными, субкортикальными, стволовыми структурами и спинным мозгом, обеспечивающими ее участие в широком спектре процессов, связанных с памятью, когнитивной деятельностью, эмоциональным и аффективным поведением и т.п. [9–17]. Анализ этих функций инфралимбической коры не входит в задачи настоящей работы, поэтому мы остановимся на ее связях и функциях, имеющих отношение к основной цели настоящей работы, а именно, к изучению нейрональных механизмов кортикальной модуляции висцеральной ноцицепции. Предполагается, что кортикальная модуляция висцеральной ноцицепции реализуется через прямые проекции инфралимбической коры к структурам мозга, входящим в состав так называемой эндогенной системы нисходящей модуляции боли [18–22], конечным звеном которой являются афферентные нейроны дорсального рога спинного мозга, формирующие восходящий поток висцероцептивной, в том числе и ноцицептивной информации в супраспинальные структуры мозга, включая кору больших полушарий. Одной из ключевых структур в этой системе является каудальная вентролатеральная ретикулярная формация продолговатого мозга [23], нейроны которой имеют прямые реципрокные связи с нейронами люмбо-сакрального отдела спинного мозга [24], где оканчиваются афферентные волокна тазового нерва от органов брюшной полости, в частности, от толстого кишечника. Электрическая или химическая стимуляция этой области продолговатого мозга сопровождается висцеромоторными и поведенческими реакциями на висцеральную боль у крыс [25]. В этой области продолговатого мозга обнаружены группы нейронов, отвечающих специфическим паттерном активности на ноцицептивное колоректальное растяжение [26], реакции которых существенно изменялись на фоне действия антиноцицептивных субстанций [27–30], а также в условиях кишечного воспаления [31, 32]. В отличие от стволовых механизмов модуляции боли [25], механизмы кортикальной модуляции висцеральной ноцицепции как острой, так и хронической остаются малоизученными. Поэтому основной целью данного исследования было оценить эффекты электрической стимуляции инфралимбической коры головного мозга крыс на реакции висцеральных ноцицептивных нейронов каудальной вентролатеральной ретикулярной формации и на изменения артериального давления, вызванные ноцицептивным колоректальным растяжением у нормальных крыс и у крыс с экспериментальным колитом.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на 22-х наркотизированных уретаном (1.5 мг/кг, внутрибрюшинно; ICN Biomedical Inc., США) самцах крыс линии Вистар массой 250–300 г, выведенных и содержавшихся в стандартных условиях вивария Института физиологии им. И.П. Павлова РАН (Коллекция лабораторных млекопитающих разной таксономической принадлежности Института физиологии им. И.П. Павлова РАН). Все эксперименты выполнены в соответствии с этическими принципами Международной ассоциации по изучению боли и Директивой Совета Европейского сообщества (86/609/EEC), а также требованиями Комиссии по контролю за содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН (заключение №02/24 от 24 февраля 2020 г.). Для изучения эффектов электрической стимуляции инфралимбической коры на висцеральную ноцицепцию использовалась экспериментальная модель абдоминальной боли на крысах. Предполагается, что эта модель имитирует болевые ощущения, возникающие у пациентов, страдающих синдромом раздраженной кишки при сверхпороговом растяжении колоректального отдела толстого кишечника. При этом болевые ощущения как у человека, так и у животных сопровождаются рефлекторными висцеромоторными реакциями в виде сокращений брюшной мускулатуры, изменений частоты сердечных сокращений и артериального давления. Величина этих реакций зависит от величины давления в баллоне и связана со степенью выраженности абдоминальной боли [33–35]. Указанные висцеромоторные рефлексы реализуются с участием нейронов структур продолговатого мозга, в частности, каудальной вентролатеральной ретикулярной формации продолговатого мозга, реакции нейронов которой могут использоваться в качестве объективных критериев боли при изучении нейрональных механизмов висцеральной ноцицепции [27, 29–31, 36].
Опыты выполнены на двух группах крыс. Первая группа из 14 животных использовалась в качестве контрольной, вторая группа состояла из 8 крыс с экспериментальным колитом, вызванным трансректальным введением с помощью шприца Гамильтона спиртового раствора пикрилсульфониевой кислоты (20 мг в 0.2 мл 50%-ного этанола; TNBS, Sigma, США) в колоректальную область по методу Morris с соавт. [31, 32, 37]. Эксперименты начинались через 6–8 дней после введения TNBS, на пике развития колита.
После 24-часовой пищевой депривации со свободным доступом к воде животное анестезировалось уретаном, и после достижения хирургического уровня анестезии производилась установка катетеров в бедренные вену и артерию для введения анестетика (при необходимости) и для регистрации артериального давления с помощью полупроводникового датчика давления (MLT0670, ADInstruments Ltd., Великобритания). Затем животное помещалось в стереотаксический прибор (Medicor, Венгрия). Для доступа к продолговатому мозгу на дорсальной поверхности шеи делался разрез, шейные мышцы, часть затылочной кости над дорсальной поверхностью мозга, а также часть твердой мозговой оболочки аккуратно удалялись, после чего поверхность продолговатого мозга покрывалась теплым вазелиновым маслом. Для доступа к инфралимбической коре головного мозга в кости черепа в области проекции медиальной префронтальной коры на дорсальную поверхность черепа выполнялась краниотомия (2.5 × 1.5 мм), твердая мозговая оболочка надрезалась, и отверстие заполнялось теплым вазелиновым маслом. Адекватность анестезии контролировалось по стабильности артериального давления крови, которое поддерживалось в диапазоне 70–100 мм рт. ст. Температура тела животного поддерживалась в диапазоне 37–39°C с помощью специальной подложки и водяного термостата (U-10, Германия). Общая схема экспериментов представлена на рис. 1.
Рис. 1.
Схема экспериментов по изучению эффектов электрической стимуляции инфралимбической коры на реакции ноцицептивных нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга, вызванные болевым колоректальным растяжением. Обозначения: 1 – стимулирующий электрод, 2 – электростимулятор А320, 3 – усилитель переменного тока DAM 80, 4 – микропогружатель МП2, 5 – регистрирующий электрод, 6 – полупроводниковый датчик давления, 7 – шприцевой насос DS-09, 8 – стимулирующий баллон, АСС – передняя поясная кора, PLC – прелимбическая кора, ILC – инфралимбическая кора, vlRF – каудальная вентролатеральная ретикулярная формация, DRG – ганглий дорсального рога.
Fig. 1. Scheme of experiments to study the effects of electrical stimulation of the infralimbic cortex on the responses of nociceptive neurons in the caudal ventrolateral medullary reticular formation caused by noxious colorectal distension. Designation: 1 – stimulating electrode, 2 – electrostimulator А320, 3 – AC amplifier DAM 80, 4 – microdriver MP2, 5 – recording electrode, 6 – semiconductor pressure sensor, 7 – syringe pump DS-09, 8 – stimulating balloon, АСС – anterior cingulate cortex, PLC – prelimbic cortex, ILC – infraralimbic cortex, vlRF – caudal ventrolateral medullary reticular formation, DRG – dorsal root ganglion.
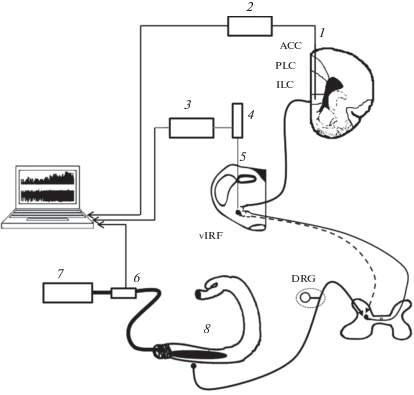
В качестве висцеральной стимуляции использовалось механическое растяжение колоректальной области толстой кишки (CRD – colorectal distension) с помощью тонкостенного резинового баллона объемом около 8 см3, который вводился ректально и соединялся катетером со шприцевым насосом (DS-09, Visma-Planar, Беларусь). Катетер фиксировался липкой лентой на хвосте животного. Насос использовался для создания давления во внутрикишечном баллоне величиной 80 мм рт. ст. в течение 60 с, со скоростью нарастания давления около 10 с. По нашим данным, указанное давление является ноцицептивным для толстого кишечника крысы [27]. Электрическая стимуляция инфралимбической коры осуществлялась с помощью вводимого в кору вольфрамового электрода сопротивлением около 50 кОм в области, ограниченной 2.0–3.5 мм рострально относительно брегмы, 0.5–1.0 мм латеральнее средней линии, 4.4–4.6 мм от дорсальной поверхности мозга. Кортикальная стимуляция производилась серией прямоугольных монополярных импульсов тока силой 100–150 мкА, длительностью 100–300 мкс и частотой следования 20 Гц в течение 10 с при помощи электростимулятора Isostim А320 (WPI, США), управляемого от компьютера.
Регистрация внеклеточной нейрональной активности осуществлялась вольфрамовым электродом (WPI, США) с кончиком диаметром около 1 мкм и сопротивлением около 1–2 МОм. Электрод с помощью электронного микропогружателя (МП2, Россия) погружался в ткань мозга в область, соответствующей каудальной вентролатеральной ретикулярной формации продолговатого мозга согласно атласу мозга крысы [38] и расположенной на 1.0–1.5 мм ростральнее задвижки, на 1.8–2.3 мм латеральнее средней линии, на глубину 2.7–3.4 мм относительно дорсальной поверхности мозга с шагом 4.0 мкм. Отводимый электродом сигнал поступал на вход усилителя (DAM 80, WPI, США) и после усиления и фильтрации в диапазоне 400–5000 Гц подавался на вход звуковой карты компьютера. Визуализация нейрональной активности осуществлялась в режиме реального времени с помощью программы Audition 3 (Adobe Corp., США) с последующим сохранением в формате звукового файла, который затем импортировался в программу Spike 2 (CED, Великобритания) для последующего анализа, обеспечивающего дифференциальную селекцию нейрональных разрядов по форме с раздельной обработкой импульсных потоков. Нейроны считались отвечающими на колоректальное растяжение, если частота их разрядов изменялась во время раздражения не менее чем на 10% по сравнению с фоновым значением. Оценка влияния электрической стимуляции коры на ноцицептивные реакции нейронов каудальной вентролатеральной ретикулярной формации и на изменения артериального давления, инициированные ноцицептивным колоректальным растяжением, осуществлялась в следующей парадигме. Сначала регистрировались реакции нейронов и изменения артериального давления на изолированное применение колоректального растяжения. Затем через 3–5 мин повторяли указанное растяжение с предшествующей (20 с) электрической стимуляцией инфралимбической коры. Расчет средних частот разрядов нейронов производился 60-секундными интервалами до, во время, а также после окончания колоректального растяжения, в этих же интервалах рассчитывались средние значения артериального давления. Соответствующие расчеты и графическое представление результатов производили с помощью программы Origin 2018 (OriginLab Corp., США). Статистический анализ и оценка достоверности результатов осуществляли с помощью программы InStat 3.02 (GraphPad Software Inc., США) с применением непараметрических статистических тестов. Результаты выражались как среднее значение ± ошибка среднего.
По окончании каждого эксперимента животное подвергалось эвтаназии внутривенным введением трехкратной дозы уретана, после чего выполнялось электролитическое разрушение ткани мозга через регистрирующий и стимулирующий электроды, мозг удалялся и помещался для фиксации в 10%-ный раствор параформальдегида в течение недели. Локализация мест регистрации и стимуляции производилась по 40 микронным срезам мозга, окрашенным тионином, с использованием атласа мозга крысы [38]. По завершении каждого опыта у здоровых крыс и животных с колитом выполнялся забор фрагмента толстой кишки длиной 8 см от ануса для визуального анализа и последующей стандартной гистологической обработки (эозин и гематоксилин) с целью исключения кишечной патологии у нормальных животных и гистологического подтверждения воспаления толстой кишки у крыс с колитом.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В данной работе с использованием экспериментальной модели абдоминальной боли на крысах [33] изучали влияние электрической стимуляции инфралимбической коры на реакции нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга и изменения артериального давления, инициированные ноцицептивным растяжением колоректального отдела толстого кишечника крысы. Работа выполнялась на двух группах анестезированных уретаном самцах крыс. Первая (контрольная) группа состояла из 14 нормальных крыс (крысы без колита). Во вторую (экспериментальную) группу входили 8 крыс с колитом. У крыс первой группы была зарегистрирована фоновая и вызванная активность 232 нейронов каудальной вентролатеральной ретикулярной формации, из которых 112 нейронов, или 48.3%, отвечали на ноцицептивное колоректальное растяжение пролонгированным увеличением частоты разрядов (возбуждающиеся нейроны, рис. 2А), 48 нейронов, или 20.7%, отвечали пролонгированным уменьшением частоты разрядов (тормозящиеся нейроны, рис. 2В) и 72 нейрона, или 31% от общего числа нейронов, не отвечали на указанное колоректальное растяжение.
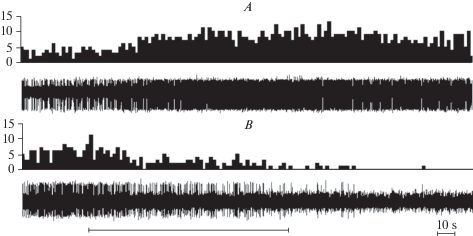
Рис. 2.
Типичные примеры активности нейронов с возбудительным (А) и тормозным (В) типами реакции на ноцицептивное колоректальное растяжение. На каждой записи вверху диаграмма частоты разрядов, внизу соответствующая спайковая последовательность. По оси ординат – частота разрядов в с, абсцисса – время в с, отметка времени – 10 с, черта под рисунками – отметка растяжения.
Fig. 2. Typical examples of the activity of neurons with excitatory (A) and inhibitory (B) types of response to nociceptive colorectal distension. Each record has a discharge frequency diagram at the top, and a corresponding spike sequence at the bottom. The ordinate is the discharge frequency in spikes/s, the abscissa is the time in s, the time stamp is 10 s, the line under the figures is the colorectal distension mark.
У животных второй группы была зарегистрирована фоновая и вызванная активность 189 нейронов, из которых 65 нейронов, или 34.4%, были возбуждающимися нейронами, 72 нейрона, или 38.1%, – тормозящимися и 52 нейрона, или 27.5% от общего числа нейронов, не отвечали на колоректальное растяжение. Таким образом, в каудальной вентролатеральной ретикулярной формации нами продемонстрированы два типа нейронов, связанных с висцеральной ноцицепцией: нейроны с пролонгированным возбуждением и нейроны с пролонгированным торможением на ноцицептивное колоректальное растяжение.
У крыс контрольной группы ноцицептивное колоректальное растяжение вызывало значительное увеличение частоты разрядов возбуждающихся нейронов до 135.7 ± 9.3% (n = 112, р < 0.0001, парный тест Вилкоксона) относительно их фоновой частоты разрядов, которое продолжалось и после окончания растяжения. Предшествующая колоректальному растяжению электрическая стимуляция инфралимбической коры сопровождалась существенным усилением нейрональных реакций на растяжение – до 155 ± 13.7% (n = 112, р < 0.0001, парный тест Вилкоксона) относительно фоновой активности, хотя это усиление не достигало значимого уровня (n = 112, p = 0.95, парный тест Вилкоксона) относительно реакции на изолированное колоректальное растяжение. При этом указанная тенденция сохранялась и после окончания растяжения (рис. 3А).
Рис. 3.
Диаграммы изменении частоты разрядов нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга с возбудительным (А) и тормозным (В) типами реакции на CRD у контрольных крыс до (CRD) и после электрического раздражения инфралимбической коры (ILC + CRD). По оси ординат – частота разрядов в % к фоновой частоте; *** – p < 0.001 относительно фоновой частоты, # и ### – p < 0.05 и < 0.001 относительно изолированного применения ноцицептивного колоректального растяжения. На нижней диаграмме – соответствующие изменения артериального давления (С).
Fig. 3. Diagrams of changes in the rate of discharges of neurons of the caudal ventrolateral medullary reticular formation with excitatory (A) and inhibitory (B) types of response to the CRD in control rats before (CRD) and after electrical stimulation of the infralimbic cortex (ILC + CRD). The ordinate shows the rate of discharges in % to the background activity, *** – p < 0.001 relative to the background frequency, # and ### – p < 0.05 and < 0.001 relative to the isolated use of nociceptive colorectal distension. The bottom diagram shows the corresponding changes in blood pressure (C).
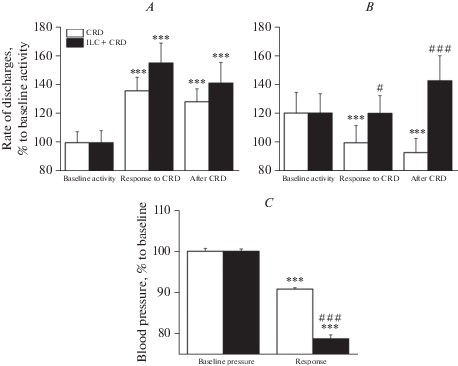
У нейронов с тормозными реакциями болевое колоректальное растяжение сопровождалось существенным уменьшением частоты разрядов до 79.5 ± 12% (n = 48, p < 0.0001, парный тест Вилкоксона) относительно фоновой частоты, которое продолжалось и после окончания растяжения. У нейронов этого типа предшествующая кортикальная стимуляция уменьшала тормозную реакцию нейронов на колоректальное растяжение до 99.8 ± 12.2% (n = 48, p = 0.025, парный тест Вилкоксона), относительно изолированного применения колоректального растяжения, которая инвертировалась после окончания растяжения (рис. 3В). В контрольной группе животных ноцицептивное колоректальное растяжение сопровождалось существенным снижением артериального давления до 91 ± 0.34% (p < 0.0001, U = 122, критерий Манна–Уитни) относительно исходного значения. Предшествующая стимуляция инфралимбической коры приводила к достоверному усилению депрессорной реакции на колоректальное растяжение до 79 ± 0.9% (p < 0.0001, U = 4.0, критерий Манна–Уитни), относительно исходных значений. Это усиление достигало значимого уровня (p < 0.0001, U = 344.0, критерий Манна–Уитни) по отношению к изолированному применению колоректального растяжения (рис. 3С). Таким образом, в контрольной группе (нормальные крысы) электрическая стимуляция инфралимбической коры вызывала усиление нейрональных и депрессорных реакций на ноцицептивное растяжение толстой кишки. В группе животных с экспериментальным колитом ноцицептивное колоректальное растяжение вызывало достоверное увеличение частоты разрядов нейронов с возбудительной реакцией на растяжение до 148.7 ± 18.5%, (n = 65, p < 0.0001, парный тест Вилкоксона) относительно фоновой активности. Это увеличение частоты сохранялось после окончания растяжения. Предшествующая стимуляция инфралимбической коры незначительно увеличивала возбудительную реакцию этих нейронов на колоректальное растяжение (154.2 ± 22.1%, n = 65, p < 0.0001, парный тест Вилкоксона), относительно фонового значения, которое сохранялось и после прекращения растяжения (рис. 4А).
Рис. 4.
Диаграммы изменений частоты разрядов нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга с возбудительным (А) и тормозным (В) типами реакции на CRD у крыс с колитом до (CRD) и после электрического раздражения инфралимбической коры (ILC + CRD). По оси ординат – частота разрядов в % к фоновой частоте; *** – p < 0.001 относительно фоновой частоты, # и ### – p < 0.05 и < 0.001 относительно изолированного применения ноцицептивного колоректального растяжения. На нижней диаграмме – соответствующие изменения артериального давления (С).
Fig. 4. Diagrams of changes in the rate of discharges of neurons of the caudal ventrolateral medullary reticular formation with excitatory (A) and inhibitory (B) types of response to the CRD in rats with colitis before (CRD) and after electrical stimulation of the infralimbic cortex (ILC + CRD). The ordinate shows the rate of discharges in % to the background activity, *** – p < 0.001, relative to the background frequency, # and ### – p < 0.05 and <0.001 relative to the isolated use of nociceptive colorectal distension. The bottom diagram shows the corresponding changes in blood pressure (C).
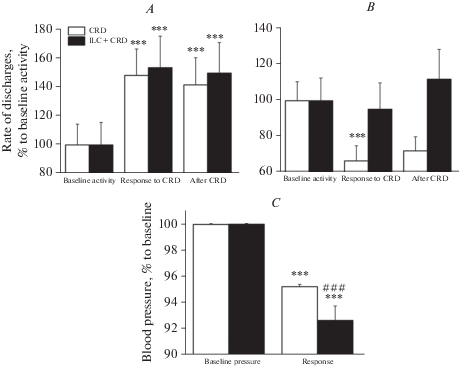
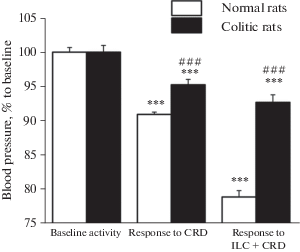
В этой группе крыс болевое колоректальное растяжение вызывало уменьшение частоты разрядов 72 нейронов до 66.5 ± 8.4% (n = 72, p < 0.0001, парный тест Вилкоксона) относительно фоновой активности, которое сохранялось после окончания растяжения. Предшествующая стимуляция инфралимбической коры вызывала уменьшение тормозной реакции на колоректальное растяжение практически до уровня фоновой активности (95.2 ± 17.7%, n = 72, p = 0.56, парный тест Вилкоксона), с последующей инверсией реакции на возбудительную, однако этот эффект не достигал достоверного уровня (n = 72, р = 0.09, парный тест Вилкоксона) (рис. 4В). В этой группе крыс ноцицептивное колоректальное растяжение также вызывало депрессорные изменения артериального давления, что выражалось в падении артериального давления до 95.2 ± 0.2% (p < 0.0001, U = 357.0, тест Манна–Уитни) относительно исходного значения. Эта реакция достоверно усиливалась после стимуляции инфралимбической коры (92.7 ± 1.1%, p < 0.0001, U = 46.0, тест Манна–Уитни) относительно исходных значений и (p < 0.0001, U = 2359.0, тест Манна–Уитни) относительно реакции на изолированное применение болевого колоректального растяжения (рис. 4С). Таким образом, в экспериментальной группе крыс электрическая стимуляция инфралимбической коры также характеризовалась облегчающим эффектом на нейрональные и депрессорные реакции на ноцицептивное растяжение толстой кишки. Вместе с тем, падение артериального давления в ответ на ноцицептивное колоректальное растяжение в группе крыс с колитом было достоверно меньше (p = 0.0001, n1 = 80, n2 = 80, U = 668.0, тест Манна–Уитни), чем в группе нормальных крыс. Электрическая стимуляция инфралимбической коры достоверно усиливала депрессорную реакцию как в группе нормальных крыс (p = 0.0001, n1 = 80, n2 = 90, U = 294.0, тест Манна–Уитни), так и в группе крыс с колитом (p = 0.0001, n1 = 80, n2 = 80, U = 1288.0, тест Манна–Уитни) (рис. 5). Это усиление депрессорной реакции было более выражено в группе нормальных крыс.
Рис. 5.
Диаграмма изменений артериального давления в ответ на ноцицептивное колоректальное растяжение у нормальных крыс (белый столбик) и у крыс с колитом (черный столбик) до (CRD) и после (ILC + CRD) предварительной электрической стимуляции инфралимбической коры. По оси ординат – величина артериального давления в % к исходному значению; *** – p < 0 .001 относительно исходных значений, ### – p < 0.001 относительно значений у нормальных крыс.
Fig. 5. Diagram of blood pressure changes to nociceptive colorectal distension in normal rats (white bar) and in rats with colitis (black bar) before (CRD) and after (ILC + CRD) preliminary electrical stimulation of the infralimbic cortex. The ordinate is the blood pressure in % to the baseline value; *** – p < 0.001, relative to baseline values, ### – p < 0.001 relative to values in normal rats.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
B настоящее время не вызывает сомнений, что инфралимбическая кора головного мозга имеет непосредственное отношение к высшим механизмам регуляции висцеральных функций и интеграции их в целостное поведение организма [1, 17, 39]. Вместе с тем, эта область коры также является интегральной частью эндогенной системы нисходящей модуляции боли, в том числе висцеральной [18, 20, 22, 25 , 40, 41]. Показано, что электрическая или химическая стимуляция инфралимбической коры может модулировать висцеральные ваго-вагальные рефлексы желудка [7], артериальное давление, частоту сердечных сокращений и дыхания, моторику желудка, частоту мочеиспускания и региональный кровоток [42–44], а также усиливать или тормозить висцеромоторные реакции на колоректальное растяжение у крыс [45]. Кроме того, часть эфферентных проекций инфралимбической коры оканчивается непосредственно на нейронах торакального отдела спинного мозга [46], поэтому влияние инфралимбической коры на ноцицепцию колоректальной области кишечника, которая получает иннервацию от нейронов люмбо-сакрального отдела спинного мозга, по-видимому, опосредуется через связи с другими структурами мозга, например, через прямые проекции к вентролатеральной ретикулярной формации продолговатого мозга [11, 47], которая играет важную роль в системе эндогенного нисходящего контроля висцеральной ноцицепциии. Эта область продолговатого мозга через прямые реципрокные связи с торакальным отделом спинного мозга [25, 48] участвует в формировании кардиоваскулярных ответов на болевую периферическую стимуляцию, что дает основания рассматривать ее в качестве центра интеграции ноцицептивной и кардиоваскулярной систем [24, 49, 50]. Благодаря прямым связям с инфралимбической корой, гипоталамусом, центральным серым веществом, миндалиной и ядром одиночного тракта вентролатеральная ретикулярная формация опосредует нисходящую модуляцию висцеральной ноцицепции, координированную с другими функциями мозга.
Кроме того, в этой области продолговатого мозга оканчиваются терминали аксонов нейронов люмбо-сакрального отдела спинного мозга, получающих висцероцептивные, в том числе, и ноцицептивные афференты от толстого кишечника, проходящие в составе тазового нерва [51–53]. Вместе с тем, электрическая или химическая стимуляция вентролатеральной ретикулярной формации сопровождается торможением ответов нейронов люмбо-сакрального отдела спинного мозга на периферическую ноцицептивную стимуляцию [24, 50, 54].
Установлено, что ноцицептивное колоректальное растяжение вызывает существенные изменения c-Fos-иммунореактивности в вентролатеральной ретикулярной формации [55–58]. Ранее нами с использованием ноцицептивного колоректального растяжения, имитирующего абдоминальную боль, сопровождающую ряд функциональных заболеваний желудочно-кишечного тракта, например, синдром раздраженной кишки, было продемонстрировано участие нейронов вентролатеральной ретикулярной формации в механизмах серотонинергической модуляции абдоминальной боли в норме [27–30] и при кишечной патологии [31, 32].
В настоящей работе с использованием модели абдоминальной боли на наркотизированных крысах [33, 34] мы изучили влияние электрической стимуляции инфралимбической коры головного мозга на реакции нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга и изменения артериального давления крови, вызванные ноцицептивным растяжением колоректального отдела толстого кишечника. Эти реакции использовались нами в качестве нейронального и системного маркеров абдоминальной ноцицепции соответственно. Ранее показано, что у анестезированных уретаном крыс ноцицептивное периферическое раздражение сопровождается преимущественно снижением артериального давления, тогда как у бодрствующих крыс – его повышением [8, 33]. В настоящей работе нами продемонстрированы два типа нейронов каудальной вентролатеральной ретикулярной формации, отвечающих на ноцицептивное (80 мм рт. ст) колоректальное растяжение. Нейроны первого типа отвечали на растяжение пролонгированным увеличением, нейроны второго типа – пролонгированным уменьшением частоты разрядов. Как в группе нормальных крыс, так и в группе крыс с колитом, эти изменения продолжались в течение 30–60 с после окончания растяжения кишки и сопровождались депрессорными изменениями артериального давления. Ранее нами было показано, что при неболевом колоректальном растяжении (20 мм рт. ст.) значимых изменений как в нейрональной активности, так и в артериальном давлении не наблюдалось [27]. Нейроны с аналогичными реакциями на колоректальное растяжение [59, 60], на растяжение пищевода [61], желудка [62], мочеточника [63] и мочевого пузыря [64] были продемонстрированы в спинном мозге. Нейроны с пролонгированными реакциями на ноцицептивное колоректальное растяжение выявлены нами ранее в ядре одиночного тракта и в каудальной вентролатеральной ретикулярной формации продолговатого мозга [27–30, 65]. В данной работе мы подтвердили существование в каудальной вентролатеральной ретикулярной формации группы нейронов с пролонгированными возбудительными и тормозными реакциями на ноцицептивное колоректальное растяжение. Очевидно, что нейроны с подобными реакциями на ноцицептивное растяжение толстого кишечника имеют непосредственное отношение к висцеральной боли и могут рассматриваться как ноцицептивные в отношении к абдоминальной боли [26–28, 36, 65, 66]. Это подтверждается депрессорными реакциями, которые регистрировались нами и другими авторами на ноцицептивное колоректальное растяжение [27, 29, 30, 32, 33, 35]. Интересно, что обнаруженные нами в вентролатеральной ретикулярной формации два типа нейронов разнонаправленно изменяли частоту разрядов в реакции на ноцицептивное растяжение. Нами не обнаружено различий в локализации этих нейронов исследуемой области, более того, оба типа нейронов зачастую могли одновременно регистрироваться в одной и той же локализации. Можно предположить, что указанные нейроны прямо или косвенно получают возбуждающие ноцицептивные входы от люмбо-сакрального отдела спинного мозга. По-видимому, нейроны с тормозными реакциями на ноцицептивное растяжение кишки получают спинальный возбуждающий вход опосредованно тормозными, возможно, ГАМК-ергическими интернейронами [67, 68]. Можно предположить, что ноцицептивные нейроны каудальной вентролатеральной ретикулярной формации прямо или косвенно участвуют в механизме нисходящей модуляции висцеральной ноцицепции. Хотя точный механизм взаимодействия этих нейронов неясен, можно предположить, что обнаруженные нами два типа ноцицептивных нейронов входят во внутриядерную систему тормозящихся и возбуждающихся (катехоламинергических) нейронов [69], которые реципрокно связаны с висцероцептивными нейронами люмбо-сакрального отдела спинного мозга и могут участвовать в динамической реализации висцеральных рефлексов на ноцицептивные периферические сигналы [70].
Функциональное состояние этих нейронов может динамически изменяться в зависимости от афферентной активности, поступающей в эту область продолговатого мозга и, в частности, от инфралимбической коры, модулируя тем самым спинальные механизмы ноцицепции и изменяя поток восходящей ноцицептивной информации в супраспинальные и кортикальные структуры [24, 70].
В данной работе впервые показано, что электрическая стимуляция инфралимбической коры у нормальных крыс сопровождается усилением ответов нейронов с возбудительной реакцией и уменьшением тормозных ответов нейронов с тормозным типом реакции в ответ на ноцицептивное колоректальное растяжение. Это позволяет говорить о возбуждающем влиянии инфралимбической коры на ноцицептивные нейроны каудальной вентролатеральной ретикулярной формации, иными словами, кортикальная стимуляция усиливает ноцицептивные реакции нейронов с возбудительным и уменьшает реакции нейронов с тормозным типом реакции на ноцицептивное колоректальное растяжение, очевидно, через прямые возбуждающие (глутаматергические) проекции инфралимбической коры к этим нейронам [70]. Это подтверждается и усилением депрессорной реакции на ноцицептивное колоректальное растяжение после предварительной кортикальной электрической стимуляции.
В целом, сходная картина наблюдалась и у крыс с экспериментальным колитом с той разницей, что реакции нейронов обоих типов на колоректальное растяжение в этом случае были несколько увеличенными, хотя это увеличение и не достигало достоверных значений. Следует добавить, что как у нормальных крыс, так и у крыс с колитом электрическая стимуляция инфралимбической коры оказывает облегчающее действие на системную реакцию в ответ на ноцицептивное растяжение кишки (усиление депрессорной реакции), причем этот эффект более выражен у нормальных крыс, чем у крыс с колитом.
Мы полагаем, что инфралимбическая кора, модулируя активность ноцицептивных нейронов каудальной вентролатеральной ретикулярной формации продолговатого мозга, изменяет баланс между возбудительными и тормозными процессами, который определяет конечный эффект (анти- или проноцицептивный) на уровне нейронов спинного мозга [71]. На системном уровне этот эффект выражается в соответствующем изменении артериального давления. В наших опытах кортикальная стимуляция вызывала усиление депрессорной реакции на ноцицептивное колоректальное растяжение, что может рассматриваться как проноцицептивное действие электрической стимуляции коры. Ранее предполагалось, что эндогенная антиноцицептивная система мозга, включающая в себя медиальную префронтальную кору и вентролатеральную ретикулярную формацию продолговатого мозга, и, как следует из названия, характеризовалась исключительно антиноцицептивным действием на периферические болевые раздражители [18, 72]. Однако последующие исследования показали, что активация этой системы может сопровождаться как анти-, так и проноцицептивным эффектом на периферическую ноцицепцию [22, 23, 40, 45, 73, 74]. Очевидно, что системным эффектам кортикального влияния на ноцицепцию могут соответствовать определенные нейрональные корреляты, регистрируемые в структурах мозга, связанных с нисходящей модуляцией ноцицепции, в нашем случае с каудальной вентролатеральной ретикулярной формацией продолговатого мозга. Это проявлялось в усилении ноцицептивных реакции нейронов с возбудительными и в уменьшении реакций нейронов с тормозными реакциями на ноцицептивное колоректальное растяжение соответственно. Вместе с тем становится очевидным, что рассмотрение эффектов кортикальной стимуляции на висцеральную ноцицепцию, оценивая только ее нейрональные корреляты без учета системных реакций на боль, делает затруднительным интерпретацию конечных результатов.
Результаты данного исследования позволяют предположить, что одним из путей, посредством которого инфралимбическая кора может модулировать восходящие ноцицептивные сигналы от толстого кишечника, реализуется через прямые возбуждающие проекции к ноцицептивным нейронам каудальной вентролатеральной ретикулярной формации продолговатого мозга, которые прямо или косвенно опосредуют кортикальные эффекты на абдоминальную ноцицепцию. Что касается кардиоваскулярных эффектов, то скорее всего, кортикальная модуляция изменений артериального давления, инициированных болевым колоректальным растяжением, реализуется через прямые связи каудальной вентролатеральной ретикулярной формации с ее ростральным отделом и с цервикальным и торкальным отделами спинного мозга [75].
Таким образом, наши результаты показали, что инфралимбическая кора оказывает общее возбуждающее действие на вызванные болевым колоректальным растяжением ответы ноцицептивных нейронов вентролатеральной ретикулярной формации и на соответствующие депрессорные реакции как у нормальных крыс, так и у крыс с колитом. Установлено, что у крыс с колитом эффекты кортикальной стимуляции менее выражены, чем у нормальных животных. Функциональное значение подобных различий неясно, но можно предположить, что у животных с колитом эффекты стимуляции инфралимбической коры осложнены хроническим воспалением кишечника, которое, в свою очередь, может активировать эндогенную антиноцицептивную систему мозга, действующую в направлении, противоположном кортикальной стимуляции. Однако это предположение требует дополнительной экспериментальной проверки.
Список литературы
Benarroch E.E. The Central Autonomic Network: Functional Organization, Dysfunction, and Perspective. Mayo Clin. Proc. 68: 988–1001.1993.
Terreberry R.R., Neafsey E. The rat medial frontal cortex projects directly to autonomic regions of the brainstem. Brain Res. Bull. 19: 639-649. 1987.
Heidbreder C.A., Groenewegen H.J. The medial prefrontal cortex in the rat: evidence for a dorso-ventral distinction based upon functional and anatomical characteristics. Neurosci. Biobehav. Rev. 27: 555–579.2003.
Terreberry R.R., Neafsey E.J. Rat medial frontal cortex: a visceral motor region with a direct projection to the solitary nucleus. Brain Res. 278: 245–249. 1983.
Al Maskati H.A., Zbrozyna A.W. Stimulation in prefrontal cortex area inhibits cardiovascular and motor components of the defense reaction in rats. J. Autonom. Nerv. System. 28: 117–126. 1989.
Verberne A.M., Owens N.C. Cortical modulation of the cardiovascular system. Progress Neurobiol. 54: 149–168. 1998.
Panteleev S., Grundy D. Descending influences from the infralimbic cortex on vago–vagal reflex control of gastric motor activity in the rat. Autonom. Neurosci.: Basic and Clinical. 86: 78–83. 2000.
Tavares R.F., Antunes-Rodrigues J., de Aguiar Correa F.M. Pressor Effects of Electrical Stimulation of Medial Prefrontal Cortex in Unanesthetized Rats. J. Neurosci. Res. 77: 613–620. 2004.
Cassell M.D., Wright D.J. Topography of Projections From the Medial Pretiontal Cortex to the Amygdale in the Rat. Brain Res. Bull. 17: 321–333. 1986.
Sesack S.R., Deutch A.Y., Roth R.H., Bunney B.S. Topographical Organization of the Efferent Projections of the Medial Prefrontal Cortex in the Rat: An Anterograde Tract-Tracing Study With Phaseolus vulgaris Leucoagglutinin. J. Compar. Neurol. 290: 213–242. 1989.
Hurley K.M., Herbert H., Moga M.M., Saper C.B. Efferent Projections of the Infralimbic Cortex of the Rat. J. Compar. Neurol. 308: 249–276.1991.
Takagishi M., Chiba T. Efferent projections of the infralimbic (area 25) region of the medial prefrontal cortex in the rat: an anterograde tracer PHA-L study. Brain Res. 566: 26–39. 1991.
Groenewegen H.J., Uylings H.B.M. The prefrontal cortex and the integration of sensory, limbic and autonomic information. Progr. Brain Res. 126: 3–28. 2000.
Gabbott P.L.A., Warner T.A., Jays P.R.L., Bacon S.J. Areal and synaptic interconnectivity of prelimbic (area 32), infralimbic (area 25) and insular cortices in the rat. Brain Res. 993: 59–71. 2003.
Gabbott P.L.A., Warner T.A., Jays P.R.L., Salway P., Busby S.J. Prefrontal Cortex in the Rat: Projections to Subcortical Autonomic, Motor, and Limbic Centers. J. Compar. Neurol. 492: 145–177. 2005.
Vertes R.P. Differential Projections of the Infralimbic and Prelimbic Cortex in the Rat. Synapse. 51: 32–58. 2004.
McKlveen J.M., Myers B., Herman J.P. The Medial Prefrontal Cortex: Coordinator of Autonomic, Neuroendocrine and Behavioural Responses to Stress. J. Neuroendocrinol. 27: 446–456. 2015.
Sandkuhler J. The organization and function of endogenous antinociceptive systems. Progr. Neurobiol. 50: 49–81.1996.
Millan M.J. Descending control of pain. Progr. Neurobiol. 66: 355–474. 2002.
Benarroch E.E. Pain-autonomic interactions. Neurol. Sci. 27: S130–S133. 2006.
Ossipov M.H., Dussor G.O., Porreca F. Central modulation of pain. J. Clin. Invest. 120(11): 3779–3787. 2010.
Patel R., Dickenson A.H. A study of cortical and brainstem mechanisms of diffuse noxious inhibitory controls in anaesthetized normal and neuropathic rats. Eur. J. Neurosci. 00: 1–11. 2019.
Heinricher M.M., Tavares I., Leith J.L., Lumb B.M. Descending control of nociception: Specificity, recruitment and plasticity. Brain Res. Rev. 60: 214 – 225. 2009.
Tavares I., Lima D. The Caudal Ventrolateral Medulla as an Important Inhibitory Modulator of Pain Transmission in the Spinal Cord. Pain. 3(5): 337–346. 2002.
Tavares I., Lima D. From neuroanatomy to gene therapy: searching for new ways to manipulate the supraspinal endogenous pain modulatory system. J. Anat. 211: 261-268. 2007.
Ness T.J., Follett K.A., Piper J., Dirks B.A. Characterization of neurons in the area of the medullary lateral reticular nucleus responsive to noxious visceral and cutaneous stimuli. Brain Res. 802: 163–174. 1998.
Panteleev S.S., Martseva A.A., Lyubashina O.A. The inhibitory effect of granisetron on ventrolateral medulla neuron responses to colorectal distension in rats. Eur. J. Pharmacol. 749: 49–55. 2015.
Любашина О.А., Сиваченко И.Б., Пантелеев С.С., Ноздрачев А.Д. Эффекты блокады 5‑НТ3-рецепторов на висцеральные ноцицептивные нейроны вентролатеральной ретикулярной области продолговатого мозга крысы. Журн. эволюц. биохим. физиол. 52(4): 281–291. 2016. [Lyubashina O.A., Sivachenko I.B., Panteleev S.S., Nozdrachev A.D. Effects of 5-HT3 receptor blockade on visceral nociceptive neurons in the ventrolateral reticular region of the rat medulla oblongata. Zhurn. Evoliuts. Biokhimii i Fiziologii. 52(4): 281–291. 2016. (In Russ)].
Lyubashina O.A., Sivachenko I.B. The 5-HT4 receptor-mediated inhibition of visceral nociceptive neurons in the rat caudal ventrolateral medulla. Neuroscience. 359: 277–288. 2017. https://doi.org/10.1016/j.neuroscience.2017.07.039
Panteleev S.S., Sivachenko I.B., Lyubashina O.A. The central effects of buspirone on abdominal pain in rats. Neurogastroenterol. & Motility. 30: e13431. 2018.
Lyubashina O.A., Sivachenko I.B., Busygina I.I., Panteleev S.S. Colitis-induced alterations in response properties of visceral nociceptive neurons in the rat caudal medulla oblongata and their modulation by 5-HT3 receptor blockade. Brain Res. Bull. 142: 183–196. 2018.
Lyubashina O.A., Sivachenko I.B., Sokolov A.Y. Differential responses of neurons in the rat caudal ventrolateral medulla to visceral and somatic noxious stimuli and their alterations in colitis. Brain Res. Bull. 152: 299–310. 2019.
Ness T.J., Gebhart G.F. Colorectal distension as a noxious visceral stimulus: physiologic and pharmacologic characterization of pseudaffective reflexes in the rat. Brain Res. 450: 153–169. 1988.
Ness T.J., Randich A., Gebhart G.F. Further behavioral evidence that colorectal distension is a 'noxious' visceral stimulus in rats. Neurosci. Lett.131: 113–116. 1991.
Sivarao D.V., Langdon S., Bernard C., Lodge N. Colorectal distension-induced pseudoaffective changes as indices of nociception in the anesthetized female rat: morphine and strain effects on visceral sensitivity. J. Pharmacol. Toxicol. Methods. 56: 43–50. 2007.
Ness T.J., Piper J.G., Follett K.A. The effect of spinal analgesia on visceral nociceptive neurons in caudal medulla of the rat. Anesth. Analg. 89: 721–726. 1999.
Morris G.P., Beck P.L., Herridge M.S., Depew W.T., Szewczuk M.R., Wallace J.L. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 96(3): 795–803. 1989.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. London. Acad. Press. 1998.
Cechetto D.F. Cortical control of the autonomic nervous system. Exp. Physiol. 99(2): 326–331. 2014.
Robinson D.A., Calejesan A.A., Wei F., Gebhart G.F., Zhuo M. Endogenous Facilitation: From Molecular Mechanisms to Persistent Pain. Current Neurovasc. Res. 1: 11–20. 2004.
Pinto M., Lima D., Tavares I. Neuronal activation at the spinal cord and medullary pain control centers after joint stimulation: a c-fos study in acute and chronic articular inflammation. Neuroscience.147: 1076–1089. 2007.
Hurley-Gius K.M., Neafsey E.J. The Medial Frontal Cortex and Gastric Motility: Microstimulation Results and Their Possible for the Overall Pattern of Organization of Rat. Frontal and Parietal Cortex. Brain Res. 365: 241–248. 1986.
Frysztak R.J., Neafsey E.J. The effect of medial frontal cortex lesions on cardiovascular conditioned emotional responses in the rat. Brain Res. 643: 181–193. 1994.
Owens N.C., Verberne A.J.M. An electrophysiological study of the medial prefrontal cortical projection to the nucleus of the solitary tract in rat. Exp. Brain Res. 110: 55–61. 1996.
Cao Z., Wu X., Chen S., Fan J., Zhang R., Owyang C., Li Y. Anterior Cingulate Cortex Modulates Visceral Pain as Measured by Visceromotor Responses in Viscerally Hypersensitive Rats. Gastroenterology. 134: 535–543. 2008.
Bacon S.J., Smith A.D. A monosynaptic pathway from an identified vasomotor centre in the medial prefrontal cortex to an autonomic area in the thoracic spinal cord. Neuroscience. 54(3): 719–728. 1993.
Verberne A.J.M. Medullary sympathoexcitatory neurons are inhibited by activation of the medial prefrontal cortex in the rat. Am. J. Physiol. 270: R713–R719. 1996.
Tavares I., Lima D. Descending projections from the caudal medulla oblongata to the superficial or deep dorsal horn of the rat spinal cord. Exp. Brain Res. 99: 455–463. 1994.
Ciriello J., Caverson M.M. Bidirectional cardiovascular connections between ventrolateral medulla and nucleus of the solitary tract. Brain Res. 367: 273–281. 1986.
Siddall P.J., Polson J.W., Dampney R.A. Descending antinociceptive pathway from the rostral ventrolateral medulla: a correlative anatomical and physiological study. Brain Res. 645: 61–68. 1994.
Ermirio R., Ruggeri P., Molinari C., Weaver L. C. Somatic and visceral inputs to neurons of the rostral ventrolateral medulla. Am. J. Physiol. 265: R35–R40. 1993.
Martinez V., Wang L., Mayer E., Tache Y. Proximal colon distention increases Fos expression in the lumbosacral spinal cord and activates sacral parasympathetic NADPHd-positive neurons in rats. J. Comp. Neurol. 390: 311–321. 1998.
Wang C.-C., Willis W.D., Westlund A.N. Ascending Projections From the Area Around the Spinal Cord Central Canal: A Phaseolus vulgaris Leucoagglutinin Study in Rats. J. Compar. Neurol. 415: 341–367. 1999.
Lovick T.A. Analgesia and the Cardiovascular Changes Evoked by Stimulating Neurones in the Ventrolateral Medulla in Rats. Pain. 25: 259–268. 1986.
Rodella L., Rezzani R., Gioia M., Tredici G., Bianchi R. Expression of Fos immunoreactivity in the rat supraspinal regions following noxious visceral stimulation Brain Res. Bull. 47(4): 357–366. 1998.
Monnikes H., Ruter J., Konig M., Grote C., Kobelt P., Klapp B.F., Arnold R., Wiedenmann B., Tebbe J.J. Differential induction of c-fos expression in brain nuclei by noxious and non-noxious colonic distension: role of afferent C-fibers and 5-HT receptors. Brain Res. 966: 253–264. 2003.
Wang L., Martínez V., Larauche M., Taché Y. Proximal colon distension induces Fos expression in oxytocin-,vasopressin-, CRF- and catecholamines-containing neurons in rat brain. Brain Res. 1247: 79–91. 2009.
Lyubashina O., Atanasova D., Panteleev S., Itzev D., Lazarov N. Differential c-fos expression in nuclei of the caudal medulla oblongata following noxious colorectal distension in anaesthetized rats. Compt. rendus de l’Academ. bulgare des Sci. 65: 709–716. 2012.
Berkley K.J., Hubscher C.H., Wall P.D. Neuronal responses to stimulation of the cervix, uterus, colon, and skin in the rat spinal cord. J. Neurophysiol. 69: 545–556. 1993.
Ji Y., Traub R.J. Differential effects of spinal CNQX on two populations of dorsal horn neurons responding to colorectal distension in the rat. Pain. 99: 217–222. 2002.
Qin C., Chandler M.J., Jou C.J., Foreman R.D. Responses and afferent pathways of C1-C2 spinal neurons to cervical and thoracic esophageal stimulation in rats. J. Neurophysiol. 91: 2227–2235. 2004.
Qin C., Chandler M.J., Miller K.E., Foreman R.D. Responses and afferent pathways of C(1)-C(2) spinal neurons to gastric distension in rats. Auton. Neurosci. 104: 128–136. 2003.
Laird J.M., Roza C., Cervero F. Spinal dorsal horn neurons responding to noxious distension of the ureter in anesthetized rats. J. Neurophysiol. 76: 3239–3248. 1996.
Ness T.J., Castroman P. Evidence for two populations of rat spinal dorsal horn neurons excited by urinary bladder distension. Brain Res. 923: 147–156. 2001.
Panteleev S.S., Martseva A.A., Lyubashina O.A. Responses of Solitary Tract Nucleus Neurons to Nociceptive Stimuli of the Large Intestine in Rats. Neurosci. Behav. Physiol. 43(6): 775–781. 2013.
Ness T.J., Gebhart G.F. Characterization of neuronal responses to noxious visceral and somatic stimuli in the medial lumbosacral spinal cord of the rat. J. Neurophysiol. 57: 1867–1892. 1987.
Millhorn D.E., Hokfelt T., Seroogy K., Oertel W., Verhofstad A.A., Wu J.Y. Immunohistochemical evidence for colocalization of gamma-aminobutyric acid and serotonin in neurons of the ventral medulla oblongata projecting to the spinal cord. Brain Res. 410: 179–185. 1987.
Owens N.C., Verberne A.J.M. Medial prefrontal depressor response: involvement of the rostral and caudal ventrolateral medulla in the rat. J. Autonom. Nerv. System. 78: 86–93. 2000.
Gabbott P.L.A., Warner T., Busby S.J. Catecholaminergic neurons in medullary nuclei are among the post-synaptic targets of descending projections from infralimbic area 25 of the rat medial prefrontal cortex. Neuroscience. 144: 623–635. 2007.
Yelle M.D., Oshiro Y., Kraft R.A., Coghill R.C. Temporal filtering of nociceptive information by dynamic activation of endogenous pain modulatory systems. J. Neurosci. 29: 10264–10271. 2009.
Castro A.R., Morgado C., Lima D., Tavares I. Differential expression of NK1 and GABAB receptors in spinal neurones projecting to antinociceptive or pronociceptive medullary centres. Brain Res. Bull. 69: 266–275. 2006.
Stamford J.A. Descending control of pain. Br. J. Anaesth. 75: 217–227. 1995.
Zhang L., Zhang Y., Zhao Z. Anterior cingulate cortex contributes to the descending facilitatory modulation of pain via dorsal reticular nucleus. Eur. J. Neurosci. 22: 1141–1148. 2005.
Calejesan A.A., Kim S.J., Zhuo M. Descending facilitatory modulation of a behavioral nociceptive response by stimulation in the adult rat anterior cingulate cortex. Eur. J. Pain. 4: 83–96. 2000.
Tavares I., Lima D., Coimbra A. The Ventrolateral Medulla of the Rat Is Connected With the Spinal Cord Dorsal Horn by an Indirect Descending Pathway Relayed in the A5 Noradrenergic Cell Group. J. Compar. Neurol. 374: 34–95. 1996.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


