Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1541-1552
Генерализация страха обстановки зависит от активности серотониновой системы медиальной префронтальной коры
Н. Б. Саульская 1, *, О. Э. Марчук 1
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: saulskayanb@infran.ru
Поступила в редакцию 18.06.2020
После доработки 18.09.2020
Принята к публикации 05.10.2020
Аннотация
Медиальная префронтальная кора (мПК) участвует в регуляции генерализации страха. Ранее мы показали, что формирование генерализованного страха в ответ на звуковые сигналы находится под контролем серотониновой системы мПК, поскольку ее фармакологическая активация во время выработки условной реакции страха (УРС – модель страха) усиливает на этапе тестирования проявления страха, вызываемого безопасными звуковыми стимулами. Цель настоящей работы заключалась в выяснении, вовлекается ли серотониновая система мПК в процесс генерализации страха обстановки. На крысах линии Спрег–Доули методом прижизненного внутримозгового микродиализа показано, что помещение животных в потенциально опасную камеру А, в которой ранее у них вырабатывали УРС (сочетание условного сигнала с неизбегаемым электрокожным раздражением), сопровождается подъемом уровня внеклеточного серотонина в мПК и вызывает замирание животных (показатель страха обстановки). Помещение этих же животных в безопасную дифференцировочную камеру Б тоже приводило к подъему уровня внеклеточного серотонина в мПК и вызывало замирание животных (показатель генерализованного страха обстановки). Введение в мПК во время выработки УРС флуоксетина (1 мкМ), селективного ингибитора обратного захвата серотонина, увеличивало на этапе тестирования замирание животных в безопасной камере Б, но не влияла на замирание в камере А. Такое фармакологическое воздействие не изменяло выраженность подъемов уровня внеклеточного серотонина в мПК, вызываемых пребыванием в камерах А и Б. Полученные данные свидетельствуют о том, что активация серотониновой системы мПК при формировании страха влияет на степень генерализации страха обстановки. Кроме того, наши результаты позволяют предположить, что усиление активности серотониновой системы мПК безопасными обстановочными стимулами может быть одним из нейрохимических проявлений генерализованного страха обстановки.
Работы последнего времени, выполненные на лабораторных животных и здоровых испытуемых, продемонстрировали важную роль медиальной префронтальной коры (мПК) в дискриминации потенциально опасных и безопасных внешних сигналов [1–3]. Дефицит этого процесса, связанный с дефицитом дифференцировочного торможения, приводит к генерализации страха, которая выражается в проявлениях страха на безопасные стимулы. В исследованиях на животных установлено, что генерализация страха тем сильнее, чем сильнее стрессовое воздействие, порождающее страх [4]. В соответствии с этим в клинике чрезмерная и стойкая генерализация страха отмечена у пациентов с посттравматическими стрессовыми расстройствами, перенесшими тяжелую психоэмоциональную травму [5–7]. Причем, у таких пациентов ухудшение дискриминации опасных и безопасных дискретных сигналов (звуковых, световых и т.д.) сопровождается нарушением взаимодействия амигдалы и мПК [8] и усилением активации дорсального отдела мПК безопасными внешними стимулами [7]. Эти данные свидетельствуют о значимости мПК для контроля генерализации страха, вызываемого такими сигналами, не только в норме, но и при психопатологии.
Ранее мы показали, что формирование генерализованного страха на звуковые сигналы зависит от активности серотониновой системы мПК, поскольку введение в эту область во время выработки условной реакции страха (УРС) селективного ингибитора обратного захвата серотонина флуоксетина, увеличивающего уровень внеклеточного серотонина в мПК, усиливает на этапе тестирования проявления страха, вызываемые безопасными звуковыми стимулами [9]. Вместе с тем, мПК является важным центром обработки полимодальных контекстуальных сигналов, приходящих из гиппокампальной формации [2], и, согласно результатам недавних исследований, выполненных методами инактивации и разрушений, вовлечена в формирование генерализованного страха обстановки [10, 11]. Изучение новых нейрохимических механизмов такого участия является актуальной задачей, поскольку при психопатологии обстановочные стимулы зачастую выполняют роль триггера, запускающего травматизирующие воспоминания и проявления страха [12].
Наши прежние данные свидетельствуют, что серотонинергический вход, возможно, оказывает влияние на префронтальную регуляцию генерализации страха обстановки [13]. А именно, мы установили, что выработка УРС сопровождается выбросом серотонина в мПК, величина которого выше у животных, демонстрирующих на этапе тестирования высокую генерализацию страха обстановки (большее замирание в безопасной дифференцировочной камере Б), и меньше у крыс с низкой генерализацией страха обстановки (меньшее замирание в камере Б), но она не коррелирует с замиранием в потенциально опасной камере А [13]. Эти данные, полученные на основе выявленных корреляций, позволяют предполагать, но не доказывают, что сопутствующая выработке УРС активация серотониновой системы мПК усиливает последующую генерализацию страха обстановки. Цель настоящей работы состояла в дальнейшей проверке этого предположения. В работе для выяснения взаимосвязи между активностью серотониновой системы мПК и генерализацией страха обстановки было изучено влияние локальной фармакологической стимуляции серотониновой системы мПК во время выработки УРС локальным введением флуоксетина (методический подход, использованный нами ранее [9]) на последующие проявления страха обстановки и на генерализацию страха обстановки (замирание в опасной условнорефлекторной камере и в безопасной дифференцировочной камере соответственно), а также на изменения уровня внеклеточного серотонина в мПК в ходе этих тестов. Такие сведения в литературе отсутствуют.
Новизна данной работы заключается в том, что в ней впервые исследованы изменения активности серотониновой системы мПК (по показателю уровня внеклеточного серотонина) в ходе проявлений генерализованного страха обстановки, а также впервые изучено влияние фармакологической стимуляции серотониновой системы мПК во время выработки УРС (модель формирования страха) на последующую генерализацию страха обстановки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на крысах-самцах линии Спрег–Доули массой 300–380 г из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Исследования проводили в соответствии с международными нормами гуманного обращения с лабораторными животными, отраженными в Базельской декларации, и рекомендациями комиссии по работе с животными Института физиологии им. И.П. Павлова РАН. Были предприняты все усилия для минимизации страданий животных и для уменьшения числа используемых животных. Животных содержали при свободном доступе к воде и корму в условиях естественного светового режима (свет в 8.00 в течение 12 ч).
В работе использовали метод прижизненного внутримозгового микродиализа. Животным под наркозом унилатерально имплантировали концентрические диализные канюли в мПК, как описано ранее [14]. На следующий день (этап обучения) каждую крысу, находящуюся в дневной домашней клетке, подключали к диализному насосу SP-300 (Next Advance, США) и начинали диализную перфузию мПК искусственной спинномозговой жидкостью [15] со скоростью 1 мкл/мин. На этом этапе животных разделяли на группы – две экспериментальных и одну контрольную. У животных экспериментальной группы 1 (n = 10) вырабатывали УРС с дискриминационным компонентом, как описано ранее [9]. Коротко, каждую крысу помещали в условнорефлекторную камеру А с решетчатым покрытием пола на 5 мин, где один раз в минуту предъявляли звуковой условный сигнал – непрерывный тон (1000 Гц, 10 с, 5 раз), который сочетали с электрокожным раздражением лап (1.5 мА, 1 с, 5 раз). Затем животных пересаживали в дневную домашнюю клетку и через 100 мин проводили дифференцировочную сессию: каждую крысу помещали на 5 мин в дифференцировочную камеру Б, где раз в минуту предъявляли дифференцировочный сигнал – прерывистый тон (1000 Гц, 10 с, 5 раз) без электрокожного раздражения. Через 5 мин крысу возвращали в дневную домашнюю клетку на 70 мин. На этом этап обучения заканчивали. С животными контрольной группы (n = 7) проводили те же процедуры, что и с крысами экспериментальной группы 1, но без электрокожного раздражения.
Животным экспериментальной группы 2 (n = 7) в первый день эксперимента в искусственную спинномозговую жидкость для перфузии мПК добавляли флуоксетин (1 мкМ; Sigma, США), селективный ингибитор транспортеров серотонина, в концентрации и по схеме, использованных нами ранее [9]. А именно, через час после начала введения проводили сначала выработку УРС, а через 100 мин после нее – дифференцировочную сессию, как описано для экспериментальной группы 1. Через 70 мин после окончания дифференцировочной сессии перфузионную жидкость, содержащую флуоксетин, заменяли на искусственную спинномозговую жидкость и проводили отмывку канюли и тканей мозга от флуоксетина в течение 30 мин. После этого эксперимент завершали.
Через два дня (этап тестирования) животных подключали к диализному насосу, подающему искусственную спинномозговую жидкость. После стабилизационного периода (1 ч) собирали 4 фоновых порций диализата (по 15 мин) для определения фонового уровня внеклеточного серотонина перед поведенческими тестами. Затем крыс экспериментальной группы 1 и экспериментальной группы 2 тестировали на генерализацию условнорефлекторного страха обстановки. Для этого каждое животное помещали на 5 мин в дифференцировочную камеру Б, не ассоциируемую с болевым раздражением. Звуковых сигналов в этом тесте не предъявляли. Затем животное возвращали в дневную домашнюю клетку. Через 70 мин крысу тестировали на проявления условнорефлекторного страха обстановки, помещая на 5 мин в условнорефлекторную камеру А, ранее сочетавшуюся с болевым раздражением. Звуковых сигналов и болевого раздражения в этом тесте не предъявляли. После этого животное возвращали в дневную домашнюю клетку и через 55 мин эксперимент завершали. С животными контрольной группы (n = 7) на этом этапе проводили те же процедуры, что и с крысами экспериментальной группы 1 и 2. На этапе тестирования диализат собирали каждые 15 мин в течение всего экспериментального дня и немедленно анализировали на содержание серотонина.
Во время поведенческих тестов проводили видеорегистрацию поведения на персональном компьютере с помощью веб-камеры (Logiteс, Китай). Регистрировали длительность замирания (с) во время пребывания в дифференцировочной камере Б и условнорефлекторной камере А, параметр, отражающий ожидание болевого раздражения в заведомо безопасной (камера Б) и потенциально опасной (камера А) обстановке.
Определение уровня серотонина в диализате мПК осуществляли методом высокоэффективной жидкостной хроматографии с электрохимической детекцией. Использовали хроматографическую систему (Shimadzu, Германия) и параметры хроматографического анализа, описанные нами ранее [9]. Регистрацию и обработку хроматограмм проводили в режиме реального времени (МультиХром 1.72, Амперсенд, Россия). Содержание серотонина в каждой диализной пробе выражали в нМ/л, а затем – в процентах по отношению к собственному среднему фоновому уровню. По завершении экспериментов животных подвергали эвтаназии (рометар, 1.4 мг/100 г массы; золетил, 5 мг/100 г массы, внутримышечно; уретан, 0.2 г/100 г массы, внутрибрюшинно). Мозг извлекали и помещали в водный 10%-ный раствор формалина для последующего морфологического контроля попаданий. В обработку были включены крысы с локализацией диализного участка канюль в мПК (преимущественно прелимбическая кора).
Статистическую обработку результатов осуществляли с использованием статистического пакета SigmaStat (3.0). Данные выражали как среднее ± стандартная ошибка среднего. Сравнение изменений уровня внеклеточного серотонина относительно фонового уровня проводили методом однофакторного дисперсионного анализа (фактор – время; F-критерий) с последующим сравнением изменений в отдельных временны́х точках относительно фона по t-критерию Бонферрони. Межгрупповое сравнение проводили методом двухфакторного дисперсионного анализа (первый фактор – группа, второй фактор – время, F-критерий) с последующим сравнением групп в конкретных временны́х точках по t-критерию Бонферрони. Сравнение параметров поведения осуществляли с помощью t-критерия Стьюдента или критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Помещение крыс экспериментальной группы 1 на этапе тестирования в безопасную дифференцировочную камеру Б сопровождалось подъемом уровня внеклеточного серотонина в мПК относительно собственного фонового уровня перед тестом (рис. 1A; F(8, 72) = 7.5, p < 0.001). Такой подъем отсутствовал у животных контрольной группы (рис. 1A; F(8, 48) = 0.43, p = 0.81). Межгрупповое сравнение показало, что вызванный пребыванием в камере Б подъем уровня внеклеточного серотонина в мПК у животных экспериментальной группы 1 был достоверно выше, чем уровень серотонина у крыс контрольной группы в ходе соответствующего контрольного теста (F(8, 135) = 4.7, p < 0.001).
Рис. 1.
Изменения уровня внеклеточного серотонина в мПК, вызванные пребыванием (A) – в дифференцировочной камере Б (Box B ) и (B) – в камере А (Box А), ранее сочетавшейся с электрокожным раздражением, крыс, подвергавшихся (After fluoxetine) и не подвергавшихся (Untreated) во время выработки УРС введению в мПК 1 мкМ флуоксетина, а также крыс контрольной группы (Control). По оси абсцисс – время, мин; по оси ординат – уровень серотонина, % к фону; разброс на графиках – ошибка среднего; стрелка – начало теста; * p < 0.01; ** p < 0.001 при сравнении с фоном; + p < 0.01; ++ p < 0.001 – при сравнении с контрольной группой.
Fig. 1 Changes in extracellular serotonin levels in the mPFC on exposure to (A) – differentiation box B , (Box B ) and (B) – to box A (Box A ), previously paired with foothock, in rats subjected to (After fluoxetine) and not subjected to (Untreated) the intra-mPFC fluoxetine infusion (1μM) during the conditioned fear response acquisition, as well as in control rats (Control). The axis x – time, min; the axis y – extracellular serotonin level, % of baseline. The deviation in the curves is a standard error of measurements. Arrows – the beginning of the tests. *p < 0.01; ** p < 0.001 – compared with basal levels; + p < 0.01; ++ p < 0.001 – compared with the control group.
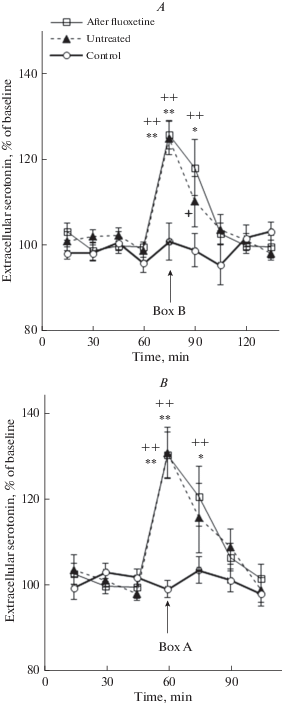
Пребывание в дифференцировочной камере Б животных экспериментальной группы 2, подвергнутых на этапе обучения введению флуоксетина в мПК, тоже приводило к подъему уровня внеклеточного серотонина в мПК относительно собственного фона перед тестом (рис. 1A; F(8, 48) = 10.0, p < 0.001). Такой подъем был выше уровня серотонина крыс контрольной группы (рис. 1A; F(8, 108) = 5.5, p < 0.001), но, по данным двухфакторного дисперсионного анализа, он не отличался значимо от роста этого показателя в ходе данного теста у крыс экспериментальной группы 1, не подвергавшихся во время обучения введению флуоксетина в мПК (рис. 1A; F(8, 135) = 0.58, p = 0.80).
Пребывание крыс экспериментальной группы 1 в условнорефлекторной камере А, ранее сочетавшейся с болевым раздражением, на этапе тестирования сопровождалось увеличением уровня внеклеточного серотонина в мПК относительно фонового уровня перед тестом (рис. 1B; F(6, 54) = 5.8, p < 0.001). Это увеличение уровня серотонина было достоверным относительно данного показателя животных контрольной группы (рис. 1B; F(6, 105) = 3.0, p = 0.009), у которых не было обнаружено статистически значимых изменений уровня внеклеточного серотонина в мПК в ходе соответствующего контрольного теста (рис. 1B; F(6, 36) = 1.3, p = 0.30).
У животных экспериментальной группы 2, подвергавшихся введению флуоксетина в мПК во время обучения, на этапе тестирования был зарегистрирован статистически значимый подъем уровня внеклеточного серотонина в этой области во время пребывания в условнорефлекторной камере А относительно фонового уровня (рис. 1B; F(6, 36) = 9.9, p < 0.001). Этот подъем был также достоверен относительно уровня серотонина в ходе соответствующего контрольного теста (рис. 1B; F(6, 84)= = 5.0, p < 0.001). Однако по данным двухфакторного дисперсионного анализа он не отличался от изменений уровня внеклеточного серотонина в ходе этого теста у крыс экспериментальной группы 1, не подвергнутых во время обучения введению флуоксетина (рис. 1B; F(6, 111) = 0.15, p = 0.99).
Анализ поведения животных на этапе тестирования показал, что крысы экспериментальной группы 2 (с введением флуоксетина в мПК во время выработки УРС) характеризовались большей длительностью замирания в безопасной дифференцировочной камере Б (показатель генерализованного страха обстановки) по сравнению с крысами экспериментальной группы 1, не подвергавшихся введению флуоксетина во время выработки УРС (рис. 2; t = 2.5, p = 0.02). При этом замирание животных обеих экспериментальных групп в камере Б было статистически значимо выше, чем уровень неподвижности крыс контрольной группы в ходе соответствующего контрольного теста (t = 4.5, p < 0.001 и t = 8.4, p < 0.001 для крыс экспериментальных групп 1 и 2 соответственно).
Рис. 2.
Замирание (s) в камере Б (Box B ) и в камере А (Box A ) животных, подвергавшихся (After fluoxetine) и не подвергавшихся (Untreated) во время выработки УРС введению в мПК 1 мкМ флуоксетина, а также крыс контрольной группы (Control). + p < 0.01; ++ p < 0.001 при сравнении с контрольной группой; * p < 0.05 при сравнении с крысами после введений флуоксетина.
Fig. 2. Time spent freezing (s) in Box B (Box B ) and in box A (Box A ) of animals previously exposed (After fluoxetine) and not exposed (Untreated) to the intra-mPFC fluoxetine infusion (1μM) during the conditioned fear response acquisition, as well as in control rats (Control). + p < 0.01; ++ p < 0.001 – compared with the control group; * p < 0.05 – compared with the rats after fluoxetine infusion.
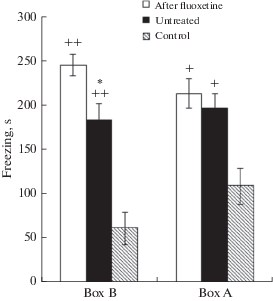
Крысы экспериментальных групп 1 и 2 (с введением и без введения флуоксетина в мПК во время обучения) не различались между собой по замиранию в условнорефлекторной камере А (рис. 2; t = 0.68, p = 0.50), что свидетельствует об одинаковом уровне проявлений у них условнорефлекторного страха обстановки. При этом длительность замирания во время пребывания в камере А у животных обеих экспериментальных групп статистически значимо превосходила уровень неподвижности животных контрольной группы (t = 3.9, p = 0.002 и t = 3.3, p = 0.004 для крыс экспериментальных групп 1 и 2 соответственно).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Серотониновая система вовлечена в регуляцию многих физиологических процессов в норме и вносит вклад в их нарушение при психопатологии [16]. Одной из ее важных функций является контроль эмоциональных реакций, включая формирование, проявления и угашение условнорефлекторного страха [17]. Кроме того, накапливаются данные о роли серотонина в процессах генерализации страха [9, 13, 18, 19]. В частности, установлено, что мыши с генным нокаутом 5HT1А-рецепторов серотонина характеризуются повышенным уровнем замирания (показатель страха) в безопасной камере по сравнению с животными дикого типа [17], что свидетельствует об участии серотониновой системы целого мозга в генерализации страха обстановки. Наши прежние данные, приведенные во введении, позволяют предположить, что серотониновая система мПК может вносить вклад в этот процесс, поскольку уровень ее эндогенной активации во время выработки УРС, оцениваемый по уровню внеклеточного серотонина в мПК, коррелирует с выраженностью последующей генерализации страха обстановки [13]. Результаты настоящего исследования поддерживают это предположение, демонстрируя, что фармакологическая стимуляция серотониновой системы мПК во время выработки УРС введением в мПК флуоксетина, значительно увеличивающим, по нашим прежним данным [9], уровень внеклеточного серотонина в этой области, приводит впоследствии к увеличению длительности замирания животных в безопасной дифференцировочной камере Б, но не влияет на замирание в потенциально опасной условнорефлекторной камере А. Эти ранее неизвестные данные свидетельствуют, что не только высокая эндогенная активность серотониновой системы мПК [13], но и ее фармакологическая стимуляция во время выработки УРС усиливают будущую генерализацию обстановочного компонента этой условнорефлекторной реакции.
Недавно с использованием аналогичного методического подхода мы установили, что введение в мПК во время выработки УРС флуоксетина в такой же дозе увеличивает на этапе тестирования замирание животных на звуковой дифференцировочный сигнал, не ассоциируемый с болевым раздражением, но не влияет на замирание животных на звуковой условный сигнал, ранее сочетавшийся с болевым раздражением [9]. Рассмотренные вместе эти данные, во-первых, позволяют заключить, что при формировании страха активация серотонинергического входа ПК может быть значимым фактором, регулирующим степень будущей генерализации различных его компонентов – страха обстановки и страха, запускаемого звуковыми сигналами опасности Во-вторых, они показывают, что такая серотониновая регуляция селективно направлена на генерализацию формирующегося страха, но не затрагивает формирование специализированного страха обстановки (настоящая работа) и страха, вызываемого звуковыми сигналами опасности [9]. Показанная избирательность действия флуоксетина в мПК по отношению к процессам генерализации страха свидетельствует, что отдаленные эффекты флуоксетина на проявления генерализованного страха, по всей видимости, не связаны с изменением под действием препарата общей подвижности животных или их способности замирать. С учетом сведений о роли серотонина в мПК в механизмах синаптической пластичности [20, 21] можно предположить, что регулируемые серотониновой активацией пластические перестройки в мПК в ходе выработки УРС способствуют формированию и/или консолидации генерализованного страха.
Следует подчеркнуть, что участие мПК в генерализации условнорефлекторного страха обстановки и условнорефлекторного страха, вызываемого звуковыми сигналами опасности, в литературе связывают с разными нейрофизиологическими механизмами, базирующимися соответственно на взаимодействии мПК и гиппокампальной формации [2, 10] и мПК и амигдалы [22]. Результаты этой и предыдущей [9] наших работ, приведенные выше, позволяют заключить, что серотониновый вход мПК однонаправленно регулирует оба эти процесса, что, возможно, обеспечивает целостность поведенческого ответа в опасных ситуациях.
Данные литературы свидетельствуют, что проявления страха во время пребывания в камере, ассоциируемой с неизбегаемым болевым раздражением, сопровождаются выбросом серотонина в мПК [23], аналогичным выбросу серотонина, вызываемому самим болевым раздражением [24]. Результаты настоящего исследования подтверждают и расширяют этот вывод, впервые демонстрируя, что при генерализации страха не только опасная, но и заведомо безопасная обстановка может вызывать сопровождаемый проявлениями страха выброс серотонина в мПК. Такие изменения отсутствуют у животных контрольной группы (те же процедуры, но без электрокожного раздражения в первый день экспериментов). То есть, они не связаны с активационным стрессом, вызванным пересадкой животного и, на наш взгляд, являются отражением генерализации страха, проявляющейся не только на поведенческом (замирание), но и на нейрохимическом (выброс серотонина в мПК) уровнях.
Функциональную роль выброса серотонина в мПК, запускаемого обстановочными сигналами опасности, предположительно, связывают с регуляцией замирания животных в ходе этого теста [23], что подтверждают результаты недавних исследований, проведенных с использованием микроиньекций в мПК лигандов рецепторов серотонина [25, 26]. Значение показанной в работе активации серотониновой системы мПК для проявлений генерализованного страха обстановки еще предстоит выяснить. Но следует подчеркнуть, что в настоящей работе мы не обнаружили видимой взаимосвязи между величиной подъема уровня внеклеточного серотонина в мПК во время пребывания в безопасной камере Б и выраженностью проявлений страха в ходе этого теста. А именно, усиление замирания в камере Б крыс экспериментальной группы 2 (ранее подвергавшихся введению флуоксетина в мПК) не сопровождалось дополнительными изменениями выброса серотонина по сравнению с этим показателем животных экспериментальной группы 1. Нужны дальнейшие исследования с использованием воздействий на серотониновую систему мПК на этапе тестирования, чтобы разобраться в этом вопросе.
Таким образом, полученные в работе новые данные свидетельствуют о том, что важной предпосылкой формирования генерализованного страха обстановки является активация серотониновой системы мПК в ходе формирования условнорефлекторного страха. Кроме того, они позволяют предположить, что усиление активности серотониновой системы мПК безопасными обстановочными стимулами может быть одним из нейрохимических проявлений генерализованного страха обстановки. Результаты вносят вклад в понимание роли серотонин-зависимых механизмов мПК в процессах генерализации страха обстановки.
Список литературы
Greenberg T., Carlson J.M., Cha J., Hajcak G., Mujica-Parodi L.R. Ventromedial prefrontal cortex reactivity is altered in generalized anxiety disorder during fear generalization. Depress. Anxiet. 30(3): 242–250. 2013. https://doi.org/10.1002/da.22016
Rozeske R.R., Valerio S., Chaudun F., Herry C. Prefrontal neuronal circuits of contextual fear conditioning. Genes Brain Behav. 14(1): 22-36. 2015. https://doi.org/10.1111/gbb.12181
Corches A., Hiroto A., Bailey T.W., Speigel J.H., Pastore J., Mayford M., Korzus E. Differential fear conditioning generates prefrontal neural ensembles of safety signals. Behav. Brain Res. 360: 169–184. 2019. https://doi.org/10.1016/j.bbr.2018.11.042
Dunsmoor J.E., Kroes M.C., Braren S.H., Phelps E.A. Threat intensity widens fear generalization gradients. Behav. Neurosci. 131(2): 168–175. 2017. https://doi.org/10.1037/bne0000186
Jovanovic T., Kazama A., Bachevalier J., Davis M. Impaired safety signal learning may be a biomarker of PTSD. Neuropharmacology. 62(2): 695–704. 2012. https://doi.org/10.1016/j.neuropharm.2011.02.023
Pitman R.K., Rasmusson A.M., Koenen K.C., Shin L.M., Orr S.P., Gilbertson M.W., Milad M.R., Liberzon I. Biological studies of post-traumatic stress disorder. Nature Rev. Neurosci. 13(11): 769–787. 2012. https://doi.org/10.1038/nrn3339
Kaczkurkin A.N., Burton P.C., Chazin S.M., Adrienne B., Manbecka A.B., Espensen-Sturges T., Cooper S.E., Sponheim S.R., Lissek S. Neural substrates of overgeneralized conditioned fear in PTSD. Am. J. Psychiatry. 174(2): 125–134. 2017. https://doi.org/10.1176/appi.ajp.2016.15121549
Morey R.A., Dunsmoor J.E., Haswell C.C., Brown V.M., Vora A., Weiner J., Stjepanovic D., Wagner H.R., LaBar K.S. Transl. Psychiatry. Fear learning circuitry is biased toward generalization of fear associations in posttraumatic stress disorder. Transl. Psychiatry. 5(12): e700. 2015. https://doi.org/10.1038/tp.2015.19
Саульская Н.Б., Марчук О.Э. Торможение обратного захвата серотонина в медиальной префронтальной коре во время выработки условнорефлекторной реакции страха способствует формированию генерализованного страха. Журн. высш. нервн. деят. 69(3): 343–353. 2019. [Saulskaya N.B., Marchuk O.E. Inhibition of serotonin reuptake in the medial prefrontal cortex during conditioned fear response elaboration promotes generalized fear formation. Zh. Vyssh. Nerv. Deiat. 69(3): 343–353. 2019. (In Russ)]. https://doi.org/10.1134/S0044467719030134
Xu W., Sudhof T.C. A neural circuit for memory specificity and generalization. Science. 339(6125): 1290–1295. 2013. https://doi.org/10.1126/science.1229534
Zelikowsky M., Bissiere S., Hast T.A., Bennett R.Z., Abdipranoto A., Vissel B., Fanselow M.S. Prefrontal microcircuit underlies contextual learning after hippocampal loss. Proc. Natl. Acad. Sci. USA. 110(24): 9938–9943. 2013. https://doi.org/10.1073/pnas.1301691110
Liberzon I., Abelson J.L. Context Processing and the Neurobiology of Post-Traumatic Stress Disorder. Neuron. 92 (1): 14–30. 2016. https://doi.org/10.1016/j.neuron.2016.09.039
Саульская Н.Б., Марчук О.Э. Активность серотониновой системы префронтальной коры мозга у крыс с высокой и низкой генерализацией страха обстановки. Рос. физиол. журн. 104(4): 466–476. 2018. [Saulskaya N.B., Marchuk O.E. Serotonergic activity of the brain prefrontal cortex in rats with high and low contextual fear generalization. Russ. J. Physiol. 104(4): 466–476. 2018. (In Russ)].
Саульская Н.Б., Судоргина П.В. Активность нитрергической системы медиальной префронтальной коры крыс с высокой и низкой генерализацией условнорефлекторной реакции страха. Журн. высш. нервн. деят. 65(3): 372–381. 2015. [Saulskaya N.B., Sudorgina P.V. Nitrergic Activity of the Medial Prefrontal Cortex in Rats with High and Low Conditioned Fear Generalization. Zh. Vyssh. Nerv. Deiat. 65(3): 372–381. 2015. (In Russ)]. https://doi.org/10.7868/S0044467715030090
Saulskaya N.B., Fofonova N.V. Effects of N-methyl-D-aspartate on extracellular citrulline level in the rat nucleus accumbens. Neurosi. Letters. 407(1): 91–95. 2006. https://doi.org/10.1016/j.neulet.2006.08.010
De Deurwaerdere P., Di Giovanni G. Serotonin in Health and Disease. Int. J. Mol. Sci. 21(10): 3500. 2020. https://doi.org/10.3390/ijms21103500
Bauer E.P. Serotonin in fear conditioning processes. Behav. Brain Res. 277: 68–77. 2015. https://doi.org/10.1016/j.bbr.2014.07.028
Klemenhagen K.C., Gordon J.A., David D.J., Hen R., Gross C.T. Increased fear response to contextual cues in mice lacking the 5-HT1A receptor. Neuropsychopharmacology. 31(1): 101–111. 2006.
Pedraza L.K., Sierra R.O., Giachero M., Nones-Sauza W., Lotz F.N., de Oliveira Alvares L. Chronic fluoxetine prevents fear memory generalization and enhances subsequent extinction by remodeling hippocampal dendritic spines and slowing down system consolidation. Translational Psychiatry. 9(1): 53. 2019. https://doi.org/10.1038/s41398-019-0371-3
Meunier C.N.J., Amar M., Lanfumey L., Hamon M., Fossier P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71: 37–45. 2013. https://doi.org/10.1016/j.neuropharm.2013.03.003
Meunier C.N.J., Callebert J., Cancela J.M. Effect of dopamine D1 receptors on plasticity is dependent of serotoninergic 5-HT1A receptors in L5-pyramidal neurons of the prefrontal cortex. Plos One. 10(3): e0120286. 2015. https://doi.org/10.1371/journal.pone.0120286
Likhtik E., Stujenske J.M., Topiwala M. A., Harris A.Z., Gordon J.A. Prefrontal entrainment of amygdala activity signals safety in learned fear and innate anxiety. Nat. Neurosci. 17(1): 106–113. 2014. https://doi.org/10.1038/nn.3582
Hashimoto S., Inoue T., Koyama T. Effect of conditioned fear stress on serotonin neurotransmission and freezing behavior in rats. Eur. J. Pharmacol. 378(1): 23–30. 1999. https://doi.org/10.1016/S0014-2999(99)00441-0
Bland S.T., Hargrave D., Pepin J.L., Amat J., Watkins L., Maier S. Stressor controllability modulates stress-induced dopamine and serotonin efflux in the medial prefrontal cortex. Neuropsychopharmacology. 28(9): 1589–1596. 2003. https://doi.org/10.1038/sj.npp.1300206
Almada R.C., Coimbra N.C., Brandao M.L. Medial prefrontal cortex serotonergic and GABAergic mechanisms modulate the expression of Contextual fear: intratelencephalic pathways and differential involvement of cortical subregions. Neuroscience. 284 (11): 988–997. 2015. https://doi.org/10.1016/j.neuroscience.2014.11.001
Leon L.A., Castro-Gomes V., Zarate-Guerrero S., Corredor K., Mello Crus A.P., Brandao M.L., Cardenas F.P., Landreira-Fernandez J. Behavioral effects of systemic, infralimbic and prelimbic injections of a serotonin 5-HT 2A antagonist in carioca high- and low-conditioned freezing rats. Front. Behav. Neurosci. 11: 117. 2017. https://doi.org/10.3389/fnbeh.2017.00117
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


