Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1553-1563
Влияние нефрэктомии на реактивность артерий крыс линии Wistar-Kyoto
В. Н. Ярцев 1, *, Г. Т. Иванова 1, Г. И. Лобов 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: yartsevv@infran.ru
Поступила в редакцию 07.09.2020
После доработки 25.09.2020
Принята к публикации 05.10.2020
Аннотация
В опытах на сегментах передней брыжеечной (ПБА) и внутренней сонной артерии (ВСА) крыс линии Wistar-Kyoto изучалось влияние нефрэктомии как модели хронической болезни почек (ХБП) на констрикторные и дилататорные свойства этих артерий в изометрическом режиме. Нефрэктомию осуществляли посредством удаления 5/6 почечной ткани крыс в возрасте 3-х месяцев. Дилатацию сосудов, пресокращенных фенилэфрином, вызывали ацетилхолином или нитропруссидом натрия в отсутствие и на фоне действия блокаторов калиевых каналов (тетраэтиламмония или глибенкламида) либо ингибитора гуанилатциклазы – метиленового синего. Было обнаружено, что нефрэктомия увеличивает сократительную реакцию ПБА, но не ВСА на фенилэфрин. Реакция ПБА и ВСА на ацетилхолин в большинстве случаев имела дилататорную и констрикторную фазу. Дилататорная фаза обеих артерий крыс после нефрэктомии не отличалась по величине от контрольных в отсутствие и на фоне действия блокаторов и ингибитора, но снижалась под действием тетраэтиламмония (у контрольных и нефрэктомированных крыс) и метиленового синего (у контрольных крыс). У нефрэктомированных крыс величина вызванной ацетилхолином констрикции в условиях отсутствия блокаторов была больше, чем у контрольных животных только для ПБА, а на фоне действия тетраэтиламмония – для обеих артерий. У нефрэктомированных крыс в отличие от контрольных в опытах на ПБА глибенкламид снижал вызванную ацетилхолином констрикцию, а в опытах на ВСА у этих крыс в отличие от контрольных животных не оказывал влияния метиленовый синий. Делается заключение, что ХБП может усиливать эндотелий-зависимые и -независимые констрикторные реакции артерий и изменять сигнальные пути этих реакций, которые могут отличаться у артерий разных типов.
Хроническая болезнь почек (ХБП) широко распространена. По данным Национального почечного фонда США, каждый десятый житель на планете страдает ХБП (если учитывать все стадии: от I до V) [1]. Пациенты с ХБП подвержены повышенному риску сердечно-сосудистых заболеваний – заболеваемость в 20–35 раз, а смертность в 10–20 раз выше, чем в общей популяции [2]. Большинство пациентов с ХБП умирают от болезней сердечно-сосудистой системы до развития терминальной стадии почечной недостаточности: это касается не только пациентов с артериальной гипертензией, сахарным диабетом и гиперхолестеринемией, но и молодых людей, а также детей с ХБП, хотя у этих пациентов отсутствуют сопутствующие заболевания [3]. При ХБП 4–5-й стадии в плазме крови накапливается большая группа веществ, объединяемых общим названием “уремические токсины”, число которых приближается к сотне [4]. Циркулирующие с кровью уремические токсины оказывают повреждающее действие, в первую очередь, на эндотелий и гладкомышечные клетки сосудов. Имеются данные о том, что уремические токсины способствуют фенотипическому изменению сосудистых гладкомышечных клеток, что приводит к экспрессии коллагена I типа и последующему ремоделированию внеклеточного матрикса в стенке сосудов [5]. В процессе кальцификации происходит остеогенная дифференцировка гладкомышечных клеток сосудов: они перестают выполнять сократительную функцию и начинают синтезировать белки, характерные для остеобластов [6]. Кальцификация сосудистой стенки проявляется в виде отложения фосфата кальция между гладкомышечными клетками и элементами соединительной ткани (артериосклероз) и является основной причиной повышения жесткости стенки артерий.
Сердечно-сосудистые заболевания среди пациентов с ХБП связаны не только с сосудистой кальцификацией, но и с эндотелиальной дисфункцией, представляющей собой системный процесс, включающий ослабление эндотелий-зависимой вазодилатации и сопровождающийся сужением сосудов и структурной перестройкой микроциркуляторного русла [7]. Было показано, что асимметричный диметиларгинин (один из важнейших уремических токсинов) подавляет продукцию эндотелием NO, это приводит к нарушениям регуляции сосудистого тонуса и провоцирует длительные тонические сокращения гладкомышечных клеток сосудов, способствуя развитию артериальной гипертензии [8]. Дисфункция эндотелия при ХБП развивается также в результате окислительного стресса и хронического воспаления [9].
Учитывая значимость ХБП и ограниченные возможности проведения исследований на человеке, было разработано несколько моделей ХБП на животных, что позволило более детально изучить повреждение стенки сосудов при этой патологии. В частности, было показано, что в сосудистой стенке при ХБП выявляется воспалительный процесс, подавлена функция эндотелиальной NO-синтазы и повышена активность индуцибельной NO-синтазы, а в гладкомышечных клетках увеличена концентрация цитоплазматического Са2+ из-за ингибирования уремическими токсинами Са2+-АТФ-азы. Анализ публикаций показывает, что в этой области было выполнено значительное количество исследований на аорте и сосудах микроциркуляторного русла [10, 11]. Работ на мелких и средних артериях значительно меньше.
В связи с этим основной целью настоящего исследования было изучение влияния ХБП на функции артерий, обеспечивающих кровоснабжение органов с различным уровнем метаболизма и различным строением стенки: исследование проводилось на передней брыжеечной артерии (ПБА), которая относится к артериям мышечно-эластического типа с преобладанием гладкомышечных клеток, и на внутренней сонной артерии (ВСА), в стенке которой преобладают соединительно-тканные компоненты. Для этой цели нами была выбрана модель ХБП, вызванная нефрэктомией (удаление 5/6 почечной ткани), поскольку она гарантированно приводит к снижению клубочковой фильтрации и метаболическим нарушениям, характерным для пациентов с уремией.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из ЦКП Биоколлекция Института физиологии им. И.П. Павлова РАН, поддержанной Программой ФАНО России по сохранению и развитию биоресурсных коллекций.
Опыты проводили (в соответствии с принципами Базельской декларации и рекомендациями комиссии по биоэтике Института физиологии им. И.П. Павлова РАН) на самцах крыс линии Wistar-Kyoto через 3 мес. после нефрэктомии (n = 12, артериальное давление (АД) 127.2 ± 2.2 мм рт. ст.) и ложнооперированных контрольных (n = 12, АД 127.1 ± 1.8 мм рт. ст.) животных массой 250–350 г. АД измеряли манжеточным методом на хвосте, используя электроманометр фирмы ELEMA (Швеция). Экспериментальную модель ХБП создавали за счет резекции 5/6 массы почечной ткани у крыс в возрасте 3-х месяцев по описанной ранее методике [11]. Как нами было показано ранее [11], через 4 мес. после такой резекции почечной ткани содержание мочевины в сыворотке крови у крыс увеличивалось в среднем до 20.1 ± 2.6 ммоль/л, у контрольных животных оно составляло 4.9 ± 0.6 ммоль/л, р < 0.001). Контролем служили ложнооперированные крысы, которые подвергались аналогичному оперативному вмешательству, но без удаления почечной ткани. Эвтаназию животных осуществляли посредством эфирного наркоза. После эвтаназии отпрепаровывали левую ВСА, а также ПБА. От каждой из этих артерий отрезали кольцевой участок длиной 2 мм. Артериальный сегмент помещали на две вольфрамовые иголочки (диаметром 70 мкм каждая), одна из которых была соединена со штоком погружателя микроэлектродов, а вторая – с механотроном 6МХ1С, сигнал от которого, отражающий изменение натяжения в стенке сегмента, усиливался и поступал на АЦП S-Recorder-L (ADSlab, Россия), а далее на компьютер для обработки в программе S-Recorder (ADSlab, Россия). Иголочки с кольцевым участком помещали в проточную термостатируемую (37°C) ванночку объемом 10 мл, заполненную бикарбонатным раствором Кребса следующего состава (в мМ): NaCl 115, KCl 4.7, CaCl2 2.6, MgSO4· 7H2O 1.2, NaHCO3 25, KH2PO4 1.2, глюкоза 10. рН раствора доводили до значения 7.4 и контролировали в течение всего эксперимента, поддерживая это значение путем пропускания через раствор соответствующего количества СО2 или комнатного воздуха. После погружения в раствор иголочки миографа ступенчато разводили до значения натяжения, при котором наблюдался максимальный ответ сосудистого сегмента на стимуляцию электрическим полем (30 В, 3 мс, в течение 3 с) с частотой 10 Гц. Электростимуляция осуществлялась с помощью двух платиновых электродов, расположенных на расстоянии 2 мм от сосудистого сегмента. После адаптации препарата в течение 30 мин начинали регистрацию натяжения стенки сосуда. Для оценки дилататорной способности сосуда использовали ацетилхолин хлорид (Sigma-Aldrich, США) 10–5 М или нитропруссид натрия (ICN Biomedicals, США) 10–6 М на фоне пресокращения фенилэфрином (Sigma-Aldrich, США) 10–5 М. Дилатацию выражали в процентном отношении к констрикции, вызванной фенилэфрином. С целью оценки участия Ca2+-активируемых К+-каналов большой проводимости, АТФ-чувствительных К+-каналов и растворимой гуанилатциклазы в сосудистых реакциях в ванночку вводили соответствующие блокаторы: тетраэтиламмоний хлорид (Вектон, Россия) 10–3 М, глибенкламид (Sigma-Aldrich, США) 10–5 М или ингибитор растворимой гуанилатциклазы – метиленовый синий (Вектон, Россия) 10–5 М. Через 15 мин после начала действия блокатора или ингибитора вводили фенилэфрин с последующим введением ацетилхолина и нитропруссида натрия. Маточный раствор глибенкламида готовили на основе диметилсульфоксида (Вектон, Россия), используемого для этой цели в экспериментах на изолированных сосудах [12]. Концентрация диметилсульфоксида в ванночке с сосудистым сегментом не превышала 0.1%. Маточные растворы всех остальных используемых веществ готовили на основе дистиллированной воды.
При статистической обработке результатов использовали программу Statistica v.12. Полученные данные представляли в виде среднего значения ± стандартная ошибка среднего. Достоверность отличий реакций сосудов нефрэктомированных и контрольных крыс в отсутствие и на фоне действия блокаторов и ингибитора в случае нормального распределения вариант определяли, применяя двухфакторный дисперсионный анализ с поправкой Бонферрони. В случае распределения вариант в выборке, отличном от нормального, при сравнении двух зависимых групп применяли критерий Уилкоксона, независимых – U-критерий Манна–Уитни. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В экспериментах, проведенных на ПБА контрольных и нефрэктомированных крыс, введение фенилэфрина вызывало сократительную реакцию, которая в среднем составляла 3.6 ± 0.3 и 4.6 ± 0.3 мН соответственно и была достоверно больше у крыс после нефрэктомии (р < 0.05). Какого-либо действия блокаторов и ингибитора на эту реакцию у крыс обеих групп обнаружено не было (рис. 1А). Величина сократительной реакции ВСА контрольных и нефрэктомированных крыс была почти в 2 раза меньше, чем у ПБА, и в среднем в условиях отсутствия блокаторов и ингибитора составляла 2.2 ± 0.4 и 2.0 ± 0.3 мН соответственно. Влияния нефрэктомии, блокаторов и ингибитора на данную реакцию у этой артерии не обнаружено (рис. 1В).
Рис. 1.
Сократительная реакция на фенилэфрин (10–5 М) сегмента верхней брыжеечной (А) и внутренней сонной (В) артерии контрольных (C) и нефрэктомированных (NE) крыс в условиях отсутствия блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего. # р < 0.05 при сравнении с контролем (C). Fig. 1. Contraction of the superior mesenteric artery (A) and internal carotid artery (В) rings of the control (C) and nefrectimized (NE) rats to phenylephrine (10–5 М) in the absence of the blockers and inhibitor (–B) and in the presence of tetraethylammonium (TEA, 10–3 М), glibenclamide (Gli, 10–5 М) or methylene blue (MB, 10–5 М). Data are presented as means ± SEM. # р < 0.05 versus control (C).

Пресокращенные фенилэфрином артерии в подавляющем большинстве случаев реагировали на введение ацетилхолина двухфазной реакцией, в которой дилататорная фаза ПБА контрольных и нефрэктомированных крыс составляла 43.5 ± 8.4 и 55.6 ± 11.8% соответственно. На фоне действия блокаторов и ингибитора достоверное изменение дилататорной фазы наблюдалось у сосудов контрольных крыс для тетраэтиламмония и метиленового синего, а у сосудов нефрэктомированных крыс только для тетраэтиламмония (рис. 2А). Какого-либо действия нефрэктомии на эту фазу реакции ни в отсутствие, ни при наличии блокаторов и ингибитора обнаружено не было. Сходные результаты были получены на ВСА (рис. 2В). Наиболее значительное уменьшение дилатации (примерно в два раза) наблюдалось на фоне действия тетраэтиламмония у сосудов контрольных крыс (с 43.5 ± 8.4 до 22.9 ± 7.6% у ПБА и с 40.9 ± 5.7 до 21.1 ± 3.3% у ВСА). Следует заметить, что сам тетраэтиламмоний вызывал сокращение сосудов, которое для ПБА контрольных и нефрэктомированных крыс составляло соответственно 4.6 ± 1.8 и 1.7 ± 0.8% (р > 0.05), а для ВСА контрольных и нефрэктомированных крыс соответственно 16.5 ± 5.3 и 17.0 ± 3.2% (р > 0.05), т.е. не изменялось в результате нефрэктомии.
Рис. 2.
Дилататорная реакция на ацетилхолин (10–5 М) пресокращенного фенилэфрином (10–5 М) сегмента верхней брыжеечной (А) и внутренней сонной (В) артерии контрольных (C) и нефрэктомированных (NE) крыс в условиях отсутствия блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего. * р < 0.05; ** р < 0.005 при сравнении с (–В) соответствующей группы. Fig. 2. Dilatation of the superior mesenteric artery (A) and internal carotid artery (В) rings of the control (C) and nefrectimized (NE) rats to acetylcholine (10–5 М) following precontraction by phenylephrine (10–5 М) in the absence of the blockers and inhibitor (–B) and in the presence of tetraethylammonium (TEA, 10–3 М), glibenclamide (Gli, 10–5 М) or methylene blue (MB, 10–5 М). Data are presented as means ± SEM. * р < 0.05; ** р < 0.005 versus (–В) of the corresponding group.
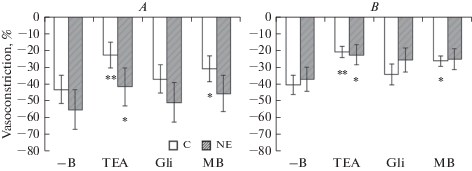
Констрикторная фаза реакции на ацетилхолин ПБА контрольных крыс составляла 6.0 ± 1.6% и не изменялась на фоне действия блокаторов и ингибитора, в то время как у нефрэктомированных крыс эта фаза в условиях отсутствия блокаторов и ингибитора, а также в присутствии тетраэтиламмония была значительно и достоверно больше, составляя 27.5 ± 8.1 и 25.4 ± 8.0% соответственно и достоверно снижалась на фоне действия глибенкламида (рис. 3А). Вызванная ацетилхолином сократительная реакция ВСА контрольных крыс в условиях отсутствия блокаторов и ингибитора была близка к полученной на ПБА (3.9 ± 1.0%) и достоверно снижалась на фоне действия тетраэтиламмония, глибенкламида и метиленового синего, составляя 0.3 ± 0.2, 0.1 ± 0.1 и 0.8 ± 0.4% соответственно (рис. 3В). Сходная картина снижения величины сократительной реакции ВСА на фоне действия блокаторов и ингибитора наблюдалась и для нефрэктомированных крыс (рис. 3В), однако степень этого снижения была меньше, в силу чего величина данной реакции у этих крыс на фоне действия тетраэтиламмония оказалась достоверно большей, чем у контрольных животных.
Рис. 3.
Сократительная реакция на ацетилхолин (10–5 М) пресокращенного фенилэфрином (10–5 М) сегмента верхней брыжеечной (А) и внутренней сонной (В) артерии контрольных (C) и нефрэктомированных (NE) крыс в условиях отсутствия блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего. * р < 0.05 при сравнении с (–В) соответствующей группы; # р < 0.05; ## р < 0.005 при сравнении с контролем (C). Fig. 3. Contraction of the superior mesenteric artery (A) and internal carotid artery (В) rings of the control (C) and nefrectimized (NE) rats to acetylcholine (10–5 М) following precontraction by phenylephrine (10–5 М) in the absence of the blockers and inhibitor (–B) and in the presence of tetraethylammonium (TEA, 10–3 М), glibenclamide (Gli, 10–5 М) or methylene blue (MB, 10–5 М). Data are presented as means ± SEM. * р < 0.05 versus (–В) of the corresponding group; # р < 0.05; ## р < 0.005 versus control (C).

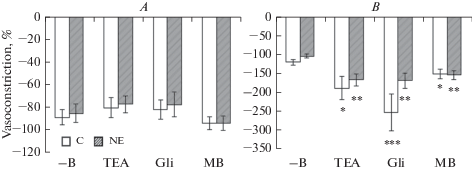
Дилататорная реакция ПБА контрольных и нефрэктомированных крыс, вызванная нитропруссидом натрия, в условиях отсутствия блокаторов и ингибитора была примерно одинаковой, составляя 88.8 ± 6.9 и 85.2 ± 8.1% соответственно, и достоверно не изменялась на фоне их действия (рис. 4А), в то время как у ВСА контрольных и нефрэктомированных крыс эта реакция при наличии блокаторов, особенно глибенкламида, значительно возрастала: с 121.7 ± 48.6 и 105.1 ± 5.5% до 253.5 ± 6.8 и 170.0 ± 19.9% соответственно (рис. 4В).
Рис. 4.
Дилататорная реакция на нитропруссид (10–6 М) пресокращенного фенилэфрином (10–5 М) сегмента верхней брыжеечной (А) и внутренней сонной (В) артерии контрольных (C) и нефрэктомированных (NE) крыс в условиях отсутствия блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего. * р < 0.05; ** р < 0.01; *** р < 0.005 при сравнении с (–В) соответствующей группы. Fig. 4. Dilatation of the superior mesenteric artery (A) and internal carotid artery (В) rings of the control (C) and nefrectimized (NE) rats to sodium nitroprusside (10–6 М) following precontraction by phenylephrine (10–5 М) in the absence of the blockers and inhibitor (–B) and in the presence of tetraethylammonium (TEA, 10–3 М), glibenclamide (Gli, 10–5 М) or methylene blue (MB, 10–5 М). Data are presented as means ± SEM. * р < 0.05; ** р < 0.01; *** р < 0.005 versus (-В) of the corresponding group.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе было показано, что нефрэктомия увеличивает сократительную реакцию ПБА, но не ВСА на фенилэфрин. Как известно, ХБП у человека и нефрэктомия, являющаяся ее моделью на животных, вызывает изменение реактивности кровеносных сосудов [13–16], причем это изменение может быть разным у разных сосудов. Так, например, в опытах на аорте и хвостовой артерии крысы [17] после нефрэктомии величина сократительного ответа на фенилэфрин на аорте возрастала, а на хвостовой артерии снижалась. Отсутствие изменения реакции на фенилэфрин после нефрэктомии, показанное в наших опытах на ВСА, было отмечено и ранее на общей сонной артерии крысы [18]. Нами не было обнаружено угнетающего действия нефрэктомии на эндотелий-зависимую дилатацию, вызванную ацетилхолином, ни на ПБА, ни на ВСА. Аналогичные результаты были получены ранее другими авторами, в частности, на ПБА [19] и на хвостовой артерии крысы [17]. Однако в ряде работ было показано снижение эндотелий-зависимой дилатации после нефрэктомии. В частности, такое снижение наблюдалось на аорте [11, 14, 15] и общей сонной артерии крысы [18]. В нашем предыдущем исследовании на ПБА [11] нефрэктомия приводила к уменьшению расслабления этой артерии, вызванного ацетилхолином, однако, тогда опыты проводили на крысах другой линии (Wistar). Как было показано в опытах на брыжеечной артерии мыши, влияние нефрэктомии на расслабление, вызванное ацетилхолином, может иметься, а может и отсутствовать в зависимости от генетической линии животных [16]. Кроме того, разница в результатах может объясняться тем, что в отличие от крыс линии Wistar, у которых нефрэктомия приводила к значительному повышению АД (165.0 ± 9.8 мм рт. ст. по сравнению с 127.2 ± 9.7 мм рт. ст. в контрольной группе, р < 0.01), в этом нашем исследовании на крысах линии Wistar-Kyoto нефрэктомия не вызывала изменения АД (127.7 ± 2.2 мм рт. ст. по сравнению с 127.1 ± 1.8 мм рт. ст. в контрольной группе, р > 0.05). Было показано, что нормализация АД с помощью терапии у крыс после нефрэктомии приводит к нормализации первоначально сниженной вазодилатации, вызванной ацетилхолином [17].
В целях выяснения участия в сосудодвигательных реакциях ПБА и ВСА Ca2+-активируемых К+-каналов большой проводимости, АТФ-чувствительных К+-каналов и растворимой гуанилатциклазы мы использовали соответствующие блокаторы и ингибиторы: тетраэтиламмоний, глибенкламид и метиленовый синий соответственно. В нашей работе было показано, что вызванная ацетилхолином дилатация ПБА и ВСА контрольных и нефрэктомированных крыс существенно уменьшалась на фоне действия тетраэтиламмония, т.е. была в значительной степени обусловлена Ca2+-активируемыми К+-каналами большой проводимости. Аналогичные данные были получены нами ранее на ПБА крыс линии Wistar [11], а также другими авторами на общей сонной артерии крыс [20]. Причем, в указанной выше работе на сонной артерии, как и в нашем исследовании, не было обнаружено действия глибенкламида на дилатацию, вызванную ацетилхолином. Нами было показано угнетающее действие метиленового синего на вызванную ацетилхолином дилатацию ПБА и ВСА контрольных, но не нефрэктомированных крыс, что может свидетельствовать о влиянии нефрэктомии на активность растворимой гуанилатциклазы в процессах эндотелий-зависимой дилатации этих артерий.
В наших опытах в подавляющем большинстве случаев отмечалась двухфазная реакция ПБА и ВСА на ацетилхолин, причем констрикторная фаза этой реакции сосудов нефрэктомированных крыс была значительно больше, чем у контрольных животных, как в условиях отсутствия блокаторов и ингибитора (для ПБА), так и на фоне действия тетраэтиламмония (для ПБА и ВСА). Вызванная ацетилхолином эндотелий-зависимая вазоконстрикция, продемонстрированная на разных кровеносных сосудах [21–24], обусловлена стимуляцией мускариновых рецепторов эндотелия [21, 22]. Она устранялась блокадой циклооксигеназы [21–24], т.е. связана с синтезом простагландинов и опосредована ваниллоидными рецепторами TRPV4 эндотелия [23]. Полученные нами данные об усилении вызванной ацетилхолином вазоконстрикции ВСА крыс после нефрэктомии согласуются с данными, полученными ранее на церебральных артериях в экспериментах in vivo [24]. Сократительная реакция в наших опытах на ПБА контрольных крыс под действием блокаторов и ингибитора не изменялась, в то время как у нефрэктомированных крыс она значительно снижалась на фоне действия глибенкламида, что может свидетельствовать об участии АТФ-чувствительных К+-каналов в повышенной сократимости этих сосудов после нефрэктомии. В опытах на ВСА использованные нами блокаторы и ингибитор в большей степени уменьшали констрикцию сосудов контрольных крыс, но наибольшая разница была отмечена на фоне действия тетраэтиламмония, что позволяет высказать предположение о меньшем участии Ca2+-активируемых К+-каналов большой проводимости в этой констрикции данных сосудов нефрэктомированных крыс. Кроме того, метиленовый синий достоверно уменьшал констрикцию ВСА только у контрольных крыс, что может свидетельствовать о снижении активности растворимой гуанилатциклазы в этих артериях после нефрэктомии.
Нами не было обнаружено влияния нефрэктомии на эндотелий-независимую дилатацию, вызванную нитропруссидом натрия, ни на ПБА, ни на ВСА. Отсутствие влияния нефрэктомии на вазодилатацию, вызванную нитропруссидом натрия, было показано ранее в большинстве исследований. В частности, оно не отмечалось ни на аорте [14, 15, 17] и хвостовой артерии крысы [17], ни на брыжеечной [16, 19] и сонной артерии [18, 25], которые были использованы в наших опытах. Следует заметить, что в исследовании, проведенном на человеке, в условиях in vivo было отмечено уменьшение эндотелий-независимого расслабления от нитропруссида натрия при ХБП [13], это может объясняться видовой специфичностью. В наших экспериментах на ПБА блокаторы и ингибитор не оказывали действия на эту реакцию, в то время как на ВСА все они значительно ее усиливали у сосудов крыс обоих групп. Отсутствие уменьшения эндотелий-независимого расслабления от нитропруссида натрия на фоне действия глибенкламида и тетраэтиламмония, которое мы наблюдали на ПБА, было показано и другими авторами [12]. Следует заметить, что величина расслабления ВСА от нитропруссида натрия была значительно больше величины ее сокращения от фенилэфрина. Это было отмечено и в работе других авторов на сонной артерии, но взятой от другого животного – кролика [25]. Данный факт может свидетельствовать о наличии спонтанного тонуса сонной артерии, который, как показано в нашем исследовании, в значительной степени может сниматься NO в условиях блокады Ca2+-активируемых и АТФ-чувствительных К+-каналов, а также ингибирования растворимой гуанилатциклазы.
Обнаруженные нами различия действия нефрэктомии на сократительные свойства ПБА и ВСА могут быть связаны с различием в строении стенки этих артерий. Большее усиление констрикции у ПБА может объясняться преобладанием гладкомышечных клеток в стенке данной артерии. Кроме того, как показало наше исследование, у этих артерий различаются сигнальные пути, обеспечивающие эндотелий-зависимую констрикцию. Различие сигнальных путей кровеносных сосудов разных типов было показано и другими авторами, в частности, для аорты и хвостовой артерии крыс после нефрэктомии [17].
Итак, в нашем исследовании на сосудах крыс линии Wistar-Kyoto было показано, что нефрэктомия посредством удаления 5/6 почечной ткани приводит к увеличению сокращения ПБА в ответ на действие фенилэфрина и ацетилхолина, а ВСА – на ацетилхолин в присутствии тетраэтиламмония, что свидетельствует о меньшем участии Ca2+-активируемых К+-каналов большой проводимости в этой констрикции данных сосудов после нефрэктомии. Кроме того, после нефрэктомии исчезало угнетающее действие метиленового синего на вызванную ацетилхолином сократительную реакцию ВСА и дилататорную реакцию обеих артерий, указывающее на снижение активности растворимой гуанилатциклазы в этих артериях в результате нефрэктомии. Полученные данные доказывают, что хроническая болезнь почек может усиливать констрикторные реакции артерий и изменять сигнальные механизмы дилататорных и констрикторных реакций, причем эти изменения могут отличаться у артерий разных типов.
Список литературы
Collins A.J., Foley R.N., Chavers B., Gilbertson D., Herzog C., Johansen K., Kasiske B., Kutner N., Liu J., St Peter W., Guo H., Gustafson S., Heubner B., Lamb K., Li S., Peng Y., Qiu Y., Roberts T., Skeans M., Snyd J. United States Renal Data System 2011 Annual Data Report: Atlas of chronic kidney disease & end-stage renal disease in the United States. Am. J. Kidney Dis. 59(1): 1–420. 2012.
Liyanage T., Ninomiya T., Jha V., Neal B., Patrice H.M., Okpechi I., Zhao M., Lv J., Garg A.X., Knight J., Rodgers A., Gallagher M., Kotwal S., Cass A., Perkovic V. Worldwide access to treatment for end-stage kidney disease: a systematic review. Lancet. 385(9981): 1975–1982. 2015.
Mitsnefes M.M. Cardiovascular complications of pediatric chronic kidney disease. Pediatr. Nephrol. 23(1): 27–39. 2008.
Ito S., Yoshida M. Protein-bound uremic toxins: new culprits of cardiovascular events in chronic kidney disease patients. Toxins (Basel). 6(2): 665–678. 2014.
Bai Y., Zhang J., Xu J., Cui L., Zhang H., Zhang S. Alteration of type I collagen in the radial artery of patients with endstage renal disease. Am. J. Med. Sci. 349(4): 292–297. 2015.
Louvet L., Bazin D., Büchel J. Characterisation of calcium phosphate crystals on calcified human aortic vascular smooth muscle cells and potential role of magnesium. PLoS One. 10(1): e0115342. 2015.
Abularrage C.J., Sidawy A.N., Aidinian G., Singh N., Weiswasser J.M., Arora S. Evaluation of the microcirculation in vascular disease. J. Vasc. Surg. 42: 574–581. 2005.
Kimura K. Methylarginies-induced endothelial dysfunction in chronic kidney disease. Yakugaku Zasshi. 132(4): 443–448. 2012.
Townsend R.R. Arterial stiffness and chronic kidney disease: lessons from the Chronic Renal Insufficiency Cohort study. Curr. Opin. Nephrol. Hypertens. 24(1): 47–53. 2015.
Лобов Г.И., Исачкина А.Н., Гурков А.С. Особенности регуляции сосудов микроциркуляторного русла у пациентов с хронической болезнью почек, получающих лечение перитонеальным диализом. Регионарное кровообращение и микроциркуляция. 15(1): 65–72. 2016. [Lobov G.I., Isachkina A.N., Gurkov A.S. Features of microvasculature regulation in patients with chronic kidney disease on peritoneal dialysis. Regional Blood Circulation and Microcirculation. 15(1): 65–72. 2016. (In Russ)].
Иванова Г.Т., Лобов Г.И., Береснева О.Н., Парастаева М.М. Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов. Нефрология. 23(4): 88–95. 2019. [Ivanova G.Т., Lobov G.I., Beresneva О.N., Parastaeva М.М. Changes in the reactivity of vessels of rats with an experimental decrease in the mass of functioning nephrons. Nephrology. 23(4): 88–95. 2019. (In Russ)].
Ohashi M., Faraci F., Heistad D. Peroxynitrite hyperpolarizes smooth muscle and relaxes internal carotid artery in rabbit via ATP-sensitive K+ channels. Am. J. Physiol. Heart Circ. Physiol. 289(5): H2244–H2250. 2005.
Kopel T., Kaufman J., Hamburg N., Sampalis J., Vita J., Dember L. Endothelium-dependent and -independent vascular function in advanced chronic kidney disease. Clin. J. Am. Soc. Nephrol. 12(10): 1588–1594. 2017.
Zanetti M., Cappellari G., Barbetta D., Barbetta D., Semolic A., Barazzoni R. Omega 3 polyunsaturated fatty acids improve endothelial dysfunction in chronic renal failure: role of eNOS activation and of oxidative stress. Nutrients. 9(8): 895. 2017.
Li T., Gua C., Wu B., Chen Y. Increased circulating trimethylamine N-oxide contributes to endothelial dysfunction in a rat model of chronic kidney disease. Biochem. Biophys. Res. Commun. 495(2): 2071–2077. 2018.
Hamzaoui M., Djerada Z., Brunel V., Mulder P., Richard V., Bellien J., Guerrot D. 5/6 nephrectomy induces different renal, cardiac and vascular consequences in 129/Sv and C57BL/6JRj mice. Sci. Rep. 10(1): 1524. 2020.
Spradley F., White J., Paulson W., Pollock D., Pollock J. Differential regulation of nitric oxide synthase function in aorta and tail artery from 5/6 nephrectomized rats. Physiol. Rep. 1(6): e00145. 2013.
Köhler R., Eichler I., Schönfelder H., Grgic I., Heinau P., Si H., Hoyer J. Impaired EDHF-mediated vasodilation and function of endothelial Ca-activated K channels in uremic rats. Kidney Int. 67(6): 2280–2287. 2005.
Nguy L., Nilsson H., Lundgren J., Johansson M., Teerlink T., Scheffer P., Guron G. Vascular function in rats with adenine-induced chronic renal failure. Am. J. Physiol. Regul. Integr. Compar. Physiol. 302(12): R1426–R1435. 2012.
Kamata K., Ohuchi K., Kirisawa H. Altered endothelium-dependent and -independent hyperpolarization and endothelium-dependent relaxation in carotid arteries isolated from streptozotocin-induced diabetic rats. Naunyn Schmiedebergs Arch. Pharmacol. 362(1): 52–59. 2000.
Baretella O., Xu A., Vanhoutte P.M. Acidosis prevents and alkalosis augments endothelium-dependent contractions in mouse arteries. Pflugers Arch. 466(2): 295–305. 2014.
Giang M., Papamatheakis D.G., Nguyen D., Paez R., Johnston C.B., Kim J., Brunnell A., Blood Q., Goyal R., Longo L.D., Wilson S.M. Muscarinic receptor activation affects pulmonary artery contractility in sheep: The impact of maturation and chronic hypoxia on endothelium-dependent and endothelium-independent function. High Alt. Med. Biol. 17(2): 122–132. 2016.
Zhang P., Sun C., Li H., Tang C., Kan H., Yang Z., Mao A., Ma X. TRPV4 (Transient Receptor Potential Vanilloid 4) mediates endothelium-dependent contractions in the aortas of hypertensive mice. Hypertension. 71(1): 134–142. 2018.
Лобов Г.И., Соколова И.Б. Роль NO и H2S в регуляции тонуса церебральныхсосудов при хронической болезни почек. Рос. физиол. журн. им. И.М. Сеченова. [Lobov G.I., Sokolova I.B. Role of NO and H2S in the Regulation of the Tone of Cerebral Vessels in Chronic Kidney Disease. Russ. J. Physiol. 106(8): 1002–1015. 2020. (In Russ)].
Moroe H., Honda H. Comparison of endothelial function in the carotid artery between 777normal and short-term hypercholesterolemic rabbits. Compar. Biochem. Physiol. C. 7 Toxicol. Pharmacol. 144(2): 197–203. 2006.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


