Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 823-842
Влияние раннего провоспалительного стресса на тревожное и депрессивно-подобное поведение крыс разного возраста
Н. Д. Брошевицкая 1, И. В. Павлова 1, *, М. И. Зайченко 1, В. А. Груздева 1, Г. А. Григорьян 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 03.12.2019
После доработки 23.01.2020
Принята к публикации 17.03.2020
Аннотация
Ранний провоспалительный стресс, создаваемый путем введения липополисахарида (ЛПС) (50 мкг/кг, п/к) на 3-и и 5-е постнатальные дни, приводил к снижению двигательной активности, уменьшению исследовательского поведения и увеличению тревожности у крыс в подростковом возрасте (1–1.5 мес.) в тестах открытого поля и приподнятого крестообразного лабиринта. Наибольшие изменения в тревожном поведении происходили у самцов по сравнению с самками. Введение ЛПС в раннем онтогенезе вызывало в подростковом возрасте появление признаков депрессивно-подобного поведения как у самцов, так и у самок, которое проявлялось в тесте на ангедонию в уменьшении предпочтения 1%-ного раствора сахарозы по сравнению с контрольными группами. Тест вынужденного плавания выявил признаки депрессивно-подобного поведения у самцов, но не у самок только при первом тестировании. У взрослых крыс (3–3.5 мес.) после усиленного хэндлинга и выработки пищедобывательных рефлексов указанные изменения в тревожном и депрессивно-подобном поведении практически исчезали. Введение ЛПС в раннем возрасте приводило у взрослых самцов к увеличению уровня IL-1β в сыворотке крови после повторных стрессовых воздействий, а у самок – к возрастанию содержания кортикостерона по сравнению с контрольными животными. Полученные результаты свидетельствуют об увеличении признаков тревожно-депрессивного поведения крыс под влиянием раннего провоспалительного стресса и наличие половых различий, а также возможности коррекции негативных последствий стресса в дальнейшей жизни.
Известно, что стрессирующие воздействия в раннем онтогенезе создают предрасположенность к развитию ряда соматических и психоневрологических заболеваний у человека, таких как депрессия, тревожные расстройства, посттравматические стрессовые расстройства и другие [1, 2]. Выявлены существенные половые различия в частоте проявления данных заболеваний, женщины страдают депрессией и тревожными расстройствами значительно чаще, чем мужчины [3–5]. В экспериментах на животных было показано, что временное отлучение от матери [6–8], провоспалительный стресс [9–12], болевые воздействия [13] и плохие условия содержания [14] в раннем возрасте оказывают негативное влияние на дальнейшее развитие организма. В настоящее время в качестве раннего стрессирующего воздействия достаточно широко используют модель провоспалительного стресса, создаваемого путем введения бактериального липополисахарида (ЛПС) крысятам в разные дни постнатального развития [см. обзор 15]. Липополисахариды являются составными компонентами внешней части мембраны грамотрицательных бактерий. Первичными клетками-мишенями для ЛПС являются фагоциты, которые экспрессируют связанный с мембраной антиген CD14 (mCD14) и толл-4 рецепторы. Протеин, связывающий ЛПС, катализирует переход мономерного ЛПС из агрегатных комплексов к связывающему рецептору CD14 (mCD14) на поверхности фагоцитов, это приводит к высвобождению большого числа эндогенных провоспалительных медиаторов (цитокины, хемокины и др.) через TLR4*MD-2 комплекс [16].
Введение ЛПС вызывает болезненное состояние (sickness behavior), длящееся несколько дней и проявляющееся в изменении температуры тела, малой подвижности, снижении аппетита, скученности животных и т.д. [17]. В литературе имеется немало сведений о том, то введение ЛПС в раннем онтогенезе оказывает влияние на проявления тревожного и депрессивно-подобного поведения, а также изменения устойчивости к повторным стрессам у взрослых крыс [см. обзор 18]. Так, например, было показано, что введение ЛПС в раннем возрасте приводит к увеличению тревожности и уменьшению социальных взаимодействий у взрослых крыс, усилению депрессивно-подобного поведения [10, 11, 19]. Увеличение тревожности проявлялось после дополнительных стрессирующих воздействий на взрослое животное [12]. Вместе с тем имеются данные, что инфекции в раннем возрасте могут защищать от стрессов во взрослой жизни [20] и приводить к снижению уровня тревожности [21]. Влияние раннего введения ЛПС различалось у линий высоко- и низкотревожных животных [22]. Введение эндотоксина сальмонеллы на 3-й и 5-й постнатальные дни приводило к увеличению реактивности гипоталамо-гипофизарной надпочечниковой системы (ГГНС) на стресс и уменьшению негативной обратной связи на синтез АКТГ [23]. Хотя имеется много данных о том, что введение ЛПС в раннем возрасте приводит к тревожному и депрессивно-подобному поведению у взрослых животных, пока что мало известно о половых различиях во влияниях ЛПС на такое поведение [15]. На этот счет имеется всего лишь несколько работ [10, 12, 21, 24, 26], результаты которых оказались неоднозначными и даже противоречивыми. Например, в одних случаях реактивность на ранний провоспалительный стресс была больше выражена у самцов [10, 12], а в других – у самок [21, 26]. Более отчетливые половые различия в действии ЛПС наблюдались при введении препарата взрослым животным непосредственно за 24 ч перед тестированием, причем у самцов признаки депрессивно-подобного поведения проявлялись сильнее, чем у самок [25, 27, 28]. Существенные половые различия были обнаружены во влиянии раннего провоспалительного стресса на оборонительное поведение [9]. Введение ЛПС на 3-й и 5-й дни от рождения приводило у взрослых самцов к большему проявлению условно-рефлекторного страха и затруднениям в его угашении при пассивных оборонительных рефлексах, но затрудняло приобретение активных оборонительных рефлексов. В целом, по характеристикам оборонительного поведения взрослых животных самки были более устойчивы к раннему провоспалительному стрессу, чем самцы.
Целью настоящей работы было изучение влияния раннего провоспалительного стресса на проявления тревожного и депрессивно-подобного поведения у самцов и самок крыс линии Вистар в подростковом (1–1.5 мес.) и взрослом возрасте (3–3.5 мес.). Ранний провоспалительный стресс создавали путем введения крысятам бактериального ЛПС на 3-й и 5-й дни постнатальной жизни. В задачи работы входило изучение влияния раннего введения ЛПС на уровень тревожности у крыс обоих полов в тестах открытого поля и приподнятого крестообразного лабиринта, а также на уровень депрессивно-подобного поведения в тестах на предпочтение сахарозы и вынужденного плавания. Кроме того, в задачи работы входила оценка влияния раннего стресса на состояние гипоталамо-гипофизарно-надпочечниковой оси и системы провоспалительных цитокинов. Для этого с помощью иммуноферментного анализа определяли уровень стресс-гормона кортикостерона и цитокина IL-1β в сыворотке крови взрослых крыс. Поскольку в литературе имеются данные о том, что хендлинг (приручение), обогащенная среда, двигательная активность оказывает антистрессовое влияние [36, 38, 39], также исследовали возможность коррекции последствий раннего провоспалительного стресса на будущее поведение с помощью усиленного хэндлинга и выработки пищедобывательных рефлексов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. В опытах участвовало 126 крыс линии Вистар в возрасте от 25 дней до 3.5 мес. (64 самца и 62 самки). Крысята (16 пометов) были выведены в виварии ИВНД и НФ от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. На 3-й и 5-й дни жизни у 37 крысят (6 пометов) вызывали провоспалительный стресс путем введения ЛПС Echerichia coli (серотип О26:В6, Sigma) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС). Во время этой процедуры крысята отлучались от матери на 15-20 мин. Животные взвешивались на электронных весах с точностью до 0.01 г и получали подкожную инъекцию ЛПС в холку с помощью инсулинового шприца. 49 крысятам (5 пометов) в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль 1). 40 крысят (5 пометов) оставались интактными, но на 3-й и 5-й дни жизни их также забирали от матери на 15–20 мин и взвешивали (группа ИНТ, контроль 2). В возрасте 25-ти дней крысят отлучали от матери и разделяли на подгруппы в зависимости от пола. В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму в клетках по 3–5 крыс, в одной клетке находились крысы одного пола и, как правило, из одного помета. Дополнительное взвешивание крыс проводилось в 1 и 3 мес. перед тестами на тревожность. С 1.5 до 3 мес. крысы участвовали в экспериментах с выработкой пищевых условных рефлексов, во время которых они подвергались многодневному хэндлингу. Стадия эстрального цикла у самок не контролировалась.
В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU) и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Тестирование уровня тревожности. В работе изучали поведение 51 крысы в двух тестах на тревожность: в открытом поле (ОП) и в приподнятом крестообразном лабиринте (ПКЛ). Перед первым тестированием для снижения стрессирующей нагрузки на животных проводился 15-ти минутный хэндлинг (приручение) в течение 4–5 дней, при этом животных брали в руки, пересаживали из домашней клетки в переноску и обратно. Первый раз крыс тестировали в возрасте 30–35 дней (подростковый возраст), второй раз – в возрасте 90–95 дней (взрослые). Использовали общепринятые размеры и конфигурации лабиринта и ОП, которые были подробно описаны ранее [29]. Время наблюдения в каждом тесте составляло 5 мин. Для фиксирования траектории движения крыс и элементов поведения использовали программу Etho Vision, а также видеорегистрацию. Анализировали показатели, отражающие тревожность/смелость крыс (время нахождения на периферии ОП, число и длительность выходов в центр ОП, в открытые рукава ПКЛ), двигательную активность крыс (пройденную дистанцию, скорость движения, время движения, число переходов между рукавами в ПКЛ), исследовательское поведение (стойки, выглядывания в открытые рукава в ПКЛ), поведение по оценке риска (свешивания в ПКЛ, вытягивания), элементы замещающего поведения (число и длительность груминга), а также ряд показателей, отражающих вегетативные реакции (число дефекаций и мочеиспусканий). Всегда вначале тестировали крысу в ОП, через 2–3 дня в ПКЛ. Перед помещением в камеру животного другого пола кроме обычной влажной и сухой уборки лабиринт протирали 20%-ным раствором этилового спирта. Для переноски самцов и самок из вивария в экспериментальную комнату и для ожидания своей очереди использовали разные клетки.
Тест на предпочтение сахарозы. Для оценки депрессивно-подобного поведения проводили тест на предпочтение сахарозы у 72 крыс в возрасте 35–40 дней и 95–100 дней. Тест проводили в течение одних или двух суток. В клетку помещали 2 бутылки, одну – с 1%-ным раствором сахарозы, другую с водой. Два раза в сутки (утром и вечером) бутылки взвешивали и меняли местами. Определяли объем выпитого раствора сахарозы и воды за сутки каждой крысой, а также процент выпитой сахарозы от общего объема потребленной жидкости.
Тест вынужденного плавания проводили в цилиндрах из оргстекла диаметром 20 и высотой 50 см, которые заполняли водой температурой 25–26°С до уровня 30 см. В возрасте 40–45 дней в первый день крыс помещали в воду на 15 мин (обучение, выработка поведенческого отчаяния), во второй день животные находились в воде 5 мин (тест). Время тестирования в 100–105 дней составляло 5 мин. При зависании (неподвижности) крысы осуществляли лишь слабые движения лапами и хвостом для коррекции положения тела около поверхности воды. Во время опыта проводили видеорегистрацию. При обработке данных подсчитывали время зависания крыс поминутно и суммарно за весь опыт, латентность первого зависания, число эпизодов зависания и среднюю длительность таких эпизодов за опыт.
Иммуноферментный анализ крови. Перед забором крови в возрасте 6 мес. проводили дополнительное стрессирование крыс в тесте вынужденного плавания. Крысы находились в воде 5 мин. Через 20–30 мин после окончания теста крыс умерщвляли декапитацией и собирали периферическую кровь, которую центрифугировали 15 мин при 4°С и 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа.
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа. Содержание провоспалительного интерлейкина-1β в сыворотке крови определяли с помощью наборов производства R&D Systems (США) согласно инструкции производителя. Измерение проводили на спектрофотометре Hidex 425-301 (Финляндия).
Статистическая обработка результатов. Для обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA. При post-hoc анализе применяли критерий Newman–Keuls. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 < р < 0.1. Во всех экспериментах анализировали влияние факторов “ПОЛ”, “ГРУППА” и “ВОЗРАСТ” крыс. При отсутствии нормальности распределения поведенческих параметров для выявления межгрупповых различий использовали Kruskal–Wallis ANOVA, затем при попарном сравнении группы ЛПС с контрольными группами применяли Mann–Whitney U тест (Nonparametric Statistics) с поправкой Бонферрони на множественные сравнения (различия считали статистически значимыми при р < 0.05 : 3 = 0.017). Данные на рисунках и в таблицах представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние раннего провоспалительного стресса на массу крыс. Масса тела крыс в группе ЛПС не отличалася от групп ИНТ или ФИЗ в возрасте 3 дней (до первого введения ЛПС), 5 дней (перед вторым введением), в 1 и 3 мес. перед началом тестирования на тревожность (табл. 1). Введение ЛПС или физиологического раствора вызывало небольшое замедление прироста массы. Прибавка массы тела у крысят группы ЛПС в 5 дней по сравнению с 3-м днем составляла 2.6–2.8 г, группы ФИЗ – 2.4–2.9 г, в то время как в группе ИНТ 4.1–4.5 г. Однако из-за большого разброса массы крысят в 3 дня влияние болевого воздействия и воспаления не сказалось на средних значения массы тела в группах. В возрасте 3 месяцев проявились половые различия в массе тела животных, самцы весили значительно больше самок.
Таблица 1.
Масса крысят разных групп в возрасте 3 дня (до введения ЛПС), 5 дней (перед вторым введением), в 1 и 3 мес. Table 1. The weight of rats of different groups at the age of 3 days (before LPS injection), 5 days (before the second injection), at the age of 1 and 3 month
| Возраст Age |
Группа крыс Group of rats |
Масса самцов, г Male weight, g |
Масса самок, г Female weight, g |
|---|---|---|---|
| 3 дня 3 days |
ИНТ NAIVE | 7.3 ± 0.6 | 6.9 ± 0.4 |
| ФИЗ SALINE | 7.8 ± 0.3 | 7.8 ± 0.3 | |
| ЛПС LPS | 7.8 ± 0.3 | 7.5 ± 0.3 | |
| 5 дней 5 days |
ИНТ NAIVE | 11.8 ± 0.8 | 11.0 ± 0.7 |
| ФИЗ SALINE | 10.7 ± 0.3 | 10.2 ± 0.3 | |
| ЛПС LPS | 10.4 ± 0.3 | 10.3 ± 0.4 | |
| 1 мес 1 month |
ИНТ NAIVE | 79.5 ± 2.8* | 76.6 ± 2.6 |
| ФИЗ SALINE | 72.6 ± 2.2* | 72.0 ± 2.5 | |
| ЛПС LPS | 80.0 ± 2.4 | 73.4 ± 2.3 | |
| 3 мес 3 months |
ИНТ NAIVE | 302.2 ± 8.0$ | 227.1 ± 7.4$ |
| ФИЗ SALINE | 323.6 ± 6.0$ | 230.5 ± 7.1$ | |
| ЛПС LPS | 317.6 ± 6.7$ | 220.0 ± 6.7$ |
* – статистически значимые различия между группами крыс в одном возрасте (p < 0.017, Mann–Whitney U Test). $ – различия между самцами и самками внутри группы. * – the significant differences between the rat’s groups at the same age (p < 0.017, Mann–Whitney U Test). $ – the differences between males and females within the group.
Влияние раннего провоспалительного стресса на поведение крыс в приподнятом крестообразном лабиринте. Необходимо отметить, что только некоторые из анализируемых показателей поведения имели нормальное распределение, результаты их анализа с помощью Factorial ANOVA представлены в табл. 2. Видно, что факторы ГРУППА крыс и ВОЗРАСТ оказывали влияние на показатели двигательной активности (пройденную дистанцию, скорость и время движения, число переходов через центр) и исследовательской активности (выглядывания в открытые рукава), а также наблюдалось взаимодействие этих факторов. Post-hoc анализ показал, что межгрупповые различия наблюдались только в подростковом возрасте, но не у взрослых крыс. В возрасте 1 мес. у всех крыс группы ЛПС по сравнению с группами ФИЗ и ИНТ была меньше (р < 0.05) пройденная дистанция, скорость, время движения (рис. 1C), число переходов через центр (рис. 1B), процент времени выходов в открытые рукава ПКЛ (рис. 1A), выглядываний в открытые рукава (рис. 1D). Сопоставление самцов и самок показало, что у самцов изменения были более выраженные, только у самцов наблюдались значимые межгрупповые различия по времени движения, числу переходов через центр, числу выглядываний (рис. 1B–D). У самцов в возрасте 1 мес. также наблюдались межгрупповые различия по числу стоек (Kruskal–Wallis test: H (2, n = 23) = 6.1, p = 0.048), наблюдалась тенденция снижения числа стоек у группы ЛПС по сравнению с группой ФИЗ (р = 0.020, Mann–Whitney U Test) и группой ИНТ (р = 0.052, Mann–Whitney U Test).
Таблица 2.
Значения F и р при анализе с помощью Factorial ANOVA некоторых показателей поведения крыс в ПКЛ и ОП Table 2. The F and р values at the analysis by Factorial ANOVA of some parameters of rat’s behavior in the elevated plus maze (EPM) and open field (OF)
| Тест Test |
Показатель
поведения Behavioral parameter |
Фактор Factor | ||||
|---|---|---|---|---|---|---|
| ВОЗРАСТ AGE |
ГРУППА GROUP |
ВОЗРАСТ/ ГРУППА AGE/GROUP |
ПОЛ SEX |
ВОЗРАСТ/ ПОЛ/ ГРУППА AGE/SEX/ GROUP |
||
| ПКЛ EPM |
% t выхода в ОР %t in open arms |
–* | – | – | – | – |
| Дистанция Distance |
F1,87 = 4.94 p = 0.029 |
F2,87 = 7.65 p = 0.001 |
F2,87 = 4.17 p = 0.019 |
– | – | |
| Скорость Velocity |
F1,87 = 5.3 p = 0.024 |
F2,87 = 7.59 p = 0.001 |
F2,87 = 4.13 p = 0.019 |
– | – | |
| t движения, % Movement time, % |
F1,87 = 12.74 p = 0.001 |
F2,87 = 8.42 p = 0.000 |
F2,87 = 3.94 p = 0.023 |
– | – | |
| Число переходов
через центр Transitions hrough the center |
F1,87 = 3.82 p = 0.054 |
F2,87 = 10.41 p = 0.000 |
– | – | – | |
| Свешивания Head dipping |
– | – | F2,87 = 3.88 p = 0.024 |
F1,87 = 4.43 p = 0.038 |
– | |
| Выглядывания Looking out |
F1,87 = 10.44 p = 0.002 |
F2,87 = 5.92 p = 0.004 |
F2,87 = 3.07 p = 0.051 |
– | – | |
| ОП OF |
Дистанция Distance |
F1,87 = 41.5 р = 0.000 |
F2,88 = 5.47 p = 0.006 |
F2,88 = 3.05 p = 0.052 |
– | – |
| Скорость Velocity |
F1,87 = 41.18 p = 0.000 |
F2,88 = 5.03 p = 0.009 |
F2,88 = 3.00 p = 0.055 |
– | – | |
| t движения, % Movement time, % |
F1,87 = 30.65 p = 0.000 |
F2,88 = 3.99 p = 0.022 |
F2,88 = 2.71 p = 0.072 |
– | – | |
| Стойки Rearing |
F1,87 = 20.51 p = 0.000 |
– | – | – | – | |
Рис. 1.
Влияние раннего провоспалительного стресса на поведение крыс в приподнятом крестообразном лабиринте в подростковом и взрослом возрасте. По горизонтали – пол крыс, по вертикали – значения различных показателей поведения. Naive – группа интактных крыс, Saline – группа с введением физиологического раствора в раннем онтогенезе, LPS – группа с введением LPS. n – число крыс в группе (самцы/самки). ОР – открытые рукава лабиринта, t – время. @ – статистически значимые различия между группой LPS и группой ИНТ, $ – между группой LPS и Saline (p < 0.05, post-hoc анализ Factorial ANOVA). Group – значимое влияние фактора Group на крыс в подростковом возрасте. Fig. 1. The influence of an early proinflammatory stress on rat’s behavior in an elevated plus maze at the adolescent and adult age. On horizontal line – the sex of rats, on vertical line – the values of different parameters of behavior. Naive – naive rats, Saline – a group of rats that received an injection of saline in early ontogenesis, LPS – a group of rats that received and injection of LPS. n – a number of rats in each group (males/females). ОР – the open arms of a maze, t – time. $ – the significant difference between LPS аnd Saline groups, @ – between LPS and Saline groups (p < 0.05, post-hoc analysis Factorial ANOVA). Group – significant influence of factor group on adolescent rats.
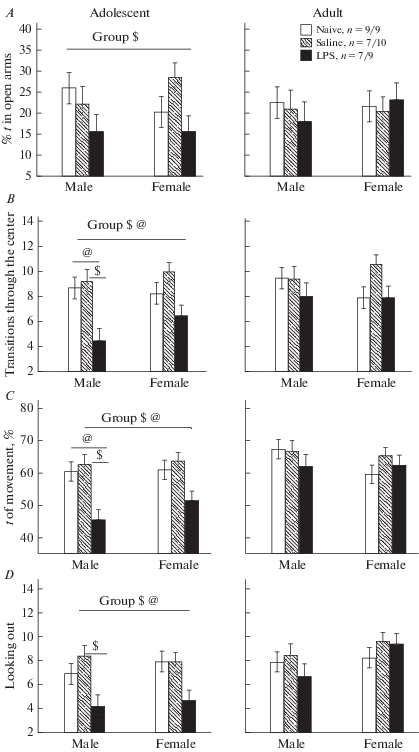
Таким образом, судя по полученным результатам, ранний провоспалительный стресс приводил в подростковом возрасте к снижению двигательной и исследовательской активности, а также к увеличению уровня тревожности, причем изменения проявились сильнее у самцов, чем у самок. Во взрослом возрасте различий между группами ЛПС и контрольными группами крыс уже не наблюдалось, что свидетельствует об исчезновении влияния раннего провоспалительного стресса на поведение крыс в ПКЛ в этом возрасте.
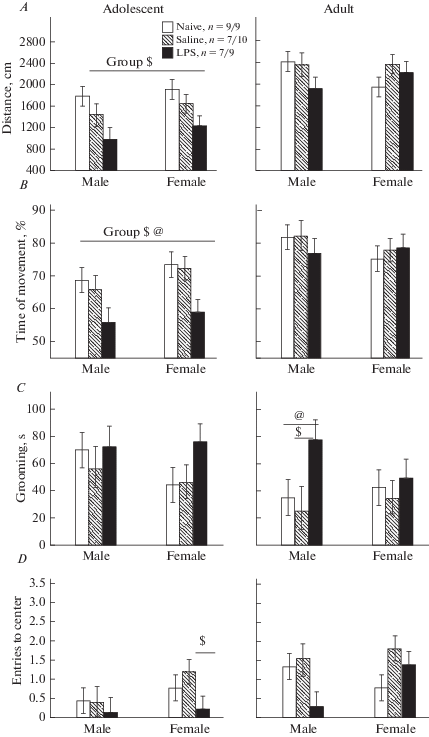
Влияние раннего провоспалительного стресса на поведение крыс в открытом поле. При анализе с помощью Factorial ANOVA показателей поведения, имеющих нормальное распределение (табл. 3), было выявлено влияние факторов ГРУППА и ВОЗРАСТ крыс, а также их взаимодействия на показатели двигательной активности крыс (дистанция, скорость и время движения). Post-hoc анализ показал, что межгрупповые различия наблюдались только в подростковом возрасте, но не у взрослых крыс. В возрасте 1 мес. у всех крыс группы ЛПС была меньше пройденная дистанция (рис. 2A), время (рис. 2B) и скорость движения, чем у животных одной или обеих контрольных групп, половых различий по этим показателям не было выявлено. Анализ остальных показателей поведения, не имеющих нормального распределения, показал, что у самок в подростковом возрасте имелись межгрупповые различия по числу выходов в центр поля (Kruskal–Wallis test: H (2, n = 28) = 6.9, p = 0.031), по времени нахождения в центре (Kruskal–Wallis test: H (2, n = 28) = 8.65, p = 0.013), при этом показатели самок группы ЛПС были меньше (р < 0.017, Mann-Whitney U Test) (рис. 2D), чем у группы ФИЗ. Во взрослом возрасте межгрупповые различия по указанным выше показателям исчезали. По числу стоек межгрупповые различия не были обнаружены ни в 1, ни в 3 мес. По длительности груминга межгрупповые различия не наблюдались в 1-м мес., но появлялись у самцов в 3 мес. (рис. 2C, Kruskal–Wallis test: H (2, n = 28) = 6.92, p = 0.031), при этом у самцов группы ЛПС время груминга было больше, чем у группы ФИЗ (р < 0.017, Mann–Whitney U Test). Таким образом, ранний провоспалительный стресс приводил в подростковом возрасте к снижению двигательной активности в ОП у всех крыс и к увеличению тревожности у самок. Во взрослом возрасте влияние провоспалительного стресса исчезало, только у самцов наблюдалось увеличение замещающей активности.
Таблица 3.
Значения F и р при анализе с помощью Factorial ANOVA некоторых показателей поведения крыс в тесте вынужденного плавания Table 3. The values of F and р at the analysis by factorial ANOVA of some parameters of rat’s behavior in the forced swimming test
| Возраст и день
тестирования Age and day of testing |
Фактор Factor | ||||
|---|---|---|---|---|---|
| ВРЕМЯ TIME |
ПОЛ SEX |
ПОЛ/ВРЕМЯ SEX/TIME |
ГРУППА/ ПОЛ GROUP/ SEX |
ГРУППА/ ПОЛ/ ВРЕМЯ GROUP/ SEX/TIME |
|
| 1 мес., 1 день 1 month, day 1 |
F4,646 = 365.4 p = 0.000 |
F1 = 3.3 p = 0.071 |
F4,646 = 2.5 p = 0.041 |
F2,646 = 9.9 p = 0.000 |
–* |
| 1 мес., 2 день 1 month, day 2 |
F4,647 = 109.8 p = 0.000 |
F1,647 = 6.4 p = 0.012 |
– | – | – |
| 3 мес. 3 months |
F4,570 = 234.3 p = 0.000 |
F1,570 = 22.4 p = 0.000 |
F4,570 = 4.4 p = 0.002 |
– | – |
Рис. 2.
Влияние раннего провоспалительного стресса на поведение крыс в открытом поле в подростковом и взрослом возрасте. По горизонтали – пол крыс, по вертикали – значения различных показателей поведения. @ – статистически значимые различия между группой LPS и группой Naive, $ – между группой LPS и Saline (p < 0.05, на A, B – post-hoc анализ Factorial ANOVA, на C, D – Mann–Whitney U Test). Group – значимое влияние фактора Group на крыс в подростковом возрасте. Остальные обозначения как на рис. 1. Fig. 2. The influence of an early proinflammatory stress on behavior of rats in the open field at the adolescent and adult age. On horizontal line – the sex of rats, on vertical line – the values of different parameters of behavior. $ – the significant difference between LPS аnd Saline groups, @ – between LPS and Naive groups (p < 0.05, on C, V – Mann–Whitney U Test, on A, B – post-hoc-analysis Factorial ANOVA). Group – significant influence of factor group on adolescent rats. The rest designations are the same as in the Fig. 1.
Влияние раннего провоспалительного стресса на предпочтение сахарозы в тесте на ангедонию. Результаты теста на потребление раствора сахарозы у крыс в разном возрасте представлены на рис. 3A, B. На процент потребления сахарозы оказывали влияние факторы ВОЗРАСТ (F1,131 = 34.4, р < 0.001) и ГРУППА крыс (F2,131 = 13.9, р < 0.001). Было также обнаружено значимое взаимодействие этих факторов (F2,131 = 53.4, р < 0.001). На объем выпитой жидкости за сутки оказывали влияние факторы ВОЗРАСТ (F1,131 = 211.1, р < 0.001) и ГРУППА (F2,131 = 9.7, р < 0.001), наблюдалось также взаимодействие факторов ВОЗРАСТ × ПОЛ (F1,131 = 18.1, р < 0.001) и ГРУППА × × ПОЛ (F2,131 = 3.2, р = 0.046). Post-hoc анализ показал, что в подростковом возрасте животные группы ЛПС потребляли существенно меньше (р < 0.05) раствора сахарозы, чем животные ФИЗ и ИНТ групп (рис. 3A), разницы между самцами и самками не наблюдалось. У самцов группы ЛПС в один месяц общий объем выпитой жидкости за сутки был больше, чем у крыс ФИЗ и ИНТ групп (рис. 3B) (р < 0.05). Во взрослом возрасте крысы группы ЛПС, наоборот, потребляли больше (р < 0.05) раствора сахарозы, чем животные группы ФИЗ или ИНТ (рис. 2A), статистически значимые различия наблюдались у самок. По объему выпитой жидкости за сутки животные разных групп не отличались в три месяца (рис. 3B).
Рис. 3.
Влияние раннего провоспалительного стресса на потребление сахарозы (А) и общее потребление жидкости (B) в тесте на предпочтение сахарозы в подростковом и взрослом возрасте. По горизонтали – пол крыс, по вертикали на A – процент выпитого раствора сахарозы от общего объема потребленной жидкости в сутки, на B – общий объем выпитой жидкости в сутки (мл). @ – статистически значимые различия между группой LPS и группой Naive, $ – между группой LPS и Saline (post-hoc анализ Factorial ANOVA). Group – значимое влияние фактора Group на крыс в данном возрасте. Остальные обозначения как на рис. 1. Fig. 3. The influence of an early proinflammatory stress on consumption of sucrose (A) and total liquid consumption (B) in the sucrose preference test at the adolescent and adult age. On horizontal line – the sex of rats, on vertical lines on A – a percentage of the consumed sucrose solution from a total amount of the consumed liquid for 24 hours, B – the total amount of the consumed liquid for 24 hours. $ – the significant difference between LPS аnd Saline groups, @ – between LPS and Naive groups (p < 0.05, post-hoc analysis Factorial ANOVA). Group – significant influence of factor group. The rest designations are the same as in the Fig. 1.
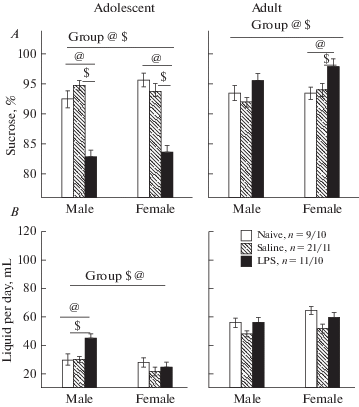
Таким образом, судя по результатам теста на сахарозу, крысы группы ЛПС в подростковом возрасте демонстрировали признаки депрессивно-подобного поведения, но у взрослых животных эти признаки исчезали.
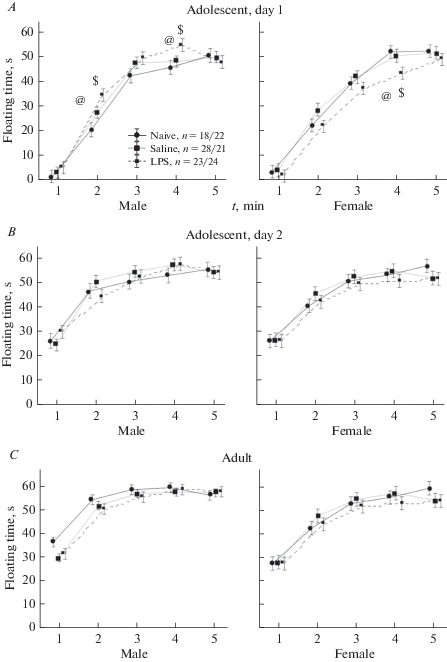
Влияние раннего провоспалительного стресса на время зависания в тесте вынужденного плавания. Результаты анализа времени зависания у крысят в подростковом возрасте (1-й и 2-й день), а также у взрослых крыс представлены на рис. 4 и в табл. 3. В первый день тестирования в подростковом возрасте наибольшие различия времени зависания в зависимости от группы крыс и от времени пребывания в воде наблюдались только в начале опыта, в дальнейшем время зависания оставалось постоянным, незначительно колеблясь около 50 с, поэтому на рисунке представлен только первый 5-минутный отрезок из 15-минутного опыта. Видно, что фактор ВРЕМЯ и ПОЛ оказывали влияние во всех опытах (табл. 3). Влияние фактора ПОЛ увеличивалось у взрослых крыс, post-hoc анализ показал, что наибольшие различия между самцами и самками наблюдались на первой минуте тестирования, самцы зависали на большее (p < 0.05) время, чем самки (рис. 4C). Влияние фактора ВРЕМЯ было максимальным в первый день тестирования у подростков. На первой минуте время зависания не превышало 5 с, к 5-й минуте – возрастало до 50–60 с (рис. 4A). В последующие дни уже на первой минуте тестирования время зависания было значительным (рис. 4B, C). Кроме того, только у подростков в 1-й день было обнаружено взаимодействие факторов ГРУППА/ПОЛ. Оно проявилось в большем времени зависания у самцов группы ЛПС по сравнению с контрольными группами, и, наоборот, в меньшем времени зависания у самок группы ЛПС по сравнению с контролем. Post-hoc анализ показал, что в 1-й день у самцов-подростков группы ЛПС время зависания на 2-й и 4-й минутах было статистически значимо больше, чем у самцов группы ИНТ и ФИЗ. У самок-подростков ЛПС группы в первый день на 4-й минуте время зависания было, наоборот, меньше, чем у самок ИНТ и ФИЗ групп. При последующих тестированиях межгрупповых различий не было обнаружено. Таким образом, тест вынужденного плавания показал, что только в первый день в подростковом возрасте самцы ЛПС группы проявляли признаки депрессивно-подобного поведения, при последующих тестированиях указанные различия в поведении исчезали. У самок группы ЛПС депрессивно-подобное поведение не проявлялось ни в подростковом, ни во взрослом возрасте.
Рис. 4.
Влияние раннего провоспалительного стресса на время зависания в тесте вынужденного плавания. А – время зависания по минутам в 1-й день в подростковом возрасте, B – во 2-й день в подростковом возрасте, C – во взрослом возрасте. n – число крыс в группе (самцы/самки). @ – статистически значимые различия между группой LPS и группой Naive, $ – между группой LPS и Saline (p < 0.05, post-hoc анализ, Factorial ANOVA). Остальные обозначения как на рис. 1. Fig. 4. The influence of an early proinflammatory stress on immobility time in the forced swimming test. А – a time of immobility by minutes on the 1st day at the adolescent age, B – on the 2d day at the adolescent age, C – at the adult age. n – a number of rats in a group (males/females). $ –the significant difference between LPS аnd Saline groups, @ – between LPS and Naive groups (post-hoc analysis Factorial ANOVA). The rest designations are the same as in the Fig. 1.
Влияние ЛПС на уровень кортикостерона и IL-1β. Проведенный иммуноферментный анализ сыворотки крови, взятой через 20–30 мин после стрессового воздействия (тест вынужденного плавания) у крыс в возрасте 6 мес. показал (рис. 5A), что на уровень кортикостерона существенное влияние оказывал фактор ПОЛ (F1,42 = 55.78, p < 0.001). У самок всех групп уровень кортикостерона был выше, чем у самцов (р < 0.05, post-hoc анализ). Фактор ГРУППА крыс оказывал слабое влияние на уровень кортикостерона в виде тенденции (F2,42 = 2.71, p = 0.078). Только у самок группы ЛПС уровень кортикостерона был выше, чем у интактной группы (post-hoc анализ).
Рис. 5.
Влияние раннего провоспалительного стресса на уровни кортикостерона (А) и ИЛ-1β (B) в сыворотке крови у взрослых самцов и самок после теста вынужденного плавания. По горизонтали – пол крыс. @ – статистически значимые различия между группой LPS и группой Naive, $ – между группой LPS и Saline (р < 0.05, post-hoc анализ Factorial ANOVA). Остальные обозначения как на рис. 1. Fig. 5. The influence of an early proinflammatory stress on the levels of corticosterone (A) and IL-1β (B) in the blood serum of the adult males and females after the forced swimming test. On horizontal line – the sex of rats. $ – the significant difference between LPS аnd Saline groups, @ – between LPS and Naive groups (р < 0.05, post-hoc analysis Factorial ANOVA). The rest designations are the same as in the Fig. 1.
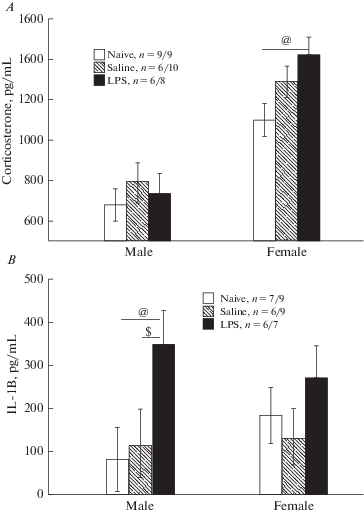
На уровень IL-1β влияние оказывал фактор ГРУППА крыс (F2,38 = 3.81, p = 0.031). Post-hoc анализ показал, что у самцов группы ЛПС уровень IL-1β был выше, чем у самцов контрольных групп (рис. 5B). У самок значимых различий в уровне IL-1β у разных групп крыс не было обнаружено.
Таким образом, ранний провоспалительный стресс оказывал разное влияние на биохимические показатели сыворотки крови у самцов и самок: у самцов в возрасте 6 мес. оставался повышенным уровень провоспалительного цитокина IL-1β, а у самок – уровень кортикостерона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящих опытах провоспалительный стресс, вызванный введением ЛПС на 3-й и 5-й дни жизни, приводил к уменьшению двигательной и исследовательской активности, усилению тревожности и к признакам депрессивно-подобного поведения у крыс в подростковом возрасте. Усиление тревожности в тесте ПКЛ проявилось в большей степени у самцов, тогда как в тесте ОП – только у самок. Усиление депрессивно-подобного поведения у крыс с ранним провоспалительным стрессом было выявлено в тесте предпочтения сахарозы в равной степени у самцов и самок, в то время как в тесте вынужденного плавания – только у самцов в первый день экспериментов. Во взрослом возрасте после выработки пищедобывательных рефлексов все перечисленные выше различия в поведении крыс, получавших провоспалительный стресс, и контрольных животных исчезали, за исключением результатов теста предпочтения сахарозы, в котором самки, получавшие ранний ЛПС стресс, показали даже большее предпочтение сахарозы, чем контрольные животные.
В литературе традиционно для оценки депрессивно-подобного поведения у грызунов применяют тесты вынужденного плавания и предпочтения сахарозы. Однако эти тесты отражают разные аспекты данного вида поведения и с этим, по-видимому, могут быть связаны некоторые различия в полученных нами результатах по этим двум тестам. Тест предпочтения сахарозы оценивает степень ангедонии животных, т.е. уменьшение удовольствия от потребления сладкого раствора. Тест вынужденного плавания, являющийся умеренным стрессогенным воздействием [19, 30, 31], оценивает степень иммобильности, пассивного зависания, склонность животных к “поведенческому отчаянию” [30]. Кроме того, некоторые различия в результатах наших опытов в тестах вынужденного плавания и предпочтения сахарозы могут быть связаны с разной чувствительностью этих двух тестов. Ранее отмечалось, что ангедония является наиболее чувствительным индикатором депрессивного поведения после хронического стресса [31]. В тесте вынужденного плавания в подростковом возрасте увеличение времени иммобильности у самцов группы ЛПС наблюдали только в первый день пребывания в воде. У самок при этом, наоборот, время зависания в ЛПС группе было меньше, чем в контрольных группах. Во второй день тестирования межгрупповые различия среди самцов и самок исчезали, все животные, начиная с первой минуты, зависали на значительное время, что свидетельствовало, по-видимому, о том, что животные обучились экономить силы. Таким образом, наиболее показателен был первый день пребывания крыс в воде, только в этот день можно было оценить copy-style, т.е. способ, как животные справляются со стрессом, предпочтение активных или пассивных реакций на неизбегаемый стресс.
В литературе имеется ряд работ, в которых исследовали влияние провоспалительного стресса в раннем возрасте на тревожное и депрессивно-подобное поведение у взрослых животных, при этом имеются существенные различия в дозе вводимого препарата (от 50 до 250 мкг/кг) и возрасте воздействия. В одних работах введение ЛПС проводилось в возрасте 3-х и 5-ти дней [12, 19, 21, 22], в других – 14-ти дней [11, 24, 32]. Возраст до 9-ти дней рассматривается в литературе как особый “сенситивный” период постнатального развития, когда из-за низкого уровня кортикостерона еще не проявляется амигдало-зависимое обучение. Возраст с 10-го по 15-й день рассматривается как окончание сенситивного периода, когда начинает проявляться амигдало-зависимое обучение через влияние на миндалину гормонов стресса [33]. При введении ЛПС на 3-й и 5-й день, так же как в нашей работе, наблюдалось увеличение тревожности у самцов в ОП (у подростков) и в ПКЛ (у взрослых) и депрессивно-подобного поведения в тесте вынужденного плавания [19]. Увеличение тревожности и депрессивно-подобного поведения у мышей самцов, но не самок, в 35 и 70 дней наблюдали после введения ЛПС на 5-й и 7-й дни жизни [10]. Эффект от введения ЛПС мог зависеть от линии крыс [22], у высокотревожных крыс введение ЛПС приводило к снижению тревожности, а у низкотревожных, наоборот, к ее увеличению. Имеются данные, что ранний провоспалительный стресс мог не менять уровень тревожности в ПКЛ и ОП у взрослых крыс, только дополнительный хронический стресс (изоляция и ограничение движения) у взрослых животных, рассматриваемый в качестве “второго удара”, вызывал увеличение тревожности [12]. Введение ЛПС взрослым животным за 24 ч до тестирования дало более однородные результаты, было показано увеличение депрессивноподобного поведения [28], причем самцы демонстрировали большую чувствительность, чем самки. В литературе при рассмотрении молекулярно-клеточных механизмов генеза депрессии большую роль отводят глюкокортикоидам и цитокинам [34]. Совсем недавно в работе [35] было получено транскриптомное доказательство того, что ранний стресс повышает чувствительность организма к будущим стрессам. Авторы использовали методику секвенирования РНК (RNA-sequencing) в вентральной тегментальной зоне, прилежащем ядре и префронтальной коре самцов и самок мышей, и показали, что стресс у взрослых животных, отчетливо представленный в транскриптомах мозга, зависит от истории ранних влияний. Они обнаружили транскрипционные регуляторы эффектов раннего стресса на стрессирующие воздействия в зрелом возрасте [35].
При анализе наших данных особый интерес вызывает исчезновение изменений в тревожном и депрессивно-подобном поведении крыс во взрослом возрасте при сохранении измененных биохимических показателей сыворотки крови. По данным литературы [10, 19], влияние провоспалительного стресса проявляется в поведении крыс не только в подростковом, но и во взрослом возрасте, причем по отдельным показателям поведения влияние стресса у взрослых даже усиливается [19]. Полученные нами данные о возможности коррекции негативных последствий провоспалительного стресса на поведение крыс представляют определенный практический интерес. Согласно данным литературы существует ряд факторов, которые могут уменьшать влияние раннего провоспалительного стресса на проявления тревожного и депрессивно-подобного поведения у взрослых животных. К ним относятся хэндлинг [36], предсказуемый умеренный хронический стресс [37], обогащенная среда [38], физические упражнения и усиленная двигательная активность [38, 39]. Эти факторы ослабляют нейровоспалительный процесс путем уменьшения продукции провоспалительных цитокинов и торможения активации микроглии. В нашем исследовании между первым (в 1–1.5 мес.) и повторным (в 3–3.5 мес.) тестированием животные были использованы в опытах с выработкой пищедобывательных условных рефлексов, во время которых они подвергались комбинированному воздействию – многодневному хендлингу, пребыванию в обогащенной среде и двигательной нагрузке, что могло уменьшить признаки тревожного и депрессивно-подобного поведения у группы ЛПС. Во всяком случае, для более полного ответа на поставленный вопрос, какое воздействие из вышеперечисленных оказало такое положительное влияние, необходимо провести специальное исследование.
Судя по полученным в настоящей работе данным, у самцов, получавших провоспалительный стресс в раннем возрасте, по некоторым показателям проявление тревожного и депрессивно-подобного поведения наблюдалось в большей степени, чем у самок. В литературе есть точка зрения [40], что провоспалительный стресс в раннем возрасте активирует микроглию (эффект прайминга, priming), которая становится более чувствительной к последующим стрессам. Это явление проходит неодинаково у самцов и самок. В то время как у самцов стресс и последующее введение ЛПС ведут к повышению реактивности микроглии, которая увеличивает экспрессию цитокина ИЛ-1β, у самок реактивность микроглии не меняется [41]. В опытах на мышах с ишемическим провоспалительным стрессом, вызванным на 9-й день жизни, у самцов в отличие от самок наблюдалось увеличение активности микроглии и макрофагов, появление амебоидной морфологии и увеличение экспрессии генов белков TNFα и ptgs2 (Cox-2) [42]. Показано, что депрессивно-подобное поведение у самцов и самок реализуется через разные молекулярные механизмы в гипоталамусе [43]. У самок оно больше связано с увеличение высвобождения кортикотропина в гипоталамусе, снижением BDNF, ростом активности ядерных глюкокортикоидных рецепторов и увеличением NFkB и 20 kDa C/EBPβ. У самцов, в отличие от самок, вместе с ростом кортиколиберина происходит увеличение уровня COX-2, глюкокортикоидных рецепторов в цитоплазме, ядерного 38 kDa C/EBPβ и NFkB [43]. При нейровоспалении, вызванном ишемическим инсультом, у самок по сравнению с самцами повышается продукция противовоспалительного цитокина IL-4, а также увеличивается экспрессия рецепторов к IL-4 и IL-10 на глиальных клетках [44]. В настоящих опытах мы обнаружили в группе ЛПС повышенный уровень провоспалительного цитокина IL-1β у самцов (но не самок) по сравнению с контрольными животными, что свидетельствует о сенситизации воспалительного процесса у самцов.
Особое место в реакциях на стресс и проявлениях тревожного и депрессивно-подобного поведения принадлежит эстрогенам. Эстрогены обладают выраженным противовоспалительным действием, что было показано in vitro на культуре микроглиальных клеток с введением 17β-эстрадиола, которое предохраняло от морфофункциональных изменений, вызываемых ЛПС, и сопутствующего синтеза провоспалительных цитокинов [45]. Эффекты эстрадиола связаны с модуляцией воспалительных реакций через глиальные клетки и регуляцией высвобождения провоспалительных цитокинов и хемокинов [46], при этом считается, что эстрогенные рецепторы альфа играют более существенную роль в уменьшении воспалительных эффектов микроглии, чем эстрогенные рецепторы бета. Овариоэктомия у грызунов приводила к большему вовлечению микроглии в нейровоспалительный процесс и усилению регуляции большего числа маркеров реактивности микроглии, включая рецепторы для провоспалительных сигналов и фагоцитоза [47]. Введение эстрадиола перед овариоэктомией блокировало активацию микроглии, это свидетельствует о том, что именно отсутствие эстрогенов при овариоэктомии связано с усилением нейровоспалительных процессов. Эстрогены усиливают также серотонинергическую активность через большое число эстрогенных рецепторов бета, расположенных на нейронах ядер шва [48]. По-видимому, благодаря противовоспалительному действию эстрогенов у самок ЛПС группы в нашей работе не наблюдалось повышения уровня ИЛ-1β по сравнению с контрольными группами после дополнительного стрессирования.
ВЫВОДЫ
1. Ранний провоспалительный стресс, создаваемый путем введения ЛПС на 3-й и 5-й постнатальные дни, приводил к снижению двигательной активности, уменьшению исследовательского поведения и увеличению тревожности у крысят в подростковом возрасте в тестах приподнятого крестообразного лабиринта и открытого поля. Наибольшие изменения в поведении происходили у самцов по сравнению с самками. Во взрослом возрасте после выработки пищедобывательных рефлексов указанные изменения практически исчезали.
2. Ранний провоспалительный стресс вызывал депрессивно-подобное поведение у самцов и самок в подростковом возрасте, которое проявлялось в уменьшении предпочтения 1%-ного раствора сахарозы по сравнению с контрольными группами. Во взрослом возрасте признаки ангедонии исчезали.
3. В тесте вынужденного плавания признаки депрессивно-подобного поведения в ответ на ранний провоспалительный стресс у самцов проявились только в 1-й день тестирования в подростковом возрасте; при повторных тестированиях во 2-й день и у взрослых крыс они исчезали. У самок группы ЛПС время зависания было, наоборот, меньше, чем у контрольных групп в подростковом возрасте, у взрослых различия исчезали.
4. Введение ЛПС в раннем возрасте приводило у взрослых самцов, но не самок, к увеличению уровня IL-1β в крови после повторных стрессовых воздействий по сравнению с самцами контрольных групп. У самок, но не у самцов, после введения ЛПС возрастало содержание в крови кортикостерона.
5. У самцов по сравнению с самками ранний провоспалительный стресс оказывал большее влияние на тревожно-депрессивное поведение и вызывал большую активацию провоспалительного сигналинга.
Авторы выражают благодарность Онуфриеву М.В и Моисеевой Ю.В., сотрудникам лаборатории функциональной биохимии нервной системы ИВНД и НФ РАН, за помощь в проведении иммуноферментного анализа.
Список литературы
Kessler R.C., Petukhova M., Sampson N.A., Zaslavsky A.M., Wittchen H.-U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. Int. J. Methods Psychiatr. Res. 21(3): 169–184. 2012.
Parker G., Brotchie H. Gender differences in depression. Int. Rev. Psychiatry. 22: 429–436. 2010.
Solomon M.B., Herman J.P. Sex differences in psychopathology: of gonads, adrenals and mental illness. Physiol. Behav. 97: 250–258. 2009.
Bangasser D.A., Valentino R.J. Sex differences in stress-related psychiatric disorders:neurobiological perspectives. Front. Neuroendocrinol. 35: 303–319. 2014.
Shansky R.M. Sex differences in PTSD resilience and susceptibility: challenges for animal models of fear learning. Neurobiol. Stress. 1: 60–65. 2015.
Benmhammed H., El Hayek S., Nassiri A., Bousalham R., Mesfioui A.,Ouichou A., El Hessni A. Effects of lipopolysaccharide administration and maternal deprivation on anxiety and depressive symptoms in male and female Wistar rats: Neurobehavioral and biochemical assessments. Behav. Brain Res. 362: 46–55. 2019.
Miragaia A.S., de Oliveira Wertheimer G.S., Consoli A.C., Cabbia R., Longo B.M., Girardi C.E.N., Suchecki D. Maternal deprivation increases anxiety- and depressive-like behaviors in an age-dependent fashion and reduces neuropeptide Y expression in the amygdala and hippocampus of male and female young adult Rats. Front. Behav. Neurosci. 7(12): 159. 2018.
Wei Y., Wang G., Wang H., He J., Zhang N., Wu Z., Xiao L., Yang C. Sex-dependent impact of different degrees of maternal separation experience on OFT behavioral performances after adult chronic unpredictable mild stress exposure in rats. Physiol. Behav. 194: 153–161. 2018.
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Онуфриев М.В., Моисеева Ю.В., Григорьян Г.А. Половые различия в оборонительном поведении взрослых крыс в ответ на ранний провоспалительный стресс. Журн. высш. нервн. деят. 70. (в печати) 2020. [Broshevitskaya N.D., Pavlova I.V., Zaichenko M.I., Onufriev M.V., Moiseeva Yu.V., Grigoryan G.A. The Sex Differences in Defensive Behavior of Adult Rats in Response to Early Neuroinflammatory Stress. Zh. Vyssh. Nerv. Deiat. im. I.P. Pavlova. 70. 2020. (In Russ)].
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., Macedo D.S. Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol. Neurobiol. 55(5): 3775–3788. 2018.
Dinel A.L., Joffre C., Trifilieff P., Aubert A., Foury A., Le R.P., Laye S. Inflammation early in life is a vulnerability factor for emotional behavior at adolescence and for lipopolysaccharide-induced spatial memory and neurogenesis alteration at adulthood. J. Neuroinflam. 11: 155. 2014.
Walker A.K., Nakamura T., Byrne R.J., Naicker S.,Tynan R.J., Hunter M., Hodgson D.M. Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behaviour and blunted corticosterone responses: implications for the double-hit hypothesis. Psychoneuroendocrinology. 34(10): 1515–1525. 2009.
Victoria N.C., Murphy A.Z. Exposure to early life pain: long term consequences and contributing mechanisms. Curr. Opin. Behav. Sci. 7: 61–68. 2016.
Walker C.D., Bath K.G., Joels M., Korosi A.Larauche M., Lucassen P.J., Morris M.J., Raineki C., Roth T.L., Sullivan R.M., Taché Y., Baram T.Z. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: critical considerations of methodology, outcomes and translational potential. Stress. 20(5): 421–448. 2017.
Григорьян Г.А. Половые различия в поведении и биохимических маркерах у животных в ответ на нейровоспалительный стресс. Успехи физиол. наук. 51(1): 1–15. 2020. [Grigoryan G.A. Sex differences in behaviour and biochemical markers in animals in response to neuroinflamatory stress. Usp. Physiol. Nauk. 51(1): 1–15. 2020. (In Russ)].
Alexander C., Rietschel E.T. Bacterial lipopolysaccharides and innate immunity. J. Endotoxin Res. 7(3): 167–202. 2001.
Dantzer R., O’Connor J.C., Freund G.G., Johnson R.W., Kelley K.W. From inflammation to sickness and depression: when the immune system subjugates the brain. Nature Rev. Neurosci. 9: 46–56. 2008.
Dudek K.A., Dion-Albert L., Kaufmann F.N., Tuck E., Lebel M., Menard C. Neurobiology of resilience in depression: immune and vascular insights from human and animal studies. Eur. J. Neurosci. 2019 https://doi.org/10.1111/ejn.14547
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav. Brain Res. 304: 1–10. 2016.
Bilbo S.D., Yirmiya R., Amat J., Paul E.D., Watkins L.R., Maier S.F. Bacterial infection early in life protects against stressor-induced depressive-like symptoms in adult rats. Psychoneuroendocrinology. 33: 261–269. 2008.
Tenk C.M., Kavaliers M., Ossenkopp K.P. Neonatal treatment with lipopolysaccharide differentially affects adult anxiety responses in the light-dark test and taste neophobia test in male and female rats. Int. J. Dev. Neurosci. 31(3): 171–180. 2013.
Claypoole L.D., Zimmerberg B., Williamson L.L. Neonatal lipopolysaccharide treatment alters hippocampal neuroinflammation, microglia morphology and anxiety-like behavior in rats selectively brad for an infantile trait. Brain Behav. Immun. 59: 135–146. 2017.
Shanks N., Larocque S., Meaney M.J. Neonatal endotoxin exposure alters the development of the hypothalamic-pituitary-adrenal axis: early illness and later responsivity to stress. J. Neurosci. 15(1 Pt 1): 376–384. 1995.
Berkiks I., Garcia-Segura L.M., Nassiri A., Mesfioui A., Ouichou A., Boulbaroud S., Bahbiti Y., Lopez-Rodriguez A.B., Hasnaoui E., El Hessni A. The sex differences of the behavior response to early Life immune stimulation: Microglia and astrocytes involvement. Physiol. Behav. 199: 386–394. 2019.
Mello B.S.F., Chaves Filho A.J.M., Custódio C.S., Cordeiro R.C., Miyajima F., de Sousa F.C.F., Vasconcelos S.M.M., de Lucena D.F., Macedo D. Sex influences in behavior and brain inflammatory and oxidative alterations in mice submitted to lipopolysaccharide-induced inflammatory model of depression. J. Neuroimmunol. 320: 133–142. 2018.
Bernardi M.M., Teixeira L.P., Ligeiro-de-Oliveira A.P., Tavares-de-Lima W., Palermo-Neto J., Kirsten T.B. Neonatal lipopolysaccharide exposure induces sexually dimorphic sickness behavior in adult rats. Psychol. Neurosci. 7(2): 113–123. 2014.
Pitychoutis P.M., Nakamura K., Tsonis P.A., Papadopoulou-Daifoti Z. Neurochemical and behavioral alterations in aninflammatory model of depression: sex differences exposed. Neuroscience. 159(4): 1216–1232. 2009.
Millett C.E., Phillips B.E., Saunders E.F.H. The Sex-specific effects of LPS on depressive-like behavior and oxidative stress in the hippocampus of the mouse. Neuroscience. 399: 77–88. 2019.
Павлова И.В., Рысакова М.П. Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн. высш. нерв. деят. им. И.П. Павлова. 65(6): 719–735. 2015. [Pavlova I.V., Rysakova M.P. The manifestation of the anxiety during fear conditioning in wistar rats. Zh. Vyssh. Nerv. Deiat. im. I.P. Pavlova. 65(6): 719–735. 2015. (In Russ)].
Porsolt R.D., Anton G., Blavet N., Jalfre M. Behavioral despair in rats: a new model sensitive to antidepressant treatments. Eur. J. Pharmacol. 47: 379–391. 1978.
Stepanichev M.Y., Tishkina A.O., Novikova M.R., Levshina I.P., Freiman S.V., Onufriev M.V., Levchenko O.A., Lazareva N.A., Gulyaeva N.V. Anhedonia but not passive floating is an indicator of depressive-like behavior in two chronic stress paradigms. Acta Neurobiol. Exp. 76(4): 324–333. 2016.
Doenni V.M., Gray J.M., Song C.M., Patel S., Hill M.N., Pittman Q.J. Deficient adolescent social behavior following early-life inflammation is ameliorated by augmentation of anandamide signaling. Brain Behav. Immun. 58: 237–247. 2016.
Opendak M., Gould E., Sullivan R. Early life adversity during the infant sensitive period for attachment: Programming of behavioral neurobiology of threat processing and social behavior. Dev. Cogn. Neurosci. 25:145–159. 2017.
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов, и нейротрофических факторов в генезе депрессивных расстройств. Успехи физиол. наук. 44(2): 3–20. 2014. [Grigoryan G.A., Dygalo N.N., Geht A.B., Stepanichev M.Yu., Gulyaeva N.V. Molecular cellular mechanisms of depression. The role of glucocorticoids, cytokines, and neurotrophic factors in the genesis of depressive disorders. Usp. Physiol. Nauk. 44(2): 3–20. 2014. (In Russ)].
Peña C.J., Smith M., Ramakrishnan A., Cates H.M., Bagot R.C., Kronman H.G., Patel B., Chang A.B., Purushothaman I., Dudley J., Morishita H., Shen L., Nestler E.J. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat. Commun. 10(1): 5098. 2019.
Bilbo S.D., Newsum N.J., Sprunger D.B., Watkins L.R., Rudy J.W., Maier SF. Differential effects of neonatal handling on early life infection-induced alterations in cognition in adulthood. Brain Behav. Immun.21(3): 332–342. 2007.
Dang R., Guo Y.Y., Zhang K., Jiang P., Zhao M.G. Predictable chronic mild stress promotes recovery from LPS-induced depression. Mol. Brain. 12(1): 42. 2019.
Harrison E.L., Baune B.T. Modulation of early stress-induced neurobiological changes: a review of behavioural and pharmacological interventions in animal models. Transl. Psychiatry. 4: 390. 2014.
Huang T.Y., Lin C.H. A comparison between chronic exercise training and desipramine as treatments for the depression-like behavior of early-life maternal deprivation rats. Neurosci. Lett. 480: 201–205. 2010.
Bilbo S.D., Schwarz J.M.: The immune system and developmental programming of brain and behavior. Front. Neuroendocrinol. 33: 267–286. 2012.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier SF. Neuroinflammatory priming to stress is differentially regulated in male and female rats. Brain Behav. Immun. 70: 257–267. 2018.
Villapol S., Faivre V., Joshi P., Moretti R., Besson V.C., Charriaut-Marlangue C. Early Sex Differences in the Immune-Inflammatory Responses to Neonatal Ischemic Stroke. Int. J. Mol. Sci. 20(15).2019. pii: E3809. https://doi.org/10.3390/ijms20153809
Adzic M., Djordjevic J., Mitic M., Brkic Z., Lukic I., Radojcic M. The contribution of hypothalamic neuroendocrine, neuroplastic and neuroinflammatory processes to lipopolysaccharide-induced depressive-like behaviour in female and male rats: Involvement of glucocorticoid receptor and C/EBP-β. Behav. Brain Res. 291: 130–139. 2015.
Bodhankar S., Lapato A., Chen Y., Vandenbark A.A., Saugstad J.A., Offner H. Role for microglia in sex differences after ischemic stroke: importance of M2. Metab. Brain Dis. (30): 1515–1529. 2015.
Vegeto E., Bonincontro C., Pollio G., Sala A., Viappiani S., Nardi F., Brusadelli A., Viviani B., Ciana P., Maggi A. Estrogen prevents the lipopolysaccharide-induced inflammatory response in microglia. J. Neurosci. 21(6): 1809–1818. 2001.
Villa A., Vegeto E., Poletti A., Maggi A. Estrogens, neuroinflammation, and neurodegeneration. Endocr. Rev. 37(4): 372–402. 2016.
Sárvári M., Kalló I., Hrabovszky E., Solymosi N., Liposits Z. Ovariectomy and subsequent treatment with estrogen receptor agonists tune the innate immune system of the hippocampus in middle-aged female rats. PLoS One. 9(2): e88540. 2014.
Barth C., Villringer A., Sacher J. Sex hormones affect neurotransmitters and shape the adult female brain during hormonal transition periods. Front. Neurosci. 9: 37. 2015. https://doi.org/10.3389/fnins.2015.00037
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


