Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1132-1143
Влияние экзогенного фибрин-мономера на гемостатический потенциал и образование фибрина в области дозированной травмы печени в эксперименте
В. М. Вдовин 1, 3, *, А. П. Момот 1, 2, 3, Д. А. Орехов 4, И. П. Бобров 1, Д. А. Момот 1, И. И. Шахматов 1, 3, В. О. Красюкова 1, В. Е. Чернусь 1, В. В. Теряев 1, Н. А. Лычёва 3, С. В. Москаленко 1
1 Алтайский государственный медицинский университет
Барнаул, Россия
2 Алтайский филиал ФГБУ Национальный медицинский исследовательский центр гематологии
Барнаул, Россия
3 Научно-исследовательский институт физиологии и фундаментальной медицины
Новосибирск, Россия
4 Алтайский краевой кардиологический диспансер
Барнаул, Россия
* E-mail: erytrab@gmail.com
Поступила в редакцию 17.03.2020
После доработки 14.04.2020
Принята к публикации 05.05.2020
Аннотация
В работе изучен гемостатический потенциал крови и морфологическая картина раны печени при профилактическом в/в введении фибрин-мономера (ФМ) в дозах 0.25 и 2.5 мг/кг на модели дозированной травмы у кроликов породы Шиншилла. Установлено, что обе дозы ФМ приводили в равной степени к снижению посттравматической кровопотери, однако, усиление гемостатического потенциала в системной циркуляции было присуще лишь дозе 2.5 мг/кг (по увеличению уровня D-димера и уплотнению сгустка по данным тромбоэластометрии). При этом усиления генерации тромбина в кровотоке на обеих дозах ФМ отмечено не было. В ходе морфологических исследований выявлен феномен многократного усиления фибринообразования в области раны, более выраженный при использовании высокой дозы ФМ.
Фибрин-мономер (дез-ААВВ-фибриноген, ФМ), хорошо известен как продукт действия тромбина на фибриноген и источник фибрина [1–3], он рассматривается и как регуляторная молекула, способная влиять на агрегационную активность тромбоцитов [4–8] и эритроцитов [9].
В наших ранее проведенных исследованиях показано, что ФМ способен минимизировать посттравматическое кровотечение при его профилактическом внутривенном введении [10, 11]. Данные эксперименты были направлены на поиск эффективных гемостатических доз ФМ (в диапазоне от 0.1 до 5.0 мг/кг), по результатам которых дозировка 0.25 мг/кг была определена как терапевтическая (не влияющая на показатели системы гемостаза по результатам исследования плазмы венозной крови). Использование доз ФМ от 2.5 мг/кг и выше влекло за собой тромботические события, включая летальные исходы, связанные с внутрисосудистым свертыванием крови. Эти дозы были определены как токсические. Уменьшение кровопотери на фоне применения токсических доз ФМ в 6.7 раза (в % объема циркулирующей крови – ОЦК) по сравнению с плацебо вполне прогнозируемо, однако близкая по результатам эффективность терапевтической дозы изучаемого производного фибриногена (0.25 мг/кг) пока не нашла своего объяснения. На наш взгляд, дополнительную информацию о механизмах последнего явления могут предоставить сравнительные исследования результатов применения разных доз ФМ с помощью современных интегральных методов исследования системы гемостаза и оценка морфологической картины, а также особенностей тромбообразования в месте нанесения дозированной травмы печени.
Учитывая изложенное, целью настоящего исследования явилось изучение особенностей гемостатического потенциала в системной циркуляции, а также морфологических проявлений последствий применения терапевтической и токсической доз фибрин-мономера при его внутривенном введении перед дозированной травмой печени в эксперименте.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования были проведены на 67 здоровых половозрелых кроликах-самцах породы Шиншилла массой 3.0–4.5 кг, эти животные являются наиболее подходящим видом биологических объектов для данного рода исследований [12]. Экспериментальные животные были получены из вивария Института цитологии и генетики Сибирского отделения Российской академии наук (г. Новосибирск) и до начала эксперимента содержались в стандартных условиях в соответствии с СП 2.2.1.3218-14 Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев).
При помощи генератора случайных чисел методом простой рандомизации из животных были сформированы 3 экспериментальные группы (дизайн исследования – см. рис. 1).
Рис. 1.
Дизайн эксперимента. ФМ – фибрин-мономер. Fig. 1. Design of the experiment. FM – fibrin monomer.
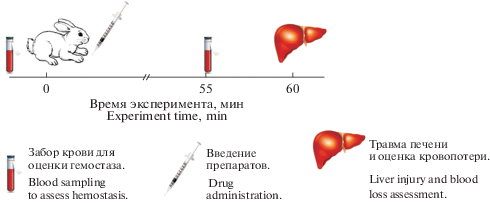
Животным группы 1 (n = 21) в краевую вену уха (внутривенно, в/в) при помощи иглы-катетера Cathy (фирма HMD) вводили водный раствор плацебо (4.0 М раствор мочевины, соответствующий ее концентрации в растворе ФМ), объемом 0.5 мл. Животным группы 2 (n = 25) и 3 (n = 21) аналогичным образом вводили водный раствор ФМ (фирма Технология-Стандарт, Россия) в дозах 0.25 и 2.5 мг/кг соответственно.
Спустя один час после в/в введения ФМ или плацебо предварительно наркотизированным животным (общая анестезия препаратом Телазол, фирма Зоэтис, Россия, внутривенно в дозе 10 мг/кг) наносилась дозированная травма печени в соответствии с имеющимися рекомендациями [13]. Затем с помощью стерильных марлевых салфеток оценивался характер паренхиматозного кровотечения – по расчетному объему кровопотери в % от ОЦК с учетом массы тела животного [14] и темпу кровопотери в единицу времени (мг/с) [12]. Животных выводили из эксперимента после прекращения кровотечения из раны путем введения анестетика в летальной дозе (в 3–4 раза превышающей терапевтическую) [15].
Для исследования системы гемостаза кровь получали из краевой вены уха (самотеком) после флеботомии [13]. Эту процедуру проводили дважды: непосредственно перед в/в введением препаратов, а также спустя 55 мин после инъекции ФМ или плацебо – перед нанесением дозированной травмы печени (см. рис. 1). Кровь помещали в полистироловые центрифужные градуированные пробирки с полихлорвиниловыми крышками, содержащими 0.11 М (3.8%) раствор цитрата натрия (соотношение крови и стабилизатора 9 : 1), в объеме 5.0 мл, при этом первые 3–4 капли крови отбрасывали. Часть стабилизированной крови отбирали для проведения тромбоэластометрии, остальную порцию крови центрифугировали при 1200 g в течение 15 мин для получения обедненной тромбоцитами плазмы крови.
Эксперименты на животных проводили в соответствии с принципами Базельской декларации, Европейской конвенции и директивами по охране позвоночных животных, используемых в эксперименте 86/609/ЕЕС, а также Хельсинской декларацией и Правилами проведения работ с использованием экспериментальных животных [16]. Работа была одобрена локальным этическим комитетом ФГБОУ ВО Алтайский государственный медицинский университет МЗ РФ (протокол № 12 от 12.11.2015 г.).
Исследование системы гемостаза включало в себя определение уровня D-димера в плазме крови при помощи тест-системы NycoCard® D-Dimer (фирма Axis-Shield PoC AS, Норвегия) и анализатора-рефлектометра NycoCard Rader II. В число использованных интегральных методов исследования системы гемостаза вошли:
1) Оценка генерации тромбина методом калиброванной автоматизированной тромбографии по Hemker с использованием планшетного флуориметра Fluoroskan Ascent при длине волны 390 нм (фирма ThermoFisher SCIENTIFIC, Финляндия), с программным обеспечением Thrombinoscopeтм 3.0.0.26 и наборами реагентов фирмы Thrombinoscope® bv (Нидерланды) (PPP-Reagent, Thrombin Calibrator, FluCa-Kit). Исследование плазмы крови осуществлялась в 96-луночном планшете типа Immulon 2HB (фирма ThermoFisher SCIENTIFIC, США).
2) Тромбоэластометрия стабилизированной цитратом крови на приборе тромбоэластометре ROTEM® Gamma (фирма Pentapharm GmbH, Германия), с реагентом Startem в режиме Natem.
После остановки кровотечения для гистологического исследования у животных забиралась ткань печени, включая всю раневую часть и фрагмент неповрежденной поверхности. Материал помещали в гистологические кассеты, маркировали и фиксировали в 10%-ном растворе нейтрального формалина по Лилли. Проводку материала осуществляли по изопропиловому спирту с помощью автомата проводки карусельного типа TISSUE-TEK VI PTM6 (фирма Sakkura, Япония), заливали материал в парафин (фирма BiOvitrum, Россия) при помощи станции парафиновой заливки TISSUE-TEK TEC 5 (фирма Sakkura, Япония). Гистологические срезы толщиной 4–5 мкм получали с использованием полуавтоматического роторного микротома Accu-Cut SRM (фирма Sakkura, Япония), окрашивали препараты гематоксилином и эозином в автомате для автоматической окраски микропрепаратов TISSUE-TEK Prisma (фирма Sakkura, Япония), заключали препараты под пленку в автомате для автоматического заключения микропрепаратов TISSUE-TEK Film (фирма Sakkura, Япония). Для определения фибрина срезы окрашивали по Маллори. Морфометрические измерения проводили с помощью лицензионного пакета морфометрических программ ВидиоТест – Морфология 5.2 (фирма ВидиоТест, Россия).
Распределение признаков в выборках оценивали по критерию Шапиро–Уилки. В зависимости от распределения признаков применяли t-критерий Стьюдента, U-критерий Манна–Уитни или W-критерий Вилкоксона. Различия считали статистически значимыми при p ≤ 0.05. Обработку экспериментальных данных проводили с использованием статистической программы MedCalc Version 17.9.7 (лицензия BU556-Р12YT-BBS55-YAH5M-UBE51). Результаты представлены в виде медианы (Ме), 25-го и 75-го перцентилей (Q): Ме [Q25–Q75].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При исследовании гемостатических свойств препаратов было установлено, что объем кровопотери в группах животных после в/в введения ФМ в дозе 0.25 мг/кг (группа 2) и ФМ в дозе 2.5 мг/кг (группа 3) оказался в 5.6 раза (1.8 [1.0–3.5] в % ОЦК) и в 6.7 раза (1.5 [1.0–3.0] по тому же показателю меньше в сравнении с группой плацебо (группа 1) (10.1 [4.3–16.3] (рис. 2А).
Рис. 2.
Сравнительный анализ параметров кровопотери у экспериментальных животных после дозированной травмы печени. Значения представлены в виде медианы – горизонтальной линии внутри прямоугольника, включающего 50% полученных значений и значений, соответствующих 2.5 и 97.5 перцентилей – нижний и верхний вертикальные бары. Fig. 2. Comparative analysis of blood loss parameters in experimental animals after dosed liver injury. The values are represented as a median – a horizontal line inside the rectangle, including 50% of the obtained values and values corresponding to 2.5 and 97.5 percentiles – lower and upper vertical bars.
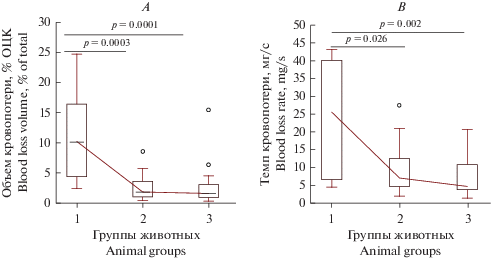
Аналогичная динамика наблюдалась и с показателем темпа кровопотери (рис. 2B), который снижался в группе 2 в 3.6 раза (7.1 [4.7–12.5] мг/с) и в 5.5 раз в группе 3 (4.7 [3, 8, 8, 9 ] мг/с) по сравнению с группой 1 (25.7 [7.1–36.5] мг/с).
Полученные данные при оценке cистемы гемостаза у животных приведены в табл. 1–3.
Как видно из табл. 1, изменений показателей генерации тромбина после введения плацебо или сопоставляемых доз ФМ в сравнении с исходными значениями (до введения препаратов ФМ) найдено не было.
Таблица 1.
Изменения показателей тромбограммы у групп животных на фоне введения ФМ и плацебо Table 1. Changes in thrombogram indicators in animal groups against the background of introduction of FM and placebo
| Показатели Indicators |
Группа 1 Group 1 | Группа 2 Group 2 | Группа 3 Group 3 | |||
|---|---|---|---|---|---|---|
| до введения плацебо (1а) before the introduction of placebo (1а) |
после введения плацебо (1б) after the introduction of placebo (1b) |
до введения ФМ (2а) before the introduction of FM (2а) |
после введения ФМ (2б) after the introduction of FM (2b) |
до введения ФМ (3а) before the introduction of FM (3а) |
после введения ФМ (3б) after the introduction of FM (3b) |
|
| Lagtime, мин (min) | 2.2 [2.0–2.7] |
2.0 [1.8–2.7 ] |
2.3 [2.0–2.4] |
2.2 [2.0–2.7] |
2.0 [1.8–2.1] |
2.1 [1. 8. 2. 2 ] |
| р1а–1б = 0.068 | р2а–2б = 0.208 | р3а–3б = 0.293 | ||||
| ETP,
нмоль мин (nmol min) |
373.9 [338.7–500.4] |
484.8 [360.6–622.5] |
421.8 [406.4–461.5] |
423.4 [380.5–451.9] |
422.6 [372.2–446.8] |
435.3 [385.0–470.3] |
| р1а–1б = 0.224 | р2а–2б = 0.702 | р3а–3б = 0.617 | ||||
| Peak thrombin, нмоль (nmol) | 76.2 [40.7–90.9] |
81.7 [34.3–138.8] |
78.3 [55.2–103.9] |
73.1 [58.5–91.2] |
58.1 [49.6–67.4] |
62.4 [50.0–82.6] |
| р1а–1б = 0.128 | р2а–2б = 0.540 | р3а-3б = 0.309 | ||||
| ttPeak, мин (min) | 5.8 [5.0–7.3] |
5.4 [4.6–6.3 ] |
4.9 [4.5–6.3 ] |
5.8 [4.6–7.3 ] |
4.5 [3.8–5.3 ] |
5.0 [4.3–5.8 ] |
| р1а–1б = 0.143 | р2а–2б = 0.299 | р3а–3б = 0.158 | ||||
| V, нмоль/мин (nmol/min) | 25.3 [9.2–29.1 ] |
26.8 [7.8–62.2 ] |
26.5 [17.0–40.9] |
23.3 [15.0–36.5] |
21.1 [17.9–29.6 ] |
23.4 [12.7–33.0] |
| р1а–1б = 0.102 | р2а–2б = 0.534 | р3а–3б = 0.831 | ||||
Lagtime – время инициации образования тромбина; ETP – эндогенный тромбиновый потенциал; Peak thrombin – пиковая концентрация тромбина; ttPeak – время достижения пиковой концентрации тромбина; V – скорость образования тромбина. Lagtime – thrombin initiation time; ETP – endogenous thrombin potential; Peak thrombin – peak thrombin concentration; ttPeak – time of reaching peak thrombin concentration; V – thrombin formation speed.
Таблица 2.
Изменения показателей тромбоэластограммы у животных на фоне введения ФМ и плацебо Table 2. Changes in thromboelastogram indicators in animals against the background of introduction of FM and placebo
| Показатели Indicators |
Группа 1 Group 1 | Группа 2 Group 2 | Группа 3 Group 3 | |||
|---|---|---|---|---|---|---|
| до введения плацебо (1а) before the introduction of placebo (1а) |
после введения плацебо (1б) after the introduction of placebo (1b) |
до введения ФМ (2а) before the introduction of FM (2а) |
после введения ФМ (2б) after the introduction of FM (2b) |
до введения ФМ (3а) before the introduction of FM (3а) |
после введения ФМ (3б) after the introduction of FM (3b) |
|
| CT, с (s) | 605.5 453.8–801.5] |
628.0 [479.0–856.0] |
636.5 [440.3–799.8] |
472.5 [380.3–727.5] |
602.0 [431.8–772.8] |
470.0 [344.0–665.5] |
| р1а–1б = 0.980 | р2а–2б = 0.150 | р3а–3б = 0.033 ∆ +22% | ||||
| угол α, град. (angle α, gr.) |
57.0 [46.5–62.0] |
55.0 [49.0–65.0] |
53.0 [45.5–62.8 ] |
54.0 [46.8–61.0] |
53.5 [46.8–57.3 ] |
53.0 [47.5–67.0] |
| p = 0.207 | р2а–2б = 0.958 | р3а–3б = 0.135 | ||||
| CFT, с (s) | 182.5 [148.8–269.3] | 206.0 [146.0–254.0] |
240.5 [141.0–285.5] |
206.0 [157.5–271.3] |
227.0 [183.3–274.3] |
202.0 [122.0–279.5] |
| р1а–1б = 0.288 | р2а–2б = 0.749 | р3а–3б = 0.205 | ||||
| MCF, мм (mm) | 59.5 [56.0–64.3] |
58.0 [54.0–64.0] |
56.5 [51.5–63.8 ] |
59.5 [53.3–62.8 ] |
59.0 [55.0–60.0] |
63.0 [53.5–67.5] |
| р1а–1б = 0.956 | р2а–2б = 0.808 | р3а–3б = 0.012 ∆ +7% | ||||
| А10, мм (mm) | 44.0 [40.8–52.5 ] |
43.0 [39.0–50.0] |
42.0 [34.8–51.3 ] |
45.0 [38.5–51.0] |
43.5 [37. 3–49. 5 ] |
45.0 [40.5–58.5 ] |
| р1а–1б = 0.422 | р2а–2б = 0.563 | р3а–3б = 0.015 ∆ +4% | ||||
CT – время начала коагуляции; угол α – амплитуда сгустка; CFT – время образования сгустка; MCF – максимальная твердость сгустка; А10 – амплитуда сгустка через 10 минут; здесь, а также в табл. 3 и 4 Δ – разница показателей. CT – coagulation time; angle α – clot amplitude; CFT – clot formation time; MCF – maximum clot firmness; A10 – clot amplitude after 10 minutes; here and in Tabl. 3 and 4, Δ – differences of indicators.
Таблица 3.
Особенности содержания в плазме крови D-димера у животных на фоне введения ФМ и плацебо Table 3. Features of D-dimer blood plasma content in animals against the background of introduction of FM and placebo
| Показатели Indicators |
Группа 1 Group 1 | Группа 2 Group 2 | Группа 3 Group 3 | |||
|---|---|---|---|---|---|---|
| до введения плацебо (1а) before the introduction of placebo (1а) |
после введения плацебо (1б) after the introduction of placebo (1b) |
до введения ФМ (2а) before the introduction of FM (2а) |
после введения ФМ (2б) after the introduction of FM (2b) |
до введения ФМ (3а) before the introduction of FM (3а) |
после введения ФМ (3б) after the introduction of FM (3b) |
|
| Уровень
D-димера, нг/мл (Level D-dimer, ng/ml) |
100.0 [100.0–100.0] |
100.0 [100.0–200.0] |
100.0 [100.0–100.0] |
100.0 [100.0–200.0] |
100.0 [100.0–200.0] |
750.0 [425.0–1250.0] |
| р1а–1б = 0.201 | р2а–2б = 0.201 | р3а–3б = 0.00001 ∆ в 7.5 раз |
||||
В то же время, по данным тромбоэластометрии крови, введение ФМ в дозе 2.5 мг/кг (группа 3) сопровождалось гиперкоагуляционным сдвигом (по показателю СТ), а также умеренным, но статистически значимым повышением плотностных характеристик фибринового сгустка (по показателям MCF и A10), что не было свойственно для животных, получивших плацебо (группа 1) или ФМ в дозе 0.25 мг/кг (группа 2) (табл. 2). Отметим, что такое повышение плотности кровяного сгустка в группе 3 сочеталось с 7.5-кратным увеличением уровня D-димера в плазме крови животных (табл. 3).
Для оценки морфологических проявлений последствий использования терапевтической и токсической доз ФМ при его внутривенном введении были исследованы срезы раневой поверхности печени, полученной после спонтанной остановки посттравматического кровотечения.
В группе плацебо (группа 1) при макроскопическом анализе ткани печени (рис. 3А) определялись тонкие, гладкие, розоватого цвета, блестящие тромботические массы. При микроскопическом исследовании (рис. 3B) тромботические отложения были представлены в виде тонких нитей фибрина и большого количества неизмененных эритроцитов. Эти отложения характеризовались тонкими розового цвета нитями фибрина, располагавшимися преимущественно параллельно поверхности печени, образуя редкие анастомозы. При морфометрическом анализе толщина волокон фибрина варьировала от 0.09 до 1.50 мкм (табл. 4).
Рис. 3.
Морфологическая картина раны печени кролика группы 1 (плацебо) после остановки кровотечения (описание в тексте). А – окраска гематоксилином и эозином, увеличение ×40. B – окраска на фибрин по Маллори, увеличение ×400. Здесь, а также на рис. 4 и 5 обозначение “F” – фибрин. Fig. 3. Morphological pattern of the wound of the rabbit liver in group 1 (placebo) after bleeding stop (description in the text). A – staining with haematoxylin and eosin, zoom ×40. B – Mallory’s fibrin staining, zoom ×400. Here, as well as in Fig. 4 and 5 the symbol “F” is fibrin.
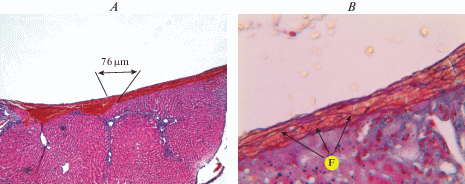
Таблица 4.
Показатели морфометрического исследования тромботических масс Table 4. Indicators of morphometric study of thrombotic masses
| Показатели Indicators |
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
|---|---|---|---|
| Толщина тромботических масс, мкм Thickness of thrombotic masses, μm |
66.2 [62.7–83.5] | 314.4 [284.8–348.3] | 328.8 [221.6–425.0] |
| р1–2 = 0.0007; ∆×4.8 | р1–3 = 0.0007; ∆×5.0 р2–3 = 0.794 |
||
| Толщина нитей фибрина, мкм Thickness of fibrin strands, μm |
0.83 [0.72–0.93] | 1.68 [1.16–2.21 ] | 2.63 [1.95–3.65] |
| р1–2 = 0.000004; ∆×2.0 | р1–3 = 0.000004; ∆×3.2 р2–3 = 0.0003; ∆×1.6 |
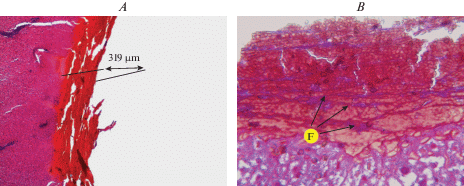
У животных, получавших ФМ в дозе 0.25 мг/кг (группа 2) морфологическая картина места повреждения печени имела значительные отличия от предыдущей – см. рис. 4. Макроскопически найдены массивные “бугристые” тромботические наложения буроватого цвета (рис. 4А). При микроскопии тромботические массы состояли из нитей фибрина, включающих в свой состав большое количество преимущественно гемолизированных эритроцитов (рис. 4B). Толщина тромботических наложений значимо превышала (в 4.8 раза) аналогичный показатель в группе плацебо (табл. 4).
Рис. 4.
Морфологическая картина раны печени кролика группы 2 (ФМ 0.25 мг/кг) после остановки кровотечения (описание в тексте). А – окраска гематоксилином и эозином, увеличение ×40. B – окраска на фибрин по Маллори, увеличение ×400. Fig. 4. Morphological pattern of the wound of the rabbit liver in group 2 (FM 0.25 mg/kg) after bleeding stop (description in the text). A – staining with haematoxylin and eosin, zoom ×40. B – Mallory’s fibrin staining, zoom ×400.

Нити фибрина располагались в различных направлениях и, как правило, имели вид развитых сетей с характерными многочисленными анастомозами. Толщина нитей фибрина в 2 раза превышала аналогичный показатель группы № 1, с пределами колебаний толщины от 0.65 до 4.1 мкм (табл. 4).
В группе животных 3, получавших ФМ в дозе 2.5 мг/кг, определяли аналогичную макроскопическую картину, что и в группе 2 (рис. 5А). Однако толщина тромботических масс уже в 5 раз превышала аналогичный показатель, определенный в группе 1. При этом статистически значимых отличий по сравнению с группой 2 получено не было (табл. 4). При микроскопии отмечалось наличие толстых, грубых нитей фибрина на фоне большого количества гемолизированных эритроцитов (рис. 5B). Нити фибрина располагались в различных направлениях, были видны их значительные утолщения и анастомозы. Толщина нитей в 1.6 раза превышала аналогичный показатель в группе 2 и в 3.2 раза отличалась от группы 1.
Рис. 5.
Морфологическая картина раны печени кролика группы 3 (ФМ 2.5 мг/кг) после остановки кровотечения (описание в тексте). А – окраска гематоксилином и эозином, увеличение ×40. B – окраска на фибрин по Маллори, увеличение ×400. Fig. 5. Morphological pattern of the wound of the rabbit liver in group 3 (FM 2.5 mg/kg) after bleeding stop (description in the text). A – staining with haematoxylin and eosin, zoom ×40. B – Mallory’s fibrin staining, zoom ×400.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Обе использованные дозы ФМ (терапевтическая и токсическая) приводили к снижению показателей кровопотери примерно в равной степени, однако усилению гемостатического потенциала в системной циркуляции способствовала лишь доза 2.5 мг/кг. Последнее иллюстрировалось гиперкоагуляционным сдвигом и увеличением плотности фибринового сгустка (по данным тромбоэластометрии), а также многократным ростом уровня D-димера – маркера состоявшегося образования фибрина и сопутствующего фибринолиза. Интересно, что при использовании как низкой, так и высокой доз ФМ не было найдено усиление генерации тромбина в тесте калиброванной тромбографии. Следовательно, полученные гемостатические эффекты не были связаны с усилением тромбинообразования, и их можно отнести на счет локальных неферментативных реакций конечного этапа свертывания крови, а именно – полимеризации/самосборки вводимого извне ФМ (дез-ААВВ-фибриногена) на раневой поверхности печени. Эти соображения подтверждаются приростом толщины тромботических масс в 4.8 раза (использование ФМ в дозе 0.25 мг/кг) и в 5.0 раз (ФМ в дозе 2.5 мг/кг) по сравнению с плацебо, где остановка кровотечения была опосредована лишь известными системными реакциями превращения фибриногена в фибрин. Кроме того, обращает на себя внимание разница в толщине волокон фибрина, которая была по медиане в 2.0–3.2 раза больше в группах животных, получивших экзогенный ФМ. Данный факт согласуется с ранее выполненными исследованиями, где описана обратная связь между толщиной фибриновых волокон и концентрацией тромбина. Так, Wolberg в экспериментах in vitro показала, что концентрация тромбина оказывает значительное влияние на структуру формирующегося фибрина при взаимодействии фибриногена и тромбина [17]. В частности, при добавлении низких концентраций тромбина к фибриногену образуются массы, состоящие преимущественно из толстых фибриновых волокон, увеличивающих пористость геля. Напротив, в присутствии высоких концентраций тромбина сгустки состоят из тонких и коротких волокон фибрина, относительно устойчивых к фибринолизу [17–20].
Возникает вопрос – насколько значительна создаваемая концентрация экзогенного ФМ при введении его в дозе 0.25 мг/кг, обуславливающая увеличение в 4.8 раза толщину тромботических отложений в области травмы и обеспечение критического снижения объема кровопотери (в 5.6 раза)?
Как известно, в условиях физиологической нормы ФМ присутствует в плазме крови человека в концентрации до 7.0 мкг/мл и может увеличиваться до 50 и более мкг/мл при внутрисосудистом свертывании крови [3, 21].
Учитывая среднюю величину объема циркулирующей крови и уровень гематокрита у животных [14], можно рассчитать, что после в/в введения ФМ в дозе 0.25 мг/кг его концентрация в плазме крови животного составит от 5.6 до 8.9 мкг/мл.
Данное обстоятельство свидетельствует о том, что вводимый ФМ сам по себе вряд ли способен формировать основу кровяного сгустка в месте травмы при свободном распределении в кровотоке.
Исходя из сказанного возникает следующий вопрос – каким образом экзогенный ФМ (в дозе 0.25 мг/кг) накапливается в месте повреждения для обеспечения эффективного тромбообразования?
При ответе можно отметить, что представления о механизмах реализации гемостатических реакций в последние годы претерпели значительные изменения в свете развития современной теории клеточной модели свертывания крови [22–27]. Данная теория описывает взаимодействие клеток крови и факторов свертывания в процессе образования кровяного сгустка. В частности, имеются работы, указывающие на способность ФМ усиливать агрегационную активность тромбоцитов [4–8], а также эритроцитов [9]. Как известно, ФМ имеет схожую структуру с фибриногеном, отличаясь от последнего отсутствием четырех фибринопептидов (2А и 2В) [1]. При этом локусы связывания фибриногена с рецептором тромбоцитов GP IIb/IIIа после действия тромбина на молекулу данного белка остаются неизменными в самой молекуле ФМ и находятся на С-конце γ-цепи (консервативная последовательность Лиз-Глн-Ала-Гли-Асп-Вал в положении 400–411) [1, 28] и α-цепи (трипептид Арг-Гли-Асп в положении 572–574) [1, 29, 30]. Таким образом, ФМ потенциально способен образовывать фибриноподобные мостики между тромбоцитами, стимулируя их прямые функции. Кроме того, известно, что в присутствии тромбина и коллагена тромбоциты способны “отдавать” в плазму крови микровезикулы, содержащие рецептор IIb/IIIа, взаимодействующий с фибрином, фибриногеном и фибронектином [31, 32].
Учитывая и суммируя сказанное можно отметить, что ФМ, как и фибриноген, может образовывать связи с тромбоцитами, которые, вероятно, способны транспортировать данный белок к месту повреждения тканей. Следует также учесть, что поврежденный эндотелий кровеносных сосудов активно экспрессирует на своей поверхности интегрин, схожий по строению с тромбоцитарным GP IIb/IIIа, участвующий не только в адгезии тромбоцитов в области травмы, но и в связывании с фибриногеном, и, возможно, с ФМ [26, 33].
Интерполируя эти данные, можно констатировать, что отчетливый гемостатический эффект ФМ, проанализированный в настоящей работе, реализуется на фоне низкой генерации тромбина как в системной циркуляции (по данным теста генерации тромбина), так и в ране (по морфологическим признакам, описывающим толщину нитей фибрина), что открывает дополнительные пути при создании принципиально новых гемостатических препаратов системного действия.
ЗАКЛЮЧЕНИЕ
Полученные результаты продемонстрировали усиление гемостатического потенциала в системной циркуляции ФМ, взятого в дозе 2.5 мг/кг (токсической) и отсутствие такого эффекта в случае использования дозы ФМ в 0.25 мг/кг (терапевтической) при сходных достижениях по уменьшению посттравматической кровопотери. При морфологических исследованиях выявлен феномен усиления фибринообразования в ране без признаков повышенной (по сравнению с плацебо) генерации тромбина. Остается вопрос о механизмах накопления экзогенного ФМ в области травмы печени, ответ на который может быть найден в ходе дальнейших экспериментов с фармакологическим подавлением функции тромбоцитов.
Список литературы
Зубаиров Д.М. Молекулярные основы свертывания крови и тромбообразования. Казань. Фэн. 2000. [Zubairov D.M. Molekulyarnie osnovi svertivaniya krovi i tromboobrazovaniya [Molecular basis of blood clotting and thrombus formation]. Kazan. Fen. 2000. (In Russ)].
Weisel J.W., Litvinov R.I. Fibrin Formation, Structure and Properties. Subcell. Biochem. 82: 405–456. 2017.
Refaai M.A., Riley P., Mardovina T., Bell P.D. The Clinical Significance of Fibrin Monomers. Thromb. Haemost. 118(11): 1856–1866. 2018.
Larrieu M.J. Action of fibrinogen degradation products and fibrin monomer soluble complexes on platelet aggregation. Scand. J. Haematol. Suppl. 13: 273–279. 1971.
Пасторова В.Е., Ляпина Л.А., Кудряшов Б.А., Луговской Э.В. Агрегация тромбоцитов, вызываемая фибрин-мономером, и влияние комплексных соединений гепарина с адреналином или плазмином на этот процесс. Гематология и трансфузиология. 7: 5–7. 1990. [Pastorova V.E., Ljapina L.A., Kudrjashov B.A., Lugovskoj Je.V. Platelet aggregation caused by fibrin monomer and the effect of complex compounds of heparin with adrenaline or plasmin on this process. Hematol. and Transfusiol. 7: 5–7. 1990. (In Russ)].
Момот А.П., Суханова Г.А. Агрегация тромбоцитов, индуцированная фибрин-мономером, и ее нарушения при внутрисосудистом свертывании крови. Гематология и трансфузиология. 11: 25–26. 1991. [Momot A.P., Suhanova G.A. Platelet aggregation induced by fibrin monomer and its disorders in intravascular blood clotting. Hematol. and Transfusiol. 11: 25–26. 1991. (In Russ)].
Васильева Т.М., Петрухина Г.Н., Макаров В.А., Момот А.П., Баркаган З.С. Агрегация тромбоцитов человека in vitro при одновременном воздействии фибрин-мономера и некоторых проагрегантов. Проблемы гематологии и переливания крови. 2: 23–26. 2002. [Vasil’eva T.M., Petruhina G.N., Makarov V.A., Momot A.P., Barkagan Z.S. Human platelet aggregation in vitro with simultaneous exposure to fibrin monomer and some proaggregants. Hematology and Blood Transfusion Probl. 2: 23–26. 2002. (In Russ)].
Левин Г.Я., Егорихина М.Н., Тараненко И.А., Момот А.П. Влияние фибрин-мономера на спонтанную агрегацию тромбоцитов. Клин. лаб. диагностика. 3: 39–42. 2011. [Levin G.Ja., Egorihina M.N., Taranenko I.A., Momot A.P. Effect of fibrin monomer on spontaneous platelet aggregation. Clin. Lab. Diagnostics. 3: 39–42. 2011. (In Russ)].
Levin G.Y., Egorihina M.N. Aggregation of erythrocytes in burn disease. Int. J. Burns. Trauma. 1(1): 34–41. 2011.
Момот А.П., Вдовин В.М., Шахматов И.И., Толстокоров И.Г., Орехов Д.А., Шевченко В.О., Лычёва Н.А., Кудинов А.В., Белозерская Г.Г., Киселёв В.И. Системные гемостатические и протромботические эффекты фибрин-мономера в эксперименте при дозированной травме печени. Сибирск. научн. мед. журн. 39(1): 6–12. 2019. [Momot A.P., Vdovin V.M., Shahmatov I.I., Tolstokorov I.G., Orekhov D.A., Shevchenko V.O., Lycheva N.A., Kudinov A.V., Belozerskaja G.G., Kiseljov V.I. Systemic hemostatic and prothrombotic effects of fibrin monomer in the experiment with dosed injury of the liver. Siberian Scientific Med. J. 39(1): 6–12. 2019. (In Russ)].
Вдовин В.М., Момот А.П., Орехов Д.А., Толстокоров И.Г., Шевченко В.О., Красюкова В.О., Шахматов И.И., Лычёва Н. А. Белозерская Г.Г. Время-зависимые системные гемостатические эффекты фибрина-мономера при дозированной травме печени в эксперименте. Казанский мед. журн. 100(2): 257–263. 2019. [Vdovin V.M., Momot A.P., Orekhov D.A., Tolstokorov I.G., Shevchenko V.O., Krasyukova V.O., Shakhmatov I.I., Lycheva N.A., Belozerskaya G.G. Time-dependent systemic hemostatic effects of fibrin monomer in case of a controlled liver injury. Kazan Med. J. 100(2): 257–263. 2019. (In Russ)].
Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Ред. А.Н. Миронов. М. Гриф и К. 2012. [Rukovodstvo po provedeniu doklinicheskih issledovaniy lekarstvenih sredstv [Guidelines for preclinical drug trial]. Part 1. Red. A.N. Mironov. Moscow. Grif and K. 2012. (In Russ)].
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Ред. Р.У. Хабриев. М. Медицина. 2005. [Rukovodstvo po eksperimentalnomu (doklinicheskomu) izucheniyu niovih farmakologicheskih veshchestv [Guidelines for experimental (preclinical) study of new pharmacological substances] Ed. R.U. Habriev. Moscow. Meditsina. 2005. (In Russ)].
Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. Ред. В.Г. Макаров. СПБ. ЛЕМА. 2013. [Spravochnik. Fiziologicheskie, biohimicheskie i biometricheskie pokazateli normi experimentalnih givotnih [Resource guide. Normal physiological, biochemical and biometric parameters in experimental animals]. Red. V.G. Makarov. St. Petersburg. LEMA. 2013. (In Russ)].
Копаладзе Р.А. Методы эвтаназии экспериментальных животных. Этика, эстетика, безопасность персонала. Успехи физиол. наук. 31(3): 79–90. 2000. [Kopaladze R.A. Methods of euthanasia of experimental animals. Ethics, esthetics and personnel safety. Achievements Physiol. Sci. 31(3): 79–90. 2000. (In Russ)].
European convention for the protection of vertebrate animals used for experimental and other scientific purposes. Strasburg. Council of Europe. 1986.
Wolberg A.S. Thrombin generation and fibrin clot structure. Blood Rev. 21(3): 131–142. 2007.
Carr M.E. Jr, Hermans J. Size and density of fibrin fibers from turbidity. Macromolecules. 11(1): 46–50. 1978.
Blombäck B., Carlsson K., Hessel B., Liljeborg A., Procyk R., Aslund N. Native fibrin gel networks observed by 3D microscopy, permeation and turbidity. Biochim. Biophys. Acta. 997(1-2): 96–110. 1989.
Blombäck B., Carlsson K., Fatah K., Hessel B., Procyk R. Fibrin in human plasma: gel architectures governed by rate and nature of fibrinogen activation. Thromb. Res. 75(5): 521–538. 1994.
Петрова О.П., Тарасов Д.Г., Никулина Д.М., Бирюкова Л.А., Мартьянова Ю.Б., Панова Е.В., Мартиросов М.Ю., Грачева Н.П., Жукова Е.Р., Кадыкова А.В. D-димер и фибрин-мономер как маркеры эффективности использования новых оральных антикоагулянтов. Клин. и эксп. хир. журн. им. акад. Б.В. Петровского. 6(3): 64–69 2018. [Petrova O.P., Tarasov D.G., Nikulina D.M., Birjukova L.A., Mart’janova Ju.B., Panova E.V., Martirosov M.Ju., Gracheva N.P., Zhukova E.R., Kadykova A.V. D-dimer and fibrin monomer as markers of efficiency of using new oral anticoagulants. Clin. Exp. Surgery. Petrovsky J. 6(3): 64–69 2018. (In Russ)].
Hoffman M., Monroe D.M. A Cell-based Model of Hemostasis. Thromb. Haemost. 85: 958–965. 2001.
Hoffman M. Remodeling the blood coagulation cascade. J. Thromb. Thrombolysis. 16(1–2): 17–20. 2003.
Папаян Л.П. Новое в представлении процесса свертывания крови. Трансфузиология. 5(1): 7–22. 2004. [Papaian L.P. New in the idea of the blood clotting process. Transfusiology. 5(1): 7–22. 2004. (In Russ)].
Hoffman M., Monroe D.M. Coagulation 2006: a modern view of hemostasis. Hematol. Oncol. Clin. North Am. 21(1): 1–11. 2007.
Кузник Б.И. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии. Чита. Экспресс-издательство. 2010. [Kuznik B.I. Kletochnye i molekuljarnye mehanizmy reguljacii sistemy gemostaza v norme i patologii [Cellular and molecular regulation mechanisms of hemostasis system in health and disease]. Chita. Ehkspress-izdatel’stvo. 2010. (In Russ)].
Ho K.M., Pavey W. Applying the cell-based coagulation model in the management of critical bleeding. Anaesth. Intensive Care. 45(2): 166–176. 2017.
Pierschbacher M.D. Ruoslahti E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule. Nature. 309(5963): 30–33. 1984.
Farrell D.H., Thiagarajan P., Chung D.W., Davie E.W. Role of fibrinogen alpha and gamma chain sites in platelet aggregation. Proc. Natl. Acad. Sci. USA. 89(22): 10729–10732. 1992.
Weisel J.W., Nagaswami C., Vilaire G., Bennett J.S. Examination of the platelet membrane glycoprotein IIb-IIIa complex and its interaction with fibrinogen and other ligands by electron microscopy. J. Biol. Chem. 267(23): 16637–16643. 1992.
Зубаиров Д.М., Зубаирова Л.Д. Микровезикулы в крови. Функции и их роль в тромбообразовании: монография. М. ГЭОТАР-Медиа. 2009. [Zubairov D.M., Zubairova L.D. Mikrovezikuly v krovi. Funkcii i ih rol' v tromboobrazovanii: monografija. [Microvesicles in the blood. Functions and their role in thromboformation: monograph]. GEOTAR-Media. 2009. (In Russ)].
Зубаиров Д.М., Щербатенко-Лушникова Л.А., Андрушко И.А., Габитов С.З., Литвинов Р.И., Кальбина А.В., Воронина И.Е. Диагностика тромбопластинемии при инфаркте миокарда. Терапевт. архив. 53(8): 29–30. 1981. [Zubairov D.M., Shherbatenko-Lushnikova L.A., Andrushko I.A., Gabitov S.Z., Litvinov R.I., Kal’bina A.V., Voronina I.E. Diagnosis of thromboplastinemia in myocardial infarction. Therap. Archive. 53(8): 29–30. 1981. (In Russ)].
Шитикова А.С. Тромбоцитопатии, врожденные и приобретенные. Под ред. Л.П. Папаян, О.Г. Головиной. СПб. ИИЦ ВМА. 2008. [Shitikova A. S. Trombocitopatii, vrozhdennye i priobretennye [Thrombocytopathy, congenital and acquired]. Eds. L.P. Papajan, O.G. Golovinoj. SPb. IIC VMA. 2008. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


