Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1235-1249
Влияние высокофруктозной диеты на физиологические, биохимические и морфологические показатели самок крыс нокаутной линии TAAR9-KO
С. А. Апрятин 1, 2, *, И. С. Жуков 1, 2, А. Л. Манасян 1, Р. З. Муртазина 2, Т. А. Хунагов 3, А. И. Лезина 4, В. М. Клименко 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Институт трансляционной биомедицины, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Московский педагогический государственный университет
Москва, Россия
* E-mail: apryatin@mail.ru
Поступила в редакцию 12.04.2021
После доработки 15.07.2021
Принята к публикации 19.07.2021
Аннотация
Открытие системы следовых аминов и их рецепторов двадцать лет назад дало новые перспективы в изучении моноаминовых систем мозга. Тем не менее, из 6 рецепторов следовых аминов, которые были обнаружены у человека, мышей и крыс, достаточно хорошо изучен только рецептор TAAR1 и его лиганды. Биологические функции остальных 5 рецепторов в настоящее время остаются неизвестными. В ходе данной работы была проведена оценка результатов поведенческих, биохимических и морфологических параметров нокаутной линии крыс TAAR9-KО, получавших 20%-ный раствор фруктозы вместо воды в течение 2 месяцев. Физиологические изменения были исследованы в поведенческих тестах “Открытое поле”, “Приподнятый крестообразный лабиринт” и “Водный лабиринт Морриса”, а также ключевые характеристики микростуктуры груминга. В результате были выявлены существенные различия в поисковой активности, “норковом рефлексе”, терморегуляции, изменения ряда биохимических параметров и накоплении липидов в паренхиме печени у крыс, нокаутных по гену TAAR9.
ВВЕДЕНИЕ
Следовые амины (СА) являются независимой группой эндогенных аминов, которые образуются в различных органах и тканях в результате декарбоксилирования аминокислот. Кроме того, СА образуются при ферментативной или термической обработке продуктов питания с участием микрофлоры желудочно-кишечного тракта [1–3]. Показано, что моноаминовые нейромедиаторы (дофамин, серотонин, норадреналин) метаболизируются с образованием СА [4–7].
С тех пор как в 2001 г. были открыты рецепторы СА [8, 9], данный тип соединений стал рассматриваться как отдельная группа эндогенных моноаминов, обладающих независимым путем рецепции и принимающих участие в патогенезе функциональных нарушений моноаминовых систем, алиментарно-зависимых и других заболеваний [2].
На сегодняшний день у разных видов открыто более 100 рецепторов СА. Для человека выявлено шесть функционально-активных рецепторов – TAAR1, 2, 5, 6, 8, 9 и три псевдогена – TAAR3, 4 и 7 [2, 10].
Одним из наименее изученных подсемейств рецепторов СА у млекопитающих является TAAR9. Информации по биологической функции этого рецептора в настоящее время очень мало. В ряде исследований установлено, как и в случае с ТААR8, что различные популяции лейкоцитов экспрессировали TAAR9 [11, 12]. Показано, что TAAR9 экспрессируется также в селезенке человека [13], в кишечнике мыши [14], гипофизе и скелетных мышцах человека [15].
Одним из современных и хорошо зарекомендовавших себя методов выявления новых физиологических и метаболических функций генов является применение метаболической нагрузки в виде кормления высококалорийными рационами или поения растворами простых углеводов нокаутных по изучаемом гену линий лабораторных животных [11, 14].
Таким образом, целью исследования явилось изучение влияния высокофруктозного рациона на поведенческие, биохимические и морфологические параметры крыс нокаутной линии TAAR9-KO.
МЕТОДЫ ИССЛЕДОВАНИЯ
Лабораторные животные
В исследовании использовались самки крыс нокаутной линии TAAR9-KO и контрольныe животные (“дикий тип”, WT, аутбредная линия Spague-Dawley) в возрасте 5–6 мес. (n = 32), полученные из вивария Института трансляционной биомедицины СПбГУ. Животные, согласно генотипам и потребляемым рационам, были разделены на 6 групп. Средняя исходная масса тела в группах не различалась.
Крысы содержались в режиме 12 : 12 ч (день : ночь). Все процедуры были выполнены в соответствии с руководящими принципами, установленными Советом Европейского сообщества (Директива 2010/63 /ЕС от 22 сентября 2010 г.).
Генотипирование
Генотипирование животных основано на методе ПДРФ (полиморфизм длины рестрикционных фрагментов). Генотипирование проводится при помощи ПЦР с ДНК, выделенной методом щелочного лизиса [16] из образца ткани, взятого из хвоста животного, и праймерами, фланкирующими сайт мутации (5'-TGGCCTTTTGCAAGAAGTTT-3' and 5'-GCAAAGCAGAAGGAGGTGTC-3'). ПЦР проводится в буфере, содержащем 2× BioMaster HS-Taq PCR-Color reaction mix (Biolab mix, Россия), 1 мкM каждого праймера и 500 нг геномной ДНК. Условия ПЦР: 3 мин при 95°C, 35 циклов по 20 с при 95°C, 20 с при 63°C, 40 с при 72°C и конечная инкубация в течение 5 мин при 72°C. Продукт реакции – ампликон 339 п.н. В ПДРФ-анализе используется рестриктаза SacI (Thermo Scientific, США). При генотипе дикого типа оба аллеля подвергаются рестрикции и образуют 2 фрагмента (195 и 143 п.н.); у гетерозигот только один аллель подвергается рестрикции, образуется три фрагмента (339, 195 и 143 п.н.); в генотипе нокаута оба аллеля теряют сайт рестрикции, поэтому образуется только один фрагмент (339 п.н.).
Рационы
Животные содержались в клетках открытого типа и получали сбалансированный гранулированный корм (ООО Лабораторкорм, Россия). Животные экспериментальных групп получали 20%-ный раствор фруктозы вместо воды. Всем животным обеспечивали доступ к пище и воде ad libitum.
Количество съеденного рациона и выпитой жидкости фиксировали ежедневно.
Дизайн экспериментов
Для решения поставленной цели было проведено 2 эксперимента.
Эксперимент 1.
Основной задачей первого эксперимента стал общий анализ поведенческих изменений крыс нокаутной линии TAAR9-KO в сравнении с группой WT. Для этого крысы с генотипами WT и TAAR9-KO были разделены на 2 группы с равной численностью (n = 6). Животным обеих групп были проведены поведенческие тесты “Открытое поле” (включая ключевые характеристики груминга), “Приподнятый крестообразный лабиринт” и “Водный лабиринт Морриса”.
Эксперимент 2.
Задачей второго эксперимента явилось исследование поведенческих, биохимических и морфологических параметров крыс нокаутной линии TAAR9-KO в сравнении с группой WT, получавших 20%-ный раствор фруктозы вместо воды в течение 2-х месяцев в режиме свободного доступа. Для этого крысы, согласно генотипам, были разделены на 4 группы (n = 5–7): животные 1-й и 2-й групп – с генотипом WT, 3-й и 4-й группы – c генотипом TAAR9-KO. Крысы1-й и 3-й групп получали сбалансированный гранулированный корм, а 2-й и 4-й групп – сбалансированный гранулированный корм с 20%-ным раствором фруктозы вместо воды.
Животным всех групп были проведены физиологические тесты “Открытое поле”, “Приподнятый крестообразный лабиринт”, морфологическое исследование ткани печени и биохимическое исследование плазмы крови.
Крыс еженедельно взвешивали с точностью ±1 г.
Сбор и хранение образцов крови.
Кровь собирали в пробирки для сбора сыворотки крови “VACUETTE” (Greiner Bio-One, Австрия), инкубировали в вертикальном положении в течение 15 мин, а затем держали при 4°C до центрифугирования. Образцы со свернувшейся кровью центрифугировали при 1500 об/мин в течение 15 мин при 4°C. Сыворотку переносили в сухие чистые пробирки и хранили до анализа при –20°C не более 5 дней.
Поведенческие эксперименты
Тест “Открытое поле” (ОП).
Уровни локомоторной активности и другие поведенческие изменения оценивали с использованием оборудования “Open Science” (Россия) и программного обеспечения, разработанного в Физиологическом отделе им. И.П. Павлова ФГБНУ “Институт экспериментальной медицины”. Уровень освещенности установки – 8300 лм. Животные помещались в центр арены на 5 мин. Регистрировали траекторию и скорость движения животного, общую и разделенную по секторам арены пройденную дистанцию. Также было посчитано количество вертикальных стоек, стоек с упором в борт арены, актов груминга, а также уровень дефекации (количество болюсов) за время тестирования.
Тест “Приподнятый крестообразный лабиринт” (ПКЛ).
Уровень тревожности животных оценивали с использованием оборудования “Open Science” (Россия) и программного обеспечения, разработанного в Физиологическом отделе им. И.П. Павлова ФГБНУ “Институт экспериментальной медицины”. Уровень освещенности установки – 8300 лм. Тест ПКЛ позволяет оценить степень выраженности эмоциональной реакции страха и тревоги, двигательную активность, скорость ориентировочных реакций. Время пребывания животных в лабиринте составляло 5 мин. Фиксировали количество переходов из одной зоны в другую, процент посещений зон и время, проведенное в рукавах, общую неподвижность в открытых рукавах, количество свешиваний в открытых рукавах, количество заходов в открытые и закрытые рукава, количество актов груминга и дефекаций.
Тест “Водный лабиринт Морриса” (ВЛМ).
Тестирование пространственной памяти животных проводили в тесте ВЛМ. Для тестирования использовали круглый бассейн диаметром 150 и высотой 60 см, заполненный водой на высоту 43 см. Температура воды составляла 22 ± 1°С. Квадратную платформу из оргстекла (“остров”) размером 10 × 10 см помещали в центр одного из секторов на глубину 1–1.5 см. В качестве стартовых позиций были выбраны северо-восточная (NE), восточная (E), южная (S) и юго-западная (SW) области бассейна. В качестве пространственных ориентиров использовали визуальные стимулы – различные геометрические фигуры (крест, круг, квадрат и треугольник), расположенные на стенках бассейна в позициях NW, NE, SE и SW. Уровень освещенности установки – 8300 лм.
Четыре дня подряд животным давали по 4 попытки для поиска скрытой под водой платформы: крысу помещали в воду мордой к стенке бассейна в одной из стартовых областей бассейна. Стартовую позицию меняли в каждую из четырех попыток одного дня. Попытка заканчивалась в момент нахождения крысой платформы или через 90 с после начала попытки, если крыса не могла найти платформу. В этом случае крысу аккуратно рукой направляли к платформе. В течение 30 с животное оставляли сидеть на платформе. Новую попытку предъявляли через 90–120 с после снятия крысы с платформы в предыдущей попытке. На 5-й день эксперимента платформу убирали и всем животным давали одну попытку длительностью 90 с. Оценивали время поиска, скорость передвижения, длину пройденного пути.
Оценка показателей микроструктуры груминга
Показатели груминга анализировали визуально на основе анализа видеозаписи тестов ОП и ПКЛ в замедленном режиме. Анализ стадий груминга оценивался по следующей цефало-каудальной (от головы до хвоста) системе: отсутствие груминга (стадия 0), лизание лап (стадия 1), умывание носа и лица (стадия 2), умывание головы (стадия 3), уход за туловищем (стадия 4), чесание туловища (стадия 5), умывание задних лап и хвоста (стадия 6), умывание гениталий (стадия 7).
Были исследованы три основных показателя груминга: латентность (в с) начала груминга (LG), общее время (в с), затраченное на груминг (TS), и число актов груминга (NB) [17, 18]. Под единичным актом подразумевается одна или несколько стадий цефало-каудальной системы груминга. Перерывы длительностью более 5 с определялись как отдельные, самостоятельные акты груминга. Акт груминга считался прерванным, если хотя бы один перерыв был зафиксирован в переходах между стадиями. Также была проведена оценка числа (NIB) и процента (% IB = NIB/NB) прерванных актов груминга.
Измерение биохимических показателей
Для биохимического скрининга использовали автоматический анализатор Random Access A-25 (Biosystems S.A., Испания). Перед анализом образцы сыворотки хранили при –20°C. Были проанализированы следующие биохимические параметры: общий белок (TP), фосфор (P), глюкоза (Glu), креатинин (CRE), общий билирубин (TB), аланинаминотрансфераза (ALT), альбумин (ALB), аспартатаминотрансфераза (AST), коэффициент де Ритиса (AST/ALT), лактатдегидрогеназа (LDH), липаза (PL), мочевина (UREA), триглицериды (TG).
Существенно измененные параметры подтверждены на дополнительном анализаторе (Olympus AU400, Япония) для исключения методических ошибок.
Морфологический анализ печени
Морфологический анализ печени проводили с использованием стандартных гистологических методов проводки с последующим окрашиванием эозин-гематоксилином [19] и черным суданом (на общие липиды) [20]. Микрофотографии образцов ткани печени были получены с использованием светового микроскопа (Carl Zeiss, Германия), оснащенным цифровой фотокамерой.
Межисследовательская повторяемость
Перед анализом образцов сыворотки и крови оборудование было обеззаражено, откалибровано и проверено внутренним контролем качества. Повторяемость результатов анализа оценивалась путем расчета коэффициента вариации (CV) 10 последовательных измерений материала внутреннего контроля качества в трех различных контролях (низком, нормальном и высоком). Коэффициенты вариации (%) рассчитывались как стандартное отклонение (SD)/среднее значение ×100.
Статистический анализ
Нормальность распределения была оценена с помощью критерия Shapiro–Wilk test (в случае W ≤ 1.0 распределение считалось ненормальным и статистический анализ проводился с использованием непараметрических критериев, описанных ниже). Статистический анализ полученных результатов проведен с использованием непараметрических критериев Mann–Whitney U-test и Kruskal–Wallis H-test с помощью компьютерных программ SPSS Statistics (США) версии 16.0 и GraphPad Prism версии 6.0 от GraphPad Software (США). Полученные значения выражены в виде среднего ± стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В тесте ОП было показано достоверное увеличение локомоторной активности (как горизонтальной, так и вертикальной). При этом увеличение горизонтальной локомоторной активности было на уровне тенденции. Тем не менее среднее общее количество стоек в группе KO было более чем в 4 раза выше, чем в группе WT, что указывает на увеличение исследовательской (поисковой) активности у животных экспериментальной группы (рис. 1).
Рис. 1.
Количество вертикальных стоек с упором в тесте ОП. WT – контрольная группа, TAAR9-KO – экспериментальная группа. *р ≤ 0.05 в сравнении с контрольной группой, Mann–Whitney U-test.

Для остальных поведенческих показателей (время в центре арены, количество заходов в центр и др.) в тесте ОП не было выявлено статистически достоверных отличий между экспериментальной и контрольной группами.
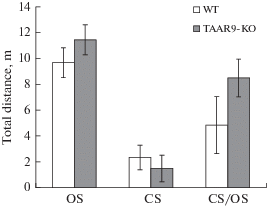
В тесте ПКЛ также не было обнаружено достоверных изменений в уровнях тревожности нокаутных по TAAR9 крыс в сравнении с контрольной группой (рис. 2).
Рис. 2.
Дистанция, пройденная в закрытых (OS) и открытых рукавах (CS), соотношение CS/OS в тесте ПКЛ. WT – контрольная группа, TAAR9-KO – экспериментальная группа.
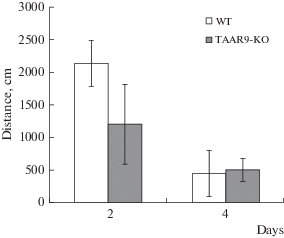
В тесте ВЛМ показано снижение средних значений времени (рис. 3) и общей пройденной дистанции (рис. 4) в группе TAAR9-KO в сравнении с “диким типом” во второй день эксперимента, что может говорить об улучшении функции краткосрочной (рабочей) памяти. Причем, отличия по времени были статистически достоверными. К 4-му дню исследования эти различия нивелировались.
Рис. 3.
Средние значения времени (в с) в тесте ВЛМ. WT – группа крыс c генотипом WT, TAAR9-KO – группа крыс с генотипом TAAR9-KO. *р ≤ 0.05 в сравнении с группой WT, Mann–Whitney U-test.
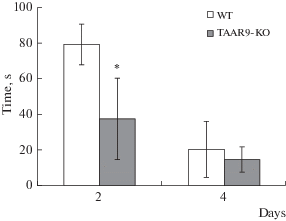
Рис. 4.
Средние значения дистанций, пройденных крысами нокаутной линии TAAR9-KO в тесте ВЛМ. WT – контрольная группа крыс c генотипом WT, TAAR9-KO – группа крыс с генотипом TAAR9-KO.
На 5-й день исследования также не было зафиксировано достоверных отличий в показателях общей пройденной дистанции (659.9 ± 128.5 и 609.6 ± 69.0 см) и времени (27.4 ± 5.3 и 19.6 ± 2.7 с) в секторе NW (платформа) ВЛМ для групп TAAR9-KO и “дикого типа” соответственно (р > 0.05, Mann–Whitney U-test).
Tрадиционные показатели груминга у крыс нокаутной линии TAAR9-KO (общая продолжительность груминга и средняя продолжительность единичного акта груминга (СПЕГ)) в тесте ОП достоверно не изменились в сравнении с контрольной группой. Тем не менее, средние значения латентности груминга были снижены на уровне тенденции в группах с генотипом KO в сравнении с группами WT вне зависимости от рациона. Кроме того, анализ микроструктуры груминга показал, что крысы нокаутной линии TAAR9-KO в среднем демонстрировали большее количество стадий и число прерываний полноценных актов груминга. По остальным показателям груминга достоверных отличий обнаружено не было.
В эксперименте с добавлением 20%-ного раствора фруктозы в рацион повышенный “норковый рефлекс” у крыс TAAR9-KO в тесте ОП (рис. 5) сочетался с хаотичным обследованием норок при одинаковом с контрольными животными временем заглядывания, что может быть интерпретировано как снижение концентрации внимания, вызванное функциональными нарушениями рецептора TAAR9.
Рис. 5.
Средние значения количества актов заглядывания в “норки” (норковый рефлекс) в тесте ОП. WT K – группа крыс c генотипом WT на контрольном рационе, WT FR – группа крыс c генотипом WT на рационе с добавкой 20%-ного раствора фруктозы вместо воды, KO K – группа крыс с генотипом TAAR9-KO на контрольном рационе, KO FR – группа крыс с генотипом TAAR9-KO на рационе с добавкой 20%-ного раствора фруктозы вместо воды. *р ≤ 0.05 в сравнении с контрольной группой, Kruskal–Wallis H-test (W ≤ 1.0).

Анализ интегральных показателей выявил снижение отношения относительной массы белого забрюшинного жира к бурому подлопаточному жиру в группе KO K в сравнении с контрольной группой WT K (рис. 6).
Рис. 6.
Средние значения отношения относительной массы белого забрюшинного жира к бурому подлопаточному жиру для крыс TAAR9-KO. WT K – группа крыс c генотипом WT на контрольном рационе, WT FR – группа крыс c генотипом WT на рационе с добавкой 20%-ного раствора фруктозы вместо воды, KO K – группа крыс с генотипом TAAR9-KO на контрольном рационе, KO FR – группа крыс с генотипом TAAR9-KO на рационе с добавкой 20%-ного раствора фруктозы. * р ≤ 0.05 в сравнении с контрольной группой WTK, ** р ≤ 0.05 в сравнении с группой WT FR, Kruskal–Wallis H-test (W ≤ 1.0).

Добавка фруктозы к рациону приводила к достоверному увеличению отношения белой и бурой жировой ткани у крыс с генотипом WT и не влияла на этот показатель у нокаутных по гену TAAR9 животных (рис. 6).
На рис. 7 показаны изменения в микроструктуре груминга (общая продолжительность и средняя продолжительность одной стадии) крыс нокаутной линии TAAR9-KO в тесте ПКЛ на фоне потребления 20%-ного раствора фруктозы.
Рис. 7.
Показатели микроструктуры груминга крыс TAAR9-KO: общая продолжительность и средняя продолжительность одной стадии груминга в тесте ПКЛ. WT K – группа крыс c генотипом WT на контрольном рационе, WT FR – группа крыс c генотипом WT на рационе с добавкой 20%-ного раствора фруктозы вместо воды, KO K – группа крыс с генотипом TAAR9-KO на контрольном рационе, KO FR – группа крыс с генотипом TAAR9-KO на рационе с добавкой 20%-ного раствора фруктозы. * р ≤ 0.05 в сравнении с контрольной группой, Kruskal–Wallis H-test (W ≤ 1.0).
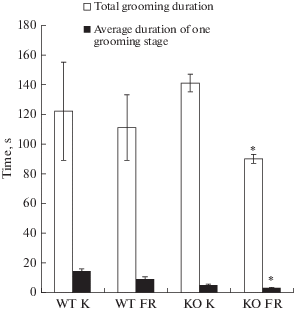
Из рис. 7 видно, что добавка фруктозы к рациону достоверно снижала показатели общей и средней продолжительности одной стадии груминга для группы c генотипом TAAR9-KO.
Средние значения латентности груминга были снижены на уровне тенденции в группах с генотипом KO в сравнении с группами WT вне зависимости от рациона. Кроме того, анализ микроструктуры груминга показал, что крысы нокаутной линии TAAR9-KO в среднем демонстрировали большее количество стадий и число прерываний полноценных актов груминга.
Метаболическая нагрузка фруктозой показала тенденцию к снижению концентрации общего белка у крыс TAAR9-KO в сравнении с “диким типом”, что может являться следствием влияния фруктозы на нарушения белкового обмена у KO (рис. 8).
Рис. 8.
Сравнительный анализ биохимических показателей крови крыс нокаутной линии TAAR9-KO, получавших рацион с добавкой 20%-ного раствора фруктозы вместо воды. WT K – группа крыс c генотипом WT на контрольном рационе, WT FR – группа крыс c генотипом WT на рационе с добавкой 20%-ного раствора фруктозы вместо воды, KO K – группа крыс с генотипом TAAR9-KO на контрольном рационе, KO FR – группа крыс с генотипом TAAR9-KO на рационе с добавкой 20%-ного раствора фруктозы. * р ≤ 0.05 в сравнении с контрольной группой WT K, ** р ≤ 0.05 в сравнении с группами WT K и WT FR, *** р ≤ 0.05 в сравнении с группами WT K, WT FR и KO K, # – р ≤ 0.05 в сравнении с группой WT FR, Kruskal–Wallis H-test (W ≤ 1.0).

Тенденция к снижению уровня общего белка у KO на высокофруктозном рационе в сравнении как с “диким типом”, так и с обоими генетическим вариантами на контрольном рационе могут говорить об увеличении скорости белкового обмена у KO под действием простых углеводов.
Выявлено снижение активности АЛТ в плазме крови для групп на высокофруктозном рационе обоих генотипов и повышение среднего значения коэффициента де Ритиса (АСТ/АЛТ) в группе KO FR (р ≤ 0.05, рис. 8).
Количество триглицероидов в крови нокаутных по гену TAAR9 животных, получавших высокофруктозный рацион, было достоверно ниже, чем в группе с генотипом WT, получавшей 20%-ный раствор фруктозы вместо воды.
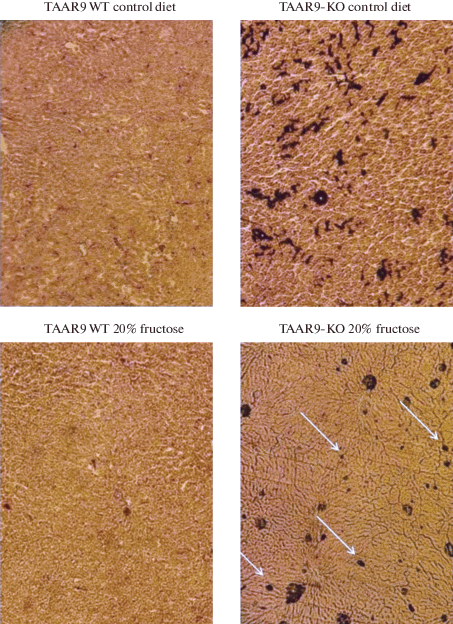
Данный факт подтверждается результатом морфологических исследований печени при качественном окрашивании на липиды черным суданом (рис. 9). В паренхиме печени животных с генотипом WT липидные вакуоли практически отсутствуют. У крыс с генотипом TAAR9-KO, напротив, обнаружено большое количество липидов в гепатоцитах, при этом на высокофруктозном рационе количество липидов снижается, что хорошо соотносится с современными представлениями о том, что избыток углеводов в рационе активирует образование липопротеинов низкой плотности и отток липидов из печени в другие органы и ткани. Окрашивание образцов печени эозином-гематоксилином не выявило серьезных изменений в структуре паренхимы печени (рис. 10).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Метаболическая нагрузка фруктозой показала снижение концентрации общего белка в плазме крыс TAAR9-KO в сравнении с “диким типом”, что может являться следствием увеличения скорости белкового обмена у KO под действием простых углеводов. Снижение активности АЛТ (маркера анаболических реакций) для исследуемых групп обоих генотипов на высокофруктозном рационе подтверждает гипотезу об ингибировании анаболических реакций (включая глюконеогенез) в сочетании с увеличением скорости расходования пула белков в плазме крови посредством избыточного содержания фруктозы в рационе.
В тесте ОП показано достоверное увеличение локомоторной активности (как горизонтальной, так и вертикальной), а также количества актов “норкового рефлекса” у крыс нокаутной линии TAAR9-KO в сравнении с контрольной группой. Повышенный “норковый рефлекс” крыс с генотипом KO в сочетании с хаотичным обследованием норок, по всей видимости, является маркером снижения концентрации внимания, вызванное нарушениями функции рецептора TAAR9. При этом не было обнаружено достоверных изменений в уровнях тревожности нокаутных по TAAR9 крыс в сравнении с контрольной группой.
В тесте ВЛМ выявлено снижение локомоторной активности (общей пройденной дистанции) в группе TAAR9-KO в сравнении с группой WT, что косвенно может говорить о влиянии функционального нарушения рецептора TAAR9 на дофаминовые системы.
Анализ микроструктуры груминга выявил тенденцию к повышению средних значений латентности, а также большее количество стадий и число прерываний полноценных актов груминга в группах с генотипом KO в сравнении с группами WT. Этот результат может говорить о повышении уровня тревожности крыс, однако в тесте ПКЛ отличий в уровнях тревожности между исследованными группами обнаружено не было. По всей видимости, данный эффект был связан с дефицитом внимания, признаки которого были обнаружены в других поведенческих тестах (ОП и ВЛМ).
Добавка фруктозы к рациону достоверно снижала показатели общей продолжительности груминга и средней продолжительности одной стадии груминга для группы c генотипом TAAR9-KO в тесте ПКЛ, что также может являться маркером дефицита внимания.
Таким образом, в проведенном исследовании впервые был выделен ряд поведенческих особенностей крыс нокаутной линии TAAR9-KO, в частности высокий уровень поисковой активности, выражающийся в повышенной локомоторной активности и увеличении количества актов “норкового рефлекса”.
Анализ интегральных показателей вывил снижение отношения массы белого забрюшинного жира к бурому подлопаточному жиру в группе KO K в сравнении с контрольной группой WT K. Добавка фруктозы к рациону животных с генотипом WT приводила к достоверному увеличению отношения белой и бурой жировой ткани, но не влияла на этот показатель у нокаутных по гену TAAR9 животных из группы FR KO. Таким образом, полученный результат может указывать на связь функционального нарушения рецептора TAAR9 c процессами терморегуляции.
Биохимическое исследование крови выявило ряд нарушений в липидном и белковом обмене крыс TAAR9-KO, связанном с потреблением высокофруктозного рациона, что выражалось в снижении уровня общего белка у нокаутных по гену TAAR9 животных, снижении активности АЛТ и концентрации триглициридов в плазме крови, а также в повышении среднего значения коэффициента де Ритиса (АСТ/АЛТ) в группе KO FR, что может указывать на активизацию катаболических процессов у животных с генотипом KO под действием фруктозного рациона, являющемся следствием компенсаторного ответа организма крыс TAAR9-KO на генетически опосредованное нарушение белкового и липидного обменов.
Полученные результаты биохимического анализа крови были подтверждены данными морфологического исследования печени (окрашивание на общие липиды черным суданом).
Обнаруженные поведенческие изменения крыс нокаутной линии TAAR9-KO характеризуют возможную связь функционального нарушения рецептора следовых аминов TAAR9 с дофаминовыми системами, что, в свою очередь, приводит к повышению локомоторной активности и дефициту внимания у нокаутов и требует проведения дальнейших физиологических и биохимических экспериментов.
Список литературы
O’Donnell MP, Fox BW, Chao P-H, Schroeder FC, Sengupta P (2020) A neurotransmitter produced by gut bacteria modulates host sensory behavior. Nature (7816): 415–420. https://doi.org/10.1038/s41586-020-2395-5
Gainetdinov RR, Hoener MC, Berry MD (2018) Trace amines and their receptors. Pharmacol Rev 70(3): 549–620. https://doi.org/10.1124/pr.117.015305
Boulton A (1974) Amines and theories in psychiatry. Lancet 304(7871): 52–53. https://doi.org/10.1016/s0140-6736(74)91390-7
Ahmad W, Mohammed GI, Al-Eryani DA, Saigl ZM, Alyoubi AO, Alwael H, Bashammakh AS, O’Sullivan CK, El-Shahawi MS (2019) Biogenic amines formation mechanism and determination strategies: future challenges and limitations. Crit Rev Anal Chem 50(6): 485–50. https://doi.org/10.1080/10408347.2019.1657793
Demarest KT, Riegle GD, Moore KE (1984) Prolactin-induced activation of tuberoinfundibular dopaminergic neurons: evidence for both a rapid ‘tonic’ and a delayed ‘delayed’ component. Neuroendocrinology 38: 467–475. https://doi.org/10.1159/000123935
Khan MZ, Nawaz W (2016) The emerging roles of human trace amines and human trace amine-associated receptors (hTAARs) in central nervous system. Biomed Pharmacother 83: 439–449. https://doi.org/10.1016/j.biopha.2016.07.002
Raab S, Wang H, Uhles S, Cole N, Alvarez-Sanchez R, Künnecke B, Ullmer C, Matile H, Bedoucha M, Norcross RD, Ottaway-Parker N, Perez-Tilve D, Conde Knape K, Tschöp MH, Hoener MC, Sewing S (2016) Incretin-like effects of small molecule trace amine-associated receptor 1 agonists. Mol Metab 5(1): 47–56. https://doi.org/10.1016/j.molmet.2015.09.015
Borowsky B, Adham N, Jones KA, Raddatz R, Artymyshyn R, Ogozalek KL, Durkin MM, Lakhlani PP, Bonini JA, Pathirana S, Boyle N, Pu X, Kouranova E, Lichtblau H, Ochoa FY, Branchek TA, Gerald C (2001) Trace amines: identification of a family of mammalian G protein-coupled receptors. Proc Natl Acad Sci U S A 98(16): 8966–8971. https://doi.org/10.1073/pnas.151105198
Bunzow JR, Sonders MS, Arttamangkul S, Harrison LM, Zhan G, Quigley DI, Darland T, Suchland KL, Pasumamula S, Kennedy JL, Olson SB, Magenis RE, Amara SG, Grandy DK (2001) Amphetamine, 3,4-methylenedioxymethamphetamine, lysergic acid diethylamide, and metabolites of the catecholamine neurotransmitters are agonists of a rat trace amine receptor. Mol Pharmacol 60(6): 1181–1188. https://doi.org/10.1124/mol.60.6.1181
Narang D, Tomlinson S, Holt A (2011) Trace amines and their relevance to psychiatry and neurology: a brief overview. Klinik Psikofarmakol Bült 2: 73–79.
Babusyte A, Kotthoff M, Fiedler J, Krautwurst D (2013) Biogenic amines activate blood leukocytes via trace amine-associated receptors TAAR1 and TAAR2. J Leukoc Biol 93(3): 387–394. https://doi.org/10.1189/jlb.0912433
D’Andrea G, Terrazzino S, Fortin D, Farruggio A, Rinaldi L, Leon A (2003) HPLC electrochemical detection of trace amines in human plasma and platelets and expression of mRNA transcripts of trace amine receptors in circulating leukocytes. Neurosci Lett 346(1–2): 89–92. https://doi.org/10.1016/s0304-3940(03)00573-1
Revel FG, Moreau JL, Gainetdinov RR, Bradaia A, Sotnikova TD, Mory R, Durkin S, Groebke Zbinden K, Norcross R, Meye CA, Metzler V, Chaboz S, Ozmen L, Trube G, Pouzet B, Bettler B, Caron MG, Wettstein JG, Hoener MC (2011) TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity. Proc Natl AcadSci U S A 108(20): 8485–8490. https://doi.org/10.1073/pnas.1103029108
Ito J, Ito M, Nambu H, Fujikawa T, Tanaka K, Iwaasa H, Tokita S (2009) Anatomical and histological profiling of orphan G-protein-coupled receptor expression in gastrointestinal tract of C57BL/6J mice. Cell Tissue Res 338(2): 257–269. https://doi.org/10.1007/s00441-009-0859-x
Rogers RD, Everitt BJ, Baldachino A, Blackshaw AJ, Swainson R, Wynne K, Baker NB, Hunter J, Carthy T, Booker E, London M, Deakin JF, Sahakian BJ, Robbins TW (1999) Dissociable deficits in the decision-making cognition of chronic amphetamine abusers, opiate abusers, patients with focal damage to the prefrontal cortex, and tryptophan-depleted normal volunteers: evidence for monoaminergic mechanisms. Neuropsychopharmacology 20: 322–339. https://doi.org/10.1016/S0893-133X(98)00091-8
Murtazina RZ, Zhukov IS, Korenkova OM, Popova EA, Kuvarzin SR, Efimova EV, Kubarskaya LG, Batotsyrenova EG, Zolotoverkhaya EA, Vaganova AN, Apryatin SA, Alenina NV, Gainetdinov RR (2021) Genetic Deletion of Trace-Amine Associated Receptor 9 (TAAR9) in Rats Leads to Decreased Blood Cholesterol Levels. Int J Mol Sci 2 (6): 2942. https://doi.org/10.3390/ijms22062942
Kalueff AV, Stewart AM, Song C, Berridge KC, Graybiel AM, Fentress JC (2016) Neurobiology of rodent self-grooming and its value for translational neuroscience. Nat Rev Neurosci 17(1): 45–59. https://doi.org/10.1038/nrn.2015.8
Kalueff A.V., Tuohimaa P. (2005) The grooming analysis algorithm discriminates between different levels of anxiety in rats: potential utility for neurobehavioural stress research. J Neurosci Methods 143(2):169-177. https://doi.org/10.1016/j.jneumeth.2004.10.001
Chan JKCT (2014) The Wonderful Colors of the Hematoyxlin−Eosin Stain in Diagnostic Surgical Pathology. Int J Surg Pathol. 22(1): 12-32. https://doi.org/10.1177/1066896913517939
Nikiforov MA (ed) (2017) Oncogene-Induced Senescence: Methods and Protocols, Methods in Molecular Biology 1534: 111–119. https://doi.org/10.1007/978-1-4939-6670-7_10
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова