Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1219-1234
Амигдалофугальная модуляция висцеральной ноцицептивной трансмиссии в каудальной вентролатеральной ретикулярной области продолговатого мозга крысы в норме и при кишечном воспалении
О. А. Любашина 1, *, И. Б. Сиваченко 1, И. И. Бусыгина 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: lyubashinaoa@infran.ru
Поступила в редакцию 24.02.2021
После доработки 25.03.2021
Принята к публикации 26.03.2021
Аннотация
Амигдала – одна из ключевых лимбических структур головного мозга, обеспечивающих центральную регуляцию функций автономной нервной системы. Центральному ядру амигдалы (ЦеА) отводят ведущую роль в эмоционально-аффективной оценке и модуляции поступающей в мозг висцеросенсорной информации, в том числе ноцицептивных сигналов от желудочно-кишечного тракта. Недавно полученные данные о нейропластических перестройках в ЦеА при воспалении толстой кишки указывают на возможность влияния периферической патологии на процессы амигдалярного контроля висцеральных болевых сигналов. Однако конкретные механизмы реализации этих процессов и изменения в них при органических заболеваниях остаются малоизученными, сдерживая разработку эффективных методов лечения абдоминальных болевых синдромов. Целью наших нейрофизиологических экспериментов на анестезированных крысах являлось определение нейрональных механизмов, обеспечивающих амигдалофугальную модуляцию висцеральной ноцицептивной трансмиссии на уровне продолговатого мозга, с оценкой особенностей их реализации при кишечном воспалении. Для этого у здоровых животных и крыс с экспериментальным колитом изучали эффекты электрической стимуляции ЦеА на импульсную активность нейронов бульбарной каудальной вентролатеральной ретикулярной области (кВЛРО), вызванную ноцицептивным колоректальным растяжением (КРР). Установлено, что ЦеА оказывает подавляющее действие на нейрональные процессы обработки кВЛРО ноцицептивных сигналов от толстой кишки, которое проявляется в уменьшении возбуждающих и ослаблении тормозных реакций бульбарных нейронов на КРР. Такой эффект может способствовать уменьшению восходящего болевого потока и инициируемых им рефлекторных реакций бульбарного уровня, т.е. является антиноцицептивным. Впервые показано, что колит сопровождается ослаблением угнетающих влияний ЦеА на возбуждающиеся в ответ на КРР клетки кВЛРО при сохранении амигдалофугального подавления тормозных ноцицептивных нейрональных реакций. Выявленные изменения могут приводить к усилению супраспинальной трансмиссии болевых сигналов от кишки, т.е. лежать в основе центральных механизмов патогенеза кишечной гипералгезии и хронической абдоминальной боли.
Амигдала является одной из ключевых лимбических структур головного мозга, обеспечивающих центральную регуляцию функций автономной нервной системы [1, 2]. Реципрокные связи амигдалы cо стволовыми структурами, а также с интегративными субкортикальными и кортикальными областями [1, 3] позволяют ей взаимодействовать с автономными центрами мозга и координировать их активность в целях формирования адекватных текущему мотивационно-эмоциональному состоянию висцеральных и эндокринных ответов [1, 2]. В этом контексте важными функциями амигдалы являются эмоционально-аффективная оценка и модуляция поступающей в мозг висцеросенсорной информации, в том числе ноцицептивных сигналов, исходящих от органов желудочно-кишечного тракта [4–6].
Участие амигдалы в контроле абдоминальной ноцицепции продемонстрировано клиническими и экспериментальными исследованиями. С помощью методов нейровизуализации мозга человека показано, что механическое растяжение прямой кишки вызывает активацию этой переднемозговой структуры [7, 8]. Усиление нейрональной активности центрального ядра амигдалы (ЦеА) после химического или механического кишечного раздражения было отмечено в экспериментах на крысах [9, 10]. Также на грызунах было установлено, что фармакологическая модуляция активности ЦеА оказывает влияние на висцеральную чувствительность. Так, микроинъекции в это ядро кортикостерона, кортикотропин-рилизинг-фактора, модуляторов его рецепторов 1 типа, глюкокортикоидных или глутаматных рецепторов способствовали усилению [6, 11–13], либо ослаблению реакции бодрствующего животного на колоректальное растяжение [12, 14, 15]. Эти данные подтверждают важную роль амигдалы и, прежде всего, ее центрального ядра в супраспинальной модуляции кишечной ноцицепции. Между тем, обеспечивающие эту функцию ЦеА нейрональные механизмы до сих пор остаются неясными.
Кроме того, в последние годы установлено, что патология желудочно-кишечного тракта сопровождается существенными структурными, молекулярными и функциональными перестройками в амигдале и ее центральном ядре. В частности, у пациентов с воспалительными заболеваниями толстой кишки обнаружены изменения объема серого вещества, количества нейрокининовых рецепторов в амигдале [16–18] и ее неадекватная активация при стрессорных воздействиях [8, 19]. В свою очередь, в экспериментальных исследованиях на моделях колита у крыс и мышей в ЦеА наблюдалось увеличение базальной и вызванной нейрональной активности, усиление синаптической передачи [20–22], повышенная экспрессия кортикотропин-рилизинг-фактора и активность метаботропных глутаматергических рецепторов I группы, сниженные экспрессии рецептора кортикостерона и нейропептида Y [21, 23, 24]. Эти вызванные периферическим воспалением перестройки могут изменять процессы обработки амигдалой интероцептивных сигналов и ее модулирующие влияния на висцеросенсорную активность автономных центров мозга, способствуя усилению абдоминальной ноцицепции и ощущения боли. Однако как сами механизмы реализации этих процессов, так и возможные изменения в них при кишечной патологии остаются неизученными. Это существенно сдерживает разработку эффективных методов лечения абдоминальных болевых синдромов, особенно их хронических форм, в патогенезе которых ведущую роль отводят нарушениям в супраспинальных механизмах контроля ноцицептивной информации от толстой кишки [25, 26].
Поэтому целью проведенных нами нейрофизиологических экспериментов на крысах являлось выяснение нейрональных механизмов, обеспечивающих амигдалофугальную модуляцию висцеральной ноцицептивной трансмиссии на уровне продолговатого мозга, с оценкой особенностей их реализации при кишечном воспалении. Для этого у здоровых животных и крыс с экспериментальным колитом мы изучали эффекты электрической стимуляции ЦеА на вызванную ноцицептивным колоректальным растяжением импульсную активность нейронов каудальной вентролатеральной ретикулярной области (кВЛРО) продолговатого мозга — первого супраспинального автономного центра, получающего ноцицептивную информацию от толстой кишки по волокнам спинальной вентролатеральной системы [2, 27, 28].
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 27 взрослых самцах крыс линии Вистар (масса тела 280–360 г) из Коллекции лабораторных млекопитающих разной таксономической принадлежности Института физиологии им. И.П. Павлова РАН. Все экспериментальные процедуры соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по контролю за содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН.
Животных после 24-часовой пищевой депривации анестезировали внутрибрюшинным введением смеси уретана (800 мг/кг; Sigma-Aldrich, США) и альфа-хлоралозы (60 мг/кг; ICN Biomedicals, США). В бедренные артерию и вену устанавливали катетеры для регистрации артериального давления с помощью полупроводникового датчика MLT0670 (ADInstruments, Великобритания) и для внутривенного введения анестетика в случае необходимости. После трахеостомии (для облегчения процесса дыхания в условиях эксперимента) голову крысы закрепляли в стереотаксическом приборе (Медикор, Венгрия) под углом 30° к горизонтальной плоскости. Посредством рассечения мягких тканей обеспечивали доступ к затылочной кости черепа, нижнюю часть которой удаляли вместе с подлежащей твердой мозговой оболочкой. Открытую дорсальную поверхность продолговатого мозга заливали теплым физиологическим раствором. Для доступа к центральному ядру амигдалы просверливали миллиметровое отверстие в зоне его проекции на левую теменную кость согласно стандартному атласу мозга крысы [29]. В отверстие погружали монополярный вольфрамовый стимулирующий электрод в лаковой изоляции с кончиком диметром 5 мкм и сопротивлением 50 кОм (Science Products GMBH, Германия), который размещали в пределах стереотаксических координат латеральной части ядра (2.1–2.6 мм каудальнее брегмы, 4.0–4.5 мм латеральнее средней линии, 6.5–7.6 мм от поверхности мозга), непосредственно связанной с процессами контроля ноцицепции [30, 31]. Индифферентный электрод закрепляли в контралатеральной височной мышце.
Для ноцицептивного колоректального растяжения использовали интраректально введенный резиновый баллон длиной 7 см, который раздували воздухом до давления 80 мм рт. ст. с помощью автоматического шприцевого насоса (ДШ-09, Висма-Планар, Беларусь). Индикатором ноцицептивного характера применяемой стимуляции на системном уровне служили вызываемые ею колебания уровня артериального давления. Внеклеточную регистрацию вызванной кишечной стимуляцией активности нейронов каудальной вентролатеральной ретикулярной области продолговатого мозга осуществляли вольфрамовыми микроэлектродами (кончик 1 мкм, сопротивление 1 МОм; World Precision Instruments, США). При поиске нейронов микроэлектрод перемещали в зоне, расположенной на 1.0–1.4 мм ростральнее задвижки и 1.9–2.3 мм латеральнее средней линии на глубине 2.8–3.4 мм от поверхности мозга, с помощью электронного погружающего устройства (МП-2, Россия) с шагом 4 мкм. Отводимый сигнал после усиления и фильтрации в диапазоне 400–5000 Гц (усилитель DAM 80, World Precision Instruments, США) поступал на вход звуковой карты компьютера. Визуализацию и запись нейрональной активности в режиме реального времени осуществляли посредством программы Audition 3 (Adobe Corp, США). Запись производили на трехминутном интервале – 1 мин до стимуляции (фоновый показатель), 1 мин во время колоректального растяжения и 1 мин после него. Последующий анализ с селекцией нейрональных разрядов по форме выполняли с помощью программы Spike 2 (CED, Великобритания). Для разных импульсных потоков определяли среднюю частоту разрядов на последовательных минутных интервалах, указанных выше. Нейроны считали реагирующими на ноцицептивную стимуляцию, если частота их разрядов во время раздражения изменялась по отношению к фоновому значению не менее чем на 15%.
Для каждого регистрируемого нейрона оценивали его исходную фоновую активность и реакцию на колоректальное растяжение, затем (с интервалом 5 мин) – те же показатели после предварительной (за 20 с) стимуляции центрального ядра амигдалы. При этом в течение 40 с записывалась текущая фоновая активность нейрона, затем осуществлялось 10-секундное раздражение амигдалы и через 10 с после его окончания начинался 60-секундный период мониторирования постстимуляционных изменений в фоновой активности или производилось 60-секундное КРР. Для электрического раздражения центрального ядра использовали прямоугольные импульсы тока отрицательной полярности силой 200–300 мкА и длительностью 500 мкс, которые генерировали с помощью электростимулятора Isostim A320 (World Precision Instruments, США) и предъявляли с частотой 50 Гц в течение 10 с. Эксперименты проводили на двух группах крыс – здоровых (15 животных) или с колитом (12 особей), инициированным по методу Morris с соавт. [32] посредством трансректального введения в ободочную кишку спиртового раствора пикрилсульфониевой кислоты (TNBS, 20 мг в 0.25 мл 50%-ного раствора этанола; Sigma-Aldrich, США). Введение раствора осуществлялось с помощью инсулинового шприца, снабженного тонким 7-сантиметровым полиэтиленовым катетером. Опыты начинали через 5–12 дней после инъекции, на пике развития колита.
По окончании каждого эксперимента осуществляли эвтаназию животного путем внутривенного введения трехкратной дозы анестезирующей смеси и выполняли электролитическое разрушение ткани мозга посредством пропускания через регистрирующий и стимулирующий электроды постоянного тока силой 0.5–1.2 мА в течение 40 с. Локализацию мест регистрации и стимуляции производили на обработанных стандартными гистологическими методами (метод Ниссля) срезах мозга толщиной 40 мкм с использованием атласа мозга крысы [29]. В случае локализации регистрирующего или стимулирующего электродов за пределами границ исследуемых структур мозга результаты нейрофизиологического исследования данного животного были исключены из дальнейшего анализа. По завершении каждого опыта у здоровых крыс и животных, подвергнутых введению пикрилсульфониевой кислоты, был осуществлен забор фрагмента толстой кишки длиной 8 см от ануса для визуального анализа и последующего гистологического окрашивания (эозин и гематоксилин) с целью исключения спонтанной патологии у животных, отнесенных к группе здоровых, и гистологического подтверждения колита у крыс второй группы.
Статистическую обработку, сравнение и графическое оформление результатов, полученных в разных условиях и на разных группах животных, производили посредством программ Origin 2015 (OriginLab, США) и GraphPad InStat 3.02 (GraphPad Software, США). Статистический анализ полученных данных производился с использованием непараметрических методов для парных (тест Фридмана и парный тест Вилкоксона) и непарных (тесты Крускала–Уоллиса и Манна–Уитни) измерений. Применение непараметрических тестов было связано с отклонением анализируемых выборок от нормального распределения (тест Шапиро–Вилка). Данные представлены как медиана (25-й процентиль; 75-й процентиль). Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В группе здоровых животных была зарегистрирована активность 145 нейронов кВЛРО продолговатого мозга, локализованных между двойным и латеральным ретикулярными ядрами (рис. 1a). Из них 128 (88.3%) клеток реагировали на ноцицептивное колоректальное растяжение (КРР) значительными и пролонгированными во времени увеличением (n = 78, p = 0.03, Fr = 7.29, тест Фридмана) или уменьшением частоты разрядов (n = 50, p = 0.04, Fr = 6.24) и были отнесены к возбуждающимся и тормозящимся соответственно. Остальные 17 (11.7%) нейронов, активность которых во время и после КРР существенно не изменялась (p = 0.08, Fr = 5.06), рассматривались как индифферентные к применяемому висцеральному раздражению и были исключены из дальнейшего анализа эффектов стимуляции амигдалы. Указанные три типа нейронов характеризовались различающимися частотами фоновой активности (p < 0.001, KW = 35.3, тест Крускала–Уоллиса), что может служить подтверждением их принадлежности к функционально различным популяциям. Возбуждающиеся клетки генерировали фоновые разряды с частотой 0.7 (0.3; 1.3) имп/с, которая была существенно ниже, чем у тормозящихся (1.4 (1.1; 2.2); p < 0.001, U = 985, тест Манна–Уитни) и индифферентных нейронов (1.9 (1.5; 3.0); p < 0.001, U = 190). Из последних двух типов клеток более высокую частоту фоновой активности демонстрировали индифферентные к КРР клетки (p = 0.04, U = 283).
Рис. 1.
Локализация мест регистрации нейронов каудальной вентролатеральной ретикулярной области продолговатого мозга (a), область электрической стимуляции центрального ядра амигдалы (b) и примеры возбуждающей (c, d) и тормозной (e, f) нейрональных реакций на колоректальное растяжение изолированно (c, e) или после предварительной (за 20 с) активации центрального ядра амигдалы (d, f). Обозначения на (a): Amb – двойное ядро, Cu – клиновидное ядро, LRt – латеральное ретикулярное ядро, Sol – ядро одиночного тракта, Sp5 – спинальное ядро тройничного нерва, XII – ядро подъязычного нерва. Обозначения на (b): BL – базолатеральное ядро амигдалы, BM – базомедиальное ядро амигдалы, Co – кортикальное ядро амигдалы, GP – бледный шар, La – латеральное ядро амигдалы, LH – латеральный гипоталамус, Me – медиальное ядро амигдалы. Схемы срезов мозга адаптированы из стандартного атласа мозга крысы [29]. Обозначения на (c–f): CRD – колоректальное растяжение, CeA – стимуляция центрального ядра амигдалы. В верхней части каждого фрагмента – нативные записи, ниже – соответствующие гистограммы. По оси абсцисс – время в секундах, по оси ординат – частота разрядов. Отрезки – время действия раздражений. Артефакты электрической стимуляции убраны с помощью амплитудного дискриминатора.
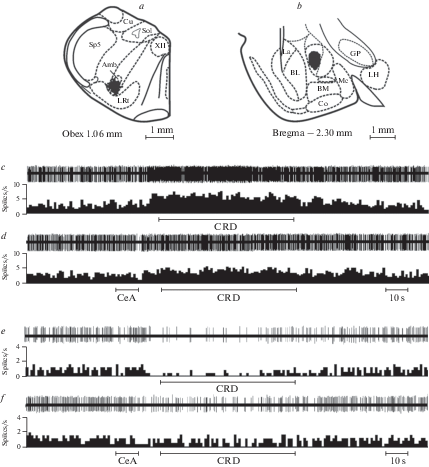
Возбуждающиеся при кишечном растяжении клетки (рис. 1c) составляли 53.8% от общего числа зарегистрированных нейронов. Вызванное КРР усиление их импульсной активности достигало 143.6 (128.1; 223.0)% от исходного (фонового) уровня (n = 78, p < 0.001, парный тест Вилкоксона) и сохранялось как минимум в течение 1 мин после окончания стимуляции (рис. 2a). В свою очередь, в популяции тормозящихся при КРР нейронов (рис. 1e), к которой были отнесены 34.5% изученных клеток, снижение частоты разрядов во время раздражения доходило до 71.3 (57.8; 78.6)% от ее исходного значения (n = 50, p < 0.001, парный тест Вилкоксона), оставаясь на сниженном уровне после прекращения КРР (рис. 2b).
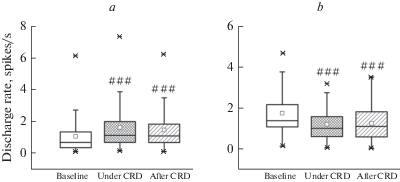
Рис. 2.
Частота разрядов у возбуждающихся (a) и тормозящихся (b) в ответ на колоректальное растяжение (CRD) нейронов каудальной вентролатеральной ретикулярной области продолговатого мозга у здоровых крыс исходно (Baseline), во время раздражения (Under CRD) и после его окончания (After CRD). Верхняя и нижняя границы каждого прямоугольника – первый и третий квартили (25-й и 75-й процентили) соответственно, поперечная линия внутри – медиана (50-й процентиль), квадрат внутри – среднее арифметическое, концы отрезков – 10-й и 90-й процентили, кресты – выбросы. Значимые различия по сравнению с соответствующим исходным значением (парный тест Вилкоксона): ### – p < 0.001.
Предварительная 10-секундная электрическая стимуляция латеральной части ЦеА (рис. 1b) у здоровых животных вызывала небольшое, но статистически значимое снижение частоты фоновой импульсации возбуждающихся при КРР нейронов (n = 78, p = 0.02, парный тест Вилкоксона; рис. 3a) и подавляла их ответы на висцеральное болевое раздражение (рис. 1d). Интенсивность последних после стимуляции ЦеА составляла 123.6 (86.6; 158.9)% от фоновой активности, что было существенно ниже, чем при изолированном применении КРР (n = 78, p < 0.01, парный тест Вилкоксона; рис. 4a). Электрораздражение амигдалы не оказывало значимого влияния на частоту фоновых разрядов тормозящихся при кишечном растяжении нейронов (рис. 3b), но приводило к ослаблению их тормозных реакций на КРР (рис. 1f), либо к их трансформации в возбуждающие. В целом, вызванный КРР уровень импульсной активности этих нейронов после стимуляции ЦеА составлял 99.9 (63.2; 129.7)% от фонового значения, существенно превышая таковой при изолированном кишечном раздражении (n = 50, p < 0.001, парный тест Вилкоксона; рис. 4b).
У крыс с колитом в исследуемой области продолговатого мозга (рис. 1a) было зарегистрировано 106 нейронов. Из них 38 (35.9%) клеток во время и после КРР демонстрировали усиление импульсной активности (p < 0.001, Fr = 42.37, тест Фридмана), а 51 нейрон (48.1%) – ее уменьшение (p < 0.001, Fr = 61.22). Остальные 17 (16%) клеток были индифферентными к болевой висцеральной стимуляции (p = 0.19, Fr = 3.29). Процентное соотношение разных типов нейронов при патологии существенно отличалось от такового в норме (p = 0.02, Chi-square = 7.9, тест хи-квадрат), характеризуясь меньшим процентом возбуждающихся и повышенной долей тормозящихся при КРР клеток (p = 0.009, точный тест Фишера) при сопоставимом с нормой соотношении реагирующих на раздражение и индифферентных к нему нейронов (p > 0.05, точный тест Фишера). Частоты фоновых разрядов указанных нейрональных типов существенно различались (p < 0.001, KW = 19.68, тест Крускала–Уоллиса), однако данная характеристика для каждого из них в отдельности была сопоставима с таковой у здоровых животных (для всех случаев p = 0.08–0.83, U = = 93–1409, тест Манна–Уитни; рис. 3a, b).
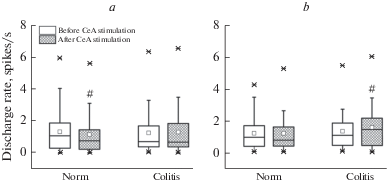
Рис. 3.
Частота фоновых разрядов у нейронов каудальной вентролатеральной ретикулярной области продолговатого мозга с возбуждающими (a) и тормозными (b) реакциями на колоректальное растяжение (CRD) до электрической стимуляции центрального ядра амигдалы (Before CeA stimulation) и после него (After CeA stimulation) у здоровых крыс (Norm) и животных с колитом (Colitis). Значимые различия по сравнению с соответствующим значением до активации амигдалы (парный тест Вилкоксона): # – p < 0.05. Остальные обозначения как на рис. 2.
У крыс с кишечным воспалением возбуждающая нейрональная реакция на КРР достигала 157.3 (130.3; 271.6)% от уровня фоновой импульсации, превышая соответствующее значение в норме (p = 0.04, U = 1018, тест Манна–Уитни; рис. 4a). Тормозящиеся нейроны в ответ на растяжение воспаленной кишки демонстрировали снижение импульсной активности до 68.2 (45.5; 78.2)% от ее фонового уровня, что не отличалось от сходной реакции в отсутствие патологии (p = 0.30, U = 1123, тест Манна–Уитни; рис. 4b).
Рис. 4.
Частота вызванных разрядов у нейронов каудальной вентролатеральной ретикулярной области продолговатого мозга, возбуждающихся (a) и тормозящихся (b) при колоректальном растяжении, исходно (CRD) и после предварительной электрической стимуляции центрального ядра амигдалы (CeA + CRD) у здоровых крыс (Norm) и животных с колитом (Colitis). Значимые различия по сравнению с соответствующим значением до активации амигдалы (парный тест Вилкоксона): ## – р < 0.01, ### – p < 0.001. Значимые различия по сравнению с соответствующим значением в норме (тест Манна–Уитни): * – р < 0.05. Остальные обозначения как на рис. 2.
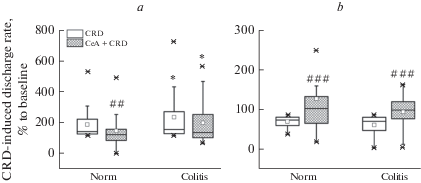
Предварительная стимуляция ЦеА при колите, в отличие от ее тормозного действия в норме, не оказывала существенного влияния на частоты фоновых и вызванных КРР разрядов у клеток возбуждающегося типа (n = 38, p = 0.66 и p = 0.10 соответственно, парный тест Вилкоксона). После такой стимуляции уровень импульсной активности нейрона во время кишечного раздражения составлял 137.6 (104.2; 253.9)% от ее фонового значения, превосходя соответствующий показатель после активации ЦеА в группе здоровых животных (p = 0.04, U = 1143, тест Манна–Уитни; рис. 4a). В свою очередь, кишечная патология сопровождалась усиливающим эффектом амигдалы на фоновую импульсацию тормозящихся при КРР клеток (n = 51, p = 0.03, парный тест Вилкоксона; рис. 3b), который не наблюдался в норме. При этом сохранялось амигдалофугальное подавление тормозных нейрональных ответов на болевое раздражение кишки (рис. 4b). Вызванный КРР уровень импульсной активности этих нейронов после стимуляции ЦеА в условиях патологии составлял 96.2 (74.6; 116.9)% от фонового значения, существенно превышая таковой при изолированном кишечном раздражении (n = 51, p < 0.001, парный тест Вилкоксона) и не отличаясь от соответствующего показателя у здоровых животных (p = 0.55, U = 1163, тест Манна–Уитни).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенных исследований нами впервые установлено, что электрическая стимуляция латеральной части ЦеА оказывает подавляющее действие на нейрональные процессы обработки ноцицептивных сигналов от толстой кишки в кВЛРО продолговатого мозга, которое проявляется в уменьшении возбуждающих и ослаблении тормозных реакций бульбарных нейронов на болевое колоректальное растяжение. Впервые показано, что кишечное воспаление (колит) сопровождается ослаблением угнетающих влияний ЦеА на возбуждающиеся в ответ на висцеральное ноцицептивное воздействие клетки кВЛРО при сохранении амигдалофугального подавления вызываемого КРР нейронального торможения.
Каудальная вентролатеральная ретикулярная формация продолговатого мозга общепризнанно считается центром интеграции кардиоваскулярных и моторных рефлекторных реакций, в том числе инициируемых ноцицептивными раздражителями, и является важным звеном эндогенной системы контроля болевой чувствительности [2, 28, 33, 34]. Ранее было установлено, что эта область, получающая висцеросенсорную информацию от восходящих спиноталамического, спиноретикулярного и спиномезенцефалического трактов [27, 35], содержит специфические популяции реагирующих на кишечное растяжение нейронов, изменения в активности которых могут служить индикатором супраспинального проведения болевых сигналов от толстой кишки [35–38]. Наше исследование свидетельствует о существовании в кВЛРО двух групп нейронов – возбуждающихся и тормозящихся в ответ на ноцицептивное колоректальное растяжение. Это согласуется с результатами других работ [36, 38] и совпадает с ранее полученными нами данными [39–41]. Кроме того, сходные по свойствам группы нейронов обнаружены в люмбосакральном и тораколюмбальном отделах спинного мозга [42], ядре одиночного тракта [41, 43], большом ядре шва [44], вентральном заднелатеральном ядре таламуса [45] и передней инсулярной коре [46].
Выявленное нами различие в фоновой импульсной активности возбуждающихся и тормозящихся при КРР нейронов кВЛРО подтверждает их принадлежность к функционально различным популяциям. Имеющиеся иммуногистохимические данные указывают, что возбуждающиеся при растяжении кишки клетки ВЛРО, по крайней мере частично, могут быть катехоламинергическими [47, 48]. По мнению ведущих специалистов в этой области, такие клетки имеют непосредственное отношение к механизмам восходящего проведения висцерального болевого сигнала и могут быть отнесены к специфическим висцеральным ноцицептивным нейронам [36, 38, 49]. Эту точку зрения поддерживают результаты наших предыдущих работ, в которых возбуждающаяся при КРР группа нейронов являлась мишенью для действия фармакологических препаратов со свойствами висцеральных анальгетиков [39, 50, 51] и демонстрировала признаки сенситизации при кишечном воспалении [40, 41]. Наблюдавшееся нами в данном исследовании снижение реактивности таких бульбарных клеток к КРР после электростимуляции ЦеА может свидетельствовать об антиноцицептивном действии амигдалы, вследствие которого представляется уместным ожидать ослабления исходящего из кВЛРО висцерального болевого потока к вышележащим структурам мозга.
Нейрохимическая и функциональная принадлежность тормозящихся в ответ на кишечную стимуляцию бульбарных нейронов в настоящее время не определена. На основании сходства этих клеток кВЛРО по своим свойствам с тормозными off-нейронами рострального вентромедиального отдела продолговатого мозга ряд авторов связывает их с функционированием бульбарной антиноцицептивной системы [38, 49]. Вместе с тем, наши предыдущие исследования показали, что такие клетки могут участвовать в процессах дифференцировки соматических и висцеральных болевых сигналов [41]. Кроме того, по крайней мере часть из них может быть вовлечена в реализацию продемонстрированных ранее гипотензивных кардиоваскулярных реакций на висцеральную ноцицепцию [41, 51, 52], которые могут обеспечиваться вазодепрессорной (симпатоингибирующей) кВЛРО [33, 34] посредством ее тормозно-возбуждающих нейрональных взаимодействий с симпатоактивирующей ростральной вентролатеральной ретикулярной областью продолговатого мозга [2, 28, 53]. Более конкретная функциональная идентификация тормозящихся при ноцицептивной кишечной стимуляции нейронов кВЛРО требует проведения специальных исследований. Наблюдавшееся в наших экспериментах уменьшение тормозных нейрональных реакций кВЛРО на кишечное растяжение после активации ЦеА может свидетельствовать в пользу амигдалофугального подавления не только возбуждающей, но и тормозной нейротрансмиссии висцеральных болевых сигналов в исследованной области продолговатого мозга, следствием чего может являться уменьшение всех вызываемых ими рефлекторных реакций бульбарного уровня. Продемонстрированное в нашем исследовании общее тормозное влияние ЦеА на бульбарные механизмы обработки висцеральных болевых сигналов согласуется с антиноцицептивными эффектами его стимуляции нейропептидами и агонистами нейротрансмиттеров на моделях соматической боли у бодрствующих животных [31, 54, 55].
Эффекты стимуляции латеральной части ЦеА могут реализоваться как через ее собственные нисходящие проекции, так и через связи активируемой ею медиальной части ядра [3, 30, 31], то есть через нисходящие пути ЦеА в целом. В частности, тормозные амигдалофугальные влияния на связанные с висцеральной ноцицепцией нейроны продолговатого мозга могут реализоваться через относительно слабо выраженные, но все же существующие прямые ГАМК-ергические проекции ЦеА на кВЛРО [1, 56–58]. Активация этих входов может приводить к подавлению возбуждающих нейрональных реакций этой бульбарной области на КРР. Эти же амигдалофугальные проекции способны подавлять активность присутствующих в кВЛРО ноцицептивных ГАМК-ергических нейронов [59], ослабляя тем самым инициируемую КРР локальную тормозную нейротрансмиссию. Существенную роль в обеспечении выявленных эффектов ЦеА могут играть его более массивные ингибиторные входы к ростральной вентролатеральной ретикулярной области продолговатого мозга и ядру одиночного тракта [1, 57, 58], которые, как известно, оказывают активирующие влияния на кВЛРО [57, 60, 61]. Поэтому общее снижение возбуждающей нейрональной активности последней частично может быть следствием амигдалофугального торможения нейронов указанных бульбарных областей. В то же время, имеющиеся в меньшем количестве глутаматергические проекции от ЦеА к этим же структурам [62] могут способствовать усилению их активирующих входов в кВЛРО с последующим ослаблением тормозных реакций части ее нейронов на растяжение кишки. Кроме вышеперечисленного, продемонстрированные нами модулирующие влияния ЦеА на возбуждающую и тормозную висцеральную ноцицептивную трансмиссию в кВЛРО могут быть опосредованы вентролатеральной областью центрального серого вещества среднего мозга – одним из ключевых компонентов эндогенной системы контроля болевой чувствительности [56, 63–65].
Как впервые показало наше исследование, развитие колита сопровождается ослаблением тормозных влияний ЦеА на активирующиеся при колоректальном растяжении нейроны кВЛРО, что может свидетельствовать о нарушении амигдалобульбарных влияний в этих условиях. Одной из причин может являться вызываемое кишечным воспалением усиление глутаматергической нейротрансмиссии в пределах исследуемого амигдалярного ядра [21, 66], которое может способствовать ослаблению тормозных ГАМК-ергических и усилению возбуждающих глутаматергических влияний ЦеА на кВЛРО и/или активирующие ее бульбарные структуры. Сходное усиление глутамат-зависимой нейрональной активности в ЦеА было продемонстрировано при соматических патологиях – артрите и периферической нейропатии [30, 31, 67]. Одним из свидетельств в пользу усиления возбуждающих амигдалярных влияний при кишечном воспалении может являться наблюдавшееся нами после стимуляции ЦеА увеличение уровня фоновой активности тормозящихся при КРР бульбарных нейронов, которое отсутствовало у здоровых животных. В связи с этим представляется закономерным, что вызываемое ЦеА ослабление тормозных нейрональных реакций на растяжение кишки при таких условиях сохранялось, тогда как его подавляющие, вероятнее всего ГАМК-зависимые, эффекты на фоновую и вызванную активность возбуждающихся ноцицептивных нейронов кВЛРО были существенно ослаблены. В своей совокупности такие опосредуемые локальными глутаматергическими механизмами изменения в нисходящих влияниях ЦеА при колите могут способствовать усилению висцеральной болевой трансмиссии при по-прежнему ослабленной, т. е. неадекватной, реализации инициируемых ею антиноцицептивных и кардиоваскулярных рефлекторных реакций бульбарного уровня. Косвенным подтверждением справедливости этого предположения является продемонстрированное ранее усиление кишечной болевой чувствительности у бодрствующих мышей после фармакологической активации в ЦеА метаботропных глутаматных рецепторов [11].
Определенную роль в способствующих ноцицепции перестройках амигдалофугальных влияний при кишечном воспалении также может играть ассоциированное с ним увеличение в ЦеА уровня экспрессии кортикотропин-рилизинг-фактора [23]. Ранее было установлено, что микроинъекции кортикотропин-рилизинг-гормона в это ядро способствует усилению реакции бодрствующего животного на ноцицептивное колоректальное растяжение [6, 12, 13], тогда как блокада локального синтеза указанного гормона или антагонизм его рецепторов 1-го типа уменьшал кишечную гиперчувствительность [12, 14, 15]. Имеющиеся к настоящему времени экспериментальные данные позволяют предполагать, что повышенный уровень локального кортикотропин-рилизинг-фактора может усиливать опосредуемые им возбуждающие влияния ЦеА на клетки паравентрикулярного ядра гипоталамуса [68–70]. Измененный уровень амигдалофугальной активации последнего, в свою очередь, может приводить к смещению баланса его возбуждающих и тормозных модулирующих влияний на кВЛРО в сторону более выраженного возбуждения [71–73], способствуя тем самым усилению висцеральной болевой трансмиссии в этой структуре.
Таким образом, в нашем исследовании впервые продемонстрировано, что центральное ядро амигдалы оказывает тормозное действие на нейрональные процессы обработки висцерального болевого сигнала в каудальной вентролатеральной ретикулярной области продолговатого мозга, что может приводить к уменьшению восходящего ноцицептивного потока и инициируемых им рефлекторных реакций бульбарного уровня. Установлено, что угнетающий эффект активации центральной амигдалы на вызываемое кишечным растяжением возбуждение бульбарных ретикулярных нейронов существенно ослабевает при колите, свидетельствуя о нарушении антиноцицептивных амигдалобульбарных влияний при висцеральной патологии. Такие нарушения могут способствовать усилению супраспинальной трансмиссии ноцицептивных сигналов от толстой кишки, т.е. лежать в основе центральных механизмов патогенеза кишечной гипералгезии и хронической абдоминальной боли при воспалительных заболеваниях желудочно-кишечного тракта. Необходимы дальнейшие исследования для выяснения конкретных анатомических путей и нейрохимических процессов, вовлеченных в реализацию антиноцицептивных амигдалобульбарных влияний и их нарушения при висцеральной патологии.
Список литературы
Любашина ОА, Пантелеев СС, Ноздрачев АД (2009) Амигдалофугальная модуляция вегетативных центров мозга. СПб Наука. [Ljubashina OA, Panteleev SS, Nozdrachev AD (2009) Amigdalofugal’naja moduljacija vegetativnyh centrov mozga [Amygdalofugal modulation of the autonomic centers of the brain]. SPb Nauka (In Russ)].
Benarroch EE (2012) Central autonomic control. In: Robertson D, Biaggioni I, Burnstock G, Low PA, Paton JFR (eds) Primer on the autonomic nervous system. 3rd ed. Elsevier Amsterdam. 9–12. https://doi.org/10.1016/B978-0-12-386525-0.00002-0
Pitkänen A (2000) Connectivity of the rat amygdaloid complex. In: Aggleton JP (ed) The amygdala: a functional analysis. Oxford Univer Press New York 31–115.
Browning KN, Travagli RA (2014) Central nervous system control of gastrointestinal motility and secretion and modulation of gastrointestinal functions. Compr Physiol 4(4): 1339–1368. https://doi.org/10.1002/cphy.c130055
Critchley HD, Harrison NA (2013) Visceral influences on brain and behavior. Neuron 77(4): 624–638. https://doi.org/10.1016/j.neuron.2013.02.008
Meerveld BG, Johnson AC (2018) Mechanisms of stress-induced visceral pain. J Neurogastroenterol Motil 24(1): 7–18. https://doi.org/10.5056/jnm17137
Bonaz B, Baciu M, Papillon E, Bost R, Gueddah N, Le Bas JF, Fournet J, Segebarth C (2002) Central processing of rectal pain in patients with irritable bowel syndrome: an fMRI study. Am J Gastroenterol 97(3): 654–661. https://doi.org/10.1111/j.1572-0241.2002.05545.x
Rubio A, Pellissier S, Van Oudenhove L, Ly HG, Dupont P, Tack J, Dantzer C, Delon-Martin C, Bonaz B (2016) Brain responses to uncertainty about upcoming rectal discomfort in quiescent Crohn’s disease – a fMRI study. Neurogastroenterol Motil 28(9): 1419–1432. https://doi.org/10.1111/nmo.12844
Lazovic J, Wrzos HF, Yang QX, Collins CM, Smith MB, Norgren R, Matyas K, Ouyang A (2005) Regional activation in the rat brain during visceral stimulation detected by c-fos expression and fMRI. Neurogastroenterol Motil 17(4): 548–556. https://doi.org/10.1111/j.1365-2982.2005.00655.x
Nakagawa T, Katsuya A, Tanimoto S, Yamamoto J, Yamauchi Y, Minami M, Satoh M (2003) Differential patterns of c-fos mRNA expression in the amygdaloid nuclei induced by chemical somatic and visceral noxious stimuli in rats. Neurosci Lett 344(3): 197–200. https://doi.org/10.1016/S0304-3940(03)00465-8
Crock LW, Kolber BJ, Morgan CD, Sadler KE, Vogt SK, Bruchas MR, Gereau RW (2012) Central amygdala metabotropic glutamate receptor 5 in the modulation of visceral pain. J Neurosci 32(41): 14217–14226. https://doi.org/10.1523/JNEUROSCI.1473-12.2012
Prusator DK, Greenwood-Van Meerveld B (2017) Amygdala-mediated mechanisms regulate visceral hypersensitivity in adult females following early life stress: importance of the glucocorticoid receptor and corticotropin-releasing factor. Pain 158(2): 296–305. https://doi.org/10.1097/j.pain.0000000000000759
Su J, Tanaka Y, Muratsubaki T, Kano M, Kanazawa M, Fukudo S (2015) Injection of corticotropin-releasing hormone into the amygdala aggravates visceral nociception and induces noradrenaline release in rats. Neurogastroenterol Motil 27(1): 30–39. https://doi.org/10.1111/nmo.12462
Johnson AC, Tran L, Greenwood-Van Meerveld B (2015) Knockdown of corticotropin-releasing factor in the central amygdala reverses persistent viscerosomatic hyperalgesia. Transl Psychiatry 5(3): e517. https://doi.org/10.1038/tp.2015.16
Taché Y (2015) Corticotrophin-releasing factor 1 activation in the central amygdale and visceral hyperalgesia. Neurogastroenterol Motil 27(1): 1–6. https://doi.org/10.1111/nmo.12495
Bao CH, Liu P, Liu HR, Wu LY, Shi Y, Chen WF, Qin W, Lu Y, Zhang JY, Jin XM, Wang XM, Zhao JM, Liu XM, Tian J, Wu HG (2015) Alterations in brain grey matter structures in patients with crohn’s disease and their correlation with psychological distress. J Crohns Colitis 9(7): 532–540. https://doi.org/10.1093/ecco-jcc/jjv057
Jarcho JM, Feier NA, Bert A, Labus JA, Lee M, Stains J, Ebrat B, Groman SM, Tillisch K, Brody AL, London ED, Mandelkern MA, Mayer EA (2013) Diminished neurokinin-1 receptor availability in patients with two forms of chronic visceral pain. Pain 154(7): 987–996. https://doi.org/10.1016/j.pain.2013.02.026
Nair VA, Beniwal-Patel P, Mbah I, Young BM, Prabhakaran V, Saha S (2016) Structural imaging changes and behavioral correlates in patients with Crohn’s disease in remission. Front Hum Neurosci 10: 460. https://doi.org/10.3389/fnhum.2016.00460
Agostini A, Filippini N, Benuzzi F, Bertani A, Scarcelli A, Leoni C, Farinelli V, Riso D, Tambasco R, Calabrese C, Rizzello F, Gionchetti P, Ercolani M, Nichelli P, Campieri M (2013) Functional magnetic resonance imaging study reveals differences in the habituation to psychological stress in patients with Crohn’s disease versus healthy controls. J Behav Med 36(5): 477–487. https://doi.org/10.1007/s10865-012-9441-1
Jain P, Hassan AM, Koyani CN, Mayerhofer R, Reichmann F, Farzi A, Schuligoi R, Malle E, Holzer P (2015) Behavioral and molecular processing of visceral pain in the brain of mice: impact of colitis and psychological stress. Front Behav Neurosci 9: 177. https://doi.org/10.3389/fnbeh.2015.00177
Ji G, Li Z, Neugebauer V (2015) Reactive oxygen species mediate visceral pain-related amygdala plasticity and behaviors. Pain 156(5): 825–836. https://doi.org/10.1097/j.pain.0000000000000120
Reichmann F, Painsipp E, Holzer P (2013) Environmental enrichment and gut inflammation modify stress-induced c-Fos expression in the mouse corticolimbic system. PLoS One 8(1): e54811. https://doi.org/10.1371/journal.pone.0054811
Greenwood-Van Meerveld B, Johnson AC, Schulkin J, Myers DA (2006) Long-term expression of corticotropin-releasing factor (CRF) in the paraventricular nucleus of the hypothalamus in response to an acute colonic inflammation. Brain Res 1071(1): 91–96. https://doi.org/10.1016/j.brainres.2005.11.071
Reichmann F, Hassan A, Farzi A, Jain P, Schuligoi R, Holzer P (2015) Dextran sulfate sodium-induced colitis alters stress-associated behaviour and neuropeptide gene expression in the amygdala-hippocampus network of mice. Sci Rep 5: 9970. https://doi.org/10.1038/srep09970
Moshiree B, Zhou Q, Price DD, Verne GN (2006) Central sensitisation in visceral pain disorders. Gut 55(7): 905–958. https://doi.org/10.1136/gut.2005.078287
Siegel CA, MacDermott RP (2009) Is chronic pain an extraintestinal manifestation of IBD? Inflammatory Bowel Diseases 15(5): 769–771. https://doi.org/10.1002/ibd.20844
Al-Chaer ED, Willis WD (2007) Neuroanatomy of visceral pain: pathways and processes. In: Pasricha PJ, Willis WD, Gebhart GF (eds) Chronic abdominal and visceral pain. Theory and practice. New York Informa Healthcare USA 33–44.
Cortelli P, Giannini G, Favoni V, Cevoli S, Pierangeli G (2013) Nociception and autonomic nervous system. Neurol Sci 34(Suppl 1): S41–S46. https://doi.org/10.1007/s10072-013-1391-z
Paxinos G, Watson C (1998) The rat brain in stereotaxic coordinates. 4th ed London Acad Press.
Neugebauer V (2015) Amygdala pain mechanisms. Handb Exp Pharmacol 227: 261–284. https://doi.org/10.1007/978-3-662-46450-2_13
Veinante P, Yalcin I, Barrot M (2013) The amygdala between sensation and affect: a role in pain. J Mol Psychiatr 1(1): 9. https://doi.org/10.1186/2049-9256-1-9
Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL (1989) Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology 96 (3): 795–803. PMID: 2914642
Martins I, Tavares I (2017). Reticular formation and pain: the past and the future. Front Neuroanat 11: 51. https://doi.org/10.3389/fnana.2017.00051
Tavares I, Lima D (2007) From neuroanatomy to gene therapy: searching for new ways to manipulate the supraspinal endogenous pain modulatory system. J Anat 211(2): 261–268. https://doi.org/10.1111/j.1469-7580.2007.00759.x
Robbins MT, Uzzell TW, Aly S, Ness TJ (2005) Visceral nociceptive input to the area of the medullary lateral reticular nucleus ascends in the lateral spinal cord. Neurosci Lett 381(3): 329–333. https://doi.org/10.1016/j.neulet.2005.02.046
Ness TJ, Follett KA, Piper J, Dirks BA (1998) Characterization of neurons in the area of the medullary lateral reticular nucleus responsive to noxious visceral and cutaneous stimuli. Brain Res 802(1–2): 163–174. https://doi.org/10.1016/s0006-8993(98)00608-8
Panteleev SS, Martseva AA, Lyubashina OA (2015) The inhibitory effect of granisetron on ventrolateral medulla neuron responses to colorectal distension in rats. Eur J Pharmacol 749: 49–55. https://doi.org/10.1016/j.ejphar.2015.01.002
Pinto-Ribeiro F, Ansah OB, Almeida A, Pertovaara A (2011) Response properties of nociceptive neurons in the caudal ventrolateral medulla (CVLM) in monoarthritic and healthy control rats: modulation of responses by the paraventricular nucleus of the hypothalamus (PVN). Brain Res Bull 86(1–2): 82–90. https://doi.org/10.1016/j.brainresbull.2011.06.014
Lyubashina OA, Sivachenko IB, Panteleev SS, Nozdrachev AD (2016) Effects of 5-HT3 receptor blockade on visceral nociceptive neurons in the ventrolateral reticular field of the rat medulla oblongata. J Evol Biochem Phys 52(4): 313–325.https://doi.org/10.1134/S0022093016040062
Lyubashina OA, Sivachenko IB, Busygina II, Panteleev SS (2018) Colitis-induced alterations in response properties of visceral nociceptive neurons in the rat caudal medulla oblongata and their modulation by 5-HT3 receptor blockade. Brain Res Bull 142: 183–196. https://doi.org/10.1016/j.brainresbull.2018.07.013
Lyubashina OA, Sivachenko IB, Sokolov AY (2019) Differential responses of neurons in the rat caudal ventrolateral medulla to visceral and somatic noxious stimuli and their alterations in colitis. Brain Res Bull 152: 299–310. https://doi.org/10.1016/j.brainresbull.2019.07.030
Wang G, Tang B, Traub RJ (2005) Differential processing of noxious colonic input by thoracolumbar and lumbosacral dorsal horn neurons in the rat. J Neurophysiol 94 (6): 3788–3794. https://doi.org/10.1152/jn.00230.2005
Panteleev SS, Sivachenko IB, Lyubashina OA (2021) The buspirone-dependent abdominal pain transmission within the nucleus tractus solitarius in the rat. Neuroscience 452: 326–334. https://doi.org/10.1016/j.neuroscience.2020.11.032
Brink TS, Mason P (2003) Raphe magnus neurons respond to noxious colorectal distension. J Neurophysiol 89(5): 2506–2015. https://doi.org/10.1152/jn.00825.2002
Zhang HQ, Al-Chaer ED, Willis WD (2002) Effect of tactile inputs on thalamic responses to noxious colorectal distension in rat. J Neurophysiol 88(3): 1185–1196. https://doi.org/10.1152/jn.2002.88.3.1185
Gao J, Wu X, Owyang C, Li Y (2006) Enhanced responses of the anterior cingulate cortex neurones to colonic distension in viscerally hypersensitive rats. J Physiol 570(Pt 1): 169–183. https://doi.org/10.1113/jphysiol.2005.096073
Han F, Zhang YF, Li YQ (2003) Fos expression in tyrosine hydroxylase-containing neurons in rat brainstem after visceral noxious stimulation: an immunohistochemical study. World J Gastroenterol 9(5): 1045–1050. https://doi.org/10.3748/wjg.v9.i5.1045
Wang L, Martínez V, Larauche M, Taché Y (2009) Proximal colon distension induces Fos expression in oxytocin-, vasopressin-, CRF- and catecholamines-containing neurons in rat brain. Brain Res 1247: 79–91. https://doi.org/10.1016/j.brainres.2008.09.094
Almeida A, Leite-Almeida H, Tavares I (2006) Medullary control of nociceptive transmission: Reciprocal dual communication with the spinal cord. Drug Discov Today Dis Mech 3(3): 305–312. https://doi.org/10.1016/j.ddmec.2006.09.001
Lyubashina OA, Sivachenko IB (2017) The 5-HT4 receptor-mediated inhibition of visceral nociceptive neurons in the rat caudal ventrolateral medulla. Neuroscience 359: 277–288. https://doi.org/10.1016/j.neuroscience.2017.07.039
Panteleev SS, Sivachenko IB, Lyubashina OA (2018) The central effects of buspirone on abdominal pain in rats. Neurogastroenterol Motil 30(11): e13431. https://doi.org/10.1111/nmo.13431
Пантелеев СС, Сиваченко ИБ, Бусыгина ИИ, Любашина ОА (2020) Эффекты стимуляции инфралимбической коры на реакции нейронов каудальной вентролатеральной ретикулярной формации, вызванные ноцицептивным раздражением толстой кишки крысы. Рос физиол журн им ИМ Сеченова 106(12): 1524–1540. [Panteleev SS, Sivachenko IB, Busygina II, Lyubashina OA (2020) Effects of the infralimbic cortex stimulation on the caudal ventrolateral reticular formation neuron responses to the nociceptive rat colon distension. Russ J Physiol 106(12): 1524–1540. (In Russ)]. https://doi.org/10.31857/S0869813920120067
Campos RR, Carillo BA, Oliveira-Sales EB, Silva AM, Silva NF, Futuro Neto HA, Bergamaschi CT (2008). Role of the caudal pressor area in the regulation of sympathetic vasomotor tone. Braz J Med Biol Res 41(7): 557–562. https://doi.org/10.1590/s0100-879x2008000700002
Han Y, Yu LC (2009) Involvement of oxytocin and its receptor in nociceptive modulation in the central nucleus of amygdala of rats. Neurosci Lett 454(1): 101–104. https://doi.org/10.1016/j.neulet.2009.02.062
Ortiz JP, Heinricher MM, Selden NR (2007) Noradrenergic agonist administration into the central nucleus of the amygdala increases the tail-flick latency in lightly anesthetized rats. Neuroscience 148(3): 737–743. https://doi.org/10.1016/j.neuroscience.2007.07.003
Cobos A, Lima D, Almeida A, Tavares I (2003) Brain afferents to the lateral caudal ventrolateral medulla: a retrograde and anterograde tracing study in the rat. Neuroscience 120(2): 485–498. https://doi.org/10.1016/s0306-4522(03)00209-4
Saha S (2005) Role of the central nucleus of the amygdala in the control of blood pressure: descending pathways to medullary cardiovascular nuclei. Clin Exp Pharmacol Physiol 32(5–6): 450–456. https://doi.org/10.1111/j.1440-1681.2005.04210.x
Jia HG, Rao ZR, Shi JW (1997) Evidence of gamma-aminobutyric acidergic control over the catecholaminergic projection from the medulla oblongata to the central nucleus of the amygdala. J Comp Neurol 381(3): 262–281.https://doi.org/10.1002/(sici)1096-9861(19970512)381:3<262::aid-cne2>3.0.co;2-0
Pinto M, Lima D, Castro-Lopes J, Tavares I (2003) Noxious-evoked c-fos expression in brainstem neurons immunoreactive for GABAB, mu-opioid and NK-1 receptors. Eur J Neurosci 17(7): 1393–1402. https://doi.org/10.1046/j.1460-9568.2003.02586.x
Gieroba ZJ, Li YW, Blessing WW (1992) Characteristics of caudal ventrolateral medullary neurons antidromically activated from rostral ventrolateral medulla in the rabbit. Brain Res 582(2): 196–207. https://doi.org/10.1016/0006-8993(92)90133-t
Oshima N, Kumagai H, Iigaya K, Onimaru H, Kawai A, Nishida Y, Saruta T, Itoh H (2012) Baro-excited neurons in the caudal ventrolateral medulla (CVLM) recorded using the whole-cell patch-clamp technique. Hypertens Res 35(5): 500–506. https://doi.org/10.1038/hr.2011.211
Chapp AD, Gui L, Huber MJ, Liu J, Larson RA, Zhu J, Carter JR, Chen QH (2014) Sympathoexcitation and pressor responses induced by ethanol in the central nucleus of amygdala involves activation of NMDA receptors in rats. Am J Physiol Heart Circ Physiol 307(5): H701–H709. https://doi.org/10.1152/ajpheart.00005.2014
Li JN, Sheets PL (2018) The central amygdala to periaqueductal gray pathway comprises intrinsically distinct neurons differentially affected in a model of inflammatory pain. J Physiol 596(24): 6289–6305. https://doi.org/10.1113/JP276935
Benarroch EE (2012) Periaqueductal gray: an interface for behavioral control. Neurology 78(3): 210–217. https://doi.org/10.1212/WNL.0b013e31823fcdee
Samineni VK, Grajales-Reyes JG, Copits BA, O’Brien DE, Trigg SL, Gomez AM, Bruchas MR, Gereau RW 4th (2017) Divergent modulation of nociception by glutamatergic and GABAergic neuronal subpopulations in the periaqueductal gray. eNeuro 4(2):ENEURO.0129-16.2017. https://doi.org/10.1523/ENEURO.0129-16.2017
Ji G, Neugebauer V (2010) Reactive oxygen species are involved in group I mGluR-mediated facilitation of nociceptive processing in amygdala neurons. J Neurophysiol 104(1): 218–229. https://doi.org/10.1152/jn.00223.2010
Gonçalves L, Dickenson AH (2012) Asymmetric time-dependent activation of right central amygdala neurones in rats with peripheral neuropathy and pregabalin modulation. Eur J Neurosci 36(9): 3204–3213. https://doi.org/10.1111/j.1460-9568.2012.08235.x
Lyubashina OA, Itsev DE (2007) NO-Dependent mechanisms of amygdalofugal modulation of hypothalamic autonomic neurons. Neurosci Behav Physiol 37(9): 895–901. https://doi.org/10.1007/s11055-007-0096-2
Callahan LB, Tschetter KE, Ronan PJ (2013) Inhibition of corticotropin releasing factor expression in the central nucleus of the amygdala attenuates stress-induced behavioral and endocrine responses. Front Neurosci 7: 195. https://doi.org/10.3389/fnins.2013.00195
Marcilhac A, Siaud P (1997) Identification of projections from the central nucleus of the amygdala to the paraventricular nucleus of the hypothalamus which are immunoreactive for corticotrophin-releasing hormone in the rat. Exp Physiol 82(2): 273–281. https://doi.org/10.1113/expphysiol.1997.sp004022
Bowman BR, Kumar NN, Hassan SF, McMullan S, Goodchild AK (2013) Brain sources of inhibitory input to the rat rostral ventrolateral medulla. J Comp Neurol 521(1): 213–232. https://doi.org/10.1002/cne.23175
Geerling JC, Shin JW, Chimenti PC, Loewy AD (2010) Paraventricular hypothalamic nucleus: axonal projections to the brainstem. J Comp Neurol 518(9): 1460–1499. https://doi.org/10.1002/cne.22283
Yang Z, Coote J (1999) The influence of the paraventricular nucleus on baroreceptor dependent caudal ventrolateral medullary neurones of the rat. Pflügers Arch 438(1): 47–52. https://doi.org/10.1007/s004240050878
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


