Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 10, стр. 1250-1263
Мезенхимальные стволовые клетки и активация репаративных процессов в мозге и сетчатке
В. А. Кульчицкий 1, *, А. С. Замаро 1, Ю. Г. Шанько 2, В. М. Рубахова 1
1 Институт физиологии НАН Беларуси
Минск, Республика Беларусь
2 Республиканский научно-практический центр неврологии и нейрохирургии МЗ РБ
Минск, Республика Беларусь
* E-mail: kulchitski48@mail.ru
Поступила в редакцию 04.03.2021
После доработки 30.06.2021
Принята к публикации 06.07.2021
Аннотация
C целью моделирования процессов апоптоза в центральной нервной системе и сетчатке глаза проведена энуклеация одного глазного яблока у крыс самцов линии Вистар (n = 10) в возрасте 10–12 нед. Одновременно в одной серии опытов (n = 5) ввели парабульбарно на стороне интактного глаза 100 000 мезенхимальных стволовых клеток (МСК), меченных PKH67, в 100 мкл буферного раствора. В другой серии опытов на крысах (n = 5) непосредственно после энуклеации с одной стороны глаза осуществили интраназальное введение в верхнюю часть полости носа 100 000 МСК, окрашенных PKH67, в 100 мкл буферного раствора. На третьи сутки после энуклеации животных декапитировали и готовили срезы головного мозга и сетчатки глаза. Установили распределение флуоресцирующих МСК в структурах четверохолмия среднего мозга, в латеральном коленчатом теле промежуточного мозга и в сетчатке сохраненного глаза в обеих сериях опытов. Заключили, что интраназальная периневральная имплантация МСК перспективна в качестве альтернативного метода доставки МСК в сетчатку глаза пациентов с признаками дегенеративных процессов в этой структуре глаза.
Функционирование зрительной системы нарушается при заболеваниях, связанных с развитием дистрофических, дегенеративных и иных разрушительных процессов в сетчатой оболочке глаза в экспериментальных [1] или в естественных условиях, что является во всем мире ведущей причиной развития слепоты (caecitas) [2–4]. Микрохирургические операции по восстановлению зрения до сих пор являются недостаточно эффективными, что постоянно инициирует поиск новых методических приемов в области офтальмологии. В последние годы арсенал клиницистов и исследователей этого актуального вопроса был расширен за счет применения методик клеточной терапии. Активация нововведений в этой области инициирована разработкой Национальным нститутом здоровья США программы SCOTS (The Stem Cell Ophthalmology Treatment Study, Identifier NCT Number 01920867. SCOTS), которая является самым обширным исследованием в области применения стволовых клеток (СК) в офтальмологии, зарегистрированным Национальным институтом здоровья США [2]. Итак, клеточные технологии в микрохирургии глаза интенсивно развиваются, но стабильных и обнадеживающих результатов в восстановлении зрения до сих пор так и не достигнуто. Этот факт является своеобразным триггером для более интенсивного экспериментального анализа новых методик с целью последующего внедрения в офтальмологии.
Одной из базовых методик клеточных технологий является метод имплантации СК, включая по показаниям мезенхимальные СК (МСК), которые микрохирурги вводят в системный кровоток или в субтеноновое пространство, интравитреально, субретинально, субконюнктивально для активации репаративных процессов в сетчатке глаза [3, 4]. Результаты микрохирургических операций, включающих клеточные технологии, обнадеживают [3, 4], но многообразие причин и закономерностей развития патологических процессов в сетчатке глаза (ретинопатии, макулодистрофии, ангиопатии сетчатки) требует конкретизации показаний к применению и детализации эффектов СК, а также поиск более эффективных и безопасных способов применения репаративных технологий. В первую очередь речь идет о минимизации побочных эффектов при манипулировании непосредственно на глазном яблоке.
Проблема клеточных технологий в офтальмологии сравнительно новая. На сочетание “stem cell retina disease” 20 лет назад в PubMed встречались лишь единичные публикации. В современных условиях, 21 февраля 2021 г., в PubMed на сочетание “stem cell retina disease” обнаружено 1734 статьи, “cell technology retina disease” – 1442 статьи. Конкретно по тематикам среди этих статей есть 206 исследований на сочетание “subretinal stem cell retina disease”, и на “stem cell technology retina disease” – 226 публикаций . Среди этих методов доминируют публикации на сочетание слов: “intravitreal method stem cell retina disease” – 93 статьи, “intravenous method stem cell retina disease” – 14 статей, “subconjunctival method stem cell retina disease” – четыре статьи, “retrobulbar stem cell retina disease” найдено пять статей; “sub-tenons stem cell retina disease” – одна статья, “parabulbar method stem cell retina disease” – отсутствуют публикации.
В рамках проекта SCOTS проводятся уникальные исследования в клиниках. К примеру [3], микрохирурги подвели итоги 32 операций с применением МСК, рекомендованные SCOTS при лечении пациентов с возрастной дегенерацией желтого пятна (Age-Related Macular Degeneration), во время которых применяли следующие способы для введения СК костного мозга: ретробульбарно, в субтеноновое пространство, внутривенно, интравитреально, субретинально. Осложнений при применении этих методов не отмечено. Авторы заключили [3], что использование клеточных технологий в сочетании с традиционной терапией возрастной дегенерации желтого пятна продемонстрировало статистически значимое улучшение остроты зрения.
Методология SCOTS изложена в тематических статьях, к примеру [2, 3]. При замене пораженной ткани в сетчатке глаза одной из основных проблем является возможность восстановления нервных связей между клетками сетчатки глаза и нейронными сетями мозга [3, 4]. Таким образом, принципиально важно начинать терапию у пациентов на ранних этапах развития процессов дегенерации в сетчатке [3, 4]. В этом отношении клеточные технологии весьма перспективны, поскольку нейротрофическая роль МСК позитивно проявляется именно на ранних этапах развития нейродегенерации [5–7]. Этот факт объясняется тем, что для выделяемых из МСК трофических факторов (nerve growth factor (NGF), glial-derived neurotrophic factor (GDNF), brain-derived neurotrophic factor (BDNF), vascular endothelial growth factor (VEGF) и др.) [5–7] необходим поврежденный, но не разрушенный полностью объект воздействия в виде ганглионарных, биполярных, горизонтальных, амакриновых нейронов, радиальных глиальных клеток Мюллера, фоторецепторов. С другой стороны, вмешательство на ранней стадии развития нейродегенерации сопряжено с риском хирургических и терапевтических осложнений, когда пациенты все еще сохраняют относительно хорошее зрение [3, 4]. В этом отношении внедрение выверенных с точки зрения эффективности и безопасности в экспериментальной и клинической практике клеточных технологий перспективно для достижения позитивного результата и минимизации побочных эффектов в микрохирургии глаза.
В связи со сказанным выше сформулирована цель экспериментальной работы, которая направлена на верификацию гипотезы о возможности миграции МСК в поврежденные участки как головного мозга, так и сетчатки глаза после имплантации МСК взрослым самцам крыс линии Вистар (3–3.5 мес.) парабульбарно (n = 5) или в подслизистый слой полости носа в области терминалей обонятельного и тройничного нервов (n = 5). При этом учитывали данные [8] о способности МСК мигрировать после интраназальной имплантации вдоль краниальных нервов (обонятельный и тройничный нервы) в область разрушенного участка мозга.
Учитывая центрипетальные и центрифугальные связи нейронов сетчатки глаза с нейронными сетями различных отделов мозга (дорсальная таламо-ретинальная, вентральная таламо-ретинальная, претекто-ретинальная, текто-ретинальная, сегменто-мезэнцефало-ретинальная, дорсальная истмо-ретинальная, вентральная истмо-ретинальная системы [9–11]), предположили, что по этим волокнам способны мигрировать эндогенные СК из мозга в сетчатку глаза или имплантированные МСК при возникновении дегенеративных процессов в сетчатке. Дополнительным подспорьем для данной точки зрения являются сведения о существовании связей между центральными элементами системы обоняния и сетчаткой глаза [11]. Такая несколько парадоксальная информация о внутрицентральных взаимосвязях нейронных сетей обоняния и зрения [11] при детальном рассмотрении является дополнительным аргументом в пользу высказанного выше предположения об эволюционно сформированной основе для миграции СК в сетчатку глаза при формировании конкретных условий, к примеру, из эндогенного пула СК в обонятельных луковицах к очагам нейродеструкции в нервной ткани [8, 12–15]. Доказано, что одним из триггеров направленной миграции МСК в поврежденные участки мозга являются разнообразные хемокины [9], к примеру, stromal-cell-derived factor 1 (SDF-1) и fractalkine [12].
В задачи работы входило моделирование на первом этапе повреждений в сетчатке глаза и в головном мозге с последующим парабульбарным или интраназальным введением МСК, меченных флуоресцентным красителем. На следующем этапе через трое суток после энуклеации животных декапитировали и готовили послойные срезы головного мозга и сетчатки глаза с целью верификации распределения МСК в головном мозге и сетчатке глаза экспериментальных животных. Ответы на цель и задачи экспериментальной работы необходимы для заключения о целесообразности или бесперспективности продолжения подобных поисковых исследований в прикладном аспекте с целью разработки альтернативных способов имплантации аутологичных МСК пациентам с возрастной дегенерацией желтого пятна.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на крысах-самцах линии Вистар (n = 10) в возрасте 10–12 нед. Содержание животных в виварии Института физиологии Национальной академии наук Беларуси и экспериментальные манипуляции осуществляли с учетом рекомендаций Хельсинской декларации 1975 г. и ее пересмотренного варианта 2000 г. Протокол исследований и план экспериментов одобрен Этическим комитетом Института физиологии Национальной академии наук Беларуси (протокол № 41 от 13.12.2019, Б18Р-227). Основой для выбора дизайна исследования явилась модель апоптоза в сетчатке и в головном мозге крыс после повреждения зрительного нерва [1].
Животных содержали в виварии при обычном 12-часовом световом режиме при свободном доступе к воде и стандартному корму в клетках по 3–4 крысы. Помимо регулярного контроля массы тела крыс, дополнительное взвешивание осуществляли непосредственно перед проведением оперативного вмешательства.
Для имплантации использовали первичную культуру МСК, полученную из жировой ткани самок крыс (n = 7) массой 240–280 г по методике, утвержденной Ученым советом Института физиологии НАН Беларуси (протокол № 8 от 26.08.2010 г.). В стерильных условиях жировую ткань выделяли из большого сальника и околопочечной жировой клетчатки наркотизированных (55.6 мг/кг кетамина, 5.5 мг/кг ксилазина, 1.1 мг/кг ацепромазина, внутрибрюшинно) самок крыс массой 300–330 г. Полученную жировую массу помещали в пробирку, заполненную фосфатным буферным раствором (Sigma-Aldrich, США, рН 7.4). В условиях ламинарного шкафа (BioHazard, США) ткань, промытую в фосфатном буферном растворе, измельчали ножницами в чашке Петри до образования однородной массы. Ферментизацию проводили в СО2-инкубаторе при 37°С (ShellLab Series 3517, США) в течение 40 мин 0.075%-ным раствором коллагеназы I типа (Sigma-Aldrich, США) или в течение 30 мин 0.25%-ным раствором трипсина-EDTA (Sigma-Aldrich, США). Объемное соотношение жировой массы и энзима 1 : 1. Для нейтрализации активности энзима добавляли равный объем питательной среды Игла, модифицированной по способу Дульбекко с низким содержанием глюкозы 1000 мг/л (DMEM) (Sigma-Aldrich, США), содержащей 10% фетальной телячьей сыворотки (Gibco, США) и 100 мкг/мл сульфата гентамицина. Полученную суспензию клеток центрифугировали 10 мин со скоростью 1500 об./мин. Сформировавшуюся пленку из адипоцитов и супернатант удаляли. Клеточный осадок дважды отмывали в фосфатном буферном растворе в течение 10 мин при 1500 об./мин. После центрифугирования клеточный осадок ресуспензировали в полной питательной среде, содержащей питательную среду DMEM, 10% фетальной телячьей сыворотки, 100 мкг/мл сульфата гентамицина. Высевали в пластиковые культуральные флаконы.
Через 48 ч из чашки удаляли среду, промывали культуру фосфатным буферным раствором, удаляя остатки среды и сыворотки, добавляли 1 мл раствора трипсина и инкубировали 3 мин при температуре 37°С. Затем клетки отмывали от трипсина, центрифугируя в 3–5-ти мл фосфатного буферного раствора в присутствии 10% сыворотки в течение 10 мин со скоростью 1500 об./мин. Надосадочную жидкость удаляли. Осадок ресуспензировали в полной питательной среде и высевали в культуральные флаконы.
В день проведения имплантации клеточную массу суспензировали методом ферментативной диссоциации. Для этого из флакона с клетками удаляли питательную среду, промывали фосфатным буферным раствором. Клетки инкубировали в присутствии 1-го мл трипсина при температуре 37°С в течение 3 мин. Действие фермента инактивировали добавлением равного объема полной питательной среды. Полученную суспензию клеток пипетировали, объем доводили до 5-ти мл и центрифугировали 10 мин при скорости 1500 об./мин. Супернатант удаляли, а осадок ресуспензировали в 5-ти мл фосфатного буферного раствора. Суспензию центрифугировали в течение 10 мин при скорости 1500 об./мин. После удаления супернатанта осадок ресуспензировали в 1-ом мл раствора Diluent C и инкубировали 5 мин. Затем добавляли 5 мл фосфатного буферного раствора и центрифугировали в течение 10 мин при 1500 об./мин. Супернатант удаляли, а осадок ресуспензировали в 50-ти мкл фосфатного буферного раствора с добавлением 10-ти мкл раствора флуоресцирующего красителя РКН67 и инкубировали в темноте в течение 5 мин. Для удаления несвязанного красителя в пробирку вносили 5 мл фосфатного буферного раствора с добавлением 5% фетальной телячьей сыворотки и центрифугировали 10 мин при скорости 1500 об./мин. Из образовавшегося после удаления супернатанта осадка готовили суспензию окрашенных клеток для имплантации. При исследовании образцов, окрашенных PKH67 Green Fluorescent Cell Linker, на флуоресцентном микроскопе использовали фильтры с длиной волны возбуждения 490 нм и длиной волны испускания 502 нм. Концентрация живых клеток в готовой для имплантации суспензии составляла 100 000 клеток в 100 мкл фосфатного буферного раствора (подсчет осуществляли в камере Горяева).
Все операционные процедуры проводили на наркотизированных животных (55.6 мг/кг кетамина, 5.5 мг/кг ксилазина, 1.1 мг/кг ацепромазина, внутрибрюшинно). В условиях наркоза c помощью изогнутого пинцета из набора для микроопераций накладывали две лигатуры на зрительный нерв и сосуды, и после перерезки между лигатурами осуществляли энуклеацию одного глаза. Одновременно в одной серии опытов (n = 5) вводили парабульбарно на стороне “интактного” глаза 100 000 МСК, меченных PKH67, в 100 мкл буферного раствора. В другой серии опытов на крысах (n = 5) непосредственно после энуклеации с одной стороны глаза осуществляли интраназальную инъекцию в верхнюю часть полости носа 100 000 МСК, меченных PKH67, в 100 мкл буферного раствора. До выхода из наркоза животных размещали в отдельных клетках.
Через трое суток осуществляли декапитацию крыс с помощью гильотины (OpenScience Ltd, Россия) и изготавливали послойные горизонтальные срезы головного мозга толщиной 8 мкм и сетчатки глаза толщиной 12 мкм при температуре –19°С на криостате Microm HM525 (Microm International GmbH, Германия). Препараты непосредственно после их приготовления анализировали с помощью флуоресцентного микроскопа в Институте физики им. Б.И. Степанова Национальной академии наук Беларуси (Zeiss AxioVert 200M inverted research, камера: Zeiss AxioCam HRm, объектив: Plan-Neofluar 40x/0.75, Plan-Neofluar 20x/0.75 или Plan-Neofluar 10x/0.75).
Статистический тест Колмогорова–Смирнова (тест K/S) использовали для выявления различий между гистограммами флуоресценции PKH67. Различия между гистограммами считали статистически значимыми, при р < 0.001.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В процессе анализа горизонтальных срезов мозга и сетчатки глаза принимали во внимание, что повреждение в процессе энуклеации II, III, IV и VI краниальных нервов сопровождается развитием деструктивных процессов не только в структурах мозга (верхние бугры четверохолмия среднего мозга, латеральное коленчатое тело промежуточного мозга, зрительная кора), которые являются центральными элементами зрительного анализатора, но также и в сетчатке глаза, который не был удален [9, 10]. Триггером нейродеструктивных процессов являются патологические события, которые развертываются в тканях мозга и в сетчатке глаза после нарушения целостности в первую очередь волокон зрительного нерва, проходящих в центрипетальном и центрифугальном направлениях в пересеченных краниальных нервах при проведении энуклеации глазного яблока [9–11]. Перекрест зрительных нервов является основой для развития нейродеструктивных процессов на ипси- и контралатеральной сторонах мозга после энуклеации глазного яблока [9–11]. Акцентируем внимание вновь на сведениях [9, 10] о присутствии в зрительных нервах волокон, идущих как в центрипетальном, так и в центрифугальном направлениях. Следовательно, развитие после энуклеации одного глаза нейродеструктивных процессов в подкорковых зрительных центрах головного мозга сопровождается повреждением нейронов, отростки которых обеспечивают также центрифугальный поток информации к сетчатке интактного глаза прооперированного животного. Итак, после энуклеации глазного яблока формируются условия для деструктивных процессов не только в подкорковых центрах головного мозга, но и в сетчатке сохраненного глаза. Доказано, что в поврежденных тканях возрастает уровень хемокинов [12] и иных слабоизученных биосубстанций, которые являются факторами [6, 12], способными активировать процессы миграции МСК в разрушенные участки мозга и в сетчатку интактного глаза.
На рис. 1 представлена флуоресценция МСК в структурах четверохолмия среднего мозга, а на рис. 2 – в латеральном коленчатом теле промежуточного мозга через три дня после парабульбарного введения МСК на стороне интактного глаза. Что является причиной данной флуоресценции? Предположительно, по сохраненным краниальным нервам интактного глаза (II, III, IV и VI) МСК мигрировали в те отделы головного мозга, в которых начали развиваться нейродеструктивные процессы после энуклеации одного глазного яблока. Дальнейшие события воспринимаются несколько невероятно, но фактом является то, что после установленной миграции МСК из парабульбарной области в участки нейродеструкции подкорковых центров зрения (рис. 1 и 2) МСК по сохраненным волокнам зрительного нерва мигрируют в обратном направлении в те участки сетчатки глаза (рис. 3), в которых развиваются деструктивные процессы после нарушения центрифугальных и центрипетальных взаимосвязей нейронов подкорковых центров зрения с сетчатой оболочкой глаза.
Рис. 1.
Распределение флуоресцирующих меток от МСК в верхних буграх четверохолмия среднего мозга через трое суток после парабульбарного введения МСК на стороне сохраненного глаза. Шкала 50 мкм.
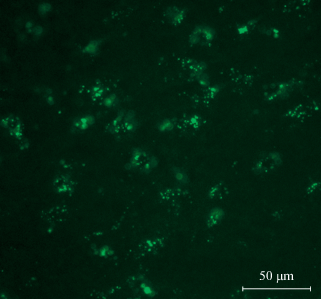
Рис. 2.
Распределение флуоресцирующих меток от МСК в латеральном коленчатом теле промежуточного мозга через трое суток после парабульбарного введения МСК на стороне сохраненного глаза. Шкала 50 мкм.
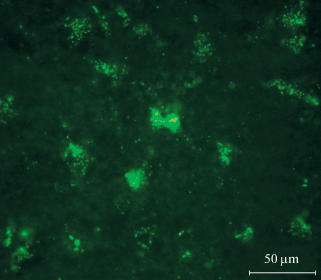
Рис. 3.
Распределение флуоресцирующих меток от МСК в сетчатке сохраненного глаза через трое суток после парабульбарного введения МСК на стороне этого глаза. Шкала 100 мкм.
Важным фактом является то, что флуоресценция обнаружена помимо сетчатки “интактного” глаза только в структурах подкорковых зрительных центров головного мозга. В остальных участках головного мозга, не входящих в состав зрительного анализатора, флуоресцирующие метки от МСК не выявлены.
На рис. 3 представлена флуоресценция МСК в сетчатке сохраненного глаза через трое суток после парабульбарного введения МСК на стороне этого глаза.
Выявленная в экспериментах миграция МСК в “интактный” глаз (и в головной мозг) после парабульбарного введения СК на стороне этого глаза гипотетически может быть обусловлена иными механизмами в отличие от тех, которые предлагают авторы статьи (к примеру, по кровеносным сосудам). Авторы приняли во внимание подобные варианты событий и в серии опытов на крысах (n = 5) после энуклеации одного глаза осуществили введение МСК интраназально. Данная методика отработана в Центре мозга Института физиологии НАН Беларуси около 10-ти лет назад [8] и является альтернативой внутривенного, эндолюмбального или введения МСК непосредственно в ткань мозга после трепанации черепа по показаниям при инсультах или травмах головного мозга [8, 16–19]. Кстати, в 2018 г. утверждена Министерством здравоохранения Республики Беларусь Инструкция по применению с использованием интраназального периневрального метода миграции МСК в поврежденную область головного мозга “Метод лечения инсульта с использованием аутологичных мезенхимальных стволовых клеток жировой ткани” (регистрационный номер № 242-1218), а в 2020 г. Инструкция по применению “Метод лечения черепно-мозговой травмы тяжелой степени с использованием биомедицинского клеточного продукта на основе мезенхимальных стволовых клеток жировой ткани” (регистрационный номер № 140-1220). Авторы статьи являются соавторами данных инструкций, которые применены по показаниям в комплексной терапии у 92 пациентов.
На рис. 4–6 визуализируются флуоресцирующие метки от МСК как в подкорковых ядрах зрительного анализатора (рис. 4 и 5), так и в сетчатке глаза (рис. 6) после интраназальной имплантации МСК.
Рис. 4.
Распределение флуоресцирующих меток от МСК в структурах верхних бугров четверохолмия среднего мозга через трое суток после интраназального введения МСК. Шкала 50 мкм.
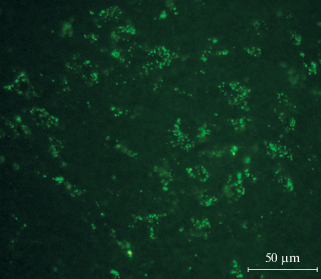
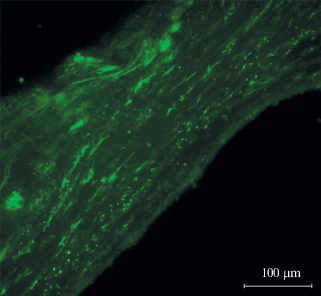
Рис. 5.
Распределение флуоресцирующих меток от МСК в латеральном коленчатом теле промежуточного мозга через трое суток после интраназального введения МСК. Шкала 50 мкм.

Рис. 6.
Распределение флуоресцирующих меток от МСК в сетчатке сохраненного глаза через трое суток после интраназального введения МСК. Шкала 50 мкм.
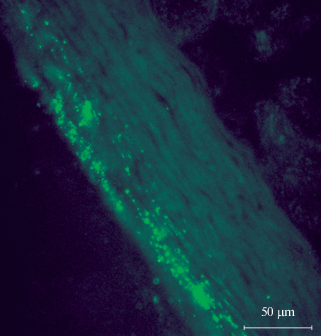
Итак, визуализация флуоресцирующих меток от МСК в структурах верхних бугров четверохолмия среднего мозга (рис. 4) и латеральном коленчатом теле промежуточного мозга (рис. 5) после интраназального введения МСК свидетельствует о миграции МСК из полости носа в те участки мозга, в которых в результате нейродеструкции накапливаются хемокины и иные биологические субстанции [5, 6], которые предположительно [5, 6, 12] являются естественными стимулами для осуществления периневрального перемещения МСК из полости носа по обонятельным и тройничным нервам в область повреждения мозга.
Поскольку факты, представленные на рис. 4 и 5, свидетельствуют о реальности перемещения МСК из подслизистой оболочки полости носа в поврежденные участки головного мозга, в которых расположены нейронные сети подкорковых центров зрительного анализатора, то логично на следующем этапе экспериментов проверить гипотезу о возможности миграции МСК из этих структур мозга в поврежденные участки сетчатки сохраненного глаза после энуклеации другого глаза. И, действительно, на рис. 6 представлена флуоресценция МСК в сетчатке сохраненного глаза через трое суток после интраназального введения МСК. Выявление флуоресценции в сетчатке глаза после интраназальной имплантации МСК требует логического объяснения, что и будет предпринято на следующем этапе анализа результатов исследования.
Что является причиной миграции МСК в “интактный” глаз? Триггером для миграции МСК в сетчатку “интактного” глаза из поврежденных участков мозга являются развивающиеся деструктивные процессы в сетчатке этого глазного яблока в результате экспериментального нарушения его иннервации после энуклеации другого глазного яблока. Перекрест зрительных нервов позволяет объяснить причину развития нейродеструктивных процессов в подкорковых зрительных центрах как ипси-, так и контралатерально. Деструктивные процессы затрагивают как центрифугальные, так и центрипетальные волокна, повреждение которых сопровождается изменением структуры и функции как в мозге, так и в сетчатке глаза. Именно поэтому в эти поврежденные участки мозга и сетчатки мигрируют МСК для участия в репаративных процессах. Авторы учитывали при формулировании этих объяснений известные факты о миграции эндогенных СК мозга и МСК, введенных извне в мозг, в направлении к тем участкам поврежденной нервной ткани, в которых накапливаются ростовые факторы, цитокины [7], хемокины [12], являющиеся ориентирами для направленной миграции МСК.
Таким образом, в экспериментах на лабораторных крысах продемонстрированы элементарные методические приемы, позволяющие реализовать задачу доставки СК в поврежденные участки сетчатки глаза после имплантации МСК в области терминалей обонятельного и/или тройничного нервов в полости носа. Прикладной аспект таких методических приемов реален при условии проявления заинтересованности офтальмологов, владеющих как микрохирургическими методами, так и клеточными технологиями.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные опыты инициированы статистическими сведениями о недостаточно эффективной терапии заболеваний, сопровождающихся развитием слепоты [20–24]. В обзоре, оформленном 20 лет назад [20], обсуждались аналогичные проблемы, которые доминируют в научных статьях и в настоящее время [21, 22]. Поскольку в последние годы действуют активные программы по устранению основных причин слепоты в детстве, то естественно, что исследования причин и терапии глазных болезней начинают смещаться в сторону основных причин слепоты в пожилом возрасте [20, 25–28]. Итак, актуальная проблема решается и требует внедрения новых эффективных и безопасных методов профилактики и терапии заболеваний сетчатки глаза. С этой точки зрения перспективным направлением выглядит в офтальмологии наряду с уникальными микрохирургическими методами применение клеточных технологий.
Авторы настоящей статьи (микрохирург, нейрохирург и нейрофизиологи) попробовали ответить на один из основных вопросов в существующей проблеме применения клеточных технологий в офтальмологии и нейрохирургии. Как снизить побочные эффекты имплантации СК непосредственно в глазное яблоко (к примеру, интравитреально)? Наилучшим решением этой проблемы является поиск альтернативных способов доставки СК к поврежденной сетчатой оболочке глаза. Этот поиск проведен в экспериментах на лабораторных крысах линии Вистар. В процессе исследований выделено несколько вопросов. Во-первых, реально ли акцентировать внимание только на эволюционно зафиксированный репаративный механизм эндогенных СК мозга для активации восстановительных процессов в сетчатой оболочке глаза? Во-вторых, поскольку большинство клинических случаев демонстрирует, что этого потенциала недостаточно, то назрела необходимость поиска способов дополнительной активации репаративных процессов эндогенных СК за счет имплантации МСК не в глазное яблоко, а парабульбарно или в области терминалей иных краниальных нервов. В последнем случае реальна периневральная миграция МСК из полости носа в участки нейродеструкции мозга [8], что минимизирует возможность побочных эффектов, которые допустимы при проведении микрохирургических операций на глазном яблоке при осуществлении интравитреальных, субтеноновых инъекций пациентам. В аспекте рассматриваемой тематики примечательна публикация статьи Wolter более 50-ти лет назад [29], в которой детально проанализированы варианты центрипетальных и центрифугальных взаимоотношений элементов сетчатки и нейронных сетей подкорковых центров головного мозга с детализацией событий на уровне перекреста (хиазмы) зрительных нервов.
Постулируется, что репаративная способность МСК в поврежденных участках мозга и по аналогии в сетчатке глаза проявляется после выделения разнообразных нейротрофических факторов в очагах нейродеструкции [3, 4, 6, 17, 19, 28]. Профессионалам несложно выделить МСК из разных тканей, и МСК проявили себя многообещающими при лечении многих заболеваний путем восстановления гомеостаза органов в поврежденных или пораженных патологическими процессами тканях.
Доказано, что трофические и иммуномодулирующие свойства МСК способны защищать нейроны сетчатки и улучшать функцию клеток пигментного эпителия сетчатки от ряда заболеваний, связанных с дегенерацией сетчатки [3, 4, 19, 28]. Недавние клинические испытания выявили реальные профили безопасности для применения МСК при заболеваниях сетчатки. Однако настороженность в отношении серьезных осложнений и побочных эффектов, возникающая до сих пор из-за неудачно спланированных клинических испытаний, способны блокировать исследования в области терапии сетчатки на основе МСК. Тем не менее, результаты проведенного авторами экспериментального исследования свидетельствуют, что МСК обладают перспективным терапевтическим потенциалом для профилактики и терапии дегенеративных процессов в сетчатке глаза. Для оптимизации хирургической доставки МСК в сетчатку глаза целесообразно использовать методы, которые позволяют исключить неблагоприятные последствия. С этой точки зрения разработанный в процессе экспериментальных исследований метод интраназальной имплантации MСК с целью последующей их направленной периневральной миграции по краниальным нервам (обонятельный и тройничный нервы) в участки нейродеструкций подкорковых центров зрения и затем по зрительным нервам в сетчатку глаза является одним из вариантов для будущего анализа в клиническом аспекте с целью лечения дегенерации сетчатки.
Результаты каждого научного исследования воспринимаются на расстоянии. Авторы понимают, что получены лишь первые экспериментальные факты, которые часто подвергаются резкой критике клиницистами. Так и должно быть в научной жизни. Поводом для доли оптимизма является научная жизнь мэтра физиологии, приближающийся юбилей которого явился стимулом для оформления данной статьи. Речь идет об Александре Даниловиче Ноздрачеве, который полон новых идей и не страшится “заглядывать за горизонт”, что побуждает других исследователей к непреходящему пересмотру и верификации гипотез, значимость которых определяет время.
Список литературы
Magharious MM, D’Onofrio PM, Koeberle PD (2011) Optic Nerve Transection: A Model of Adult Neuron Apoptosis in the Central Nervous System. J Vis Exp 51: 2241. https://doi.org/10.3791/2241
Wong WL, Su X, Li X, Cheung CMG, Klein R, Cheng CY, Wong TY (2014) Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: A systematic review and meta-analysis. Lancet Glob Health 2: 106–116. https://doi.org/10.1016/S2214-109X(13)70145-1
Weiss JN, Levy S (2020) Stem Cell Ophthalmology Treatment Study (SCOTS): Bone Marrow-Derived Stem Cells in the Treatment of Age-Related Macular Degeneration. Medicines (Basel) 7(4): 16. https://doi.org/10.3390/medicines7040016
Akyol E, Lotery A (2020) Gene, Cell and Antibody-Based Therapies for the Treatment of Age-Related Macular Degeneration. Biologics 14: 83–94. https://doi.org/10.2147/BTT.S252581
Levine ES, Crozier RA, Black IB, Plummer MR (1998) Brain-derived neurotrophic factor modulates hippocampal synaptic transmission by increasing N-methyl-D-aspartic acid receptor activity. Proc Natl Acad Sci USA 95: 10235–10239. https://doi.org/10.1073/pnas.95.17.10235
Wagenaar N, de Theije C, de Vries L, Groenendaal F, Benders MJNL, Nijboer CHA (2018) Promoting neuroregeneration after perinatal arterial ischemic stroke: neurotrophic factors and mesenchymal stem cells. Pediatr Res 83: 372–384. https://doi.org/10.1038/pr.2017.243
Shao A, Tu S, Lu J, Zhang J (2019) Crosstalk between stem cell and spinal cord injury: pathophysiology and treatment strategies. Stem Cell Res Ther 10(1): 238. https://doi.org/10.1186/s13287-019-1357-z
Kulchitsky VA, Shanko YG, Molchanov PG, Cherehkevich SN, Chotianovich MO, Denisov AA, Pashkevich SG, Strizhak IV, Andrievskaya MV, Rodich AV, Pitlik TN, Bulay PM (2012) The direction of stem cells movement into the brain depends on the areas of their injection into peripheral parts of the nervous system. Biological Motility: Fundamental and Applied Science. Pushchino: Foton-Vek: 99–101. https://docplayer.net/129455540-Biological-motility-fundamental-and-applied-science.html
Davis BM, Crawley L, Pahlitzsch M, Javaid F, Cordeiro MF (2016) Glaucoma: the retina and beyond. Acta Neuropathol 132(6): 807–826. https://doi.org/10.1007/s00401-016-1609-2
Repérant J, Médina M, Ward R, Miceli D, Kenigfest NB, Rio JP, Vesselkin NP (2007) The evolution of the centrifugal visual system of vertebrates. A cladistic analysis and new hypotheses. Brain Res Rev 53(1): 161–197. https://doi.org/10.1016/j.brainresrev.2006.08.004
Behrens U, Wagner H-J (2004) Terminal nerve and vision. Microsc Res Tech 65(1–2): 25–32. https://doi.org/10.1002/jemt.20108
Ji JF, He BP, Dheen ST, Tay SSW (2004) Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury. Stem Cells 22(3): 415–427. https://doi.org/10.1634/stemcells.22-3-415
Kaneko N, Sawada M, Sawamoto K (2017) Mechanisms of neuronal migration in the adult brain. J Neurochem 141(6): 835–847. https://doi.org/10.1111/jnc.14002
Hayashi Y, Jinnou H, Sawamoto K, Hitoshi S (2018) Adult neurogenesis and its role in brain injury and psychiatric diseases. J Neurochem 147(5): 584–594. https://doi.org/10.1111/jnc.14557
Li Q, Siri T, Bressan C, de Koninck Y, Saghatelyan A (2020) Developmental Potential and Plasticity of Olfactory Epithelium Stem Cells Revealed by Heterotopic Grafting in the Adult Brain. Stem Cell Reports 14(4): 692–702. https://doi.org/10.1016/j.stemcr.2020.03.008
Ferri ALM, Bersano A, Lisini D, Boncoraglio G, Frigerio S, Parati E (2016) Mesenchymal Stem Cells for Ischemic Stroke: Progress and Possibilities. Curr Med Chem 23(16): 1598–1608. https://doi.org/10.2174/0929867323666160222113702
Detante O, Rome C, Papassin J (2017) How to use stem cells for repair in stroke patients. Rev Neurol (Paris) 173(9): 572–576. https://doi.org/10.1016/j.neurol.2017.09.003
Levy ML, Crawford JR, Dib N, Verkh L, Tankovich N, Cramer SC (2019) Phase I/II Study of Safety and Preliminary Efficacy of Intravenous Allogeneic Mesenchymal Stem Cells in Chronic Stroke. Stroke 50(10): 2835–2841. https://doi.org/10.1161/STROKEAHA.119.026318
Mead B, Berry M, Logan A, Scott RA, Leadbeater W, Scheven BA (2015) Stem cell treatment of degenerative eye disease. Stem Cell Res 14(3): 243257. https://doi.org/10.1016/j.scr.2015.02.003
West SK (2000) Looking forward to 20/20: a focus on the epidemiology of eye diseases. Epidemiol Rev 22(1): 64–70. https://doi.org/10.1093/oxfordjournals.epirev.a018025
Camelo S, Latil M, Veillet S, Dilda PJ, Lafont R (2020) Beyond AREDS Formulations, What Is Next for Intermediate Age-Related Macular Degeneration (iAMD) Treatment? Potential Benefits of Antioxidant and Anti-inflammatory Apocarotenoids as Neuroprotectors. Oxid Med Cell Longev 2020: 4984927. https://doi.org/10.1155/2020/4984927
Li HY, Ruan YW, Ren CR, Cui Q, So KF (2014) Mechanisms of secondary degeneration after partial optic nerve transection. Neural Regen Res 9(6): 565–574. https://doi.org/10.4103/1673-5374.130093
Guedes ME, Almeida AC, Patricio MS, Costa JM (2011) Acquired retrograde transsynaptic degeneration. BMJ Case Rep 2011:bcr0820114653. https://doi.org/10.1136/bcr.08.2011.4653
Gennarelli TA, Thibault LE, Tipperman R, Tomei G, Sergot R, Brown M, Maxwell WL, Graham DI, Adams JH, Irvine A, Gennarelli LM, Duhaime AC, Boock R, Greenberg J (1989) Axonal injury in the optic nerve: a model simulating diffuse axonal injury in the brain. J Neurosurg 71(2): 244–253. https://doi.org/10.3171/jns.1989.71.2.0244
Weishaupt JH, Bahr M (2001) Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor Neurol Neurosci 19(1–2): 19–27. https://pubmed.ncbi.nlm.nih.gov/12082226/
Gokoffski KK, Peng M, Alas B, Lam P (2020) Neuro-protection and neuro-regeneration of the optic nerve: recent advances and future directions. Curr Opin Neurol 33(1): 93–105. https://doi.org/10.1097/WCO.0000000000000777
Savvaki M, Kafetzis G, Kaplanis S-I, Ktena N, Theodorakis K, Karagogeos D (2021) Neuronal, but not glial Contactin 2, negatively regulates axon regeneration in the injured adult optic nerve. Eur J Neurosci 53(6): 1705–1721. https://doi.org/10.1111/ejn.15121
Silva-Junior AJ, Mesentier-Louro LA, Nascimento-Dos-Santos G, Teixeira-Pinheiro LC, Vasquez JF, Chimeli-Ormonde L, Bodart-Santos V, Carvalho LRP, Santiago MF, Mendez-Otero R (2021) Human mesenchymal stem cell therapy promotes retinal ganglion cell survival and target reconnection after optic nerve crush in adult rats. Stem Cell Res Ther 12(1): 69. https://doi.org/10.1186/s13287-020-02130-7
Wolter JR (1965) The centrifugal nerves in the human optic tract, chiasm, optic nerve, and retina. Trans Am Ophthalmol Soc 63: 678–707. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1310211/pdf/taos00036-0690.pdf
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


