Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1359-1371
Пептид АКТГ4–7-PGP корригирует поведение и уровень кортикостерона у крыс в условиях хронического стресса
А. О. Ворвуль 1, *, И. И. Бобынцев 1, М. В. Свищева 1, О. А. Медведева 1, А. Ю. Мухина 1, Л. А. Андреева 2
1 Курский государственный медицинский университет
Курск, Россия
2 Институт молекулярной генетики РАН
Москва, Россия
* E-mail: vorvul1996@mail.ru
Поступила в редакцию 14.05.2021
После доработки 06.08.2021
Принята к публикации 12.08.2021
Аннотация
Пептид АКТГ4–7-PGP обладает широким спектром нейротропного действия, в том числе анксиолитическим и антидепрессивным эффектами в условиях стресса. При этом одним из важных вопросов является выяснение роли кортикостерона в поведенческих реакциях на фоне многократного введения АКТГ4–7-PGP при хроническом стрессе. Целью работы явилось изучение влияния АКТГ4–7-PGP на поведенческие реакции и содержание кортикостерона и их взаимосвязь при длительном стрессировании крыс. АКТГ4–7-PGP вводили крысам-самцам Вистар в дозах 5, 50, 150, 450 мкг/кг в течение 14 дней за 12–15 мин до стрессорного воздействия. Поведение животных исследовали в тестах открытого поля и приподнятого крестообразного лабиринта, концентрацию кортикостерона в крови определяли методом иммуноферментного анализа. Установлено, что пептид в условиях хронического стресса оказывал анксиолитическое действие и снижал уровни тревожности в дозах 50 и 150 мкг/кг (p < 0.05–0.01). Во всех использованных дозах АКТГ4–7-PGP снижал концентрацию кортикостерона в сыворотке крови стрессированных крыс на 28.6–34.2% ( р < 0.05). Корреляционный анализ показал, что после введения АКТГ4–7-PGР в дозе 50 мкг/кг уменьшение тревожности имело прямую сильную связь со снижением уровня кортикостерона.
Регуляторные пептиды семейства меланокортинов обладают широким спектром биологической активности и представляют собой класс регуляторных пептидов, который включает в себя как гормональные, так и другие физиологические эффекты [1, 2]. Эффекты данных пептидов реализуются путем взаимодействия с пятью подтипами меланокортиновых рецепторов (MCR). Известно, что адренокортикотропный гормон (АКТГ) и его фрагменты способствуют обучению, концентрируют внимание и усиливают консолидацию памятного следа [1]. При этом установлена способность фрагментов АКТГ и α-меланоцитстимулирующего гормонов проникать через гематоэнцефалический барьер [3].
На основе меланокортинов был создан фармакологический препарат Семакс, представляющий собой синтетический аналог участка АКТГ4–7, защищенный от действия эндопептидаз путем присоединения глипролина Pro-Gly-Pro (PGP). Препарат применяется для лечения интеллектуально-мнестических расстройств при сосудистых поражениях головного мозга, а также для повышения адаптационных возможностей в экстремальных условиях и профилактики психического утомления в наиболее тяжелые периоды работы в стрессовых условиях [3].
В настоящее время известно аксиолитическое и антидепрессивное действие АКТГ4–7-PGP при хроническом введении пептида в течение 10–14 дней, однако данное исследование было выполнено с использованием только одной дозы – 50 мкг/кг [4], которая ранее применялась в исследовании анксиолитических и антидепрессивных эффектов пептида на моделях хронического непредсказуемого стресса на протяжении 6 недель с определением относительной массы надпочечников [5]. При этом уровень кортикостерона в крови экспериментальных животных в обеих работах не исследовался, тогда как вопрос об участии кортикостерона в формировании тревожности при хроническом стрессе остается открытым. Так, в ряде исследований показана как сонаправленность уровня тревожности с концентрацией кортикостерона [6] и относительной массой надпочечников [5], так и их обратная взаимосвязь [7]. АКТГ4–7-PGP также оказывал разнонаправленное действие в различных моделях стресса. При хроническом непредсказуемом стрессе отмечался анксиолитический эффект на фоне снижения относительной массы надпочечников [5], однако на модели неонатальной изоляции показано увеличение уровня кортикостерона до контрольных значений при применении гептапептида [7].
Однако до настоящего времени не были выполнены исследования одновременного влияния АКТГ4–7-PGP на поведенческие реакции (в том числе на тревожность) и уровень кортикостерона в крови в условиях одной модели хронического стресса.
Целью работы явилось изучение влияния АКТГ4–7-PGP на поведенческие реакции у крыс, содержание кортикостерона в крови и их взаимосвязь при хроническом иммобилизационном стрессе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 60 крысах-самцах Вистар массой 200–230 г, полученных из SPF-вивария Института цитологии и генетики СО РАН. Животных содержали при режиме освещенности 12 ч – свет, 12 ч – темнота и свободном доступе к воде и корму.
Пептид АКТГ4–7-PGP, имеющий формулу Met-Glu-His-Phe-Pro-Gly-Pro (M-EHFPGP), синтезированный в Институте молекулярной генетики НИЦ “Курчатовский институт” РАН, растворяли в физиологическом растворе и вводили внутрибрюшинно в дозах 5, 50, 150 и 450 мкг/кг за 15 мин до стрессорного воздействия в объеме из расчета 1 мл на 1 кг массы тела. Использованные в эксперименте дозы пептида были выбраны в соответствии с имеющимися данными литературы об их эффективности [3, 10]. Контрольные животные получали эквивалентные объемы физиологического раствора. Все процедуры соответствовали этическим стандартам, утвержденным правовыми актами РФ, директиве 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 г по охране животных, используемых в научных целях, “Руководства по проведению доклинических исследований лекарственных средств” (Москва, 2012), и рекомендациям регионального этического комитета при Курском государственном медицинском университете.
Хронический стресc моделировали путем иммобилизации животных с помощью индивидуальных пластиковых вентилируемых боксов в течение 2-х ч на протяжении 14 дней [8].
Поведение крыс изучали через час после окончания последней иммобилизации в тестах “приподнятый крестообразный лабиринт” (ПКЛ) и “открытое поле” (ОП) с использованием аппаратного и программного обеспечения для видеослежения за телом животного “SMART Video Tracking System” (PanLab Harvard Apparatus, Испания).
В тесте ПКЛ в течение 5 мин для оценки уровня тревожности у крыс определяли время их нахождения в открытых и закрытых рукавах, на центральной площадке, а также число свешиваний. В тесте ОП оценивали двигательную и исследовательскую (горизонтальную) активность, локомоторное поведение, эмоциональность, короткий груминг. Горизонтальную двигательную и исследовательскую активность определяли по числу пересеченных квадратов. Пересечением границы считали тот момент, когда животное находилось четырьмя лапами в одном квадрате. Эмоциональность оценивали по числу фекальных болюсов и актов уринации, локомоторное поведение – по пройденной дистанции в центральных и периферических квадратах, а также общей пройденной дистанции. За короткий груминг принимали 1–2 быстрых круговых движений передних лап вокруг носа или глаз. Также регистрировали время нахождения животных в центральных и периферических квадратах [9].
Для исследования уровня кортикостерона использовали сыворотку крови крыс. Забор крови у животных производили в течение 30 мин после проведения тестов под эфирным наркозом с помощью систем с прокоагулянтом S-Monovette (SARSTED, Германия) из правого желудочка сердца (локализацию иглы оценивали визуально). Уровень кортикостерона определяли иммуноферментным методом с помощью набора Corticosterone ELISA Kit (Enzo, США).
Статистическую обработку полученных данных проводили с использованием интегрированной среды разработки для языка R “RStudio Desktop 1.4.1717” (RStudio, PBC, США). Характер распределения в вариационных рядах определяли с помощью теста Шапиро–Уилка, оценку равенства дисперсий – по критерию Левене. При принятии нулевой гипотезы о нормальности распределения для оценки достоверности различий между двумя группами применяли непарный t-критерий Стьюдента с поправкой Уэлча, тремя и более – однофакторный дисперсионный анализ (one-way ANOVA) с post-hoc анализом (тест Ньюмана–Кейлса), при ее отклонении – непарный U-критерий Манна–Уитни для двух групп или критерий Краскела–Уоллиса с post-hoc анализом (тест Дана) для трех и более групп. Для оценки взаимосвязи уровня кортикостерона и показателей тревожности проводился корреляционный анализ с расчетом рангового коэффициента корреляции Спирмена (ρ). Для исключения эффекта множественных сравнений применялась поправка Бенжамини–Хохберга. Достоверно значимыми различия считали при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка общей исследовательской, двигательной активностей и уровня тревожности при применении АКТГ4–7-PGP в тесте “Открытое поле”
Установлено, что стресс вызывал изменение поведенческой активности животных в тесте ОП в виде достоверного увеличения горизонтальной двигательной активности (увеличение числа пересеченных центральных квадратов и пройденной дистанции в них) и времени, проведенного крысами в центральных квадратах (рис. 1).
Рис. 1.
Показатели поведения крыс в тесте “открытое поле” после введения АКТГ4–7-PGP. (a) – время в периферических квадратах; (b) – время в центральных квадратах; (с) – пройденная дистанция в периферических квадратах; (d) – пройденная дистанция в центральных квадратах; (e) – число пересеченных периферических квадратов; (f ) – число пересеченных центральных квадратов. Полужирная черта – медиана, ящик – межквартильный размах, усы – крайние значения вариационных рядов, полужирная точка – выброс. х – р < 0.05 по сравнению с контрольной группой нестрессированных крыс (U-критерий Манна–Уитни).

В контрольной группе стрессированных животных отмечалось повышение эмоциональной напряженности (увеличение числа уринаций и фекальных болюсов) и количества актов короткого груминга (рис. 2).
Рис. 2.
Показатели проявления тревожности у исследуемых животных после введения АКТГ4–7-PGP. (a) – число фекальных болюсов; (b) – число уринаций; (с) – общая продолжительность груминга. Полужирная черта – медиана, ящик – межквартильный размах, усы – крайние значения вариационных рядов, полужирная точка – выброс. х – р < 0.05 по сравнению с контрольной группой нестрессированных крыс (U-критерий Манна–Уитни), * – р < 0.05 по сравнению с контрольной группой стрессированных крыс (критерий Краскела–Уоллиса с post-hoc анализом Дана), ** – p < 0.01 по сравнению с контрольной группой стрессированных крыс (критерий Краскела–Уоллиса с post-hoc анализом Дана).
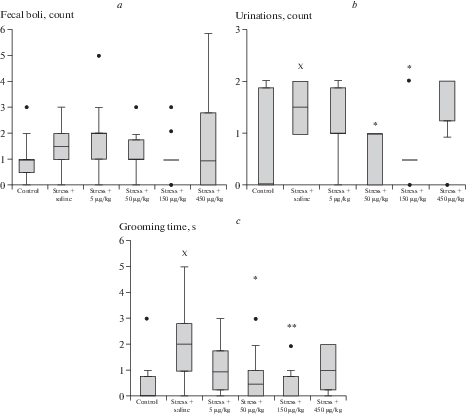
Применение АКТГ4–7-PGP в дозе 5 мкг/кг не вызывало значимого изменения поведенческой активности в тесте ОП в сравнении с контрольной группой стрессированных крыс. При увеличении вводимой дозы до 50 мкг/кг наблюдалось значительное уменьшение эмоциональности и тревожности в виде снижения числа уринаций и количества актов короткого груминга в сравнении с контрольными стрессированными животными. При этом пептид не влиял на ориентировочно-исследовательскую и двигательную активность, измененную в условиях стресса. Увеличение дозы до 150 мкг/кг вызывало усиление эффектов: отмечалось снижение двигательной активности в центральных квадратах и показателей тревожности. В наибольшей использованной дозе 450 мкг/кг АКТГ4–7-PGP не оказывал влияния на вызванные стрессом изменения поведения в тесте ОП.
Оценка анксиолитических эффектов АКТГ4–7-PGP в тесте “Приподнятый крестообразный лабиринт” и уровня кортикостерона
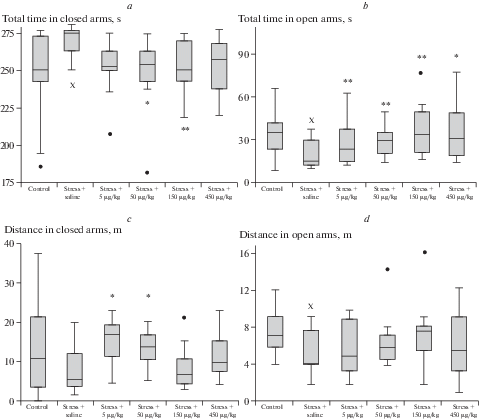
При исследовании поведения в ПКЛ у крыс контрольной стрессированной группы отмечалось достоверное увеличение времени нахождения в закрытых рукавах лабиринта на фоне снижения данного показателя в открытых рукавах в сравнении с нестрессированным контролем, что свидетельствует об увеличении уровня тревожности. Также при этом отмечалось уменьшение количества свешиваний из открытого рукава установки (рис. 3).
Рис. 3.
Показатели поведения крыс в приподнятом крестообразном лабиринте после введения АКТГ4–7-PGP. (a) – время в закрытых рукавах; (b) – время в открытых рукавах; (с) – дистанция в закрытых рукавах; (d) – дистанция в открытых рукавах. Полужирная черта – медиана, ящик – межквартильный размах, усы – крайние значения вариационных рядов, полужирная точка – выброс. х – р < 0.05 по сравнению с контрольной группой нестрессированных крыс (U-критерий Манна–Уитни), * – р < 0.05 по сравнению с контрольной группой стрессированных крыс (критерий Краскела–Уоллиса с post-hoc анализом Дана), ** – p < 0.01 по сравнению с контрольной группой стрессированных крыс (критерий Краскела–Уоллиса с post-hoc анализом Дана).
Концентрация кортикостерона в сыворотке крови у крыс контрольной стрессированной группы возросла на 59% в сравнении с нестрессированным контролем (р < 0.01) (рис. 4).
Рис. 4.
Влияние АКТГ4–7-PGP на содержание кортикостерона в сыворотке крови крыс (среднее ± ошибка среднего). х – р < 0.05 по сравнению с контрольной группой нестрессированных крыс (t-критерий Стьюдента с поправкой Уэлча), * – р < 0.05 по сравнению с контрольной группой стрессированных крыс (one-way ANOVA с post-hoc анализом Ньюмана–Кейлса).
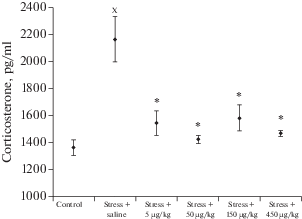
В дозе 5 мкг/кг пептид увеличивал время нахождения животных на центральной площадке при уменьшении времени их пребывания в закрытых рукавах на фоне достоверного снижения содержания кортикостерона сыворотки крови на 28.6% (р < 0.01). При использовании АКТГ4–7-PGP в дозе 50 мкг/кг достоверно возрастало время нахождения животных как в открытых рукавах, так и на центральной площадке экспериментальной установки при значительном уменьшении времени нахождения в закрытых рукавах. Подобные эффекты наблюдались и при применении пептида в дозе 150 мкг/кг: возросло время нахождения крыс в открытых рукавах и снизилось – в закрытых. Важно отметить, что при этом абсолютные значения исследуемых показателей были близки к соответствующим значениям группы нестрессированного контроля. Отмеченные изменения поведенческой активности после применения пептида в дозах 50 и 150 мкг/кг происходили при снижении уровня кортикостерона соответственно на 34.2 и 27% (р < 0.01). Дальнейшее увеличение дозы пептида до 450 мкг/кг сопровождалось ослаблением эффектов на фоне снижения содержания кортикостерона на 32.2% (р < 0.01).
Оценка взаимосвязи между кортикостероном и уровнем тревожности при применении АКТГ4–7-PGP в условиях хронического стресса
Результаты выполненного корреляционного анализа между средним уровнем кортикостерона и средними значениями показателей тревожности показали наличие между ними целого ряда статистически значимых взаимосвязей (рис. 5).
Рис. 5.
Взаимосвязь между уровнем кортикостерона и показателями тревожности. Цветная шкала отображает значение коэффициента корреляции Спирмена, вытянутость эллипсов – направление связи: снизу вверх – прямая, сверху вниз – обратная.
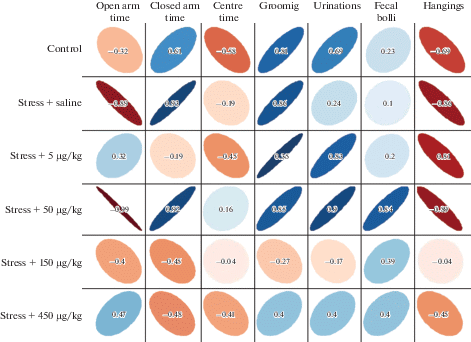
Так, в группе нестрессированных животных отмечалась обратная связь средней силы между уровнем кортикостерона со временем, проведенном в открытых рукавах (ρ = –0.32, p > 0.05), временем пребывания в центре (ρ = –0.58, p > 0.05), числом свешиваний (ρ = –0.69, p < 0.05). При этом установлена сильная прямая связь между уровнем кортикостерона и числом актов короткого груминга (ρ = 0.81, p < 0.05), прямая связь средней силы – со временем в закрытых рукавах (ρ = 0.61, p > 0.05), числом уринаций (ρ = 0.69, p < 0.05) и количеством фекальных болюсов (ρ = 0.23, p > 0.05).
В условиях хронического стресса наблюдалось усиление корреляционных взаимоотношений: появлялась сильная обратная связь между уровнем кортикостерона, временем нахождения в открытых рукавах (ρ = –0.89, p < 0.01) и числом свешиваний (ρ = –0.86, p < 0.05), слабая обратная связь – со временем пребывания в центре (ρ = –0.19, p > 0.05). Выявлена сильная корреляционная связь уровня кортикостерона со временем нахождения в открытых рукавах (ρ = 0.93, p < 0.01) и числом актов короткого груминга (ρ = 0.86, p < 0.05), прямая связь средней силы – с числом уринаций (ρ = 0.24, p > 0.05) и слабая прямая связь – с числом фекальных болюсов (ρ = 0.10, p > 0.05).
В группе животных, получавших АКТГ4–7-PGP в дозе 5 мкг/кг, обнаружена сильная прямая связь между уровнем кортикостерона и числом актов короткого груминга (ρ = 0.95, p < 0.05), уринаций (ρ = 0.83, p < 0.05) и сильная обратная связь – с числом свешиваний (ρ = –0.81, p < 0.05).
У крыс, получавших АКТГ4–7-PGP в дозе 50 мкг/кг, сохранялась сила и направленность связей уровня кортикостерона со временем в открытых и закрытых рукавах, числом актов короткого груминга и свешиваний, обнаруженных в группе контрольных стрессированных животных. Кроме того, появлялись сильные прямые связи между уровнем кортикостерона и числом уринаций (ρ = 0.90, p < 0.05), фекальных болюсов (ρ = 0.84, p < 0.05).
После введения пептида в дозах 150 и 450 мкг/кг отсутствовали сильные достоверно значимые связи между уровнем кортикостерона и показателями тревожности.
Таким образом, проведенный корреляционный анализ у контрольных животных показал возникновение значимых связей между уровнем кортикостерона и поведенческими показателями в условиях хронического стресса. После применения АКТГ4–7-PGP характер корреляционных взаимоотношений значительно изменялся в зависимости от использованной дозы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выполненные эксперименты показали, что применение АКТГ4–7-PGP в дозах 50 и 150 мкг/кг значительно снижало уровень стресс-индуцированной тревожности у крыс, тогда как в дозах 5 и 450 мкг/кг эффекты пептида были маловыраженными. Такое проявление зависимости действия АКТГ4–7-PGP от использованной дозы известно как U-эффект, характерный для целого ряда регуляторных пептидов.
При выяснении механизмов выявленных эффектов необходимо учитывать, что биологические эффекты меланокортинов реализуются посредством воздействия на различные подтипы меланокортиновых рецепторов [1], а АКТГ4–7-PGP является антагонистом MС4R и MС5R [10]. В связи с этим выявленный U-эффект может иметь следующее объяснение. Известно, что передача сигнала с меланокортиновых рецепторов осуществляется за счет взаимодействия с аденилатциклазой и активации цАМФ-сигнального пути [11]. Однако пути передачи сигнала могут зависеть от концентрации лиганда и передаваться с включением других систем вторичных мессенджеров, что может отражаться на направленности и выраженности эффектов. Например, сигнал с MС3R может передаваться по фосфоинозитольному пути [12], а с MС5R – с участием Jak/STAT [13].
В развитии поведенческих реакций в условиях стресса важную роль играют MCR4, сигнал с которых вызывает активацию гипоталамо-гипофизарно-адреналовой системы и проявляется усилением эмоциональности и груминга [14–16]. Данные механизмы могут находиться в основе отмеченного нами в контрольной группе стрессированных крыс увеличения количества уринаций и актов короткого груминга в тесте ОП, а также изменений поведения в тесте ПКЛ, свидетельствующих об увеличении тревожности у крыс. При этом известно, что АКТГ4–7-PGP как антагонист MС4R в экспериментах без стрессорного воздействия после введения пептида на протяжении 14 дней проявляет анксиолитическое действие [4]. Необходимо отметить, что в выполненном нами исследовании АКТГ4–7-PGP вводили до начала стрессорного воздействия также в течение 14 дней. Известно, что длительность ноотропных эффектов пептида составляет 20–24 ч [17, 18], и его действие могло проявляться на всех звеньях развивающейся стрессорной реакции на протяжении всего эксперимента. При этом продолжительность анксиолитического действия после курсового введения пептида остается неизученным вопросом. Полученные в работе данные также согласуются с результатами исследования, в котором АКТГ4–7-PGP в значительной степени корригировал анксиогенный эффект холецистокинина-тетрапептида [19].
Следует отметить, что при однократном введении за 15 мин до начала тестирования АКТГ4–7-PGP не оказывал анксиолитического действия как в тесте конфликтной ситуации по Вогелю, так и в бесконфликтных условиях модели ПКЛ [20].
Анксиолитическое действие АКТГ4–7-PGP при многократном введении в течение продолжительного промежутка времени может достигаться за счет увеличения концентрации в тканях мозга BDNF, который оказывает влияние на созревание нейронов и на процессы обучения и памяти. Кроме того, BDNF участвует в регуляции тревожных и стрессорных расстройств, и за счет изменения его экспрессии может реализовываться анксиолитический эффект пептида [21]. Его участие в модуляции реакции тревоги и депрессии у экспериментальных животных также возможно вследствие влияния пептида на системы биогенных аминов головного мозга [22].
Стрессорное воздействие в условиях нашего эксперимента вызывало типовую стресс-реакцию в виде значительного увеличения содержания кортикостерона в сыворотке крови у крыс. Применение пептида способствовало существенному снижению его уровня, а проведенный корреляционный анализ показал значимую взаимосвязь между уровнем кортикостерона и показателями тревожности в условиях использованной нами модели хронического стресса. Обращает внимание, что снижение содержания гормона происходило во всех группах животных, не зависело от выраженности анксиолитического эффекта пептида, что может свидетельствовать о преимущественно центральных (стероидонезависимых) механизмах влияния пептида на исследованные поведенческие реакции и является поводом для дальнейшего анализа. Так, известно, что хронический иммобилизационный стресс вызывает проявление тревожности и депрессии на фоне повышения уровня кортикостерона и увеличения экспрессии рецепторов к глюкокортикостероидам [6], что согласуется с результатами нашего исследования. Однако введение АКТГ4–7-PGР в условиях стресса в течение первых 21 дней жизни детенышам крыс вызывало снижение уровня тревожности, рост ориентировочно-исследовательской активности и улучшение обучения крыс на фоне восстановления до контрольных значений уровня кортикостерона [7]. Данные различия могут являться следствием различного функционального состояния гипоталамо-гипофизарно-надпочечниковой системы в зависимости от возраста животных [23], а также отсутствием ежедневной стимуляции, обусловленной социальными взаимодействиями [24].
Подтверждением данному предположению о преимущественно центральных (стероидонезависимых) механизмах влияния пептида могут являться результаты корреляционного анализа между исследованными нами показателями. Так, в условиях хронического стресса уровень кортикостерона во всех подопытных группах сильно коррелировал с показателями поведения. У контрольных стрессированных крыс выявлены сильные прямые связи между уровнями кортикостерона и тревожности. Однако после введения АКТГ4–7-PGР характер данных взаимоотношений существенно различался в зависимости от использованной дозы. В частности, при введении АКТГ4–7-PGР в дозах 5, 150, 450 мкг/кг отмечалось изменение направленности связей или их значительное ослабление. При этом только в дозе 50 мкг/кг, оказавшей наибольшее анксиолитическое действие, взаимосвязи между уровнем кортикостерона и показателями тревожности имели сходный с контрольными стрессированными животными характер. Возможно, в данной группе наибольшая выраженность анксиолитического эффекта достигалась за счет сочетания центрального нейротропного действия АКТГ4-7-PGР и выраженного снижения уровня кортикостерона вследствие значительного ослабления психоэмоционального стрессорного воздействия иммобилизации. Подобный механизм может находиться в основе анксиолитических эффектов данной дозы в выполненных ранее работах [4, 5].
Также в развитии установленных эффектов АКТГ4–7-PGP могут участвовать изменения в оси кишечник-мозг. Выявленная нами ранее коррекция пептидом стрессиндуцированного дисбиоза и развивающейся воспалительной реакции [25, 26] могла отразиться на функциональном состоянии нервной системы вследствие изменений в системе кишечник-мозг [27].
ЗАКЛЮЧЕНИЕ
Хронический иммобилизационный стресс вызывал снижение общей исследовательской и двигательной активности на фоне повышения тревожности у крыс и уровня кортикостерона в сыворотке крови. АКТГ4–7-PGР способствовал коррекции стрессиндуцированных сдвигов в поведении у крыс, оказывая анксиолитическое действие в дозах 50 и 150 мкг/кг. При этом установлено снижение уровней кортикостерона во всех исследуемых группах в сравнении с контрольными стрессированными животными. Проведенный анализ корреляционных взаимосвязей между уровнем кортикостерона и поведенческими показателями показал значение стероидозависимых механизмов в опосредовании дозозависимого анксиолитического эффекта АКТГ4–7-PGР. Применение АКТГ4–7-PGР в условиях хронического стресса не оказывало влияния на исследовательскую и двигательную активность.
Список литературы
Левицкая НГ, Каменский АА (2009) Меланокортиновая система. Успехи физиол наук 40(1): 44–65. [Levitskaya NG, Kamensky AA (2009) Melanocortin System. Uspekhi fiziol nauk 40(1): 44–65. (In Russ)].
Catania A, Gatti S, Colombo G, Lipton JM (2004) Targeting melanocortin receptors as a novel strategy to control inflammation. Pharmacol Rev 56(1): 1–29. PMID: https://doi.org/10.1124/pr.56.1.115001661
Koroleva SV, Myasoedov NF (2018) Semax as a universal drug for therapy and research. Biol Bull 45(6): 589–600. https://doi.org/10.1134/S000233291806005X
Виленский ДА, Левицкая НГ, Андреева ЛА, Алфеева ЛЮ, Каменский АА, Мясоедов НФ (2007) Влияние хронического введения Семакса на исследовательскую активность и эмоциональное состояние белых крыс. Рос физиол журн им ИМ Сеченова 93(6): 661–669. [Vilensky DA, Levitskaya NG, Andreeva LA, Alfeeva LYu, Kamensky AA, Myasoedov NF (2007) Effects of chronic Semax administration on exploratory activity and emotional reaction in white rats. Russ J Physiol 93(6): 661–669. (In Russ)].
Yatsenko KA, Glazova NY, Inozemtseva LS, Andreeva LA, Kamensky AA, Grivennikov IA, Levitskaya NG, Dolotov OV, Myasoedov NF (2013) Heptapeptide Semax attenuates the effects of chronic unpredictable stress in rats. Dokl Biol Sci 453: 353–357. https://doi.org/10.1134/S0012496613060161
Chiba S, Numakawa T, Ninomiya M, Richards MC, Wakabayashi C, Kunugi H (2012) Chronic restraint stress causes anxiety- and depression-like behaviors, downregulates glucocorticoid receptor expression, and attenuates glutamate release induced by brain-derived neurotrophic factor in the prefrontal cortex. Prog Neuropsychopharmacol Biol Psychiatry 9(1): 112–119. https://doi.org/10.1016/j.pnpbp.2012.05.018
Volodina MA, Sebentsova EA, Glazova NY, Manchenko DM, Inozemtseva LS, Dolotov OV, Andreeva LA, Levitskaya NG, Kamensky AA, Myasoedov NF (2012) Correction of long-lasting negative effects of neonatal isolation in white rats using semax. Acta Naturae. 4(1): 86–92.
Zheng J, Dobner A, Babygirija R, Ludwig K, Takahashi T (2009) Effects of repeated restraint stress on gastric motility in rats. Am J Physiol Regul Integr Comp Physiol 296(5): R1358–R1365. https://doi.org/10.1152/ajpregu.90928.2008
Воронина ТА, Середенин СБ, Яркова МА, Воронин МВ (2012) Методические рекомендации по доклиническому изучению транквилизирующего (анксиолитического) действия лекарственных средств. 264–275 В: Руководство по проведению доклинических исследований лекарственных средств. Миронов АН (ред) Том 1. М. Гриф и К. [Voronina TA, Seredenin SB, Yarkova MA, Voronin MV (2012) Methodological recommendations for the preclinical study of the tranquilizing (anxiolytic) effect of drugs. 264–275 In: Guidelines for conducting preclinical studies of medicines. Mironov AN (ed) Vol 1. M. Grif and K. (In Russ)].
Adan RA, Szklarczyk AW, Oosterom J, Brakkee JH, Nijenhuis WA, Schaaper WM, Meloen RH, Gispen WH (1999) Characterization of melanocortin receptor ligands on cloned brain melanocortin receptors and on grooming behavior in the rat. Eur J Pharmacol. 378(3): 249–258. https://doi.org/10.1016/s0014-2999(99)00465-3
Clark AJ, Forfar R, Hussain M, Jerman J, McIver E, Taylor D, Chan L (2016) ACTH Antagonists. Front Endocrinol (Lausanne) 7: 101. https://doi.org/10.3389/fendo.2016.00101
Konda Y, Gantz I, DelValle J, Shimoto Y, Miwa H, Yamada T (1994) Interaction of dual intracellular signaling pathways activated by the melanocortin-3 receptor. J Biol Chem 269(18): 13162–13166.
Buggy JJ (1998) Binding of alpha-melanocyte-stimulating hormone to its G-protein-coupled receptor on B-lymphocytes activates the Jak/STAT pathway. Biochem J 331(Pt 1): 211–216. https://doi.org/10.1042/bj3310211
Shimazaki T, Chaki S (2005) Anxiolytic-like effect of a selective and non-peptidergic melanocortin 4 receptor antagonist, MCL0129, in a social interaction test. Pharmacol Biochem Behav 80(3): 395–400. https://doi.org/10.1016/j.pbb.2004.11.014
Von Frijtag JC, Croiset G, Gispen WH, Adan RA, Wiegant VM (1998) The role of central melanocortin receptors in the activation of the hypothalamus-pituitary-adrenal-axis and the induction of excessive grooming. Br J Pharmacol 123(8): 1503–1508. https://doi.org/10.1038/sj.bjp.0701750
Yamano Y, Yoshioka M, Toda Y, Oshida Y, Chaki S, Hamamoto K, Morishima I (2004) Regulation of CRF, POMC and MC4R gene expression after electrical foot shock stress in the rat amygdala and hypothalamus. J Vet Med Sci 66(11): 1323–1327. https://doi.org/10.1292/jvms.66.1323
Манченко ДМ, Глазова НЮ, Левицкая НГ, Андреева ЛА, Каменский АА, Мясоедов НФ (2010) Ноотропные и анальгетические эффекты семакса при различных способах введения. Рос физиол журн им ИМ Сеченова 96(10): 1014–1023. [Manchenko DM, Glazova NYu, Levitskaya NG, Andreeva LA, Kamensky AA, Myasoedov NF (2010) Nootropic and analgesic effects of Semax following different routes of administration. Russ J Physiol 96(10): 1014–1023 (In Russ)].
Ashmarin IP, Nezavibatko VN, Levitskaya NG, Koshelev VB, Kamensky AA (1995) Disign and Investigation of An ACTH4–10 Analogue Lacking D-Amino Acids and Hydrophobic Radicals. Neurosci Res Commun 16(2): 105–112.
Levitskaya NG, Vilenskii DA, Sebentsova EA, Andreeva LA, Kamensky AA, Myasoedov NF (2010) Influence of semax on the emotional state of white rats in the norm and against the background of cholecystokinin-tetrapeptide action. Biol Bull Russ Acad Sci 37:186–192. https://doi.org/10.1134/S1062359010020147
Dodonova SA, Bobyntsev II, Belykh AE, Telegina IA, Muzaleva YuA, Andreeva LA, Myasoedov NF (2020) Effects of Peptides ACTH6–9 PGP and ACTH4–7-PGP on Anxiety Levels in Rats in Punished and Unpunished Behavior. Neurosci Behav Physiol 50: 1203–1208. https://doi.org/10.1007/s11055-020-01022-w
Dolotov OV, Karpenko EA, Seredenina TS, Inozemtseva LS, Levitskaya NG, Zolotarev YA, Kamensky AA, Grivennikov IA, Engele J, Myasoedov NF (2006) Semax, an analogue of adrenocorticotropin (4–10), binds specifically and increases levels of brain-derived neurotrophic factor protein in rat basal forebrain. J Neurochem 97 Suppl 1: 82–86. https://doi.org/10.1111/j.1471-4159.2006.03658.x
Eremin KO, Kudrin VS, Grivennikov IA, Miasoedov NF, Rayevsky KS (2004) Effects of Semax on dopaminergic and serotoninergic systems of the brain. Dokl Biol Sci 394(1–6): 1–3.
Segar TM, Kasckow JW, Welge JA, Herman JP (2009) Heterogeneity of neuroendocrine stress responses in aging rat strains. Physiol Behav 8; 96(1): 6–11. https://doi.org/10.1016/j.physbeh.2008.07.024
Haller J, Halász J (1999) Mild social stress abolishes the effects of isolation on anxiety and chlordiazepoxide reactivity. Psychopharmacology (Berl) 144(4): 311–315. https://doi.org/10.1007/s002130051012
Svishcheva MV, Mukhina AY, Medvedeva OA, Shevchenko AV, Bobyntsev II, Kalutskii PV, Andreeva LA, Myasoedov NF (2020) Composition of Colon Microbiota in Rats Treated with ACTH(4–7)-PGP Peptide (Semax) under Conditions of Restraint Stress. Bull Exp Biol Med 169(3): 357–360. https://doi.org/10.1007/s10517-020-04886-7
Svishcheva MV, Mishina YS, Medvedeva OA, Bobyntsev II, Mukhina AY, Kalutskii PV, Andreeva LA, Myasoedov NF (2021) Morphofunctional State of the Large Intestine in Rats under Conditions of Restraint Stress and Administration of Peptide ACTH(4-7)-PGP (Semax). Bull Exp Biol Med 170(3): 384–388. https://doi.org/10.1007/s10517-021-05072-z
Forsythe P, Bienenstock J, Kunze WA (2014) Vagal pathways for microbiome-brain-gut axis communication. Adv Exp Med Biol 817: 115–133. https://doi.org/10.1007/978-1-4939-0897-4_5
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


