Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 11, стр. 1372-1384
Роль сероводорода в релаксации капсулы лимфатических узлов при ЛПС-индуцированном воспалении
Г. И. Лобов *
Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
* E-mail: lobovgi@infran.ru
Поступила в редакцию 18.06.2021
После доработки 03.09.2021
Принята к публикации 07.09.2021
Аннотация
Сероводород принимает участие в регуляции функций различных органов как в физиологических условиях, так и при патологии, и, в частности, является важнейшим участником воспалительного процесса. В данном исследовании мы изучили роль и механизмы действия сероводорода в липополисахарид-индуцированной релаксации капсулы брыжеечных лимфатических узлов быка. Исследование проведено на полосках капсулы брыжеечных лимфатических узлов быков. Изолированные полоски капсулы лимфатических узлов инкубировали на протяжении 6 ч в среде F-10 Ham с добавлением липополисахарида (ЛПС Escherichia coli O55:B5). По окончании инкубирования препараты исследовали на миографической установке. Сократительные свойства оценивали посредством применения фенилэфрина, а способность к релаксации – посредством применения папаверина. Участие H2S и NO в ЛПС-индуцированной релаксации определяли посредством применения специфических ингибиторов. Инкубация полосок капсулы лимфатических узлов в среде F-10 Ham + ЛП приводила к ингибированию фазных сокращений и снижению уровня тонического напряжения препаратов. Стойкое угнетение сократительной функции гладкомышечных клеток капсулы лимфатических узлов происходило под влиянием H2S, синтезируемого ферментами цистатионин-γ-лиазой, цистатионин-β-синтазой и 3-меркаптосульфуртрансферазой, а также NO, продуцируемого индуцибельной NO-синтазой. Полученные данные показали, что H2S является одним из основных веществ, достаточно быстро образующихся при моделировании воспаления в лимфатических узлах. Мы полагаем, что H2S является важнейшей молекулой, запускающей совместно с NO воспалительное ремоделирование лимфатических узлов, способствующее быстрому увеличению их размеров.
ВВЕДЕНИЕ
Лимфатическая сосудистая сеть, включающая лимфатические капилляры, лимфатические сосуды и лимфатические узлы (ЛУ), является одним из основных участников воспаления и играет важную роль как в развитии, так и в разрешении воспалительного процесса [1, 2]. Исторически сложилось так, что длительное время при исследовании функций ЛУ внимание специалистов было сконцентрировано в основном на изучении гемопоэтических клеток, которые участвуют в распознавании антигенов (дендритные клетки) и иммунном ответе (В- и Т-лимфоциты) [3, 4]. Позднее появились работы, в которых была показана важная роль лимфатических эндотелиальных клеток в осуществлении иммунных функций ЛУ [5, 6]. Было установлено, что в ЛУ располагаются по меньшей мере три отдельные группы лимфатических эндотелиоцитов (ЛЭК субкапсулярного синуса, кортикальные и медуллярные ЛЭК). Было показано также, что помимо различной локализации, разные типы ЛЭК экспрессируют разнообразные хемокины, регулирующие миграцию иммунных клеток в пределах ЛУ [7]. Более того, недавно было показано, что лимфатические эндотелиальные клетки ЛУ являются мощными презентаторами аутоантигенов и участвуют в поддержании толерантности периферических Т-клеток [8]. В последние годы также появились данные о том, что стромальные клетки ЛУ негематопоэтического происхождения выполняют не только опорно-трофическую функцию, но и принимают участие в инициации и поддержании иммунитета [9]. Считается, что различные стромальные клетки играют активную роль в иммунном ответе благодаря их взаимодействию с дендритными клетками и лимфоцитами [10]. Чтобы приспособиться к притоку большого количества нейтрофилов, макрофагов, дендритных клеток и лимфоцитов, задействованных во время иммунного ответа, стромальные клетки способны быстро делиться с целью ремоделирования ЛУ [11].
Уникальной особенностью ЛУ является их способность значительно изменять размер: при воспалении их объем может увеличиваться в 10–20 раз по сравнению с нормальным размером в течение нескольких дней, и этот рост сопровождается пролиферативным расширением и ремоделированием сосудисто-стромального компартмента ЛУ с сохранением его основополагающей структуры [12]. В этом процессе принято выделять несколько фаз: фаза инициации, фаза расширения и фаза восстановления [13]. Опубликованы результаты исследований нескольких лабораторий, в которых показано, что среди пяти подмножеств стромальных клеток ЛУ только фибробластные ретикулярные клетки обладают выраженными сократительными способностями и экспрессируют α-актин и легкую цепь миозина гладких мышц [14, 15]. Предполагают, что именно эти клетки играют основную роль в ремоделировании ЛУ при воспалении, однако механизм, посредством которого они способствуют быстрому увеличению размеров ЛУ, остается неясен [16].
ЛУ, являющиеся основными органами в системе адаптивного иммунитета, интенсивно изучаются в различных лабораториях [11, 17]. В Pubmed по ключевым словам “endothelial cells in a lymph node” найдено более 1600 работ за последние 15 лет, а по словам “stromal cells in a lymph node” – более 1100 работ. При этом на фоне массива публикаций о роли стромальных клеток в процессе воспалительного ремоделирования ЛУ удивительно мало данных об участии в этом процессе клеток капсулы ЛУ. Между тем, как было показано в наших работах, именно капсула, содержащая значительное количество соединительнотканных волокон и гладкомышечных клеток (ГМК), является наиболее жестким компонентом ЛУ, выполняющим функцию его каркаса и определяющим размеры и форму ЛУ [18, 19].
В более поздних наших работах было установлено, что при моделировании воспаления сократительная функция капсулы брыжеечных ЛУ быка значительно изменяется: прекращаются быстрые фазные сокращения и происходит довольно быстрое снижение тонического напряжения [20]. Нами также было показано, что в физиологических условиях в регуляции фазных и тонических сокращений капсулы мезентериальных ЛУ быка принимает участие H2S [21]. Роль H2S в воспалительном процессе и сепсисе была предметом дискуссий в течение длительного времени. К настоящему времени общепризнано, что H2S является важным фактором регуляции функций органов при разного рода патологии, в т.ч. и при воспалении [22]. В настоящей работе была поставлена задача изучить роль эндогенного H2S в регуляции сократительной функции ГМК капсулы мезентериальных ЛУ быка и их ремоделировании при ЛПС-индуцированном воспалении на модели, описанной ранее [20]. Поскольку “активные” компоненты, ответственные за биологические эффекты H2S, в настоящее время не полностью определены [23], в настоящей статье термин H2S будет объединять все формы H2S (в т.ч. и полисульфиды), которые будут присутствовать в растворе при физиологических значениях pH и температуры.
МЕТОДЫ ИССЛЕДОВАНИЯ
Материал для исследования забирали на пункте забоя животных ЗАО “Племенной завод “Приневское”. ЛУ первого порядка забирали из брыжейки быков чернопестрой породы (Bos taurus taurus) в возрасте 16–18 мес. через 15 мин после обескровливания животных, промывали в холодном физиологическом солевом растворе (PSS) и вырезали из них полоски капсулы с небольшим количеством коркового вещества. Полоски капсулы (n = 54 от 23 животных) доставляли в лабораторию в охлажденном (2–4°С) PSS. В лаборатории полоски капсулы ЛУ тщательно очищали от окружающей соединительной ткани и перикапсулярного жира и готовили препараты для исследования (полоски капсулы ЛУ длиной 10 мм и шириной 2 мм). У части полосок капсулы ЛУ удаляли субкапсулярный синус (SS). Контроль качества удаления эндотелия SS осуществляли посредством оценки релаксационного ответа полосок капсулы ЛУ на ацетилхолин (отсутствие ответа свидетельствовало о качественной деэндотелизации).
Подготовленные полоски капсулы ЛУ были разделены на несколько групп (табл. 1). Препараты инкубировали в среде F-10 Ham (“ДИА-М”, Россия) с добавлением бензилпенициллина (100 ЕД/мл) и стрептомицина (10 мг/мл) при 37°C в течение 6 ч. В среду F-10 Ham для всех групп был также добавлен индометацин (10 мкМ) для подавления возможного образования вазоактивных простаноидов. В среду F-10 Ham, в которой инкубировали полоски 3–4 групп был добавлен липополисахарид (ЛПС) (20 мкг/мл), в среду для 5-й и 6-й групп был добавлен ЛПС + актиномицин D (ингибитор синтеза РНК), а в среду для 7-й и 8-й групп – ЛПС + циклогексимид (ингибитор синтеза белка).
Таблица 1.
Особенности полосок капсулы мезентериальных ЛУ быка разных групп и состав среды для инкубации
| № группы (количество полосок) | Особенности препаратов | Инкубационная среда |
|---|---|---|
| 1 (9) | Полоска капсулы с субкапсулярным синусом (SS+) | Среда F-10 Ham |
| 2 (8) | Полоска капсулы без субкапсулярного синуса (SS–) | Среда F-10 Ham |
| 3 (14) | Полоска капсулы (SS+) | Среда F-10 Ham + ЛПС |
| 4 (15) | Полоска капсулы (SS–) | Среда F-10 Ham + ЛПС |
| 5 (9) | Полоска капсулы (SS+) | Среда F-10 Ham + ЛПС + актиномицин D |
| 6 (10) | Полоска капсулы (SS–) | Среда F-10 Ham + ЛПС + актиномицин D |
| 7 (8) | Полоска капсулы с (SS+) | Среда F-10 Ham + ЛПС + циклогексимид |
| 8 (7) | Полоска капсулы (SS–) | Среда F-10 Ham + ЛПС + циклогексимид |
По завершении инкубации препараты дважды промывали PSS и размещали в камере миографа с датчиком силы FORT-10 (WPI, США). Информацию от датчика после преобразования в АЦП “Labmaster” записывали на жесткий диск компьютера. Эксперименты проводили при непрерывном протоке PSS следующего состава (мМ): NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.0; бычий сывороточный альбумин – 10 г/л. PSS сатурировали газовой смесью, состоящей из 95% О2 и 5% СО2. Температуру раствора в камере поддерживали на уровне 38.0 ± 0.1°С. Препараты подвергали исходному натяжению в 16 мН. Такая величина натяжения была выбрана в связи с тем, что после подобного натяжения и 30-минутной стабилизации уровень тонического напряжения интактных полосок капсулы ЛУ (1-я группа) устанавливался на уровне 10.3 ± 1.2 мН, что соответствовало трансмуральному давлению около 4 см водн. ст. Для проверки сократительных реакций полосок применяли гиперкалиевый раствор (заменяли 55 мМ NaCl в PSS на KCl). После оценки сократительной способности препаратов их дважды промывали PSS.
В настоящем исследовании использовали следующие вещества: ЛПС Escherichia coli O55:B5(Sigma-Aldrich), 100 мкг/мл; бензилпенициллина натриевая соль (“Красфарма”, Россия), 100 ЕД/мл; стрептомицин (“Фармасинтез”, Россия), 10 мг/мл. Остальные реактивы приобретены в Sigma-Aldrich и использовались в следующих концентрациях: актиномицин D (аctinomycin D), 100 нМ; циклогексимид (Cycloheximide), 10 мкМ; 1400W (N-([3-(Aminomethyl)phenyl] methyl)ethanimidamide dihydrochloride), 20 мкМ; DL-пропаргилглицин (DL-Propargylglycine, PPG), 10 мкМ; аминооксиацетат (Aminooxy)acetic acid hemihydrochloride, АОАА), 100 мкМ; L-аспарагиновая кислота (L-Aspartic acid, (L-Asp), 10 мкМ; фенилэфрин, ((R)-(−)-Phenylephrine hydrochloride, PE), 100 мкМ; папаверин, (Papaverine hydrochloride, РР), 40 мкМ; ацетилхолин (аcetylcholine chloridea), 1 мкМ; индометацин (Indomethacin), 3 мкМ.
Все вещества растворяли в PSS непосредственно перед экспериментом. Актиномицин D и индометацин предварительно растворяли в диметилсульфоксиде (ДМСО), циклогексимид – в этаноле, и перед экспериментом добавляли необходимое количество концентрата в PSS. ДМСО в разведении 1/1000 и этанол в разведении 1/2000 не вызывали статистически значимых изменений параметров сократительной активности полосок капсулы ЛУ. Детали экспериментов с применением химических веществ подробно описаны в разделе “Результаты исследования”
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
Статистическую обработку полученных результатов проводили с помощью программы “StatSoft STATISTICA 6.1.478”. Для проверки нормальности распределения данных применяли критерий Шапиро–Уилка. Поскольку данные соответствовали распределению Гаусса, они представлены в виде среднего арифметического значения и стандартной ошибки (M ± m). Для сравнения данных использовали t-критерий Стьюдента. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Полоски капсулы ЛУ (SS+) и (SS–), инкубированные в течение 6 ч в среде F-10 Ham, после промывки и 30-минутной выдержки в PSS в камере миографа имели стабильный уровень тонуса, на фоне которого регистрировались ритмичные фазные сокращения. Величина тонуса и параметры фазных сокращений препаратов представлены в табл. 2. Полоски капсулы ЛУ без субкапсулярного синуса имели более высокий тонус и несколько бóльшую частоту фазных сокращений по сравнению с интактными.
Таблица 2.
Параметры сокращений полосок капсулы мезентериальных ЛУ быка после инкубации в среде F-10 Ham и в среде F-10 Ham + ЛПС с актиномицином D и циклогексимидом
| № группы полосок капсулы ЛУ | Особенности препаратов и их инкубации | Тонус, мН | Амплитуда фазных сокращений, мН | Частота, мин–1 |
|---|---|---|---|---|
| 1 | ( SS+) | 9.8 ± 0.4 | 8.3 ± 0.4 | 0.96 ± 0.07 |
| 2 | (SS–) | 10.9 ± 0.5* | 8.6 ± 0.5 | 1.13 ± 0.07* |
| 3 | (SS+) + ЛПС | 7.1 ± 0.3& | – | – |
| 4 | (SS–) + ЛПС | 8.8 ± 0.6# | – | – |
| 5 | (SS+) + ЛПС + актиномицин D | 9.4 ± 0.5* | 7.7 ± 0.3* | 0.91 ± 0.06 |
| 6 | (SS ) + ЛПС + актиномицин D | 9.7 ± 0.4 | 7.9 ± 0.5@ | 1.06 ± 0.07 |
| 7 | (SS+) + ЛПС + циклогексимид | 9.9 ± 0.6 | 7.5 ± 0.4* | 0.91 ± 0.05 |
| 8 | (SS–) + ЛПС + циклогексимид | 10.3 ± 0.5 | 7.8 ± 0.5@ | 1.04 ± 0.07@ |
* – различия достоверны по отношению к показателям интактных полосок первой группы, р < 0.05; & – различия достоверны по отношению к показателям интактных полосок первой группы, р < 0.01; @ – различия достоверны по отношению к показателям деэндотелизированных полосок второй группы, р < 0.05; # – различия достоверны по отношению к показателям деэндотелизированных полосок второй группы, р < 0.01.
Поскольку данных об эффектах ЛПС на сократительную функцию ГМК капсулы ЛУ крайне мало, мы оценили параметры сократительной активности интактных и деэндотелизированных полосок капсулы ЛУ после добавления в инкубационную среду ЛПС (через 1 и через 6 ч). Исследование препаратов, инкубированных в среде с ЛПС на протяжении 1 ч, не выявило достоверных изменений параметров их сократительной функции по сравнению с препаратами 1-й и 2-й групп (не показано). Полоски капсулы ЛУ, обработанные ЛПС на протяжении 6 ч (группы 3 и 4), имели более низкий уровень тонуса, ни в одном из препаратов этих групп не было зарегистрировано спонтанных фазных сокращений (табл. 2).
С целью исследования механизмов действия ЛПС на капсулу мезентериальных ЛУ быка в одной из серий опытов (группы 5 и 6) одновременно с ЛПС в среду был добавлен актиномицин D (ингибитор синтеза РНК), а в другой (группы 7 и 8) – циклогексимид (ингибитор синтеза белка). После 6-часовой инкубации, полоски капсулы ЛУ исследовали по стандартной схеме. Было установлено, что параметры сократительной активности полосок капсулы ЛУ групп 5–8 мало отличались от аналогичных в группах 1 и 2. Частота фазных сокращений полосок капсулы ЛУ групп 5–8 были несколько меньше по сравнению с аналогичными препаратами групп 1 и 2, однако это уменьшение было незначительным и составляло в различных экспериментах 3–7% от величин, зарегистрированных в группах 1 и 2.
С целью исследования релаксационных свойств полосок капсулы ЛУ, после инкубации в среде F-10 Ham полоски дважды промывали PSS и помещали в камеру миографа. Все препараты подвергали исходному натяжению в 16 мН. После 30-минутного нахождения в камере миографа устанавливался стабильный уровень тонического напряжения полосок (табл. 2 и рис. 1). Затем в камеру миографа вводили раствор папаверина (40 мкМ), под действием которого препараты максимально расслаблялись. На рис. 1 представлены фрагменты записи двух экспериментов (на рис. 1а – запись изменения напряжения полоски капсулы ЛУ, инкубированной в среде F-10 Ham + ЛПС, на рис 1b – запись изменения напряжения полоски, инкубированной в среде F-10 Ham без ЛПС).
Рис. 1.
Реакции полосок капсулы ЛУ на папаверин. a – реакция полоски капсулы ЛУ, инкубированной в среде F-10 Ham + ЛПС; b – реакция полоски капсулы ЛУ, инкубированной в среде F-10 Ham без ЛПС. Левая часть кривой демонстрирует тонус препаратов через 30 мин после помещения в камеру миографа и создания исходного натяжения в 16 мН. ↓PP – момент добавления в PSS папаверина. Правая часть кривой показывает тонус препаратов под влиянием папаверина. Вертикальная стрелка показывает амплитуду релаксации полосок. Внизу – шкала времени (в мин).
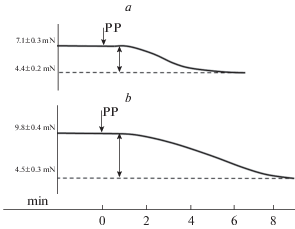
Папаверин-индуцированная релаксация полосок капсулы ЛУ разных групп отличалась. Амплитуда релаксации препаратов, инкубированных в среде F-10 Ham без ЛПС, была значительно больше по сравнению с таковой полосок капсулы ЛУ, инкубированных с ЛПС. Однако детальный анализ показал, что обе группы препаратов под влиянием папаверина достигли примерно одинакового уровня напряжения. Эти данные являются чрезвычайно интересными и свидетельствуют о том, что ГМК полосок капсулы ЛУ, инкубированные с ЛПС, уже были значительно расслаблены еще до воздействия папаверина.
В следующих экспериментах с целью изучения сигнальных путей, активируемых или ингибируемых ЛПС в клетках капсулы ЛУ и приведших к дилатации интактных полосок капсулы ЛУ (SS+), в PSS, омывающий препараты, добавляли ингибиторы индуцибельной NO-синтазы (iNOS) – 1400W, цистатионин-γ-лиазы (CSE) – DL-Propargylglycine, цистатионин-β-синтазы (CBS) – аминооксиацетат и 3-меркаптопуриватсульфуртрансферазы (3-MST) – L-Aspartic acid. В первой серии опытов по завершении инкубирования полосок капсулы ЛУ в среде F-10 Ham и в среде F-10 Ham + ЛПС препараты размещали в камере миографа, задавали стандартное натяжение и выдерживали 30 мин для стабилизации. После этого в омывающий раствор добавляли фенилэфрин (PE) и через 5 мин измеряли величину тонического напряжения, развиваемого полосками под действием РЕ. В ответ на применение PE, полоски капсулы ЛУ реагировали выраженным повышением тонуса. Сократительные реакции полосок капсулы ЛУ, инкубированных в среде F-10 Ham, имели бóльшую амплитуду по сравнению с реакциями полосок капсулы ЛУ, инкубированных в среде F-10 Ham + ЛПС. Затем заменяли раствор с РЕ на PSS, через 10 мин в PSS добавляли 1400W и через 20 мин вводили РЕ и вновь измеряли величину тонического напряжения, сравнивая ее с предыдущим показателем.
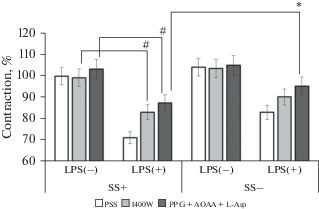
На других полосках капсулы ЛУ исследования проводили по такой же схеме, но в раствор добавляли ингибиторы ферментов, синтезирующих H2S: PPG + АОАА + L-Asp. На фоне действия ингибиторов H2S-продуцирующих ферментов, амплитуда PE-индуцированной сократительной реакции полосок капсулы ЛУ, инкубированных в среде F-10 Ham + ЛПС, увеличивалась. В другой серии опытов с целью определения роли эндотелия в ЛПС-индуцированной дилатации капсулы ЛУ, исследования были проведены на полосках капсулы ЛУ с удаленным субкапсулярным синусом. Опыты были проведены по такой же схеме, концентрации применяемых химических веществ были одинаковыми. Результаты этих двух серий опытов представлены на рис. 2.
Рис. 2.
Амплитуда РЕ-индуцированного сокращения интактных полосок капсулы брыжеечных ЛУ быка (SS+) и полосок капсулы ЛУ с удаленным субкапсулярным синусом (SS–) после инкубирования в среде F-10 Ham (LPS–) и в среде F-10 Ham + LPS (LPS+) на фоне действия ингибитора индуцибельной NO-синтазы (1400W) и смеси ингибиторов H2S-продуцирующих ферментов (DL-Propargylglycine + + аминооксиацетат + L-Aspartic acid). PSS – физиологический солевой раствор. Амплитуда РЕ-индуцированного сокращения интактных полосок капсулы брыжеечных ЛУ быка в PSS принята за 100%.
Поскольку ЛПС оказывал на капсулу ЛУ релаксирующий эффект, а на рис. 2 представлены величины сократительных реакций препаратов, то анализировать эти данные достаточно сложно. Поэтому нами представлены результаты этих же исследований в другом виде. Мы исходили из того, что разница в амплитудах PE-индуцированного сокращения полосок капсулы ЛУ, инкубированных в среде F-10 Ham и в среде F-10 Ham + ЛПС, по сути своей представляет собой величину релаксации препаратов, вызванной действием ЛПС. Поэтому на рис. 3 мы представили данные о величинах релаксации полосок капсулы ЛУ (интактных и деэндотелизированных), вызванной действием ЛПС в PSS и на фоне применения ингибиторов ферментов, продуцирующих NO и H2S. Применение 1400W сопровождалось значительным уменьшением амплитуды релаксации капсулы ЛУ. В свою очередь, действие комплекса ингибиторов синтеза H2S также приводило к значительному ослаблению ЛПС-индуцированной релаксации капсулы ЛУ.
Рис. 3.
Амплитуда релаксации интактных полосок капсулы брыжеечных ЛУ быка (SS+) и полосок капсулы ЛУ с удаленным субкапсулярным синусом (SS–) после инкубирования в среде F-10 Ham + ЛПС на фоне действия ингибитора индуцибельной NO-синтазы (1400W) и смеси ингибиторов H2S-продуцирующих ферментов (DL-Propargylglycine + аминооксиацетат + L-Aspartic acid). PSS – реакции в физиологическом растворе. Различия достоверны: * – р < 0.01.

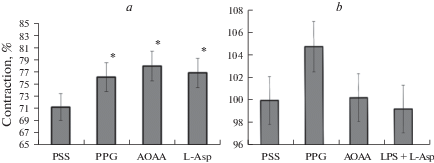
Поскольку ферментативный путь образования H2S в большинстве биологических тканей считается основным [24], то в последующих опытах с целью определения конкретных ферментов, продуцирующих H2S в капсуле ЛУ при воспалении, мы применяли по одному ингибитору. Полоски капсулы ЛУ с сохраненным субкапсулярным синусом подвергали воздействию РЕ и оценивали амплитуду сокращения. Затем удаляли РЕ, в раствор вводили один из ингибиторов H2S-продуцирующих ферментов и через 20 мин в раствор вновь добавляли РЕ. Измеряли амплитуду сократительной реакции и сравнивали ее с амплитудой РЕ-индуцированного сокращения в растворе без ингибитора. Разницу в амплитудах PE-индуцированного сокращения полосок капсулы ЛУ в физиологическом растворе и в растворе с ингибитором считали релаксацией, вызванной H2S, продуцируемым ингибированным ферментом. Данные этой серии опытов представлены на рис. 4. Применение каждого из трех ингибиторов ферментов, синтезирующих H2S, сопровождалось достоверным увеличением амплитуды сокращения, т.е. уменьшением релаксирующего эффекта ЛПС (рис. 4a). Для сравнения на рис. 4b представлены результаты аналогичных экспериментов на полосках капсулы ЛУ, инкубированных в среде F-10 Ham без ЛПС. Представляется интересным, что тенденция к увеличению амплитуды РЕ-индуцированного сокращения (хотя и недостоверное) в этих препаратах наблюдалось только при ингибировании цистатионин-γ-лиазы.
Рис. 4.
Амплитуда PE-индуцированного сокращения полосок капсулы ЛУ с сохраненным субкапсулярным синусом, инкубированных в среде F-10 Ham + ЛПС (a) и в среде F-10 Ham без LPS (b) в физиологическом растворе (PSS) и при действии ингибиторов H2S-продуцирующих ферментов: цистатионин-γ-лиазы (PPG), цистатионин-β-синтазы (AOAA) и 3-меркаптопуриват сульфуртрансферазы (L-Asp). Амплитуда сокращения препаратов показана в % от амплитуды сокращения полосок капсулы ЛУ, инкубированных в среде F-10 Ham без ЛПС. * – различия достоверны по отношению к величине сокращения препаратов в PSS, р < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К настоящему времени хорошо известно, что Н2S участвует в регуляции функций сердечно-сосудистой системы, желудочно-кишечного тракта, нервной системы и почек, а также является важнейшим участником воспалительного процесса [25]. Помимо этого, Н2S способен оказывать влияние на различные аспекты иммунного ответа, как врожденного (регуляция функций нейтрофилов, макрофагов и тучных клеток [26], так и приобретенного – стимуляция дифференцировки Т-клеток [27]. Что касается исследований влияния Н2S на органы лимфатической сосудистой системы, обеспечивающие транспорт лимфы – лимфатические сосуды и ЛУ, то подобные работы единичны, зарегистрированы лишь эффекты экзогенного H2S и продемонстрированы вероятные сигнальные пути, вовлеченные в ответ на применение H2S [21, 28].
Как уже указывалось во “Введении”, в задачу нашего исследования не входило изучение иммунных клеток ЛУ и регуляции их взаимодействия с дендритными клетками. Задача была более простой (хотя и менее изученной) – оценить роль эндогенного H2S в релаксации капсулы ЛУ в процессе его воспалительного ремоделирования. ЛУ – это очень динамические структуры, которые должны иметь возможность в процессе адаптивных реакций быстро увеличиваться в размерах с целью рекрутирования лимфоцитов и дендритных клеток и сохранять при этом свою структурную целостность. Подобное уникальное свойство ЛУ обеспечивается сетью фибробластических ретикулярные клеток (FRC), формирующих довольно жесткий каркас, поддерживающий внутреннюю структуру ЛУ [29]. Помимо FRC, в процесс быстрого и обширного ремоделирования ЛУ вовлекаются и другие стромальные клетки, формирующие основу ЛУ. Основными причинами, приводящими к увеличению размеров ЛУ сразу после инфицирования или иммунизации, являются расширение афферентных лимфатических сосудов, что приводит к возрастанию рекрутирования антигенпрезентирующих ДК с периферии [30], а также увеличение количества, размеров и проницаемости вен с высоким эндотелием для облегчения проникновения в ткань ЛУ наивных лимфоцитов [31]. Увеличение размеров ЛУ также связано с блокированием выхода лимфоцитов из ЛУ [32, 33]. В итоге количество антигенпрезентирующих клеток и лимфоцитов в дренирующих ЛУ сильно увеличивается. Реконструкция плотной жесткой сети FRC в ЛУ в процессе воспалительного ремоделирования изучена лишь частично [30]. Что же касается изменений структуры и функции капсулы ЛУ при воспалительном ремоделировании, то таковых данных к настоящему времени практически нет.
Результаты проведенного нами исследования показывают, что кратковременное (на протяжении 1 ч) действие ЛПС на капсулу брыжеечных ЛУ быка не оказывает влияния на параметры ее сократительной функции (уровень тонического напряжения и параметры фазных сокращений практически не изменялись). В то же время 6-часовое воздействие ЛПС приводило к ингибированию фазных сокращений и выраженному снижению уровня тонического напряжения капсулы. Полученные данные дают основания предположить, что в процессе 6-часовой инкубации препаратов в среде с ЛПС под его влиянием происходит экспрессия ряда генов, приводящая к образованию белков, оказывающих ингибирующее влияние на сократительную функцию ГМК капсулы ЛУ. Данное предположение подтверждается результатами экспериментов с добавлением в инкубационную среду актиномицина D (ингибитора синтеза РНК), или циклогексимида (ингибитора синтеза белка). Наличие в инкубационной среде ингибиторов препятствовало развитию ЛПС-индуцированного угнетения сократительной функции ГМК клеток капсулы ЛУ (табл. 2).
Какие белки экспрессируются в капсуле ЛУ под действием ЛПС? В нашей предыдущей работе было показано, что такими белками могут быть индуцибельная NO-синтаза и циклооксигеназа-2 [20]. Данные настоящего исследования (результаты экспериментов с применением специфического ингибитора iNOS – 1400W) также подтверждают, что ЛПС способствует экспрессии в капсуле ЛУ индуцибельной NO-синтазы, которая способна производить большие количества NO [34], приводящие к мощной релаксации ГМК капсулы ЛУ.
Поскольку ранее нами было доказано, что в физиологических условиях H2S оказывает выраженный релаксирующий эффект на капсулу ЛУ быка [21], естественно было предположить, что этот газотрансмиттер принимает участие в регуляции функций ГМК капсулы ЛУ при воспалении. Поэтому в следующей серии опытов мы оценили сократительные свойства ГМК капсулы после воздействия на нее ингибиторов H2S-синтезирующих ферментов. На первоначальном этапе мы применяли смесь ингибиторов (DL-пропаргилглицин + аминооксиацетат + L-аспарагиновая кислота). На фоне действия ингибиторов H2S-продуцирующих ферментов амплитуда PE-индуцированной сократительной реакции полосок капсулы ЛУ, инкубированных в среде F-10 Ham + ЛПС, увеличивалась, что подтверждает участие H2S в релаксации ГМК капсулы ЛУ, обработанного ЛПС. Близкие результаты были получены также при исследовании по аналогичной схеме полосок капсулы ЛУ с удаленным субкапсулярным синусом, это дает основания предположить, что основным источником эндогенного H2S являются не эндотелиальные клетки субкапсулярного синуса, а гладкомышечные клетки капсулы ЛУ.
Поскольку наличие в растворе смеси ингибиторов трех ферментов, продуцирующих H2S в капсуле ЛУ, значительно уменьшало амплитуду релаксации капсулы ЛУ, естественно вставал вопрос о значимости каждого из ферментов в этом процессе. Следующая серия опытов была поставлена с целью получения ответа на этот вопрос. Применение ингибиторов в действующих концентрациях по одному на разных препаратах (с целью исключения кумулятивного и других нежелательных эффектов) показало, что в капсуле ЛУ при моделировании воспаления экспрессируются все три H2S-синтезирующих фермента: цистатионин-γ-лиаза (CSE), цистатионин-β-синтаза (CBS) и 3-меркаптопуриватсульфуртрансфераза (3-MST). Данные наших экспериментов показывают, что роль каждого из них в ЛПС-индуцированной релаксации капсулы ЛУ была примерно одинаковой. При этом необходимо отметить интересный факт: полоски капсулы ЛУ, не подвергавшиеся воздействию ЛПС, наиболее активно реагировали на применение DL-пропаргилглицина, это дает основание предположить, что в физиологических условиях в капсуле ЛУ наиболее активна CSE.
При всей важности и многообразии механизмов действия H2S в капсуле ЛУ важно не забывать об NO, синтезируемым в этой же структуре. Одновременная экспрессия в капсуле ЛУ H2S и NO позволяет существенно усилить релаксационный эффект: способствует образованию биологически активных гибридных форм S/N, H2S индуцирует высвобождения NO из его различных стабильных “пулов” и повышает удельную активность NO-синтаз. H2S стабилизирует растворимую гуанилатциклазу в восстановленной форме, чувствительной к NO, а также ингибирует сосудистую фосфодиэстеразу (PDE5), тем самым продлевая биологический период полужизни cGMP. Наконец, полисульфиды, производные H2S, непосредственно активируют cGMP-зависимую протеинкиназу (PKG). В итоге, H2S, сам являясь мощным релаксантом, является еще и важным эндогенным усилителем передачи сигналов NO, способствуя дополнительной релаксации [35]. Таким образом, наличие в капсуле воспаленного ЛУ двух газотрансмиттеров способствует ее достаточно быстрой и мощной релаксации, что позволяет ЛУ увеличиться в объеме и начать задерживать в синусах ЛУ дендритные клетки и лимфоциты, создавая условия для развития иммунный реакций.
Список литературы
von der Weid PY, Muthuchamy M (2010) Regulatory mechanisms in lymphatic vessel contraction under normal and inflammatory conditions. Pathophysiology 17: 263–276. https://doi.org/10.1016/j.pathophys.2009.10.005
Liao S, von der Weid PY (2015) Lymphatic system: an active pathway for immune protection. Semin Cell Dev Biol 38: 83–89. https://doi.org/10.1016/j.semcdb.2014.11.012
Wülfing C, Günther HS (2015) Dendritic cells and macrophages neurally hard-wired in the lymph node. Sci Rep 19;5: 16866. https://doi.org/10.1038/srep16866
Willard-Mack CL (2006) Normal structure, function, and histology of lymph nodes. Toxicol Pathol 34(5): 409–424. https://doi.org/10.1080/01926230600867727
Lucas ED, Tamburini BAJ (2019) Lymph Node Lymphatic Endothelial Cell Expansion and Contraction and the Programming of the Immune Response. Front Immunol 10: 36. https://doi.org/. eCollection 2019https://doi.org/10.3389/fimmu.2019.00036
Jalkanen S, Salmi M (2020) Lymphatic endothelial cells of the lymph node. Nat Rev Immunol 20(9): 566–578. https://doi.org/10.1038/s41577-020-0281-x
Bonavita O, Mollica Poeta V, Setten E, Massara M, Bonecchi R (2017) ACKR2: An Atypical Chemokine Receptor Regulating Lymphatic Biology. Front Immunol 7: 691. https://doi.org/10.3389/fimmu.2016.00691
Cohen JN, Guidi CJ, Tewalt EF, Qiao H, Rouhani SJ, Ruddell A, Farr AG, Tung KS, Engelhard VH (2010) Lymph node-resident lymphatic endothelial cells mediate peripheral tolerance via Aire-independent direct antigen presentation. J Exp Med 207(4): 681–688. https://doi.org/10.1084/jem.20092465.9
Saxena V, Li L, Paluskievicz C, Kasinath V, Bean A, Abdi R, Jewell CM, Bromberg JS (2019) Role of lymph node stroma and microenvironment in T cell tolerance. Immunol Rev 292(1): 9–23. https://doi.org/10.1111/imr.12799
Reynoso ED, Lee JW, Turley SJ (2009) Peripheral tolerance induction by lymph node stroma. Adv Exp Med Biol 633: 113–112 https://doi.org/10.1007/978-0-387-79311-5_10
Thierry GR, Gentek R, Bajenoff M (2019) Remodeling of reactive lymph nodes: Dynamics of stromal cells and underlying chemokine signaling. Immunol Rev 289(1): 42–61. https://doi.org/10.1111/imr.12750
Acton SE, Reis e Sousa C. (2016) Dendritic cells in remodeling of lymph nodes during immune responses. Immunol Rev 271(1): 221–229. https://doi.org/10.1111/imr.12414
Zhu M, Fu YX (2011) The role of core TNF/LIGHT family members in lymph node homeostasis and remodeling. Immunol Rev 244(1): 75–84. https://doi.org/10.1111/j.1600-065X.2011.01061.x
Köhler CN (2010) The actin-binding protein caldesmon is in spleen and lymph nodes predominately expressed by smooth-muscle cells, reticular cells, and follicular dendritic cells. J Histochem Cytochem 58(2): 183–193. https://doi.org/10.1369/jhc.2009.954651
Breslin JW, Yang Y, Scallan JP, Sweat RS, Adderley SP, Murfee WL (2018) Lymphatic Vessel Network Structure and Physiology. Compr Physiol 9(1): 207–299. https://doi.org/10.1002/cphy.c180015
Koning JJ, Mebius RE (2012) Interdependence of stromal and immune cells for lymph node function. Trends Immunol 33(6): 264–270. https://doi.org/10.1016/j.it.2011.10.006
Yang CY, Vogt TK, Favre S, Scarpellino L, Huang HY, Tacchini-Cottier F, Luther SA (2014) Trapping of naive lymphocytes triggers rapid growth and remodeling of the fibroblast network in reactive murine lymph nodes. Proc Natl Acad Sci U S A 111(1): E109–E118. https://doi.org/10.1073/pnas.1312585111
Lobov GI, Pan’kova MN (2011) Mechanical properties of lymph node capsule. Bull Exp Biol Med 151(1): 5–8. https://doi.org/10.1007/s10517-011-1246-7
Lobov GI, Pan’kova MN, Dvoretsky DP, Sergeev IV (2010) Characteristic of the active and passive mechanical properties of the lymph node capsule. Dokl Biol Sci 434: 310–312. https://doi.org/10.1134/S0012496610050054
Lobov GI, Unt DV (2018) Protective Effect of Dexamethasone on Lipopolysaccharide-Induced Inhibition of Contractile Function of Isolated Lymphatic Vessels and Nodes. Bull Exp Biol Med 165(5): 602–605. https://doi.org/10.1007/s10517-018-4222-7
Lobov GI (2020) Relaxing Effect of Hydrogen Sulfide on Isolated Bovine Mesenteric Lymph Nodes. Bull Exp Biol Med 169(2): 192–196. https://doi.org/10.1007/s10517-020-04848-z
Sun HJ, Wu ZY, Nie XW, Bian JS (2020) Role of Endothelial Dysfunction in Cardiovascular Diseases: The Link Between Inflammation and Hydrogen Sulfide. Front Pharmacol 10: 1568. https://doi.org/10.3389/fphar.2019.01568
Greiner R, Pálinkás Z, Bäsell K, Becher D, Antelmann H, Nagy P, Dick TP (2013) Polysulfides link H2S to protein thiol oxidation. Antioxid Redox Signal 19(15): 1749–1765. https://doi.org/10.1089/ars.2012.5041
Lechuga TJ, Chen DB (2019) Analysis of Vascular Hydrogen Sulfide Biosynthesis. Methods Mol Biol. 2007: 19–36. https://doi.org/10.1007/978-1-4939-9528-8_3
Chen CQ, Xin H, Zhu YZ (2007) Hydrogen sulfide: third gaseous transmitter, but with great pharmacological potential. Acta Pharmacol Sin 28(11): 1709–1716. https://doi.org/10.1111/j.1745-7254.2007.00629.x
Roviezzo F, Bertolino A, Sorrentino R, Terlizzi M, Matteis M, Calderone V, Mattera V, Martelli A, Spaziano G, Pinto A, D’Agostino B, Cirino G (2015) Hydrogen sulfide inhalation ameliorates allergen induced airway hypereactivity by modulating mast cell activation. Pharmacol Res100: 85–92. https://doi.org/10.1016/j.phrs.2015.07.032
Yang R, Yu T, Liu D, Shi S, Zhou Y (2018) Hydrogen sulfide promotes immunomodulation of gingiva-derived mesenchymal stem cells via the Fas/FasL coupling pathway. Stem Cell Res Ther 9(1): 62. https://doi.org/10.1186/s13287-018-0804-6
Lobov GI (2020) The Role of Hydrogen Sulfide in the Dilatation of Mesenteric Lymphatic Vessels in Bulls. Bull Exp Biol Med 169(3): 302–305. https://doi.org/10.1007/s10517-020-04874-x
Yang CY, Vogt TK, Favre S, Scarpellino L, Huang HY, Tacchini-Cottier F, Luther SA (2014) Trapping of naive lymphocytes triggers rapid growth and remodeling of the fibroblast network in reactive murine lymph nodes. Proc Natl Acad Sci U S A 111(1): E109–E118. https://doi.org/10.1073/pnas.1312585111
Tan KW, Yeo KP, Wong FH, Lim HY, Khoo KL, Abastado JP, Angeli V (2012) Expansion of cortical and medullary sinuses restrains lymph node hypertrophy during prolonged inflammation. J Immunol 188(8): 4065–4080. https://doi.org/10.4049/jimmunol.1101854
Girard JP, Moussion C, Förster R (2012) HEVs, lymphatics and homeostatic immune cell trafficking in lymph nodes. Nat Rev Immunol (11): 762–773. https://doi.org/10.1038/nri3298
Hess E, Duheron V, Decossas M, Lézot F, Berdal A, Chea S, Golub R, Bosisio MR, Bridal SL, Choi Y, Yagita H, Mueller CG (2012) RANKL induces organized lymph node growth by stromal cell proliferation. J Immunol 188(3): 1245–1254. https://doi.org/10.4049/jimmunol.1101513
Cyster JG, Schwab SR (2012) Sphingosine-1-phosphate and lymphocyte egress from lymphoid organs. Annu Rev Immunol 30: 69–94. https://doi.org/10.1146/annurev-immunol-020711-075011
Förstermann U, Sessa WC (2012) Nitric oxide synthases: regulation and function. Eur Heart J 33(7): 829–37, 837a-837d. https://doi.org/10.1093/eurheartj/ehr304
Szabo C (2017) Hydrogen sulfide, an enhancer of vascular nitric oxide signaling: mechanisms and implications. Am J Physiol Cell Physiol 312(1): C3–C15. https://doi.org/10.1152/ajpcell.00282.2016
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


