Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1490-1504
Развитие гиппокамп-ассоциированных когнитивных нарушений у мышей с моделью болезни Хантингтона
Н. А. Красковская 1, *, А. И. Ерофеев 1, Е. Д. Гришина 1, С. А. Пушкарева 1, Е. И. Герасимов 1, О. Л. Власова 1, И. Б. Безпрозванный 1, 2, **
1 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
2 Юго-Западный Медицинский Центр Университета Штата Техас
Даллас, Техас, США
* E-mail: ninakraskovskaya@gmail.com
** E-mail: mnlabspb@gmail.com
Поступила в редакцию 17.09.2021
После доработки 24.09.2021
Принята к публикации 24.09.2021
Аннотация
Болезнь Хантингтона – наследственное неизлечимое нейродегенеративное заболевание, которое характеризуется двигательными нарушениями – прогрессирующим хореическим гиперкинезом, а также когнитивными и психическими расстройствами, включающими нарушения памяти, депрессию, панические атаки, навязчивые состояния и др. Согласно данным литературы, небольшие когнитивные нарушения начинают проявляться еще до возникновения первых моторных симптомов. Считается, что основную роль в развитии когнитивной дисфункции играет нейродегенерация коры и стриатума. При этом патологические изменения в гиппокампе, которые также могут вызывать когнитивные нарушения, изучены в гораздо меньшей степени. В настоящем исследовании с использованием электрофизиологических экспериментов, морфофункционального анализа, а также поведенческих тестов, мы произвели комплексную оценку гиппокамп-ассоциированных изменений на трансгенной линии мышей YAC128, моделирующей болезнь Хантингтона. Выявленные нарушения механизмов синаптической пластичности и изменения морфологии синапсов в гиппокампе у мышей линии YAC128 носят прогрессирующий характер и наблюдаются раньше, чем нарушения в координации движений. Таким образом, полученные результаты подтверждают гипотезу о развитии нейродегенеративных изменений в гиппокампе , которые вносят вклад в развитие когнитивной дисфункции при болезни Хантингтона.
Болезнь Хантингтона (БХ) – аутосомно-доминантное, наследственное неизлечимое нейродегенеративное заболевание. Данная нейропатология относится к группе патологий, называемых экспансиями тринуклеотидных повторов, характеризующихся повышением числа таких повторов в регуляторной или транслируемой части генов. В случае БХ имеет место увеличение CAG повтора, кодирующего аминокислоту глутамин в первом экзоне гена белка хантингтина, что приводит к формированию полуглутаминового тракта в белке и развитию фенотипа БХ [1]. Когнитивные и моторные нарушения при нейродегенеративных заболеваниях связаны с морфофункциональными изменениями, происходящими в высших отделах центральной нервной системы. Хотя БХ и считается двигательным расстройством [2], у пациентов также наблюдаются когнитивные нарушения, которые проявляются еще до моторных симптомов [3]. Подобное обстоятельство свидетельствует, что помимо стриатума при БХ патологические процессы затрагивают и другие отделы мозга, ответственные за когнитивные функции [4, 5]. При БХ основными “очагами” нейропатологий считаются стриатум, кора головного мозга, таламус и гиппокамп. При этом последний является наименее изученным среди всех перечисленных образований. К гиппокамп-ассоциированным нарушениям относят нарушения памяти, особенно пространственной, внимания, способности к обучению и запоминанию новой информации. Ключ к пониманию патогенеза дегенеративных процессов, которые происходят в гиппокампе при БХ, лежит в изучении изменений синаптической пластичности и деградации синаптических связей нейронов [6]. Стабильная связь между нейрональными клетками поддерживается контактами аксональных бутонов с постсинаптическими структурами – дендритными шипиками [7]. Однако в результате накопления мутантного белка, количество дендритных шипиков сокращается, вследствие чего развивается синаптическая дисфункция, ведущая в дальнейшем к когнитивным и двигательным нарушениям. Развитие кортико-стриатной синаптической дисфункции и элиминация дендритных шипиков в областях коры и стриатума при БХ детально описана [8–13]. Однако развитие дефектов синаптической пластичности в гиппокампе и их взаимосвязь со снижением количества синапсов и поведенческими нарушениями практически не изучены или исследованы на “агрессивных” мышиных моделях БХ, линиях R6/1 и R6/2, с трансгенной вставкой, несущей только фрагмент mhtt (1 экзон). Основным их недостатком считается быстрое развитие фенотипа заболевания, в то время как БХ, как и другие нейродегенеративные заболевания, являются возраст-ассоциированными патологиями, и развитие характерных клинических симптомов начинается в зрелом возрасте. В данном исследовании в качестве модели БХ использовались мыши линии YAC128, несущие трансгенную вставку с полноразмерным геном mhtt человека. Использование этой модели позволило в лучшей степени моделировать возраст-ассоциированный фенотип заболевания и при помощи электрофизиологических, морфологических и поведенческих тестов оценить прогрессирование гиппокамп-ассоциированной синаптической дисфункции и когнитивных нарушений.
МЕТОДЫ ИССЛЕДОВАНИЯ
Трансгенные животные
Исследование проводилось на мышах линии Tg(YAC128)53Hay-М (сокращенно YAC128), которые несут полноразмерный ген человеческого белка хантингтина в составе искусственной хромосомы дрожжей. Также в эксперименте в качестве контроля использовались мыши дикого типа (WT) того же бэкграунда. Гетерозиготных самцов линии FVB-Tg(YAC128)53Hay/J в возрасте 3–6 мес. скрещивали с самками дикого типа такого же возраста. Наличие трансгенной вставки определяли при помощи полимеразной цепной реакции с праймерами к первому экзону гена хантингтина человека (последовательность прямого праймера: 5'-CCG CTC-AGG TTC TGC TTT TA-3' и обратного: 5'-TGG AAG GAC TTG AGG GAC TC-3'). Наличие в пробе зоны на уровне ~170 пар оснований свидетельствовало о наличии трансгенной вставки. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям комиссии по биоэтике Института биомедицинских систем и технологий Санкт-Петербургского Политехнического университета Петра Великого.
Транскардиальная перфузия и приготовление переживающих срезов головного мозга
Перед транскардиальной перфузией мышь анестезировали газовой смесью кислорода с изофлураном (1.5–3%). Перфузию проводили ледяным раствором искусственной спинномозговой жидкости (ИСМЖ) № 1 (в мМ: 92 NMDG, 2.5 KCl, 1.2 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 D-глюкозы, 2 тиомочевины, 5 аскорбата натрия, 3 пирувата натрия, 0.5 CaCl2, 10 MgSO4, 6 N-ацетилцистеина) (0–2°С, pH 7.3–7.4), аэрируемой карбогеном (5% О2 + 95% СО2). После декапитации мозг быстро извлекали с последующим удалением мозжечка, помещали в ледяной раствор ИСМЖ № 1 на 1 мин. Дорсальную часть мозга фиксировали цианакрилатным клеем на специальной подложке, после чего помещали в ледяной карбогенируемый раствор ИСМЖ № 1 для последующего получения горизонтальных срезов гиппокампа.
Получение горизонтальных срезов гиппокампа осуществляли на вибрационном микротоме Leica VT1200 с амплитудой 1 см и скоростью 0.8 мм/c в дорсовентральной плоскости (рис. 3–4 ). Толщина срезов составляла 400 мкм для регистрации долговременной потенциации. Далее из полученного среза с помощью скальпеля вырезали область гиппокампа, которую затем переносили в раствор ИСМЖ № 1 комнатной температуры. Через 10 мин полученные срезы гиппокампа переносили в водяную баню для инкубации при температуре 34°С в течение 30 мин. По окончании 30 мин срезы инкубировали в течении 1 ч в растворе ИСМЖ № 2 (в мМ: 92 NaCl, 2.5 KCl, 1.2 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 D-глюкозы, 2 тиомочевины, 5 аскорбата натрия, 3 пирувата натрия , 2 CaCl2, 2 MgSO4, 6 N-ацетилцистеина) (0–2°С, pH 7.3–7.4), насыщенном карбогеном, при комнатной температуре. После инкубационного периода проводилась регистрация локальных полевых возбуждающих постсинаптических потенциалов (пВПСП).
Метод регистрации электрофизиологической внеклеточной активности
Для изучения механизмов синаптической пластичности в срезах гиппокампа мышей дикого типа и мышей линии YAC128 использовался электрофизиологический метод, основанный на явлении долговременной потенциации (ДВП). Перед началом регистрации возбуждающих постсинаптических потенциалов срезы переносили в специальную ванночку, заполненную раствором ИСМЖ № 3 (в мМ: 124 NaCl, 2.5 KCl, 1.2 NaH2PO4, 24 NaHCO3, 5 HEPES, 12.5 D-глюкозы, 2 CaCl2, 2 MgSO4), насыщенном карбогеном, с постоянным потоком (5 мл/мин) и поддерживаемой температурой на уровне 32°C, и инкубировали в течение 20 мин. В эксперименте использовали 5–6 срезов от каждой мыши. Для регистрации пВПСП и индукции ДВП использовали стимулирующий биполярный электрод (двойная скрученная нить изолированной нихромовой проволоки диаметром 50 мкм (A-M Systems, США)) и регистрирующий стеклянный микроэлектрод. Стимулирующий биполярный электрод располагали на границе областей CA1 и CA2 гиппокампа по ходу расположения коллатералей Шаффера, регистрирующий электрод, заполненный раствором ИСМЖ № 3, – в область CA1. Регистрация пВПСП осуществлялась с помощью усилителя Multiclamp 700B (Molecular devices, США) и цифро-аналогового преобразователя Digidata серии 1440A (Molecular devices, США) с использованием программного обеспечения MultiClamp Commander и pClamp 10.7 (Axon Instruments, США). Запись пВПСП до индукции ДВП осуществляли каждые 20 с парными электрическими импульсами с длительность 0.1 мс и межстимульным интервалом равным 50 мс. Электрические импульсы использовали в диапазоне от 25 до 300 мкА. Силу электрической стимуляции, используемую в эксперименте, подбирали следующим образом. Электрическая стимуляция среза производилась с нулевого значения тока с постепенным увеличением тока с шагом 10 мкА до появления излома у нисходящей фазы пВПСП или появления популяционного спайка. Итоговый ток стимуляции был на 10 мкА (значение равно шагу, с которым производился подбор) меньше тока, при котором появлялся популяционный спайк или излом нисходящей фазы пВПСП. С подобранным током записывали базовую линию (до индукции пВПСП) и производили индукцию ДВП.
Перед индукцией ДВП осуществляли запись пВПСП в течение 20 мин (базовая линия). При этом к индукции ДВП приступали только в случае, если зависимость угла наклона (slope) пВПСП от силы электрической стимуляции не менялась более чем на 10% от первоначального значения. Долговременную потенциацию вызывали с помощью высокочастотной электрической стимуляции (HFS): 100 импульсов в течение 1 с с двухкратным повтором через 200 мс. Регистрацию потенцированных пВПСП после высокочастотной стимуляции производили в течение 60 мин. Для оценки постсинаптической потенциации в срезе усредняли нормированные значения угла наклона в течение первых 3-х мин после высокочастотной стимуляции. Нормированные значения угла наклона рассчитывались как отношение угла наклона после индукции ДВП к среднему значению угла наклона базовой линии.
Приготовление фиксированных срезов головного мозга и анализ морфологии дендритных шипиков
Для визуализации морфологии шипиков на конфокальном микроскопе и дальнейшего анализа был проведен кроссбридинг мышей линии YAC128 с мышами линии Tg(Thy1-EGFP)MJrs/J (линия М ). У мышей линии М в одиночных нейронах головного мозга экспрессируется зеленый флуоресцентный белок, что позволяет контрастно выделить тело и отростки отдельных нейронов гиппокампа. В результате скрещивания был получен гибрид двух линий, который затем скрещивали с мышью линии М в рамках одного бэкграунда. Животные 4-го и 5-го поколений составили экспериментальные группы. Всего было сформировано 4 группы из мышей обоих генотипов в возрасте 6 и 9 месяцев, каждая возрастная группа состояла из 5 мышей. Для получения фиксированных срезов головного мозга после анестезии животного уретаном (250 мг/мл разведенные в 0.9%-ном растворе хлорида натрия) производилась транскардиальная перфузия 4%-ным раствором параформальдегида, растворенном в фосфатно-солевом буфере (pH 7.2). Фиксированные срезы были сделаны на вибрационном микротоме Campden Instruments Ltd. Среднее количество срезов составило 35–40 микрофотографий. Микрофотографии дендритов нейронов гиппокампа были сделаны с помощью конфокального микроскопа ThorLabs. Параметры съемки: объектив Olympus UPlanSApo ×100, разрешение 1024 × 1024, толщина среза 0.2 мкм/пиксель, толщина серии срезов составляла 4–5 мкм. От каждой мыши было получено не менее 10 микрофотографий с фрагментами дендритов длиной не менее 40 мкм, на расстоянии 50 мкм от тела нейронов , которые в дальнейшем обрабатывались в программе Imaris. Затем на основе получившихся изображений производился “слепой” анализ морфологии и количества дендритных шипиков вторичных апикальных дендритов нейронов СА1 области гиппокампа с использованием программного обеспечения NeuronStudio software package. Шипики классифицировались согласно следующим параметрам: минимальный размер пенькового шипика (min stubby size) – 10; непенькового (non-stubby) – 10; отношение размеров головки шипика к шейке (neck ratio) – 1.1; соотношение сторон для тонкого шипика (thin ratio) – 2.5; размер грибовидного шипика (mushroom size) – 0.3.
Поведенческий тест “водный лабиринт Морриса”
Для исследования пространственной памяти у животных использовался тест “водный лабиринт Морриса”, основу которого составлял бассейн из полипропилена диаметром 1.5 м. Навигация для поиска платформы осуществляется при помощи четырех черно-белых ориентиров, расположенных за пределами бассейна и ориентированных в соответствии со сторонами света. Регистрация трека животного осуществляется видеосистемой VS 1304-1 при помощи интерфейса Gigabit Ethernet. Поведенческий тест проводится в течение 5 дней, в ходе которых мышь при помощи черно-белых ориентиров ищет платформу, погруженную в непрозрачную воду в круглом бассейне при температуре воды 21–23°С. Обучающая сессия состоит из 4-ех испытаний в день с интервалом не менее 15 мин и проводится ежедневно в одно и то же время. В течение 90 с мышь ищет в бассейне погруженную платформу. На 5-й день проводится одно тестовое испытание в отсутствие платформы также в течение 90 с. Анализ трека животного осуществлялся в программе “Minopontikos” [14]. Были подсчитаны стандартные параметры: процентное время нахождения в квадранте в тестовый день, где ранее располагалась платформа и количество пересечений платформы. Подсчитывалось также количество успешных попыток во время обучающих сессий.
Статистическая обработка результатов
Для проверки экспериментальных выборок на нормальность распределения использовали критерий Шапиро–Уилка. Если группы демонстрировали дисперсионную однородность, достоверность различий между двумя выборками выявляли с помощью t-критерия Стьюдента и между несколькими выборками – однофакторным дисперсионным анализом с последующим применением апостериорного теста Тьюки. При ненормальном распределения данных для выявления различий между двумя выборками использовали U-критерий Манна–Уитни, при нескольких выборках использовали критерий Краскела–Уоллиса и метод Беньямини–Йекутили. Результаты считали достоверными, если вероятность (р) нарушения гипотезы об отсутствии различий между выборками была меньше 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Нарушение долговременной потенциации у мышей с моделью болезни Хантингтона
Для выявления нарушений синаптической пластичности у мышей с моделью БХ измеряли величину ДВП у мышей контрольной (дикий тип, WT) и экспериментальной групп (модель БХ, линия YAC128) в возрасте 4-ех и 6-ти мес. Сравнения проводились между животными одинакового возраста. Регистрация ДВП осуществлялась в переживающих срезах гиппокампа. Сравнение значений ДВП в контроле у мышей дикого типа и мышей линии YAC128 в возрасте 4-ех мес. подтверждают наличие нарушений синаптической пластичности у последних: значение ДВП составило 2.24 ± 0.22 и 1.53 ± 0.15 соответственно (критерий Манна–Уитни, p < 0.05; рис. 1a). Сравнение значений ДВП у мышей дикого типа и линии YAC128 в возрасте 6-ти месяцев также подтверждают наличие нарушений у последних (рис. 1b). У мышей дикого типа среднее значение ДВП составило 1.75 ± 0.13, что статистически значимо отличается (критерий Манна-Уитни, p < 0.05) от значения у мышей линии YAC128 (1.35 ± 0.09). Обобщенные результаты представлены на рис. 1c в виде диаграмм, иллюстрирующих изменение значения ДВП после высокочастотной стимуляции в контрольной и экспериментальной группах мышей в возрасте 4-ех и 6-ти мес. Кроме оценки уровня ДВП в разных возрастных группах мышей дикого типа и мышей с моделью БХ дополнительно была проведена оценка посттетанического потенцирования (ПТП) . Несмотря на то, что статистически значимых различий обнаружено не было, прослеживается тренд к уменьшению значение ПТП у мышей с моделью БХ по сравнению с мышами дикого типа в 4 месяца: 3.49 ± 0.43 и 2.11 ± 0.1 соответственно. В 6 месяцев статистически значимых различий в значении ПТП обнаружено не было: у мышей дикого типа значение ПТП составило 2.6 ± 0.3, а у мышей линии YAC128 – 1.97 ± 0.17 (рис. 1d).
2. Морфологические изменения дендритных шипиков нейронов СА1 области гиппокампа у мышей с моделью болезни Хантингтона
Для исследования морфологии дендритных шипиков нейронов в результате кроссбридинга была выведена новая трансгенная линия мышей YAC128-M. У данной линии, помимо mHTT, в одиночных нейронах разных отделов головного мозга этих животных, в том числе пирамидных нейронах гиппокампа, экспрессируется зеленый флуоресцентный белок, который контролируется нейрон-специфичным промотором Тhy1. Это свойство позволяет визуализировать структуру нейрональных клеток для дальнейшего изучения морфологии дендритного древа. Важно отметить, что наличие трансгенной вставки не влияло на уровень флуоресценции белка у мышей с моделью БХ (рис. 2a).
Рис. 1.
Долговременная потенциация ослаблена в поле СА1 гиппокампа мышей с моделью БХ в возрасте 4 и 6 месяцев. a – примеры записей и нормализованное значение угла наклона пВПСП до (отмечено сплошной линией) и после (отмечено пунктирной линией) высокочастотной стимуляции у мышей дикого типа WT (n = 4) и мышей линии YAC128 (n = 3) в 4 мес. b – примеры записей и нормализованное значение угла наклона пВПСП до (отмечено сплошной линией) и после (отмечено пунктирной линией) высокочастотной стимуляции у мышей дикого типа WT (n = 4) и мышей линии YAC128 (n = 4) в 6 мес. c – диаграмма, иллюстрирующие различия в величине ДВП между мышами дикого типа и мышами с моделью БХ в возрасте 4-ех и 6-ти мес. Данные представлены как среднее ± стандартная ошибка среднего, * p < 0.05 достоверность рассчитана по критерию Манна–Уитни. d – диаграмма, иллюстрирующая значения ПТП между мышами дикого типа и мышами с моделью БХ в возрасте 4-ех и 6-ти мес. Данные представлены как среднее ± стандартная ошибка среднего.
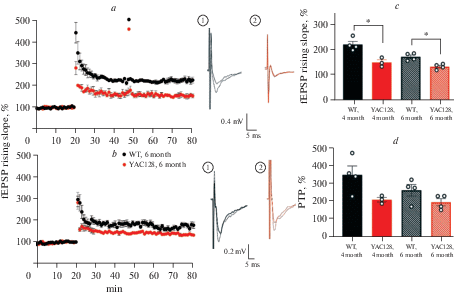
Рис. 2.
Изменение морфологии и количества постсинаптических дендритных шипиков у мышей с моделью болезни Хантингтона. a – экспрессия зеленого флуоресцентного белка в нейронах гиппокампа на срезах головного мозга мышей дикого типа (WT) и мышей линии YAC128, скрещенных с мышами линии М. Конфокальная микроскопия, ×4. Длина масштабного отрезка 100 мкм . b и c – микрофотографии фрагментов дендритного древа, иллюстрирующие морфологию дендритных шипиков нейронов CA1 области гиппокампа мышей дикого типа WT (n = 5) и мышей линии YAC128 (n = 5) в возрасте (b) 6-ти и (c) 9-ти мес. Конфокальная микроскопия, ×100. Длина масштабного отрезка 10 мкм. d – гистограмма, иллюстрирующая плотность дендритных шипиков нейронов СА1 области гиппокампа мышей дикого типа (WT) и мышей с моделью БХ (YAC128) в возрасте 6-ти и 9-ти месяцев. Данные представлены как среднее ± стандартная ошибка среднего, **p < 0.005 . e – гистограмма, иллюстрирующая количество грибовидных дендритных шипиков нейронов СА1 области гиппокампа мышей дикого типа (WT) и мышей с моделью БХ (YAC128) в возрасте 6-ти и 9-ти мес. Данные представлены как среднее ± стандартная ошибка среднего, ***p < 0.001.
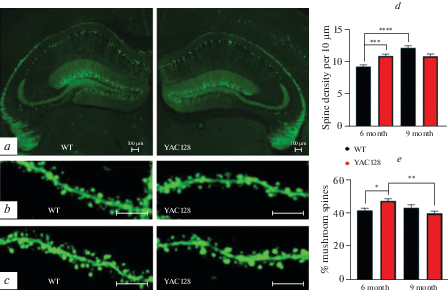
Рис. 3.
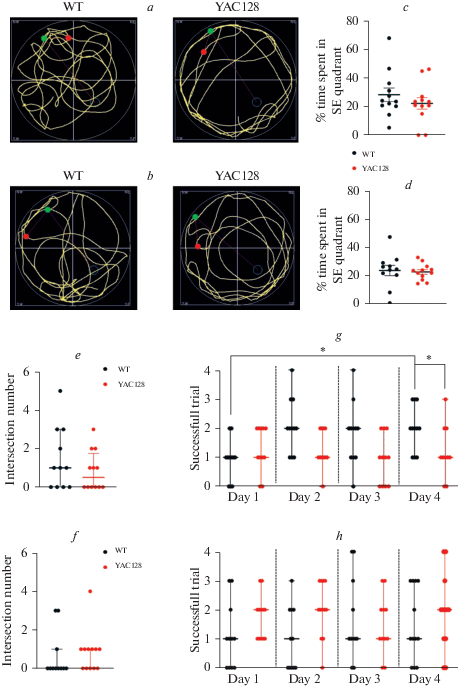
Нарушения в формировании пространственной памяти у мышей с моделью болезни Хантингтона. a – траектория движения мышей дикого типа WT (n = 11) и мышей линии YAC128 (n =11) в бассейне в возрасте 6-ти месяцев в тестовый день. b – траектория движения мышей дикого типа WT (n = 12) и мышей линии YAC128 (n = 10) в бассейне в возрасте 9-ти месяцев в тестовый день. c – график, иллюстрирующий индивидуальные значения процентного времени нахождения в квадранте бассейна SE в тестовый день, где при обучении находилась скрытая платформа мышей дикого типа WT и мышей линии YAC128 в возрасте 6-ти мес. Данные представлены как среднее значение ± ошибка среднего. d – график, иллюстрирующий индивидуальные значения процентного времени нахождения в квадранте бассейна SE в тестовый день, где при обучении находилась скрытая платформа мышей дикого типа WT и мышей линии YAC128 в возрасте 9-ти мес. Данные представлены как среднее значение ± ошибка среднего. e – график, иллюстрирующий количество пересечений платформы в тестовый день для мышей дикого типа WT и мышей линии YAC128 в возрасте 6-ти мес. Данные представлены как медиана ± межквартильный интервал. f – график, иллюстрирующий индивидуальное количество успешных попыток нахождения платформы в каждый из дней обучения мышей дикого типа WT и мышей линии YAC128 в возрасте 9-ти мес. Данные представлены как медиана ± межквартильный интервал. g – график, иллюстрирующий количество пересечений платформы в тестовый день для мышей дикого типа WT и мышей линии YAC128 в возрасте 6-ти мес. Данные представлены как медиана ± межквартильный интервал, p < 0.05. h – график, иллюстрирующий индивидуальное количество успешных попыток нахождения платформы в каждый из дней обучений мышей дикого типа WT и мышей линии YAC128 в возрасте 9-ти мес. Данные представлены как медиана ± межквартильный интервал.
Для оценки морфологических различий дендритных шипиков нейронов СА1 области гиппокампа были получены серии микрофотографий фрагментов дендритов мышей в возрасте 6-ти и 9-ти месяцев . В возрасте 6-ти месяцев наблюдались значительные различия в плотности дендритных шипиков у диких и трансгенных мышей (WT – 9.3 ± 0.3 на 10 мкм; YAC128 – 10.9 ± 0.3 на 10 мкм; p < 0.001; рис. 2b). Наибольший вклад в эту разницу внесло увеличение числа грибовидных шипиков (WT – 41.8 ± 1.3%; YAC128 – 47. 5 ± 1.4%; p = 0.03). Однако к возрасту 9-ти месяцев плотность дендритных шипиков нейронов СА1 области гиппокампа у мышей дикого типа оказалась выше, чем у мышей с моделью БХ (WT – 12.1 ± 0.3 на 10 мкм; YAC128 – 10.9 ± 0.3 на 10 мкм; p = 0.01; рис. 2с). Количество грибовидных шипиков у мышей с БХ оказалось незначительно ниже, чем у мышей дикого типа (WT – 43.3 ± 1.9%; YAC128 – 40 ± 1.4%, YAC128 6 мес. – 47.4 ± 1.3%; p = 0.15). У СА1 нейронов мышей дикого типа с возрастом наблюдается тенденция к увеличению плотности дендритных шипиков (WT 6 мес. – 9.2 ± 0.3 на 10 мкм; WT 9 мес. – 12.1 ± 0.3 на 10 мкм; p = 0.0001) , в то время как у животных с моделью БХ этот показатель практически не изменился (YAC128 в возрасте 6-ти мес. – 10.9 ± 0.3 на 10 мкм; YAC128 в возрасте 9-ти мес. – 10.9 ± 0.3 на 10 мкм; p = 0.9) (рис. 2d). Кроме того, количество грибовидных шипиков СА1 нейронов мышей трансгенной линии в возрасте 9-ти мес. снижено по сравнению с показателем более молодых животных того же генотипа (YAC128 6 мес. – 47.4 ± 1.3%; YAC128 9 мес. – 40 ± 1.4%; p = = 0.004) (рис. 2e).
3. Нарушения в формировании пространственной памяти у мышей с моделью болезни Хантингтона
Для анализа когнитивных нарушений у мышей с моделью БХ использовался наиболее распространенный тест – водный лабиринт Морриса, позволяющий оценить гиппокамп-ассоциированные нарушения в формировании памяти, в том числе при приобретении новых навыков и запоминания информации. На рис. 3a и 3b представлены треки мышей дикого типа и мышей линии YAC128 в возрасте 6-ти и 9-ти мес. в тестовый день.
Согласно полученным результатам, мыши линии YAC128 в возрасте 6-ти месяцев в тестовый день в среднем проводили одинаковое количество времени в квадранте, где во время обучения располагалась платформа (28.0 ± 5.1% и 21.6 ± 4.2%) (рис. 3c). Мы также рассчитали количество пересечений с областью, где располагалась платформа в обучающих сессиях. Мыши дикого типа в среднем пересекали область расположения платформы чаще – количество пересечений в тестовый день составило 1.81 ± 0.5 раза, а для трансгенных мышей этот показатель составил 1 ± 0.4 раз. Однако статистически значимых значений этот показатель также не достигал (рис. 3e). Далее мы оценили способность мышей к обучению, проанализировав количество успешных попыток нахождения платформы в 1-й и 4-й день. Согласно полученным данным, мыши дикого типа к концу обучающих сессий успешнее справлялись с поиском платформы и в среднем находили ее в половине попыток, в то время как количество успешных попыток у мышей с моделью БХ были заметно ниже по сравнению с мышами дикого типа и в среднем состояло из одной успешной попытки (р = 0.04). Количество успешных попыток в первый день обучения было одинаковым у мышей обоих генотипов и в среднем состояло из одной попытки. Таким образом, мыши линии дикого типа продемонстрировали способность к обучению и запоминанию новой информации, увеличив количество успешных попыток с 1-й до 2-х к 4-му дню обучения (р = 0.02), в то время как мыши линии YAC128 количество успешных попыток в 1-й и 4-й день осталось одинаковым (рис. 3g).
К возрасту 9-ти мес. способность к обучению у мышей обоих генотипов в целом снизилась: в среднем они проводили одинаковое количество времени в квадранте, где во время тренировочных сессий находилась платформа (24.16 ± 3.6% и 23.14 ± 1.7% для мышей дикого типа и линии YAC128 соответственно) (рис. 3d). В тестовый день количество пересечений зоны, где ранее находилась платформа, также достоверно не отличалось и составило 0.72 ± 0.3 и 1 ± 0.3 для диких и трансгенных мышей соответственно (рис. 3f). При оценке количества успешных попыток также не было обнаружено различий как между генотипами, так и мышами одного генотипа в первый и последний день обучающих сессий, их количество составило 1 и 2 для мышей дикого типа и мышей линии YAC128 соответственно (рис. 3h).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Долгое время считалось, что когнитивная дисфункция у пациентов с БХ вызвана патологическими изменениями в кортико-стриатном пути. Об этом свидетельствовали данные, полученные как на моделях мышей, так и исследования среди пациентов с БХ [15]. Однако в ряде исследований было отмечено, что патологические процессы в гиппокампе, возникающие вследствие mhtt, могут вносить вклад в развитие когнитивной дисфункции. Об этом свидетельствует прогрессирующее с возрастном накопление mHTT в ядрах клеток гиппокампа с формированием нейрональных внутриядерные включений [16, 17]. Кроме того, в поддержку данной гипотезы свидетельствуют эксперименты по изучению механизмов ДВП в гиппокампе животных с моделью БХ. ДВП представляет собой усиление синаптической передачи между двумя нейронами, сохраняющееся в течение длительного времени после прекращения действия стимула. Согласно концепции современной нейробиологии данный процесс лежит в основе клеточных механизмов памяти и обучения. Впервые нарушение механизмов ДВП в гиппокампе мышей с моделью БХ было показано в статье [18]. Дальнейшие исследования показали взаимосвязь между снижением ДВП и поведенческим фенотипом, выражающимся в нарушении пространственного восприятия [19], причем указанные нарушения имеют место еще до гибели нейрональных клеток. Впоследствии этот феномен был зарегистрировано на различных моделях БХ, в том числе на трансгенной (knock-in) модели Hu97/18 [20], которая уникальна тем, что содержит только ген хантингтина человека. У мышей модели Hu97/18 в возрасте 9 месяцев авторы обнаружили полное отсутствие ДВП в срезах через 50–60 мин после высокочастотной стимуляции, что согласуется с данными [18, 19, 21], при этом в возрасте 3 месяцев было показано, что ДВП не нарушена [22], т.е. когнитивные нарушения в модели Hu97/18 имеют прогрессивный характер. В нашем исследовании ДВП в возрасте 4-ех мес. мы также зарегистрировали снижение величины пластичности после высокочастотной стимуляции у мышей с моделью БХ по сравнению с мышами дикого типа. В возрасте 6-ти мес. также наблюдалось различие ДВП между генотипами.
Функциональные изменения, происходящие в нейронах гиппокампа при БХ, находят отражение в морфологических изменениях. Как и при других нейродегенеративных заболеваниях, при БХ наблюдаются изменения структуры дендритного древа нейронов, в особенности дендритных шипиков [13]. Шипики являются весьма динамичными постсинаптическими структурами, поэтому изменения в морфологии шипиков отражают функциональные изменения, происходящие в синапсе при синаптической передаче. Их плотность и морфология тесно коррелирует с активностью множества клеточных процессов, некоторые из которых вовлечены в механизмы регуляции синаптической пластичности, которая, в свою очередь, является субстратом когнитивных функций, таких как обучение и память [23]. Элиминация шипиков приводит к потере синаптических связей между нейронами и лежит в основе клеточных механизмов когнитивных нарушения. Ранее был проведен анализ морфологии апикальных дендритов пирамидных нейронов CA1 области гиппокампа только у мышей модели R6/2, который выявил снижение плотности дендритных шипиков, преимущественно за счет снижения фракции грибовидных шипиков по сравнению с контрольной группой. Кроме того, авторы также отметили увеличение количества филоподиеподобных структур у мышей с моделью БХ [24]. Исследования морфологии дендритных шипиков проводилось также на культивируемых нейронах гиппокампа. Было показано, что грибовидные дендритные шипики больше остальных подвержены элиминации вблизи агрегатов mHTT [25]. Однако у мышей линии YAC128 агрегаты мутантного белка наблюдаются с возраста 12 месяцев [2], поэтому не могут негативно влиять на морфофункциональные изменения в синапсах. В нашем исследовании мы наблюдали сначала увеличение плотности дендритных шипиков и количества грибовидных дендритных шипиков по сравнению с диким типом в возрасте 6 месяцев и затем постепенное снижение плотности шипиков к 9 месяцам, что не может быть объяснено агрегацией mHTT, которая еще не наблюдается в данной возрасте в гиппокампе. Ранее анализ электрофизиологической активности клеток выявил повышенный выброс глутамата из аксонных терминалей кортикальных нейронов, которое было зарегистрировано на данной модели [26]. Эксперименты по изучению колокализации пре- и постсинаптических маркерных белков VGLUT1 и GluA2 также продемонстрировали увеличение грибовидных шипиков в культивируемых нейронах коры, выделенных из мышей линии YAC128 [27]. Еще одно объяснение результатов исследований может вытекать из нормальной функции белка HTT, который в норме усиливает экспрессию нейротрофического фактора мозга (BDNF). Геном мышей трансгенной линии кроме гена, кодирующего собственный HTT, содержит ген человеческого HTT. Поэтому в досимптоматический период повышенный уровень BDNF может приводить к увеличению фракции грибовидных шипиков, важную роль в поддержании структуры которых как раз и играет BDNF. Однако с прогрессированием нейропатологии наблюдается снижение уровня BDNF, которое ранее было показано в статье, описывающей взаимосвязь между структурными изменениями в дендритных шипиках и нарушением синаптической пластичности в гиппокампе при БХ [21]. Как отмечалось выше, морфология синапсов тесно коррелирует с их функциональной активностью, поэтому снижение уровня BDNF при БХ в конечном итоге приводило к снижению полимеризации актина – основного биохимического процесса, ответственного за структурную организацию цитоскелета дендритного шипика.
Нарушение пространственной памяти вследствие агрегации mHTT у мышей линии R6/2 детектируется раньше других поведенческих изменений [28]. У мышей линии YAC128 в возрасте 8-ми мес. также наблюдается нарушения пространственной памяти, выявленное в упрощенном плавательном тесте, отличающимся от теста Морриса малым размером бассейна и временем испытания. У мышей линии Hu97/18 также ухудшается пространственное обучение, детектируемое в тесте “узнавание известного объекта в новой локации”. В этом тесте у модели БХ нарушения пространственного обучения было отмечено с возраста в 6 месяцев [22].
У пациентов с БХ гиппокамп-ассоциированные нарушения в пространственной ориентации также были выявлены при помощи виртуального бассейна, разделенного на 4 квадранта, в котором осуществляется поиск скрытой платформы. Согласно полученным данным, в среднем контрольная группа и группа пациентов с БХ в доманифестный период проводили большую часть время поиска платформы в правильном квадранте, а пациенты с ранней стадией БХ проводят значительно меньше времени в правильном квадранте по схеме, предполагающей случайный поиск. Кроме того, в ходе исследования испытуемые также выполняли тест парных ассоциаций, оценивающий визуальную и ассоциативную память. Данный тест используется для диагностики болезни Альцгеймера и активирует область гиппокампа, что было показано при помощи функциональной магнитно-резонансной томографии. Пациенты с ранней стадией БХ делали ошибки гораздо чаще, чем здоровые добровольцы. Кроме того, среди пациентов в доманифестный период наблюдалось в три раза больше ошибок в заданиях с шестью и восемью образцами, причем частота ошибок коррелировала с расчетным временем до манифестации болезни [29]. В нашем исследовании мы также наблюдали нарушение в формировании пространственной памяти, начиная с возраста 6-ти мес. И хотя в тестовый день различий в процентном времени и количестве пересечений зоны платформы не было обнаружено, мыши дикого типа в целом лучше справлялись с поиском платформы по окончанию обучающих сессии, в то время как мыши с моделью БХ не были способны запоминать новую информацию и не улучшали свои показатели к концу обучающих сессий, что хорошо коррелирует со снижением синаптической пластичности, наблюдаемое в этом возрасте.
Таким образом, полученные нами данные указывают на непосредственную вовлеченность нейродегенеративных изменений в гиппокампе в развитие когнитивных нарушений, наблюдаемых при БХ. Полученные нами результаты о нарушениях в гиппокампе указывают на системную синаптическую дисфункцию при данной нейропатологии в разных отделах головного мозга, наблюдаемую даже в отсутствие агрегатов мутантного белка в нейронах.
Список литературы
The Huntington’s Disease Collaborative Research Group (1993) A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington’s disease chromosomes. Cell 72: 971–983. https://doi.org/10.1016/0092-8674(93)90585-e
Van Raamsdonk JM, Warby SC, Hayden MR (2007) Selective degeneration in YAC mouse models of Huntington disease. Brain Res Bull 72: 124–131. https://doi.org/10.1016/j.brainresbull.2006.10.018
Van Raamsdonk JM, Pearson J, Slow EJ, Hossain SM, Leavitt BR, Hayden MR (2005) Cognitive dysfunction precedes neuropathology and motor abnormalities in the YAC128 mouse model of Huntington’s disease. J Neurosci 25: 4169–4180. https://doi.org/10.1523/JNEUROSCI.0590-05.2005
Lichter DG, Hershey LA (2010) Before chorea: pre-Huntington mild cognitive impairment. Neurology 75: 490–491. https://doi.org/10.1212/WNL.0b013e3181ec805b
Lawrence AD, Hodges JR, Rosser AE, Kershaw A, French-Constant C, Rubinsztein DC, Robbins TW, Sahakian BJ (1998) Evidence for specific cognitive deficits in preclinical Huntington’s disease. Brain 121 (Pt 7): 1329–1341. https://doi.org/10.1093/brain/121.7.1329
Nithianantharajah J, Hannan A (2013) Dysregulation of synaptic proteins, dendritic spine abnormalities and pathological plasticity of synapses as experience-dependent mediators of cognitive and psychiatric symptoms in Huntington’s disease. Neuroscience 251: 66–74. https://doi.org/10.1016/j.neuroscience.2012.05.043
Tonnesen J, Nagerl UV (2016) Dendritic Spines as Tunable Regulators of Synaptic Signals. Front Psychiatry 7: 101.https://doi.org/10.3389/fpsyt.2016.00101
Wu J, Ryskamp DA, Liang X, Egorova P, Zakharova O, Hung G, Bezprozvanny I (2016) Enhanced Store-Operated Calcium Entry Leads to Striatal Synaptic Loss in a Huntington’s Disease Mouse Model. J Neurosci 36: 125–141. https://doi.org/10.1523/JNEUROSCI.1038-15.2016
Cepeda C, Hurst RS, Calvert CR, Hernandez-Echeagaray E, Nguyen OK, Jocoy E, Christian LJ, Ariano MA, Levine MS (2003) Transient and progressive electrophysiological alterations in the corticostriatal pathway in a mouse model of Huntington’s disease. J Neurosci 23: 961–969. https://doi.org/10.1523/JNEUROSCI.23-03-00961.2003
Indersmitten T, Tran CH, Cepeda C, Levine MS (2015) Altered excitatory and inhibitory inputs to striatal medium-sized spiny neurons and cortical pyramidal neurons in the Q175 mouse model of Huntington’s disease. J Neurophysiol 113: 2953–2966. https://doi.org/10.1152/jn.01056.2014
Murmu RP, Li W, Holtmaat A, Li JY (2013) Dendritic spine instability leads to progressive neocortical spine loss in a mouse model of Huntington’s disease. J Neurosci 33: 12997–13009. https://doi.org/10.1523/JNEUROSCI.5284-12.2013
Schmidt ME, Buren C, Mackay JP, Cheung D, Dal Cengio L, Raymond LA, Hayden M (2018) Altering cortical input unmasks synaptic phenotypes in the YAC128 cortico-striatal co-culture model of Huntington disease. BMC Biol 16: 58. https://doi.org/10.1186/s12915-018-0526-3
Spires TL, Grote HE, Garry S, Cordery PM, Van Dellen A, Blakemore C, Hannan AJ (2004) Dendritic spine pathology and deficits in experience-dependent dendritic plasticity in R6/1 Huntington’s disease transgenic mice. Eur J Neurosci 19: 2799–2807. https://doi.org/10.1111/j.0953-816X.2004.03374.x
Chernyuk DP, Zorin AG, Derevtsova KZ, Efimova EV, Prikhodko VA, Sysoev YI, Vlasova OL, Bolsunovskaia MV, Bezprozvanny IB (2021) Automatic analysis of the “Morris water maze” behavioral test data. Zhurn Vysshei Nervn Deyatelnosti Im IP Pavlova. 71: 126–135. https://doi.org/10.31857/S0044467721010044
Montoya A, Price BH, Menear M, Lepage M (2006) Brain imaging and cognitive dysfunctions in Huntington’s disease. J Psychiatry Neurosci 31: 21–29.
Milnerwood AJ, Cummings DM, Dallerac GM, Brown JY, Vatsavayai SC, Hirst MC, Rezaie P, Murphy KP (2006) Early development of aberrant synaptic plasticity in a mouse model of Huntington’s disease. Hum Mol Genet 15: 1690–1703. https://doi.org/10.1093/hmg/ddl092
Paldino E, Giampa C, Montagna E, Angeloni C, Fusco FR (2019) Modulation of Phospho-CREB by Systemically Administered Recombinant BDNF in the Hippocampus of the R6/2 Mouse Model of Huntington’s Disease. Neurosci J 2019: 8363274. https://doi.org/10.1155/2019/8363274
Usdin MT, Shelbourne PF, Myers RM, Madison DV (1999) Impaired synaptic plasticity in mice carrying the Huntington’s disease mutation. Hum Mol Genet 8: 839–846. https://doi.org/10.1093/hmg/8.5.839
Murphy KP, Carter RJ, Lione LA, Mangiarini L, Mahal A, Bates GP, Dunnett SB, Morton AJ (2000) Abnormal synaptic plasticity and impaired spatial cognition in mice transgenic for exon 1 of the human Huntington’s disease mutation. J Neurosci 20: 5115–5123. https://doi.org/10.1523/JNEUROSCI.20-13-05115.2000
Kolodziejczyk K, Parsons MP, Southwell AL, Hayden MR, Raymond LA (2014) Striatal synaptic dysfunction and hippocampal plasticity deficits in the Hu97/18 mouse model of Huntington disease. PLoS One 9: e94562. https://doi.org/10.1371/journal.pone.0094562
Lynch G, Kramar EA, Rex CS, Jia Y, Chappas D, Gall CM, Simmons DA. (2007) Brain-derived neurotrophic factor restores synaptic plasticity in a knock-in mouse model of Huntington’s disease. J Neurosci 27: 4424–4434. https://doi.org/10.1523/JNEUROSCI.5113-06.2007
Southwell AL, Warby SC, Carroll JB, Doty CN, Skotte NH, Zhang W, Villanueva EB, Kovalik V, Xie Y, Pouladi MA, Collins JA, Yang XW, Franciosi S, Hayden MR (2013) A fully humanized transgenic mouse model of Huntington disease. Hum Mol Genet 22: 18–34. https://doi.org/10.1093/hmg/dds397
McCann RF, Ross DA (2017) A Fragile Balance: Dendritic Spines, Learning, and Memory. Biol Psychiatry 82: e11–e13. https://doi.org/10.1016/j.biopsych.2017.05.020
Bulley SJ, Drew CJ, Morton AJ (2012) Direct Visualisation of Abnormal Dendritic Spine Morphology in the Hippocampus of the R6/2 Transgenic Mouse Model of Huntington’s Disease. J Huntingtons Dis 1: 267–273. https://doi.org/10.3233/JHD-120024
Richards P, Didszun C, Campesan S, Simpson A, Horley B, Young KW, Glynn P, Cain K, Kyriacou CP, Giorgini F, Nicotera P (2011) Dendritic spine loss and neurodegeneration is rescued by Rab11 in models of Huntington’s disease. Cell Death Differ 18: 191–200. https://doi.org/10.1038/cdd.2010.127
Koch ET, Woodard CL, Raymond LA (2018) Direct assessment of presynaptic modulation of cortico-striatal glutamate release in a Huntington’s disease mouse model. J Neurophysiol 120: 3077–3084. https://doi.org/10.1152/jn.00638.2018
Smith-Dijak AI, Nassrallah WB, Zhang LYJ, Geva M, Hayden MR, Raymond LA (2019) Impairment and Restoration of Homeostatic Plasticity in Cultured Cortical Neurons From a Mouse Model of Huntington Disease. Front Cell Neurosci 13: 209. https://doi.org/10.3389/fncel.2019.00209
Lione LA, Carter RJ, Hunt MJ, Bates GP, Morton AJ, Dunnett SB (1999) Selective discrimination learning impairments in mice expressing the human Huntington’s disease mutation. J Neurosci 19: 10428–10437. https://doi.org/10.1523/JNEUROSCI.19-23-10428.1999
Begeti F, Schwab LC, Mason SL, Barker RA (2016) Hippocampal dysfunction defines disease onset in Huntington’s disease. J Neurol Neurosurg Psychiatry 87: 975–981. https://doi.org/10.1136/jnnp-2015-312413
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


