Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1505-1517
Влияние блокады синтеза NO на осморегулирующую функцию почек в условиях моделирования гипотиреоза у крыс с различным уровнем вазопрессина в крови
П. Д. Правикова 1, *, Л. Н. Иванова 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
* E-mail: PollyPravi@yandex.ru
Поступила в редакцию 17.09.2021
После доработки 28.09.2021
Принята к публикации 29.09.2021
Аннотация
Исследовано влияние блокады синтеза оксида азота (NO) на осморегулирующую функцию почек у крыс линии WAG, а также у вазопрессин-дефицитных крыс линии Brattleboro в условиях моделирования гипотиреоза раствором метимазола. Установлено, что NO модулирует гидроосмотический эффект вазопрессина, влияя на параметры гидруреза вне зависимости от уровня синтеза тиреоидных гормонов. Между тем выявлено, что NO играет существенную роль в развитии антинатрийуреза у крыс в условиях блокады синтеза тиреоидных гормонов, причем данный эффект не зависит от уровня эндогенного вазопрессина в крови. У крыс WAG и вазопрессин-дефицитной линии Brattleboro моделирование гипотиреоза способствует развитию антинатрийуретической реакции, в то время как устранение действия NO на фоне блокады синтеза тиреоидных гормонов приводит к развитию натрийуреза. Результаты исследования свидетельствуют о существенной роли NO в подавлении экскреции натрия почками при гипотиреозе. Обсуждаются возможные механизмы, лежащие в основе влияния NO на параметры натрийуретической функции почек у крыс линий WAG и Brattleboro в условиях подавления синтеза тиреоидных гормонов.
Почка млекопитающих является основным эффектором в системе регуляции водно-электролитного баланса благодаря способности в широких пределах варьировать экскрецию воды и натрия в ответ на изменение уровня в крови ряда системных гормонов: вазопрессина (ВП), окситоцина, глюкокортикоидов, минералкортикоидов и др. [1]. Тиреоидная система непосредственно оказывает влияние на процесс формирования и роста почечной ткани [2], на почечную гемодинамику [3] и участвует в регуляции экскреции солей и воды [4, 5]. Дисфункция щитовидной железы является причиной значительных изменений в регуляции водно-солевого гомеостаза, механизмы которых нуждаются в дальнейшем изучении. Гипотиреоз, как известно, сопровождается снижением скорости клубочковой фильтрации [6], нарушением способности к разведению мочи вследствие гиперсекреции вазопрессина (СНПВ), приводящего к значительному удержанию воды [7, 8]. В то же время при гиперсекреции щитовидной железы, напротив, выявляется полиурия [9] вследствие ускорения скорости клубочковой фильтрации [10].
Адекватность и устойчивость работы любой регуляторной системы у высших животных зависит от функционирования механизмов, модулирующих эффект основного стимулирующего фактора по принципу отрицательной обратной связи. Одним из таких факторов, эндогенным субстратом для синтеза которого служит L-аргинин, является оксид азота, NO, который будучи почечным аутакоидом модулирует процесс осмотического концентрирования благодаря прямому ингибирующему влиянию на транспорт натрия в почечных канальцах [11, 12], а также ВП-независимой активацией транспорта воды [13, 14]. В то же время известно, что в условиях гипотиреоза фиксируется увеличение уровня NO во многих тканях организма [15, 16], в том числе почечной медулле [17], что указывает на роль тиреоидной системы в модуляции синтеза почечного аутакоида NO.
Принимая во внимание важность активности локального фактора почки NO в регуляции водно-солевого гомеостаза на фоне дисфункции щитовидной железы, целью данной работы явилось исследование влияния NO на функцию осмотического концентрирования у крыс с различным уровнем эндогенного ВП в крови в условиях гипотиреоза.
МЕТОДЫ ИССЛЕДОВАНИЯ
В опытах использованы крысы в возрасте 60-ти дней и массой 150–200 г из вивария конвенциональных животных Института цитологии и генетики СО РАН, содержавшиеся в условиях стандартного рациона со свободным доступом к питьевой воде и сухому корму. Эксперименты проведены на крысах инбредной линии WAG (Wistar Albino Glaxo) с высоким уровнем ВП в крови и на гомозиготных крысах линии Brattleboro, лишенных ВП вследствие мутации гена, кодирующего предшественник гормона [18]. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ (Приложение к Приказу Министерства здравоохранения РФ № 267 от 19.06.2003), а также с учетом международных рекомендаций по работе с экспериментальными животными.
Все животные были разделены на 4 экспериментальные группы для каждой линии (по 9 особей в каждой): 1) контрольная группа; 2) крысы в условиях блокады синтеза тиреоидных гормонов раствором метимазола; 3) блокада синтеза NO введением L-NAME в течение 2-х сут; 4) гипотиреоидные особи на фоне блокады синтеза NO. Крысы WAG в течение 6 нед. потребляли 0.05%-ный раствор метимазола (Тирозол, Merk, Германия), блокирующий пероксидазу, участвующую в йодировании тиреоидных гормонов [19]. В то же время, учитывая межлинейные различия в суточном объеме потребляемой жидкости, для уравнивания суточной дозы препарата особи Brattleboro имели свободный доступ к 0.01%-ному раствору метимазола, поскольку суточное потребление жидкости у интактных особей Brattleboro было в пять раз больше по сравнению с контрольными крысами WAG. Контрольные особи двух линий потребляли дистиллированную воду.
Учитывая данные литературы об увеличении в условиях гипотиреоза уровня NO во многих тканях организма, в том числе почечной ткани [17], для выявления эффекта NO на концентрирующую функцию почек при гипотиреозе была предпринята серия экспериментов, в которых блокада синтеза тиреоидных гомонов раствором метимазола осуществлялась на фоне внутрибрюшинного введения неселективного ингибитора синтаз NO (L-NAME) дважды в день в течение последних 2 сут в дозе 3 мг на 100 г массы тела [20]. Контрольным особям линий WAG и Brattleboro, содержавшимся в условиях стандартного потребления воды, устранение действия NO осуществлялось на фоне введения L-NAME (дважды в сутки в течение 2-х дней, 3 мг/100 г массы тела).
В течение всего экспериментального периода ежедневно подсчитывали объем выпитой жидкости, каждую неделю животных взвешивали и на 2 ч помещали в индивидуальные клетки с проволочным дном для сбора спонтанно экскретируемой мочи. По окончании эксперимента животных анестезировали тиопенталом натрия (10 мг/100 г массы тела, внутрибрюшинно), декапитировали и забирали пробы крови.
Осмоляльность мочи и сыворотки крови определяли криоскопическим методом (миллиосмометр ОСКР-1М КИВИ, Россия). Концентрацию креатинина в моче и сыворотке крови определяли методом Яффе на спектрофотометре (BioPhotometr plus, “Eppendorf”, Германия, 490 нм), скорость клубочковой фильтрации рассчитывали по клиренсу эндогенного креатинина. Концентрацию общего уровня тетрайодтиронина в сыворотке крови определяли иммуноферментным методом (Rat thyroxine (T4) ELISA Kit, Сusabio, CSB-E05082r). Содержание катионов натрия в пробах мочи и сыворотке крови измеряли методом пламенной фотометрии (Flame photometer 410 Sherwood, Великобритания). По стандартным формулам рассчитывали клиренс осмотически активных веществ (Сосм), максимальную реабсорбцию $\left( {T_{{{{{\text{H}}}_{2}}{\text{O}}}}^{C}} \right),$ осмотически свободной воды, экскрецию натрия (ЕNa) и экскретируемую фракцию натрия (FENa).
Данные представлены в виде среднего значения ± ошибка среднего (M ± SEM). Достоверность межлинейных различий оценивали в программе Statistica 8.0 с помощью апостериорного LSD критерия Фишера для множественных сравнений. Для парного сравнения средних внутри линий применялся критерий Стьюдента для независимых выборок. Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
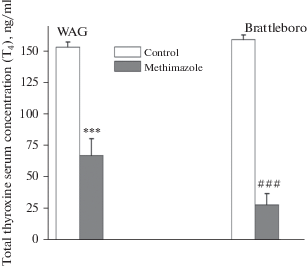
Базальный уровень тетрайодтиронина (T4) в сыворотке крови у контрольных групп WAG и Brattleboro был достаточно высоким и не имел межлинейных различий (рис. 1). У крыс обеих линий, содержавшихся в течение 6 недель в условиях подавления метимазолом синтеза тиреоидных гормонов, было выявлено значительное снижение общего уровня тетрайодтиронина (Т4), более выраженное у ВП-дефицитных крыс Brattleboro (рис. 1).
Рис. 1.
Концентрация гормона Т4 в сыворотке крови крыс линии WAG и ВП-дефицитной линии Brattleboro в контрольных условиях и при хроническом подавлении синтеза тиреоидных гормонов (гипотиреоз). Достоверность различий: *** p < 0.01 – сравнение с контрольными показателями крыс WAG; ###p < 0.001 – сравнение с контрольными показателями крыс Brattleboro.
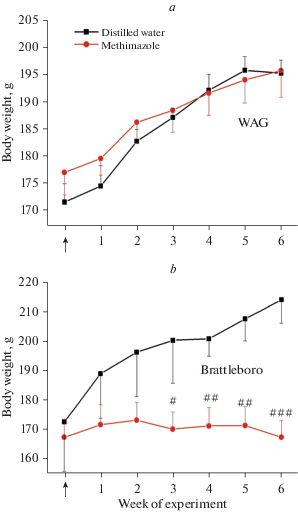
У контрольных крыс линии WAG и Brattleboro, содержавшихся в условиях стандартного потребления жидкости и корма, в течение двух месяцев экспериментального цикла был зафиксирован прогрессирующий рост массы тела (рис. 2). У крыс WAG при шестинедельной блокаде синтеза тиреоидных гормонов метимазолом динамика массы тела не имела существенных различий по сравнению с контрольной группой, в то время как у крыс Brattleboro в условиях потребления метимазола масса тела оставалась на низком исходном уровне в течение всего экспериментального периода (рис. 2). Отсутствие существенного роста массы тела у ВП-дефицитных крыс Brattleboro в условиях моделирования гипотиреоза является следствием устранения активирующего влияния тиреоидной системы на скорость основного обмена, являющуюся ключевым условием роста и развития организма [4]. Кроме того, количество рецепторов в печени к соматотропному гормону, а также активность в плазме гормона соматомедина, существенно снижена у крыс Brattleboro [21], это является возможным объяснением того, что линия Brattleboro более чувствительна к любым нарушениям регуляции роста. В то же время у крыс WAG наличие эндогенного ВП в крови явилось фактором, компенсирующим подавление обменных процессов организма на фоне потребления раствора метимазола.
Рис. 2.
Динамика массы тела в течение 6 недель у крыс линии WAG (a) и ВП-дефицитной линии Brattleboro (b) в условиях потребления раствора метимазола по сравнению с контрольными особями. Достоверность различий: #p < 0.05; ##p < 0.01; ###p < 0.001 — сравнение с контрольными показателями крыс линии Brattleboro.
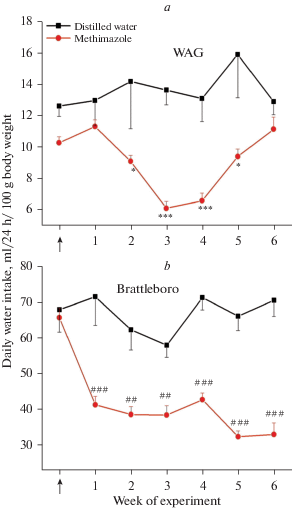
Как известно, чувство жажды регулируется содержанием электролитов в плазме крови, а также объемом циркулирующей крови: при увеличении натрия в экстраклеточном пространстве, сопровождаемого гиповолемией, активируется гипоталамический центр жажды [22]. В экспериментах использованы крысы Brattleboro, потреблявшие за сутки объем воды, превышающий 60 мл, что характерно для ВП-дефицитных гомозигот [18]. В то же время крысы WAG с нормальным уровнем ВП в крови выпивали за сутки объем жидкости не более 14 мл (рис. 3). У крыс WAG в течение двух недель эксперимента при моделировании раствором метимазола гипотиреоза было выявлено достоверное снижение суточного объема потребляемого раствора, которое сохранялось в течение 2-х нед., а затем объем увеличивался до значений, характерных для контрольных особей (рис. 3). Между тем у ВП-дефицитных крыс Brattleboro было выявлено снижение объема выпитого раствора на протяжении всего эксперимента с первой недели опыта (рис. 3), что согласуется с ранее зафиксированным снижением потребления воды у крыс в условиях гипотиреоза [23].
Рис. 3.
Изменение суточного потребления жидкости в течение 6 нед. у крыс линии WAG (a) и ВП-дефицитной линии Brattleboro (b) в условиях потребления раствора метимазола по сравнению с контрольными особями. Достоверность различий: *p < 0.05; ** p < 0.01; *** p < 0.001 —сравнение с контрольными показателями крыс WAG; ##p < 0.01; ###p < 0.001—сравнение с контрольными показателями крыс линии Brattleboro.
Нарушение питьевого поведения у крыс Brattleboro отражается на параметрах гидруретической функции при потреблении метимазола (рис. 4). У ВП-дефицитных крыс Brattleboro было выявлено снижение скорости мочеотделения вследствие увеличения реабсорбции осмотически свободной воды (рис. 4) на фоне закономерного уменьшения скорости клубочковой фильтрации при гипотиреозе (рис. 5) [6]. Между тем у крыс WAG моделирование гипотиреоза раствором метимазола не привело к изменению гидруретической функции почек по сравнению с контрольными особями, потреблявшими дистиллированную воду (рис. 4) несмотря на значительное снижение скорости клубочковой фильтрации (рис. 5). По-видимому, наличие ВП оказывает преобладающее влияние на показатели гидруретической функции, компенсируя эффект блокады синтеза тиреоидных гормонов. В то же время выявленное увеличение показателя реабсорбции осмотически свободной воды у крыс Brattleboro в условиях потребления метимазола является следствием устранения тонического ингибирующего влияния тиреоидной системы на факультативную реабсорбцию воды. Ранее было обнаружено, что моделирование гипофункции щитовидной железы приводило к увеличение экспрессии аквапорина AQP1-3 в ткани почки, проводящее к задержке воды [19, 24], в то время как введение в течение двух недель крысам тироксина способствовало развитию полиурии, которая была следствием снижения экспрессии аквапоринов AQP1 и AQP2 в корковом и мозговом веществе почки [9]. Зафиксированная антидиуретическая реакция у крыс Brattleboro подтверждает ранее выявленный факт о ВП-независимых механизмах, лежащих в основе нарушения экскреции воды при гипотиреозе [25].
Рис. 4.
Параметры гидруретической функции почек в условиях подавления активности тиреоидной системы на фоне блокады синтеза NO введением L-NAME у крыс линий WAG и Brattleboro (M ± SEM). a — скорость мочеотделения (V); b — реабсорбция осмотически свободной воды $\left( {T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}} \right)$. Достоверность различий: *p < 0.05; ** p < 0.01;*** p < 0.001 — сравнение с контрольными показателями крыс линии WAG; &&p < 0.01 — сравнение с гипотиреоидной группой WAG; ##p < 0.01; ###p < 0.001 — сравнение с контрольными показателями крыс линии Brattleboro; ^ p < 0.05 — сравнение с гипотиреоидной группой крыс линии Brattleboro.
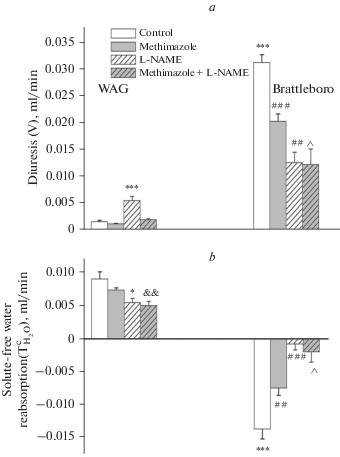
Рис. 5.
Скорость клубочковой фильтрации в условиях подавления активности тиреоидной системы на фоне блокады синтеза NO (L-NAME) у крыс линий WAG и Brattleboro (M ± SEM). Достоверность различий: * p < 0.05; *** p < 0.001 — сравнение с контрольными показателями крыс WAG; ###p < 0.001 — сравнение с контрольными показателями крыс линии Brattleboro.

Поскольку в условиях гипотиреоза ранее было зафиксировано увеличение как уровня NO в сыворотке крови, так и экспрессии iNOS в щитовидной железе [15], а также рост NOS-активности в почечной медулле [17], представляло интерес оценить функцию осмотического концентрирования в условиях гипотиреоза на фоне блокады синтеза NO. NO — локальный фактор, синтез которого в почке регулирует сам ВП, формируя негативную обратную связь [26]. NO модулирует процесс осмотического концентрирования благодаря прямому ингибирующему влиянию на транспорт натрия в почечных канальцах [27], а также ВП-независимой активацией транспорта воды [14]. Как было показано нами ранее [28], устранение действия NO при введении L-NAME вызывает разнонаправленные изменения гидруретической функции почек у крыс двух линий при существенном снижении скорости клубочковой фильтрации в связи с вазоконстрикторным эффектом блокады [29]. У крыс WAG, потреблявших дистиллированную воду, в условиях блокады синтеза NO наблюдалось снижение реабсорбции осмотически свободной воды, которое также было зафиксировано в условиях подавления синтеза тиреоидных гормонов раствором метимазола (рис. 4). Блокада синтеза NO привела к снижению эффективности концентрирования мочи вследствие торможения реабсорбции воды, что указывает на стимулирующее влияние NO на водопроницаемость эпителия почечных канальцев, выявленное ранее в экспериментах in vitro, согласно которым активация синтеза NO индуцирует транслокацию аквапорина AQP2 в апикальную мембрану эпителиоцитов собирательных трубок [30]. В то же время блокада синтеза NO у ВП-дефицитных крыс Brattleboro привела как в условиях нормального уровня синтеза тиреоидных гормонов, так и при подавлении их секреции к проявлению принципиально иной реакции по сравнению с крысами WAG – к развитию антидиуреза (рис. 4), что является, очевидно, следствием устранения тонического ингибирующего действия эндогенного NO на процесс реабсорбции воды [31]. Учитывая полученные данные, можно заключить, что NO модулирует гидруретическую функцию почек вне зависимости от уровня синтеза тиреоидных гормонов.
Основным катионом внеклеточной жидкости организма является натрий, динамика выведения которого почками вносит несомненный вклад в концентрирование мочи и в осморегулирующий процесс в целом. Реабсорбция натрия осуществляется эпителием всех сегментов нефрона и собирательных трубок и находится под контролем комплекса гормональных и местных гуморальных факторов. Почечный аутакоид NO, как известно, принимает участие в модуляции различных физиологических процессов в почке, включая регуляцию реабсорбции солей и воды [32]. NO оказывает преимущественный ингибирующий эффект на транспорт натрия вдоль нефрона и собирательных трубок: активация синтеза NO блокирует активность эпителиального натриевого канала EnaС и приводит к развитию натрийуреза [27], а блокада нейрональной синтазы NO (NOS1), напротив, снижает экскрецию натрия [33]. Устранение действия NO в условиях введения L-NAME контрольным крысам, потреблявшим дистиллированную воду, способствовало изменению натрийуретической функции лишь у ВП-дефицитных крыс Brattleboro: снижение экскреции и экскретируемой фракции натрия (рис. 6). В то же время у крыс WAG на фоне введения L-NAME не было выявлено существенных изменений параметров натрийуреза (рис. 6), что обусловлено сохранением преимущественного активирующего влияния эндогенного ВП на реабсорбцию натрия.
Рис. 6.
Параметры натрийуретической функции в условиях подавления активности тиреоидной системы на фоне блокады синтеза NO введением L-NAME у крыс линий WAG и Brattleboro (M ± SEM). a – скорость экскреции натрия (ENa); b — экскретируемая фракция натрия (FENa). Достоверность различий: **p < 0.01; ***p < 0.001 — сравнение с контрольными показателями крыс WAG; ##p < 0.01; ###p < 0.001 — сравнение с контрольными показателями крыс линии Brattleboro; &&p < 0.01 — cравнение с гипотиреоидной группой WAG; ^^p < 0.01 — сравнение с гипотиреоидной группой крыс линии Brattleboro.
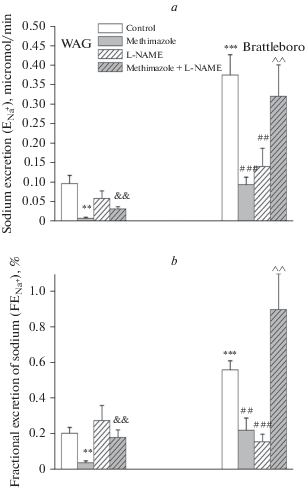
Известно, что тиреоидные гормоны регулируют работу многих ионных транспортеров в канальцах почки, усиливая как активность Na-P-котранспортера, Na-H-обменника, Na/K-насоса, так и влияя на их экспрессию при связывании с промоторами соответствующих генов [34, 35]. Подавление синтеза тиреоидных гормонов вне зависимости от уровня эндогенного ВП способствовало развитию антинатрийуретической реакции (рис. 6). У крыс WAG и у крыс Brattleboro было выявлено снижение скорости экскреции и экскретируемой фракции натрия, что, очевидно, является следствием усиления реабсорбции катиона. Антинатрийуретическая реакция у крыс Brattleboro, по-видимому, способствовала увеличению реабсорбции воды (рис. 4) вследствие прироста кортико-медуллярного градиента натрия и активации функции противоточно-множительной системы. Выявленное увеличение реабсорбции натрия в условиях гипотиреоза подтверждается данными на тиреоидэктомированных животных, у которых по прошествии 45 дней эксперимента было зафиксировано снижение экскреции натрия [36]. Кроме того, ранее было показано, что антинатрийуретическая реакция явилась следствием увеличения уровня экспрессии NKCC2-котранспортера и эпителиального натриевого канала ENaC у крыс в условиях хронической блокады синтеза тиреоидных гормонов [37, 38]. Как известно, при снижении уровня синтеза тиреоидных гормонов усиливается секреция тиреотропного гормона (ТТГ), который, связываясь с Gs-рецепторами щитовидной железы, активирует по аденилатциклазному пути высвобождение Т3 и Т4 [39]. Почечная ткань в том числе является мишенью действия ТТГ, поскольку известно, что в ней экспрессируются рецепторы к гормону (TSHR): в сосудах, включая артериолы клубочка, а также в клетках почечных канальцев [40, 41]. По всей видимости, выявленная у крыс обеих линий антинатрийуретическая реакция в условиях гипотиреоза объясняется активирующим влиянием ТТГ на транспорт натрия в собирательных трубках и в дистальных частях нефрона в результате активации аденилатциклазного пути при связывании с TSHR, что аналогично стимулирующему эффекту на реабсорбцию натрия в условиях действия сAMP-зависимого сигнального пути при связывании с V2-рецепторами ВП [42]. В то же время блокада синтеза NO на фоне потребления метимазола приводит как у крыс WAG, так и у крыс Brattleboro к принципиально иной реакции – к натрийурезу, указывая на значимость NO в стимуляции реабсорбции натрия при гипотиреозе (рис. 6). Учитывая данные об увеличенной активности NO-системы в почечной ткани в условиях подавления синтеза тиреоидных гормонов [17], можно заключить, что антинатрийуретическая реакция у крыс WAG и Brattleboro в условиях гипотиреоза обусловлена в том числе активацией NO/cGMP/PKG-сигнального пути. Известно, что активация гуанилатциклазной системы приводит к усилению транспорта натрия через ENaC, как было выявлено на эпителиоцитах мочевого пузыря лягушки [12], что является следствием взаимодействия аденилатциклазной и гуанилатциклазной систем.
Таким образом, NO модулирует гидроосмотический эффект ВП, влияя на параметры гидруреза вне зависимости от уровня синтеза тиреоидных гормонов. В то же время NO играет одну из ключевых ролей в развитии антинатрийуреза у крыс в условиях хронической блокады синтеза тиреоидных гормонов, причем данный эффект не зависит от уровня эндогенного ВП в крови. Предполагается, что усиление реабсорбции натрия у крыс линий WAG и Brattleboro в условиях гипотиреоза является следствием взаимодействия аденилатциклазной и гуанилатциклазной систем в условиях активации действия ТТГ и NO соответственно.
Список литературы
Seifter JL, Chang HY (2017) Extracellular acid-Base balance and ion transport between body fluid compartments. Physiology (Bethesda) 32: 367–379. https://doi.org/10.1152/physiol.00007.2017
Kumar J, Gordillo R, Kaskel FJ, Druschel CM, Woroniecki RP (2009) Increased prevalence of renal and urinary tract anomalies in children with congenital hypothyroidism. J Pediatr 154: 263–266. https://doi.org/10.1016/j.jpeds.2008.08.023
den Hollander JG, Wulkan RW, Mantel MJ, Berghout A (2005) Correlation between severity of thyroid dysfunction and renal function. Clinical Endocrinol 62: 423–427. https://doi.org/10.1111/j.1365-2265.2005.02236.x
Iglesias P, Bajo MA, Selgas R, Díez JJ (2009) Thyroid dysfunction and kidney disease. Eur J Endocrinol 160: 503–515. https://doi.org/10.1007/s11154-016-9395-7
Mariani LH, Berns JS (2012) The renal manifestations of thyroid disease. J Am Soc Nephrol 23(1): 22–26. https://doi.org/10.1681/ASN.2010070766
Vargas F, Moreno JM, Rodríguez-Gómez I, Wangensteen R, Osuna A, Alvarez-Guerra M, García-Estañ J (2006) Vascular and renal function in experimental thyroid disorders. Eur J Endocrinol 2: 197–212. https://doi.org/10.1530/eje.1.02093
Skowsky WR, Kikuchi TA (1978) The role of vasopressin in the impaired water excretion of myxedema. Am J Med 64(4): 613–621. https://doi.org/10.1016/0002-9343(78)90581-8
Chen YC, Cadnapaphornchai MA, Yang J, Summer SN, Falk S, Li C, Wang W, Schrier RW (2005) Nonosmotic release of vasopressin and renal aquaporins in impaired urinary dilution in hypothyroidism. Am J Physiol: Renal Physiol 289: 672–678. https://doi.org/10.1152/ajprenal.00384.2004
Wang W, Li C, Summer SN, Falk S, Schrier RW (2007) Polyuria of thyrotoxicosis: downregulation of aquaporin water channels and increased solute excretion. Kidney Int 72: 1088–1094. https://doi.org/10.1038/sj.ki.5002475
Syme HM (2007) Cardiovascular and renal manifestations of hyperthyroidism. Vet Clin North Am Small Anim Pract 4: 723–743. https://doi.org/10.1016/j.cvsm.2007.05.011
Oliveira CJ, Schindler F, Ventura AM, Morais MS, Arai RJ, Debbas V, Stern A, Monteiro HP (2003) Nitric oxide and cGMP activate the Ras-MAP kinase pathway-stimulating protein tyrosine phosphorylation in rabbit aortic endothelial cells. Free Radic Biol Med 35: 381–396. https://doi.org/10.1016/S0891-5849(03)00311-3
Yamada T, Matsuda K, Uchiyama M (2006) Atrial natriuretic peptide and cGMP activate sodium transport through PKA-dependent pathway in the urinary bladder of the Japanese tree frog. J Compar Physiol [B] 176: 203–212. https://doi.org/10.1007/s00360-005-0041-z
Bouley R, Pastor-Soler N, Cohen O, McLaughlin M, Breton S, Brown D (2005) Stimulation of AQP2 membrane insertion in renal epithelial cells in vitro and in vivo by the cGMP phosphodiesterase inhibitor sildenafil citrate (Viagra). Am J Physiol Renal Physiol 288: 1103–1112. https://doi.org/10.1152/ajprenal.00337.2004
Sanches TR, Volpini RA, Massola Shimizu MH, Braganca AC, Oshiro-Monreal F, Seguro AC,Andrade L (2012) Sildenafil reduces polyuria in rats with lithium-induced NDI. Am J Physiol Renal Physiol 302: 216–225. https://doi.org/10.1152/ajprenal.00439.2010
Rong S, Gao Y, Yang Y, Shao H, Okekunle AP, Lv C, Du Y, Sun H, Jiang Y, Darko GM, Sun D (2018) Nitric oxide is involved in the hypothyroidism with significant morphology changes in female Wistar rats induced by chronic exposure to high water iodine from potassium iodate. Chemosphere 206: 320–329. https://doi.org/10.1016/j.chemosphere.2018.05.015
Zhou J, Cheng G, Pang H, Liu Q, Liu Y (2018) The effect of 131I-induced hypothyroidism on the levels of nitric oxide (NO), interleukin 6 (IL-6), tumor necrosis factor alpha (TNF-α), total nitric oxide synthase (NOS) activity, and expression of NOS isoforms in rats. Bosn J Basic Med Sci 18(4): 305–312. https://doi.org/10.17305/bjbms.2018.2350
Sarati LI, Toblli JE, Martinez CR, Uceda A, Feldman M, Balaszczuk AM, Fellet AL (2013) Nitric oxide and aqp2 in hypothyroid rats: A link between aging and water homeostasis. Metabolism 62: 1287–1295. https://doi.org/10.1016/j.metabol.2013.04.013
Valtin H, Schroeder HA (1997) Familial hypothalamic diabetes insipidus in rats (Brattleboro rata).1964 [classical article]. J Am Soc Nephrol 8: 1333–1341. https://doi.org/10.1681/ASN.V881333
Schmitt R, Klussmann E, Kahl T, Ellison DH, Bachmann S (2003) Renal expression of sodium transporters and aquaporin-2 in hypothyroid rats. Am J Physiol Renal Physiol 284: 1097–1104. https://doi.org/10.1152/ajprenal.00368.2002
Tain YL, Huang LT, Lee CT, Chan JY, Hsu CN (2015) Maternal citrulline supplementation prevents prenatal NG-nitro-l-arginine-methyl ester (l-NAME)-induced programmed hypertension in rats. Biol Reprod 92: 1–7. https://doi.org/10.1095/biolreprod.114.121384
Bullier-Picard F, Wolf BA, Hugues JN, Durand D, Voirol MJ, Charrier J, Czernichow P, Postel-Vinay MC (1985) The Brattleboro rat: normal growth hormone secretion, decreased hepatic growth hormone receptors and low plasma somatomedin activity. Mol Cell Endocrinol 45(1): 49–56. https://doi.org/10.1016/0303-7207(86)90081-X
Egan G, Silk T, Zamarripa F, Williams J, Federico P, Cunnington R, Carabott L, Blair-West J, Shade R, McKinley M, Farrell M, Lancaster J, Jackson G, Fox P, Denton D (2003) Neural correlates of the emergence of consciousness of thirst. Proc Natl Acad Sci U S A 100: 15241–15246. https://doi.org/10.1073/pnas.2136650100
Fadlalla MB, Wei Q, Fedail JS, Mehfooz A, Mao D, Shi F (2017) Effects of hyper- and hypothyroidism on the development and proliferation of testicular cells in prepubertal rats. Anim Sci J 88: 1943–1954. https://doi.org/10.1111/asj.12883
Yeum CH, Kim SW, Kim NH, Choi KC, Lee J (2002) Increased expression of aquaporin water channels in hypothyroid rat kidney. Pharmacol Res 46: 85–88. https://doi.org/10.1016/S1043-6618(02)00036-1
Iwasaki Y, Oiso Y, Yamauchi K, Takatsuki K, Kondo K, Hasegawa H, Tomita A (1990) Osmoregulation of plasma vasopressin in myxedema. J Clin Endocrinol Metab 70(2): 534–539. https://doi.org/10.1210/jcem-70-2-534
Martin PY, Bianchi M, Roger F, Niksic L, Feraille E (2002) Arginine vasopressin modulates expression of neuronal NOS in rat renal medulla. Am J Physiol Renal Physiol 283: 559–568. https://doi.org/10.1152/ajprenal.00309.2001
Hyndman KA, Mironova EV, Giani JF, Dugas C, Collins J, McDonough AA, Stockand JD, Pollock JS (2017) Collecting Duct Nitric Oxide Synthase 1-beta Activation Maintains Sodium Homeostasis During High Sodium Intake Through Suppression of Aldosterone and Renal Angiotensin II Pathways. J Am Heart Assoc 6(10): e006896. https://doi.org/10.1161/JAHA.117.006896
Правикова ПД, Иванова ЛН (2018) Влияние блокады синтеза оксида азота на диуретическую и натрийуретическую функции почки у крыс с различным уровнем эндогенного вазопрессина в крови. Рос физиол журн им ИМ Сеченова 104(1): 97–103. [Pravikova PD, Ivanova LN (2018) Effect of nitric oxide (II) synthesis inhibition on the diurethic and natriuretic kidney functions in rats with various blood vasopressin levels. Russ J Physiol 104(1): 96–102 2018. (In Russ)].
Böger RH, Bode-Böger SM, Gerecke U, Frölich JC (1994) Long-term administration of L-arginine, L-NAME, and the exogenous NO donor molsidomine modulates urinary nitrate and cGMP excretion in rats. Cardiovasc Res 28(4): 494–499. https://doi.org/10.1093/cvr/28.4.494
Boone M, Kortenoeven M, Robben JH, Deen PM (2010) Effect of the cgmp pathway on aqp2 expression and translocation: Potential implications for nephrogenic diabetes insipidus. Nephrol Dial Transpl 25: 48–54. https://doi.org/10.1093/ndt/gfp409
Ortiz PA, Garvin JL (2002) Role of nitric oxide in the regulation of nephron transport. Am J Physiol Renal Physiol. 282: 777–784. https://doi.org/10.1152/ajprenal.00334.2001
Stoos BA, Garcia NH, Garvin JL (1995) Nitric oxide inhibits sodium reabsorption in the isolated perfused cortical collecting duct. J Am Soc Nephrol 6: 89–94. https://doi.org/10.1681/ASN.V6189
Nakano D, Pollock JS, Pollock DM (2008) Renal medullary ETB receptors produce diuresis and natriuresis via NOS1. Am J Physiol Renal Physiol 294: 1205–1211. https://doi.org/10.1152/ajprenal.00578.2007
Li X, Misik AJ, Rieder CV, Solaro RJ, Lowen A, Fliegel L (2002) Thyroid hormone receptor alpha 1 regulates expression of the Na+/H+ exchanger (NHE1). J Biol Chem 277: 28656–28662. https://doi.org/10.1074/jbc.M203221200
Basu G, Mohapatra A (2012) Interactions between thyroid disorders and kidney disease. Indian J Endocrinol Metab 16(2): 204–213. https://doi.org/10.4103/2230-8210.93737
Compare JA, Aguirre JA, Ibarra FR, Barontini M, Armando I (2001) Effects of thyroid hormone on the renal dopaminergic system. Endocrine 15: 297–303. https://doi.org/10.1385/ENDO:15:3:297
Schmitt R, Kahl T, Mutig K (2004) Bachmann S. Selectively reduced expression of thick ascending limb TammHorsfall protein in hypothyroid kidneys. Histochem Cell Biol 121(4): 319–327. https://doi.org/10.1007/s00418-004-0638-4
Moreno JM, Perez-Abud R Wangensteen, Rodrıguez Gomez I, Opez Merino IL, Osuna A (2012) Function and expression of renal epithelial sodium transporters in rats with thyroid dysfunction. J Endocrinol Invest 35: 735–741. https://doi.org/10.3275/8064
Allen MD, Neumann S, Gershengorn MC (2011) Occupancy of both sites on the thyrotropin (TSH) receptor dimer is necessary for phosphoinositide signaling. FASEB J 25: 3687–3694. https://doi.org/10.1096/fj.11-188961
Beau I, Misrahi M, Gross B, Vannier B, Loosfelt H, Hai MT, Pichon C, Milgrom E (1997) Basolateral localization and transcytosis of gonadotropin and thyrotropin receptors expressed in Madin-Darby canine kidney cells. J Biol Chem 272: 5241–5248. https://doi.org/10.1074/jbc.272.8.5241
Sellitti DF, Akamizu T, Doi SQ, Kim GH, Kariyil JT, Kopchik JJ, Koshiyama H (2000) Renal expression of two ‘thyroid-specifific’ genes: thyrotropin receptor and thyroglobulin. Exp Nephrol 8: 235–243. https://doi.org/10.1159/000020674
Boulkroun S, Ruffieux-Daidié D, Vitagliano JJ, Poirot O, Charles RP, Lagnaz D, Firsov D, Kellenberger S, Staub O (2008) Vasopressin-inducible ubiquitinspecific protease 10 increases ENaC cell surface expression by deubiquitylating and stabilizing sorting nexin 3. Am J Physiol Renal Physiol 295: F889–F900. https://doi.org/10.1152/ajprenal.00001.2008
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


