Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1530-1541
Соматостатин-содержащие нейроны туберальной области гипоталамуса крыс при старении
П. А. Вишнякова 1, К. Ю. Моисеев 1, В. В. Порсева 1, Л. Г. Панкрашева 1, А. Ф. Будник 2, А. Д. Ноздрачев 3, П. М. Маслюков 1, *
1 Ярославский государственный медицинский университет
Ярославль, Россия
2 Кабардино-Балкарский государственный университет им. Х.М. Бербекова
Нальчик, Россия
3 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: mpm@ysmu.ru
Поступила в редакцию 20.09.2021
После доработки 30.09.2021
Принята к публикации 01.10.2021
Аннотация
Расположение и нейрохимический состав соматостатин (SOM)-содержащих нейронов в туберальной области гипоталамуса крысы исследовались при помощи иммуногистохимического метода у молодых (2–3 мес.), взрослых (1 год) и старых (2–2.5 года) крыс самцов и самок. SOM обнаруживался в наибольшем проценте в дугообразном (AN) и вентролатеральной части вентромедиального ядра (VMNvl). Меньшая часть SOM-содержащих нейронов наблюдалась в дорсомедиальном (DMN), медиальном туберальном (MTu), и оболочке VMN (shell). Лишь единичные нейроны обнаруживались в дорсомедиальной части вентромедиального ядра (VMNdm), перивентрикулярном и перифорникальном ядрах. Нами не было обнаружено возрастных изменений числа SOM-иммунореактивных (ИР) нейронов. При старении в AN увеличивался процент SOM-содержащих нейронов, колокализующих кальбиндин (CB), нейрональную синтазу оксида азота (nNOS), нейропептид Y (NPY). В VMNvl от трети до половины SOM-ИР нейронов у всех крыс колокализовали nNOS, а ИР к CB и NPY – от 7.9 до 18.6%. В DMN самцов наблюдалось достоверно большее число SOM-ИР нейронов, колокализующих NPY в сравнении с самками во всех возрастных группах. Таким образом, при старении наблюдаются нейрохимические изменения SOM-ергической системы туберальных ядер гипоталамуса, главным образом со стороны дугообразных ядер.
Соматостатин (SOM) является нейрогормоном и нейротрансмиттером и существует в двух биологически активных формах, содержащих 14 и 28 аминокислот [1]. SOM участвует в контроле различных физиологических процессов при воздействии на G-белок-сопряженные рецепторы пяти подтипов: sst1–sst5 [1, 2]. SOM подавляет выделение гормона роста, соматолиберина, гормонов желудочно-кишечного тракта, регулирует высвобождение в гипоталамусе кортиколиберина, норадреналина и самого SOM [1, 3].
В пределах гипоталамуса большинство SOM-содержащих нейронов расположено в переднем перивентрикулярном ядре. SOM также встречается, хотя и с меньшей плотностью, в супрахиазмальном, паравентрикулярном ядре, дугообразном (AN) и вентромедиальном ядре гипоталамуса (VMN) [4–6]. SOM-иммунореактивные (ИР) нейроны гипоталамуса крысы и овцы коэкспрессируют рецепторы лептина [1]. Лептин и SOM играют противоположную роль в потреблении пищи, ожирении и расходе энергии [7]. SOM-ИР нейроны в преоптической области и AN тесно связаны с синаптическими контактами с нейронами, экспрессирующими кисспептин, который является регулятором репродуктивной системы [8, 9].
Одной из возможных причин старения является дисфункция гипоталамуса, в частности возрастное повышение порога чувствительности гипоталамуса к гомеостатическим сигналам [10–12]. При этом в туберальной группе ядер, в частности в VMN и дорсомедиальном (DMN) ядрах увеличивается экспрессия нейрональной синтазы оксида азота (nNOS) и снижается экспрессия кальций-связывающего белка кальбиндина (CB) [13, 14]. К числу распространенных в головном мозге, в том числе и в гипоталамусе, нейропептидов относится нейропептид Y (NPY) [15].
Целью исследования явилось определение локализации SOM-иммунореактивных нейронов в туберальной группе ядер гипоталамуса и колокализации SOM с CB, nNOS, NPY.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на 30 белых крысах самках (n =15) и самцах (n = 15) линии Вистар в возрасте 2–3 мес. (молодые, n = 10), 1 год (взрослые, n = 10) и 2–2.5 года (старые, n = 10) после рождения с соблюдением “Правил проведения работ с использованием экспериментальных животных” (приказ № 775 от 12.08.1977 г. МЗ СССР), в соответствии с принципами Базельской декларации и рекомендациями этического комитета Ярославского государственного медицинского университета Минздрава РФ. Молодые самки находились в фазе диэструса, что определялось по влагалищному мазку с окраской метиленовым синим по Леффлеру.
После введения летальной дозы уретана (3 г/кг, внутрибрюшинно), животных перфузировали транскардиально раствором стандартного фоcфатно-cолевого буфеpа (PBS; 0.01 М, pH 7.4) (БиолоТ, Россия). С целью проведения иммуногистохимических исследований, животных (n = 20) затем перфузировали 4%-ным pаcтвоpом паpафоpмальдегида (Sigma, США) на PBS. После перфузии головной мозг извлекали и иссекали участок гипоталамуса в области срединного возвышения согласно координатам атласа мозга крыс [16]. Серии коронарных срезов гипоталамуса толщиной 14 мкм изготовляли с помощью криотома Shandon E (Thermo Scientific, Великобритания).
С целью выявления нейронов, содержащих SOM, CB, nNOS, NPY применялось двойное мечение антителами. Срезы прединкубировали в течение 30 мин при комнатной температуре в PBS с добавлением 10% ослиной сыворотки (“Jackson Immunoresearch”, США), 1% тритона X-100, 0.1% бычьего сывороточного альбумина, 0.05% тимерозола. Затем срезы инкубировали с первичными антителами (козьи против SOM, 1 : 200, Santa Cruz, sc-7819; кроличьи против CB, 1 : 500, Abcam, ab11426; кроличьи против nNOS, 1 : 200, Abcam, ab76067; кроличьи против NPY, 1 : 500, Abcam, ab30914) в течение 24 ч при комнатной температуре. После кратковременной промывки в PBS срезы инкубировали со вторичными антителами в течение 2 ч. Вторичные антитела были конъюгированы с флуорохромами — флуоресцеин-изотиоцианатом (FITC), дающим зеленую флуоресценцию и индокарбоцианином (Cy3), дающим красную флуоресценцию (разведение 1 : 150, Jackson Immunoresearch, США). После этого срезы снова отмывали в PBS и заключали в среду для иммунофлуоресценции (VectaShield, Vector Laboratories, США). Окраску клеток всей популяции нейронов проводили красителем, флуоресцирующим в зеленой области спектра, NeuroTrace Green Fluorescent Nissl Stains (Molecular Probes, США) – разведение 1 : 200. После этого срезы отмывали в PBS и заключали в среду для флуоресцентной микроскопии VectaShield (Vector Laboratories, США). Для исключения неспецифической реакции, часть срезов инкубировали без первичных и/или вторичных антител.
Анализ препаратов проводили на флуоресцентном микроскопе Olympus BX43 (Токио, Япония) с соответствующим набором светофильтров и охлаждаемой цифровой CCD камерой Tucsen FL-20 c программным обеспечением Mosaic V2.1 (Китай). Для выявления меченых нейронов использовали каждый третий из серийных срезов. Число ИР нейронов определяли на изображениях срезов, полученных под объективом 20×/0.50. Площадь изображений составляла 0.14 мм2. Долю SOM-ИР нейронов определяли как их отношение к общему количеству нейронов, выявленных NeuroTrace Fluorescent Nissl Stains, или суммарному количеству SOM-ИР и SOM-негативных нейронов, которое принимали за 100%. Анализу подлежали нейроны, срез которых прошел через ядро с видимым ядрышком и с флуоресценцией, превышающей фоновое свечение. Процент ИР нейронов определяли с помощью программы Image J (NIH, США).
Математическая обработка данных и построение графиков выполнено с использованием программы Sigma Plot (Systat Software, США). Все величины представлены как средняя арифметическая ± ошибка среднего (М ± m). Достоверность различий средних величин определяли с использованием однофакторного дисперсионного анализа (ANOVA) с коррекцией Бонферрони. Достоверными считали различия при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В туберальной области SOM-иммунореактивные (ИР) нейроны выявлялись в AN, VMN, DMN, медиального туберального (MTu), перивентрикулярного (PeV) и перифорникального (PeF) ядер. В VMN SOM-ИР нейроны определялись в оболочке ядра (shell), вентролатеральной части ядра (VMNvl) и в дорсомедиальной части (VMNdm) (рис. 1).
Рис. 1.
Обзорная микрофотография SOM-ИР нейронов в ядрах туберальной области гипоталамуса крысы. AN – дугообразное ядро, VMNvl – вентролатеральная части вентромедиального ядра, VMNdm – дорсомедиальная часть вентромедиального ядра, VMN shell – оболочка вентромедиального ядра, DMN – дорсомедиальное ядро, MTu – медиальное туберальное ядро, PeV – перивентрикулярное ядро, PeF – перифорникальное ядро. Флуоресценция Сy3. Масштаб – 300 мкм.

У крыс всех возрастных групп наибольшее количество SOM-ИР нейронов выявлялось в области AN и VMNvl. Меньший процент наблюдался в DMN, MTu, VMN shell. Единичные нейроны обнаруживались в VMNdm, перивентрикулярного (PeV) и перифорникального (PeF) ядер (табл. 1).
Таблица 1.
Процент SOM-ИР нейронов в ядрах туберальной области гипоталамуса крыс разного возраста
| Возраст | AN | VMNvl | DMN | MTu | VMN shell |
|---|---|---|---|---|---|
| Самки | |||||
| Молодые | 9.1 ± 1.5 | 12.2 ± 1.6 | 5.4 ± 0.6 | 4.2 ± 0.6 | 2.2 ± 0.1 |
| Взрослые | 11.3 ± 0.9 | 10.5 ± 1.1 | 6.1 ± 0.8 | 6.3 ± 0.7 | 1.9 ± 0.2 |
| Старые | 8.4 ± 1.3 | 11.1 ± 1.3 | 7.3 ± 0.4 | 5.0 ± 0.6 | 2.0 ± 0.2 |
| Самцы | |||||
| Молодые | 10.1 ± 1.2 | 11.5 ± 0.8 | 6.6 ± 0.9 | 5.5 ± 0.6 | 1.6 ± 0.2 |
| Взрослые | 9.2 ± 0.8 | 10.6 ± 1.1 | 7.0 ± 0.5 | 4.1 ± 0.7 | 2.2 ± 0.3 |
| Старые | 8.6 ± 1.4 | 9.4 ± 1.2 | 5.7 ± 0.6 | 5.2 ± 0.9 | 2.4 ± 0.2 |
В AN молодых крыс только в единичных SOM-ИР нейронах выявлялся CB, nNOS и NPY. Процент SOM/CB-ИР нейронов достоверно возрастал от молодого возраста к взрослому (p < 0.001), а также от взрослых к старым (p < 0.05), процент SOM/NPY-ИР достоверно был меньше у молодых крыс в сравнении с взрослыми и старыми животными обоего пола (p < 0.001, рис. 2, табл. 2–4). SOM/nNOS-ИР нейроны не выявлялись у молодых животных, но присутствовали у взрослых и старых крыс без достоверных различий между ними (p > 0.05).
Рис. 2.
Микрофотографии SOM-ИР нейронов, содержащих CB (a, b), nNOS (c, d), а также NPY (e, f) в AN молодых (a, c, e) и старых (b, d, f) крыс. Колокализация двух маркеров указана стрелкой. Флуоресценция Сy3 (красный, CB, nNOS, NPY), FITC (зеленый, SOM). Масштаб – 50 мкм.

Рис. 2.
Окончание
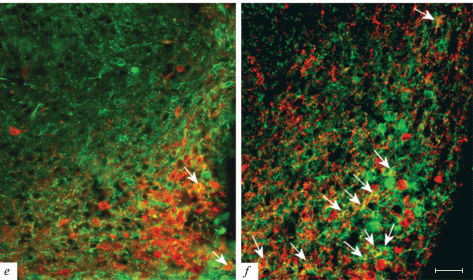
Таблица 2.
Процент SOM/CB-ИР нейронов в ядрах туберальной области гипоталамуса крыс разного возраста
| Возраст | AN | VMNvl | VMN shell | VMNdm | DMN | MTu | PeV | PeF |
|---|---|---|---|---|---|---|---|---|
| Самки | ||||||||
| Молодые | 6.6 ± 1.5 | 18.3 ± 1.7 | – | – | 19.5 ± 3.6 | 15.5 ± 3.4 | 23.6 ± 10.4 | 23.6 ± 10.5 |
| Взрослые | 41.7 ± 3.6* | 22.8 ± 3.5 | – | – | 16 ± 2.9 | 22 ± 4.4 | 23.6 ± 10.4 | 20 ± 9.4 |
| Старые | 72.3 ± 5.9* ◆ | 7.9 ± 0.9 | – | – | 22 ± 4.2 | 20 ± 3.7 | 28.6 ± 8.7 | 30.8 ± 8.5 |
| Самцы | ||||||||
| Молодые | 29.4 ± 3.3 | 18.6 ± 1.4 | – | – | 17 ± 1.8 | 18 ± 3.7 | 33.6 ± 9.6 | 35.8 ± 4.4 |
| Взрослые | 49.5 ± 4.1* | 17.1 ± 1.2 | – | – | 23 ± 3.6 | 16 ± 2.9 | 32.2 ± 9.1 | 20 ± 12.3 |
| Старые | 66.5 ± 5.7* ◆ | 15.4 ± 1.6 | – | – | 18 ± 2.5 | 20 ± 3.3 | 35.8 ± 9.1 | 42. 2± 4.6 |
Таблица 3.
Процент SOM/nNOS-ИР нейронов в ядрах туберальной области гипоталамуса крыс разного возраста
| Возраст | AN | VMNvl | VMN shell | VMNdm | DMN | MTu | PeV | PeF |
|---|---|---|---|---|---|---|---|---|
| Самки | ||||||||
| Молодые | 0 | 34.6 ± 8.5 | – | – | 19.2 ± 4.5 | 4.4 ± 1.3 | 15.0 ± 10.0 | – |
| Взрослые | 13.7 ± 4.9 | 38.8 ± 10.2 | – | – | 17.8 ± 3.5 | 4.8 ± 0.7 | 15.0 ± 10.0 | – |
| Старые | 16.1 ± 2.5 | 36.0 ± 8.2 | – | – | 20.0 ± 5.1 | 5.2 ± 1.9 | 18.6 ± 8.2 | – |
| Самцы | ||||||||
| Молодые | 0 | 43.4 ± 6.7 | – | – | 20.4 ± 5.0 | 4.4 ± 1.7 | 13.6 ± 8.8 | – |
| Взрослые | 13.5 ± 3.6 | 49.6 ± 7.0 | – | – | 28.0 ± 5.9 | 5.6 ± 0.7 | 20.0 ± 12.3 | – |
| Старые | 18.2 ± 4.5 | 42.4 ± 3.1 | – | – | 18.8 ± 4.9 | 5.0 ± 1.0 | 20.0 ± 9.4 | – |
Таблица 4.
Процент SOM/NPY-ИР нейронов в ядрах туберальной области гипоталамуса крыс разного возраста
| Возраст | AN | VMNvl | VMN shell | VMNdm | DMN | MTu | PeV | PeF |
|---|---|---|---|---|---|---|---|---|
| Самки | ||||||||
| Молодые | 4.2 ± 0.7 | 16.4 ± 3.3 | 39.3 ± 6.5 | 30.0 ± 14.6 | 9.2 ± 1.3 | 9.1 ± 0.9 | – | – |
| Взрослые | 28.5 ± 3.9* | 9.0 ± 2.3 | 33.3 ± 2.7 | 30.0 ± 14.6 | 12.4 ± 2.5 | 13.4 ± 2.2 | – | – |
| Старые | 24 ± 2.9* | 14.1 ± 2.6 | 28.4 ± 3.1 | 33.6 ± 12.4 | 9.8 ± 1.9 | 11.1 ± 2.5 | – | – |
| Самцы | ||||||||
| Молодые | 5.3 ± 1.1 | 17.7 ± 3.5 | 35.7 ± 4.3 | 38.6 ± 12.5 | 33.0 ± 3.5◆ | 9.7 ± 1.3 | – | – |
| Взрослые | 28 ± 0.9* | 10.3 ± 2.6 | 44.3 ± 6.3 | 25.0 ± 11.2 | 37.1 ± 5.1◆ | 9.4 ± 1.3 | – | – |
| Старые | 31 ± 3.6* | 11.5 ± 2.2 | 46.1 ± 3.8 | 37.2 ± 12.3 | 26.6 ± 4.7◆ | 10.8 ± 2.0 | – | – |
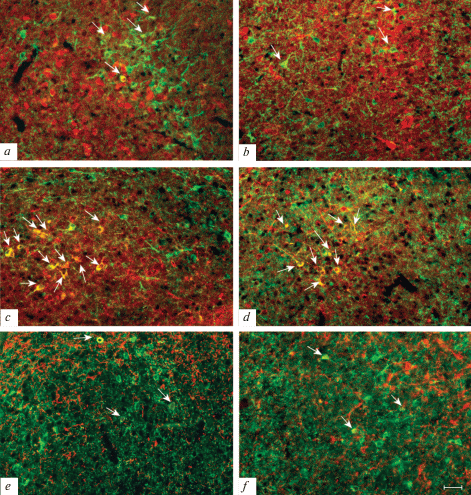
В VMN SOM-ИР нейроны VMN shell и VMNdm не содержали CB и nNOS, но часть из них была ИР к NPY. В VMNvl от трети до половины SOM-ИР нейронов экспрессировали nNOS, а ИР к CB и NPY была обнаружена у небольшого процента нейронов (от 7.9 до 18.6%) независимо от возраста и пола (рис. 3, табл. 2–4).
Рис. 3.
Микрофотографии SOM-ИР нейронов, содержащих CB (a, b), nNOS (c, d), а также NPY (e, f) в VMNvl молодых (a, c, e) и старых (b, d, f) крыс. Колокализация двух маркеров указана стрелкой. Флуоресценция Сy3 (красный, CB, nNOS, NPY), FITC (зеленый, SOM). Масштаб – 50 мкм.
В DMN до трети SOM-ИР нейронов экспрессировало CB, nNOS и NPY. При этом в DMN самцов наблюдался достоверно больший процент SOM-ИР нейронов, колокализующих NPY в сравнении с самками во всех возрастных группах (p < 0.001) (табл. 2–4).
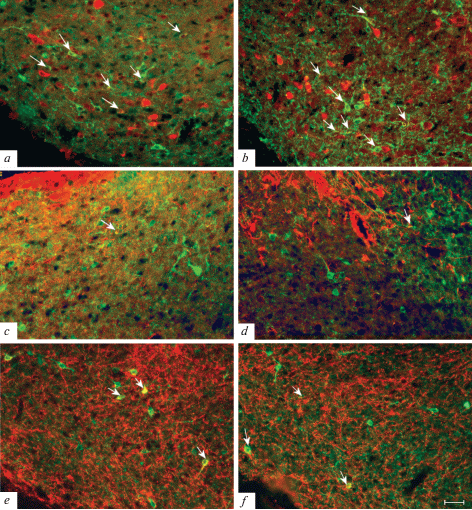
В MTu процент SOM/CB-ИР нейронов варьировал от 15 до 20%, SOM/NPY-ИР нейронов – от 9 до 11%, и лишь небольшой процент SOM-ИР нейронов этой области содержал nNOS (рис. 4, табл. 2–4).
Рис. 4.
Микрофотографии SOM-ИР нейронов, содержащих CB (a, b), nNOS (c, d), а также NPY (e, f) в MTu молодых (a, c, e) и старых (b, d, f) крыс. Колокализация двух маркеров указана стрелкой. Флуоресценция Сy3 (красный, CB, nNOS, NPY), FITC (зеленый, SOM). Масштаб – 50 мкм.
Отдельные SOM-ИР нейроны выявлялись в PeV и PeF. В PeV треть SOM-ИР нейронов была также CB-ИР, 13–20% – nNOS-ИР, но NPY-негативной. В PeF от 20 до 42% нейронов были SOM/CB-ИР и не экспрессировали nNOS-ИР и NPY (табл. 2–4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты нашего исследования свидетельствуют, что SOM-ИР нейроны у крыс в туберальной области расположены в AN, DMN, VMN, MTu, PeV и PeF ядрах. Ранее наличие SOM было отмечено в AN, VMN, DMN, PeV ядрах взрослых крыс [1, 2, 5], туберальном ядре у взрослых мышей [17]. Мы впервые показали наличие SOM-ИР нейронов у крыс в MTu, PeF и оболочке VMN. В VMN SOM-ИР нейроны локализовались главным образом в области VMNvl. Количество SOM-ИР нейронов было небольшим по сравнению с общим числом клеток в этих ядрах. Наибольшее число SOM-ИР нейронов выявлялось в AN и VMNvl.
Нами впервые было установлено, что при старении локализация SOM-ИР нейронов в ядрах туберальной области гипоталамуса, а также их число не изменяется у самцов и у самок. Согласно данным литературы, уровень соматолиберина в срединном возвышении снижался у старых крыс, тогда как уровень соматостатина в срединном возвышении и уровни соматолиберина и соматостатина в телах клеток не изменялись. Было установлено, что соматостатин-индуцированное ингибирование соматотропина было сенсибилизировано у старых крыс, что указывает на возможную причину возрастного уменьшения уровня соматотропина в плазме [12].
Тем не менее, при старении в AN увеличивался процент SOM-ИР нейронов, колокализующих CB, nNOS и NPY. AN характеризуется отсутствием гематоэнцефалического барьера и является важным ядром-сенсором биохимических параметров крови [18]. В этом ядре перестройки нервных синапсов часто происходят во время различных изменений метаболических состояний, что с возрастом может приводить к накоплению “клеточного мусора” в межклеточном пространстве ядра и развитию нейровоспаления с возрастом [11]. При этом данные литературы также свидетельствуют в пользу того, что NO и NPY оказывают провоспалительный эффект в нервной системе [19, 20].
Согласно данным литературы, у мыши небольшая часть SOM-ИР нейронов колокализовала родственный белку Агути пептид (Aguti-related peptide, AgRP), но не проопиомеланокортин (POMC) [21]. AgRP/NPY являются орексигенными пептидами в отличие от POMC, метаболиты которого обладают анорексигенным эффектом [22]. SOM оказывает ингибирующее влияние на POMC-содержащие нейроны, которые экспрессируют рецепторы к SOM [1]. Можно предположить, что увеличение процента колокализации SOM с орексигенными пептидами (в частности с NPY) в AN нейронах способствует нарушению баланса между потреблением пищи и энергозатратами в сторону увеличения поглощения пищи и уменьшения расхода энергии, что приводит к развитию ожирения и метаболического синдрома в старости.
В наших предыдущих исследованиях мы обнаружили увеличение экспрессии nNOS при старении в DMN, VMN и AN [13]. Вероятно, с этим связано и отмеченное в настоящей работе увеличение процента нейронов, колокализующих SOM и nNOS в AN. Результаты наших предыдущих работ свидетельствуют о том, что доля CB-ИР нейронов в AN с возрастом не изменяется [14]. Можно предположить, что с возрастом в AN происходят разнонаправленные изменения экспрессии CB, при котором его экспрессия увеличивается в одних группах нейронов и уменьшается в других.
Данные литературы показывают, что SOM-ИР нейроны тесно связаны синаптическими контактами с нейронами, экспрессирующими кисспептин, в частности в преоптической области и AN. Тем не менее, лишь единичные нейроны содержат SOM и кисспептин [8].
VMNvl в основном отвечает за агрессию у самцов и самок, а также половое поведение у самок крыс и характеризуется присутствием нейронов, которые экспрессируют рецепторы эстрогена, в то время как дорсомедиальная часть VMNdm больше связана с регуляцией аппетита [23]. Мы обнаружили, что VMNvl от трети до половины SOM-ИР нейронов у всех крыс колокализовали nNOS, а ИР к CB и NPY – от 7.9 до 18.6%. Отсутствие половых различий связано с тем, что SOM-ИР нейроны VMNvl, вероятно, в большей степени связаны с регуляцией агрессивного, чем полового поведения.
Согласно данным литературы, SOM и nNOS колокализованы в 55% нейронов PeV и VMN [5]. По результатам нашей работы в PeV колокализация SOM и nNOS составляла лишь 15–20% и не изменялась при старении. Предположительно, SOM /nNOS-ИР нейроны PeV координируют выделение кисспептина, что играет важную роль в регуляции секреции половых гормонов. SOM-ИР /nNOS-негативные нейроны PeV могут участвовать в регулировании потребления пищи и расхода энергии [8].
Половые различия со стороны SOM-ИР нейронов нами отмечены в DMN. В DMN самцов наблюдался достоверно больший процент SOM-ИР нейронов, колокализующих NPY в сравнении с самками во всех возрастных группах. Данные литературы также подтверждают наличие половых различий со стороны NPY-ергической системы в DMN. Применение диеты с большим содержанием жира или систематическое введение лептина снижала экспрессию рецепторов Y1 к NPY у самцов, но не у самок мышей [24]. Клинические наблюдения демонстрируют увеличение активности симпатической нервной системы при ожирении в большей степени у мужчин, чем у женщин [25], что также может быть связано с NPY-содержащими нейронами DMN, проецирующимися к паравентрикулярному ядру и участвующими в регуляции пищевого поведения и косвенно – в модулировании активности симпатической нервной системы [26].
Таким образом, SOM-ИР нейроны туберальной области представляют собой гетерогенную популяцию нейронов. Небольшая часть SOM-ИР нейронов AN, вероятно, экспрессирующая AGRP, участвует в регуляции метаболизма. При этом функция основной популяции SOM-ИР клеток этого ядра в молодом возрасте, вероятно, связана с управлением выделения гормона роста и половых гормонов. С регуляцией полового поведения связаны и SOM-ИР нейроны VMNvl, содержащие nNOS. При старении происходят нарушение метаболизма и угасание половой функции, что может находить отражение в изменении нейрохимического состава AN.
Список литературы
Kumar U, Singh S (2020) Role of Somatostatin in the Regulation of Central and Peripheral Factors of Satiety and Obesity. Int J Mol Sci 21(7): 2568. https://doi.org/10.3390/ijms21072568
Patel YC (1999) Somatostatin and its receptor family. Front Neuroendocrinol 20: 157–198. https://doi.org/10.1006/frne.1999.0183
Shamsi BH, Chatoo M, Xu XK, Xu X, Chen XQ (2021) Versatile Functions of Somatostatin and Somatostatin Receptors in the Gastrointestinal System. Front Endocrinol (Lausanne) 12: 652363. https://doi.org/10.3389/fendo.2021.652363
Kumar U (2007) Colocalization of somatostatin receptor subtypes (SSTR1-5) with somatostatin, NADPH-diaphorase (NADPH-d), and tyrosine hydroxylase in the rat hypothalamus. J Comp Neurol 504(2): 185–205. https://doi.org/10.1002/cne.21444
Zou SL, Somvanshi RK, Paik S, Kumar U (2015) Colocalization of Cannabinoid Receptor 1 with Somatostatin and Neuronal Nitric Oxide Synthase in Rat Brain Hypothalamus. J Mol Neurosci 55: 480–491.
Stepanyan Z, Kocharyan A, Behrens M, Koebnick C, Pyrski M, Meyerhof W (2007) Somatostatin, a negative-regulator of central leptin action in the rat hypothalamus. J Neurochem 100(2): 468–78. https://doi.org/10.1111/j.1471-4159.2006.04219.x
Barrios V, Frago LM, Canelles S, Guerra-Cantera S, Arilla-Ferreiro E, Chowen JA, Argente J (2021) Leptin Modulates the Response of Brown Adipose Tissue to Negative Energy Balance: Implication of the GH/IGF-I Axis. Int J Mol Sci 22(6): 2827. https://doi.org/10.3390/ijms22062827
Dufourny L, Delmas O, Teixeira-Gomes AP, Decourt C, Sliwowska JH (2018) Neuroanatomical connections between kisspeptin neurones and somatostatin neurones in female and male rat hypothalamus: a possible involvement of SSTR1 in kisspeptin release. J Neuroendocrinol 15: e12593. https://doi.org/10.1111/jne.12593
Proudan N, Peroski M, Grignol G, Merchenthaler I, Dudas B (2015) Juxtapositions between the somatostatinergic and growth hormone-releasing hormone (GHRH) neurons in the human hypothalamus. Neuroscience 297: 205–210. https://doi.org/10.1016/j.neuroscience.2015.03.054
Masliukov PM, Nozdrachev AD (2021) Hypothalamic Regulatory Mechanisms of Aging. J Evol Biochem Phys 57: 473–491 https://doi.org/10.1134/S0022093021030030
Liu T, Xu Y, Yi CX, Tong Q, Cai D (2021) The hypothalamus for whole-body physiology: from metabolism to aging. Protein Cell. https://doi.org/10.1007/s13238-021-00834-x
Kim K, Choe HK (2019) Role of hypothalamus in aging and its underlying cellular mechanisms. Mech Ageing Dev 177: 74–79. https://doi.org/10.1016/j.mad.2018.04.008
Moiseev KY, Vishnyakova PA, Porseva VV, Masliukov AP, Spirichev AA, Emanuilov AI, Masliukov PM (2020) Changes of nNOS expression in the tuberal hypothalamic nuclei during ageing. Nitric Oxide 100-101: 1-6. https://doi.org/10.1016/j.niox.2020.04.002
Vishnyakova PA, Moiseev KY, Spirichev AA, Emanuilov AI, Nozdrachev AD, Masliukov PM (2021) Expression of calbindin and calretinin in the dorsomedial and ventromedial hypothalamic nuclei during aging. Anat Rec (Hoboken) 304: 1094–1104. https://doi.org/10.1002/ar.24536
Nozdrachev AD, Masliukov PM (2011) Neuropeptide Y and autonomic nervous system. J Evol Biochem Phys 47: 121–130. https://doi.org/10.1134/S0022093011020010
Paxinos G, Watson C (2005) The Rat Brain in Stereotaxic Coordinates. 5th Edition. Elsevier Acad Press.
Luo SX, Huang J, Li Q, Mohammad H, Lee CY, Krishna K, Kok AM, Tan YL, Lim JY, Li H, Yeow LY, Sun J, He M, Grandjean J, Sajikumar S, Han W, Fu Y (2018) Regulation of feeding by somatostatin neurons in the tuberal nucleus. Science 361(6397): 76–81. https://doi.org/10.1126/science.aar4983
Jais A, Brüning JC (2021). Arcuate nucleus-dependent regulation of metabolism – pathways to obesity and diabetes mellitus. Endocr Rev bnab025. https://doi.org/10.1210/endrev/bnab025
Chandrasekharan B, Nezami BG, Srinivasan S (2013) Emerging neuropeptide targets in inflammation: NPY and VIP. Am J Physiol Gastrointest Liver Physiol 304(11): G949–G957.
Tewari D, Sah AN, Bawari S, Nabavi SF, Dehpour AR, Shirooie S, Braidy N, Fiebich BL, Vacca RA, Nabavi SM (2021) Role of Nitric Oxide in Neurodegeneration: Function, Regulation, and Inhibition. Curr Neuropharmacol 19(2): 114–126. https://doi.org/10.2174/1570159X18666200429001549
Campbell JN, Macosko EZ, Fenselau H, Pers TH, Lyubetskaya A, Tenen D, Goldman M, Verstegen AM, Resch JM, McCarroll SA, Rosen ED, Lowell BB, Tsai LT (2017) A molecular census of arcuate hypothalamus and median eminence cell types. Nat Neurosci 20(3): 484–496. https://doi.org/10.1038/nn.4495
Yoo ES, Yu J, Sohn JW (2021) Neuroendocrine control of appetite and metabolism. Exp Mol Med 53(4): 505–516. https://doi.org/10.1038/s12276-021-00597-9
Khodai T, Luckman SM (2021) Ventromedial Nucleus of the Hypothalamus Neurons Under the Magnifying Glass. Endocrinology 162(10):bqab141. https://doi.org/10.1210/endocr/bqab141
Mele P, Zammaretti F, Longo A, Panzica G, Oberto A, Eva C (2016) Sex-dependent regulation of hypothalamic neuropeptide Y-Y1 receptor gene expression in leptin treated obese (ob/ob) or lean mice. Brain Res 1649: 102–109.
Shi Z, Cassaglia PA, Pelletier NE, Brooks VL (2019) Sex differences in the sympathoexcitatory response to insulin in obese rats: role of neuropeptide Y. J Physiol 597(6): 1757–1775. https://doi.org/10.1113/JP277517
Bi S, Kim YJ, Zheng F (2012) Dorsomedial hypothalamic NPY and energy balance control. Neuropeptides 46(6): 309–314. https://doi.org/10.1016/j.npep.2012.09.002
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


