Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1518-1529
Повышение системного уровня эндотоксина ослабляет барорефлекс и кардиоваскулярные эффекты электростимуляции инфралимбической коры анестезированной крысы
Т. С. Туманова 1, 2, Т. Н. Кокурина 1, Г. И. Рыбакова 1, В. Г. Александров 1, *
1 Институт физиологии им. И.П. Павлова РАН
Москва, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
Санкт-Петербург, Россия
* E-mail: aleksandrovv@infran.ru
Поступила в редакцию 04.08.2021
После доработки 18.09.2021
Принята к публикации 30.09.2021
Аннотация
Известно, что повышение уровня эндотоксина (бактериального липополисахарида, ЛПС) приводит к гиперцитокинемии и развитию системной воспалительной реакции, которая сопровождается нарушениями кровообращения. Согласно современным представлениям, кровообращение контролируется цереброкардиальной осью, на высшем уровне которой располагается инфралимбическая кора (ИЛ). Важнейшим рефлекторным механизмом, регулирующим уровень артериального давления (АД), является барорефлекс. Целью настоящей работы стала проверка гипотезы о том, что нарушение нервного контроля является одним из факторов, способствующих расстройству кровообращения при эндотоксемии. В острых опытах на крысах Вистар регистрировали АД в бедренной артерии, тестировали барорефлекторную чувствительность путем внутривенного введения фенилэфрина, а также подвергали микроэлектростимуляции ИЛ. Введение ЛПС крысам экспериментальной группы (n = 10) вызывало первоначальное повышение и последующее снижение среднего АД; частота сердечных сокращений (ЧСС) постепенно повышалась. В контрольной группе (n = 11) АД и ЧСС оставались стабильнымы. Было установлено, что после введения ЛПС происходит ослабление БРЧ и снижение депрессорных ответов на стимуляцию ИЛ. Эти результаты свидетельствуют о возможном ослаблении кортикального и рефлекторного контроля кровообращения в условиях эндотоксемии. Они подтверждают выдвинутую гипотезу и позволяют предполагать, что изменение уровня провоспалительных цитокинов оказывает модулирующее влияние на состояние цереброкардиальной оси и рефлекторные механизмы регуляции кровообращения.
Эндотоксин (бактериальный липополисахарид ЛПС) представляет собой компонент внешней мембраны грамотрицательных бактерий, который обеспечивает поддержание ее целостности и взаимодействие с другими клетками [1, 2]. В частности, взаимодействие ЛПС с комплексом TLR4/MD-2, который экспрессируется на поверхности макрофагов, моноцитов, дендритных и эпителиальных клеток, запускает синтез провоспалительных цитокинов этими клетками [3]. Инициирование провоспалительных сигнальных каскадов направлено на уничтожение бактерий, однако при сепсисе, в условиях бактериемии, содержание эндотоксина в плазме крови возрастает многократно [4, 5]. Тяжелый сепсис, который традиционно рассматривается в качестве одного из вариантов системной воспалительной реакции, характеризуется эндотоксемией, устойчивой гипотензией, тахикардией и острыми нарушениями гемодинамики, которые приводят к гипоперфузии тканей и, в тяжелых случаях, к полиорганной недостаточности [4, 6]. Ключевую роль в патогенезе сепсиса играет перепрограммирование клеток эндотелия сосудов в сторону проапоптотического, провоспалительного, проадгезивного и прокоагулянтного фенотипов [7]. Одним из факторов, запускающих этот процесс, являются провоспалительные цитокины, которые выделяются активированными миелоидными клетками [8]. Результатом является снижение сосудистого тонуса и увеличение проницаемости сосудистой стенки, которые и приводят к нарушению микроциркуляции в органах, снижению объема циркулирующей крови и гипотонии.
Вместе с тем, следует иметь в виду, что провоспалительные цитокины влияют на клетки глии и нейроны [9, 10], а повышение их системного уровня изменяет состояние центральной нервной системы, включая те ее отделы, которые участвуют в контроле автономных функций [11]. Согласно современным представлениям, нервный контроль кровообращения осуществляется так называемой цереброкардиальной осью, которая образована центральной автономной сетью, автономной нервной системой и органами системы кровообращения [12]. Центральная автономная сеть представляет собой сложную систему, в состав которой входят структуры, расположенные на разных уровнях нервной оси, от коры больших полушарий (инфралимбическая, поясная, островковая) до продолговатого мозга, и охваченные многочисленными прямыми и опосредованными связями [13, 14]. Именно центральная автономная сеть контролирует и координирует преганглионарные, нейросекреторные и респираторные выходы. Структуры нижнего уровня центральной автономной сети, а именно ядра блуждающего нерва (ядро солитарного тракта и дорсальное моторное ядро), а также группы пресимпатических нейронов вентролатеральной области продолговатого мозга, образуют дугу артериального барорефлекса, который является важнейшим механизмом быстрого [15], а, возможно, и долговременного [16] контроля артериального давления.
На высшем уровне цереброкардиальной оси размещают полифункциональную инфралимбическую кору (ИЛ), которая по совокупности признаков рассматривается как висцеральная сенсорно-моторная область [17]. Циркуляторные эффекты стимуляции ИЛ воспроизводились разными исследователями неоднократно, причем было установлено, что они реализуются при участии других структур, входящих в центральную автономную сеть. Поэтому можно полагать, что при экспериментальных воздействиях, затрагивающих не только ИЛ, но и центральную автономную сеть и цереброкардиальную ось в целом, ответы на стимуляцию ИЛ будут изменяться.
Целью настоящего исследования стала проверка предположения о том, что одной из причин развития расстройств кровообращения при системной воспалительной реакции является нарушение центральных механизмов регуляции кровообращения, вызванное повышением системного уровня эндотоксина. С этой целью было изучено влияние внутривенного введения бактериального ЛПС на циркуляторные эффекты стимуляции ИЛ и барорефлекторную чувствительность анестезированной крысы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на крысах линии Вистар из центра коллективного пользования “Биоколлекция” Института физиологии им. И.П. Павлова РАН (самцы, массой тела 250–300 г, n = 21). Все процедуры, выполненные в исследовании, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Биоэтического комитета Института физиологии им. И.П. Павлова РАН.
Животных подвергали общей анестезии (уретан, 1.6 г/кг, в/б); глубину анестезии контролировали, ориентируясь по реакции на болевой стимул (ущемление хвоста) и выраженности роговичного рефлекса. Температуру тела измеряли и поддерживали на уровне 36.5–37.5°С при помощи гомеотермического контроллера (ML295/R, ADInstruments, Австралия). Хирургическая подготовка к эксперименту предусматривала, прежде всего, трахеостомию для обеспечения свободного дыхания, а также катетеризацию правой бедренной артерии и вены. Затем крыс помещали в стереотаксический аппарат (SR-6R-HT, Narishige, Япония), в прональной позиции. Голову фиксировали в горизонтальном положении и проводили локальную краниотомию по средней линии над точкой введения раздражающего электрода.
Артериальный катетер, заполненный гепаринизированным физиологическим раствором (50 Ед/мл), присоединяли к датчику артериального давления (MLT1199), камера которого была заполнена тем же раствором. Датчик подключали ко входу мостового усилителя (FE224), сигнал с выхода усилителя подавали на вход устройства сбора данных PowerLab 8/35. На протяжении всего эксперимента непрерывно регистрировали артериальное давление (АД); среднее АД (АДср) и частоту сердечных сокращений (ЧСС) рассчитывали в режиме онлайн при помощи программного пакета LabChart 7.0. При дальнейших расчетах величину АДср и ЧСС измеряли каждые 10 мин непосредственно перед экспериментальным воздействием и выражали в процентах к ее величине на 60-й минуте эксперимента.
Венозный катетер был соединен сo шприцем объемом 5 мл, который заполняли физиологическим раствором, содержавшим 0.05% фенилэфрина гидрохлорида (Merk, Германия), и устанавливали в шприцевый насос (AL-300, WPI, США). Для тестирования барорефлекторной чувствительности 135 мкл раствора фенилэфрина вводили в бедренную вену со скоростью 45 мкл/с. Фенилэфрин является избирательным альфа‑адреномиметиком, который вызывает сокращение гладких мышц кровеносных сосудов, увеличение периферического сопротивления и подъем АД, что в свою очередь приводит к рефлекторному снижению ЧСС. Изменение барорефлекторной чувствительности оценивали по изменению наклона прямой линии, аппроксимирующей зависимость между увеличением АДср и соответствующим уменьшением ЧСС. Для определения величины наклона на записях, отражающих увеличение АДср, вызванное введением фенилэфрина, и, соответственно, снижение ЧСС, выделяли временной интервал 2.0–2.5 с, в котором оба параметра изменялись линейно. В этом интервале определяли величину прироста АДср (ΔАДср) и соответствующего падения ЧСС (ΔЧСС). Наклон рассчитывали, как отношение ΔЧСС (уд./мин)/ΔMАP (мм рт. ст.) = наклон ((уд./мин)/мм рт. ст.).
Для стимуляции ИЛ металлический электрод (TM33B01, WPI, США) погружали через трепанационное отверстие на глубину 4 мм от поверхности мозга, в точку с координатами +2.5 мм относительно уровня bregma и 0.5 мм левее сагиттальной плоскости. Индифферентный электрод вводили в мышцы шеи. Серии монополярных отрицательных прямоугольных импульсов тока (150–200 мкА, длительность 1 мс, частота 50 имп/с, продолжительность серий 20 с), подавали, используя изолированный стимулятор (модель 4100, A-M Systems, США).
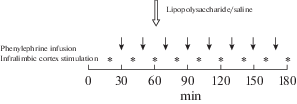
Длительность эксперимента составляла 3 ч. В течение этого времени у животного непрерывно регистрировали температуру тела и АД. В режиме реального времени рассчитывали АДср и ЧСС. Через 20 мин после начала регистрации производили первую стимуляцию ИЛ, через 30 мин – первое введение фенилэфрина. В дальнейшем эти экспериментальные воздействия повторяли с интервалом 20 мин (рис. 1). На 60-й минуте животным экспериментальной группы (n = 10) вводили внутривенно 1 мл раствора ЛПС (L 2630, Sigma-Aldrich, 40 мг/кг); животным контрольной группы (n = 11) вводили 1 мл физиологического раствора.
Рис. 1.
Экспериментальный протокол. На оси – время от начала регистрации. Светлая стрелка – момент введения растворов, темные стрелки – инфузии фенидэфрина, звездочки – электрическая стимуляция ИЛ.
После окончания эксперимента животное умерщвляли передозировкой анестетика, мозг извлекали, фиксировали в формалине и проводили гистологический контроль места введения раздражающего электрода.
Изменения учитываемых параметров оценивали, рассчитывая их среднюю величину и среднюю квадратичную ошибку. Влияние ЛПС оценивали, сравнивая значения учитываемых показателей после введения вещества с их значениями до введения (фон), а также с соответствующими значениями, полученными в экспериментах с введением физиологического раствора (контроль). Достоверность изменений определяли, используя метод однофакторного дисперсионного анализа и U‑критерий Манна–Уитни. Критический уровень значимости при проверке нулевой гипотезы принимался равным 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Средняя величина АДср до введения растворов не отличалась в контрольной и экспериментальной группах и не претерпевала статистически значимых колебаний внутри групп. Непосредственно перед введением растворов она составляла 96 ± 5 мм рт. ст. в контрольной и 94 ± 6 мм рт. ст. в экспериментальной группе, различия между этими величинами оказались статистически недостоверными (p = 0.88). В контрольной группе не было зафиксировано статистически значимых изменений АДср после введения физиологического раствора (p = 0.99). Введение ЛПС приводило к увеличению АДср, которое достигало максимальной величины через 30–40 мин после введения, достоверно отличаясь как от фоновых, так и от контрольных значений (рис. 2a). Затем этот эффект постепенно ослабевал, АД начинало падать. Через 90 мин после введения ЛПС величина АДср была достоверно ниже исходных и контрольных значений и продолжала уменьшаться до конца эксперимента. Фоновые значения ЧСС в контрольной и экспериментальной группах не проявили достоверных различий.
Рис. 2.
Динамика АДср (a) и ЧСС (b) в экспериментах с введением ЛПС (темные маркеры) и физиологического раствора (светлые маркеры). АДср и ЧСС выражен в процентах к их величине на 60-й минуте эксперимента. * – значение параметра в экспериментальной группе достоверно отличается от значения в контрольной группе; # – значение параметра в экспериментальной группе достоверно отличается от фоновых значений. Стрелки указывают момент введения растворов.
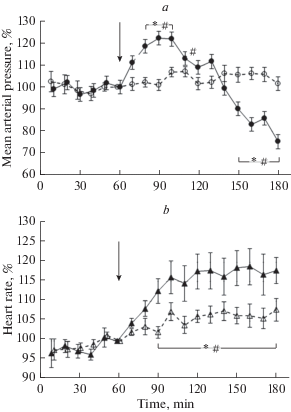
Непосредственно перед введением физиологического раствора средняя величина ЧСС составляла 391 ± 15 уд./мин, а перед введением ЛПС 365 ± 32 уд./мин, эти различия оказались недостоверными (p = 0.097). Рост ЧСС имел место как в контрольной, так и в экспериментальной группе, однако в экспериментальной группе он происходил быстрее, чем в контрольной (рис. 2b). В контрольной группе ЧСС росла до 100-й минуты регистрации, а затем стабилизировалась. Через 30 мин после введения ЛПС этот параметр был больше соответствующей величины в контрольной группе (p = 0.013) и в дальнейшем оставался на достигнутом уровне, не обнаруживая тенденции к снижению. Относительные величины ЧСС, зарегистрированные в экспериментальной серии в каждый момент времени после введения ЛПС, оказались достоверно выше фоновых и соответствующих контрольных величин (рис. 2b). Таким образом, ЛПС вызывал снижение АДср и повышение ЧСС анестезированных крыс. Оба эти эффекта сохранялись до конца эксперимента.
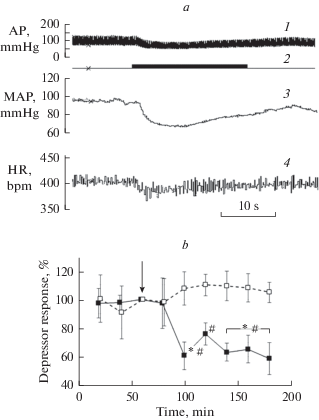
При тестировании барорефлекторной чувствительности введение фенилэфрина вызывало повышение АД и рефлекторное снижение ЧСС (рис. 3a). При введении фенилэфрина на 50-й минуте АДср увеличивалось на 40 ± 2 мм рт. ст. в контрольной группе и на 45 ± 3 мм рт. ст. в группе с введением ЛПС. В ответ на повышение АД происходило снижение ЧСС соответственно на 79 ± 15 уд./мин и 85 ± 15 уд./мин. Тестирование барорефлекторной чувствительности на 50-й минуте эксперимента показало, что значения показателя, характеризующего величину барорефлекторной чувствительности, рассчитанные по описанной выше методике, составляли в контрольной группе 1.90 ± 0.40 (уд./мин)/мм рт. ст., а в экспериментальной 1.89 ± ± 0.23 (уд./мин)/мм рт. ст., то есть практически совпадали (рис. 3b). В контрольных экспериментах не наблюдалось достоверных изменений барорефлекторной чувствительности. Вместе с тем, барорефлекторная чувствительность достоверно снижалась через 30 мин после введения ЛПС и оставалась ниже фоновых и контрольных значений до конца эксперимента. Эти результаты позволяют утверждать, что повышение системного уровня ЛПС у анестезированных крыс приводит к ослаблению барорефлекторной чувствительности.
Рис. 3.
Эффект введения фенилэфрина (a) и изменение барорефлекторной чувствительности под влиянием ЛПС (b). 1 – запись АД, 2 – отметка введения фенилэфрина, 3 – изменение АДср, 4 – изменение ЧСС. * – значение параметра в экспериментальной группе достоверно (при p < 0.05) отличается от значения в контрольной группе; # – значение параметра в экспериментальной группе достоверно (при p < 0.01) отличается от фоновых значений. Стрелкой отмечен момент введения растворов.

Микроэлектростимуляция ИЛ вызывала реакцию системы кровообращения в виде снижения АД и некоторого уменьшения ЧСС (рис. 4а). Величина депрессорного ответа на 60-й минуте эксперимента составляла в контрольной группе в среднем 23.8 ± 2.8 мм рт. ст., а в экспериментальной группе 21.0 ± 1.0 мм рт. ст. (p = 0.98). Введение физиологического раствора не оказывало влияния на величину депрессорного компонента (рис. 4b). Через 40 мин после введения ЛПС ответ достоверно уменьшался по сравнению с фоновыми и контрольными величинами, и этот эффект сохранялся до конца эксперимента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исходные величины АДср и ЧСС анестезированных крыс в контрольной и экспериментальной группах не отличались между собой и были близки к значениям, которые обычно регистрируются в сходных экспериментальных условиях, при использовании того же анестетика [18–20]. Величина АДср в контрольной группе была стабильной на протяжении всего эксперимента; ЧСС росла в течение первых 100 мин регистрации, а затем также стабилизировалась. Полученные результаты позволяют сделать вывод о том, что состояние системы кровообращения в наших экспериментальных условиях было стабильным; это дало возможность адекватно оценивать эффекты экспериментальных воздействий и сравнивать полученные результаты с результатами других авторов.
Системное введение ЛПС широко используется в качестве методического приема, позволяющего моделировать эффекты эндотоксинемии в условиях острых и хронических экспериментов [21–25]. В наших экспериментах введение ЛПС приводило к первоначальному повышению и последующему снижению АДср, а также к повышению ЧСС. В контрольной группе эти показатели оставались стабильными на протяжении всего времени регистрации.
Повышение АД непосредственно после введения ЛПС в наших экспериментах могло быть следствием проявления некоторых центральных эффектов нарастающего уровня провоспалительных цитокинов, которые обычно маскируются их периферическими эффектами. Так, установлено, что интерлейкин-6, поступая в центральную нервную систему, активировал группу аргинин-вазопрессиновых нейросекреторных клеток внутри супраоптического ядра гипоталамуса [23]. В свою очередь, аргинин-вазопрессин вызывал сокращение гладкомышечных клеток периферических сосудов, повышение периферического сопротивления. В результате в течение 30-ти–40-а мин АДср поднималось на 10–15 мм рт. ст., стабилизировалось на повышенном уровне, а затем снижалось, достигая через 150–180 мин значений близких к исходным. В наших экспериментах наблюдалась сходная временная динамика АДср после введения ЛПС, однако падение АДср после подъема было гораздо глубже, что, по-видимому, объясняется уже периферическими эффектами эндотоксемии.
Гипотензия и тахикардия являются обычной реакцией сердечно-сосудистой системы на эндотоксемию. Эти симптомы развиваются при эндогенном повышении системного уровня ЛПС, в том числе при сепсисе [6, 25]; они воспроизводятся в экспериментах на подвижных [26] и анестезированных [27] животных. Повышение системного уровня ЛПС вызывает усиленное выделение провоспалительных цитокинов, в том числе фактора некроза опухолей и интерлейкина-1бета, а также NO клетками иммунной системы и эндотелием сосудов [28]. Повышенный уровень NO вызывает релаксацию гладкомышечных клеток сосудов, снижение периферического сопротивления и падение АД [29]. В свою очередь, снижение АД должно вызывать рефлекторный рост ЧСС. В наших экспериментах ЧСС возрастала после введения ЛПС, а затем стабилизировалась, несмотря на прогрессивное падение АДср (рис. 2). Этот факт можно рассматривать в качестве косвенного доказательства снижения барорефлекторной чувствительности в условиях эндотоксемии, вызванной введением ЛПС.
Результаты настоящего исследования прямо показывают, что под влиянием ЛПС происходит снижение барорефлекторной чувствительности. Такой эффект впервые получен в острых экспериментах на анестезированных животных, хотя ослабление рефлекторной брадикардии под влиянием ЛПС описано в одной из недавних работ, выполненных на бодрствующих крысах [30]. Известно, что в замыкании рефлекторных дуг, реализующих барорефлекс, участвуют нейроны ядра солитарного тракта (ЯСТ) и вентролатеральной области продолговатого мозга [31]. Некоторые из этих нейронов экспрессируют рецепторы к провоспалительным цитокинам, однако их основной мишенью являются клетки эндотелия сосудов и микроглии. В частности, под влиянием ИЛ-1бета, эти клетки начинают усиленно секретировать NO и простагландины (ПГ). В свою очередь ПГЕ2, действуя пресинаптически, облегчает глутаматергическую передачу в цепях нейронов внутри ЯСТ, но, одновременно действуя также пресинаптически, подавляет выделение глутамата из терминалей первичных афферентов, оканчивающихся в ЯСТ [32, 33]. Во всяком случае, можно считать доказанным, что повышение системного уровня ЛПС приводит к снижению барорефлекторной чувствительности и, следовательно, ухудшает состояние одного из важнейших механизмов нервного контроля функции кровообращения.
Полученные результаты свидетельствуют о том, что повышение системного уровня ЛПС ослабляют депрессорный эффект стимуляции ИЛ. Эта область коры расположена на высшем уровне цереброкардиальной оси [23] и является одним из кортикальных узлов центральной автономной сети [13, 14]. С точки зрения функциональной специализации, ИЛ может рассматриваться в качестве висцеральной сенсорно-моторной коры, которая принимает участие в формировании моторных команд [32, 34]. Участие ИЛ в контроле кровообращения доказано предыдущими исследованиями и депрессорные реакции являются обычным эффектом локальной микростимуляции ИЛ анестезированных животных [35, 36]. При интерпретации результатов подобных исследований следует иметь в виду, что одним из основных свойств центральной автономной сети являются реципрокность и параллелизм связей [14]. Описаны, в частности, прямые и опосредованные проекции, нисходящие из ИЛ к многочисленным структурам, расположенным на разных уровнях нервной оси, включая бульбарный [35]. Установлено, кроме того, что эфферентные импульсы, возникающие в ИЛ, могут достигать бульбарного уровня по прямым моносинаптическим проекциям к ЯСТ [36], но показано, что депрессорные эффекты стимуляции ИЛ реализуются при участии латеральной гипоталамической области и центрального серого вещества [36]. Учитывая то, что эффекты стимуляция ИЛ реализуются при участии других структур, входящих в центральную автономную сеть, изменение этих эффектов в условиях эндотоксемии свидетельствует не столько о влиянии повышенного уровня провоспалительных цитокинов на саму ИЛ, сколько об изменении состояния цереброкардиальной оси в целом.
Рис. 4.
Реакция системы кровообращения на стимуляцию ИЛ (a) и влияние ЛПС на эту реакцию (b). 1 – нативная запись АД; 2 – отметка раздражения; 3 – АДср; 4 – ЧСС. Величина депрессорных ответов выражена в процентах к их величине на 60-й минуте эксперимента. Остальные обозначения как на рис. 3.
Таким образом, полученные результаты подтвердили гипотезу о том, что в условиях эндотоксемии происходит ослабление механизмов нервного контроля функции кровообращения, вероятно, вследствие повышения системного уровня провоспалительных цитокинов. Подобный эффект провоспалительных цитокинов был установлен ранее в аналогичных экспериментальных условиях для функции дыхания [37]. Что касается функции кровообращения, то вопрос о влиянии провоспалительных цитокинов на нервные механизмы регуляции этой функции требует дальнейшего экспериментального исследования.
Список литературы
Bertani B, Ruiz N (2018) Function and Biogenesis of Lipopolysaccharides. EcoSal Plus 8(1). https://doi.org/10.1128/ecosalplus.ESP-0001-2018
Raetz CR, Whitfield C (2002) Lipopolysaccharide endotoxins. Ann Rev Biochem 71: 635–700. https://doi.org/10.1146/annurev.biochem.71.110601.135414
Skirecki T, Cavaillon JM (2019) Inner sensors of endotoxin – implications for sepsis research and therapy. FEMS Microbiol Rev 43(3): 239–256. https://doi.org/10.1093/femsre/fuz004
Stubljar D, Skvarc M (2015) Effective strategies for diagnosis of systemic inflammatory response syndrome (SIRS) due to bacterial infection in surgical patients. Infect Disorders Drug Targets 15(1): 53–56. https://doi.org/10.2174/1871526515666150320161804
Mohammad S, Thiemermann C (2021) Role of Metabolic Endotoxemia in Systemic Inflammation and Potential Interventions. Front Immunol 11: 594150. https://doi.org/10.3389/fimmu.2020.594150
Marik PE, Taeb AM (2017) SIRS, qSOFA and new sepsis definition. J Thoracic Disease 9(4): 943–945. https://doi.org/10.21037/jtd.2017.03.125
Joffre J, Hellman J, Ince C, Ait-Oufella H (2020) Endothelial Responses in Sepsis. Am J Respirat Crit Care Med 202(3): 361–370. https://doi.org/10.1164/rccm.201910-1911TR
Mera S, Tatulescu D, Cismaru C, Bondor C, Slavcovici A, Zanc V, Carstina D, Oltean M (2011) Multiplex cytokine profiling in patients with sepsis. APMIS: Acta Pathol Microbiol Immunol Scandinav 119(2): 155–163. https://doi.org/10.1111/j.1600-0463.2010.02705.x
Kaur D, Sharma V, Deshmukh R (2019) Activation of microglia and astrocytes: a roadway to neuroinflammation and Alzheimer’s disease. Inflammopharmacology 27(4): 663–677. https://doi.org/10.1007/s10787-019-00580-x
Ferro A, Auguste Y, Cheadle L (2021) Microglia, Cytokines, and Neural Activity: Unexpected Interactions in Brain Development and Function. Front Immunol 12: 703527. https://doi.org/10.3389/fimmu.2021.703527
Felger JC (2018) Imaging the Role of Inflammation in Mood and Anxiety-related Disorders. Current Neuropharmacol 16(5): 533–558. https://doi.org/10.2174/1570159X15666171123201142
Tahsili-Fahadan P, Geocadin RG (2017) Heart-Brain Axis: Effects of Neurologic Injury on Cardiovascular Function. Circulat Res 120(3): 559–572. https://doi.org/10.1161/CIRCRESAHA.116.308446
Benarroch EE (1993) The central autonomic network: functional organization, dysfunction, and perspective. Mayo Clin Proceed 68(10): 988–1001. https://doi.org/10.1016/s0025-6196(12)62272-1
Benarroch EE (2019) Control of the cardiovascular and respiratory systems during sleep. Autonom Neurosci Basic Clin 218: 54–63. https://doi.org/10.1016/j.autneu.2019.01.007
Dampney RA (2016) Central neural control of the cardiovascular system: current perspectives. Advanc Physiol Educat 40(3): 283–296. https://doi.org/10.1152/advan.00027.2016
Barrett CJ, Malpas SC (2005) Problems, possibilities, and pitfalls in studying the arterial baroreflexes' influence over long-term control of blood pressure. Am J Physiol Regul Integrat Compar Physiol 288(4): R837–R845. https://doi.org/10.1152/ajpregu.00456.2004
Aleksandrov VG, Kokurina TN, Rybakova GI, Tumanova TS (2021) Autonomic Functions of the Prefrontal Cortex. Human Physiol 47(5): 110–117. https://doi.org/10.31857/S0131164621050027
Maggi CA, Giuliani S, Santicioli P, Regoli D, Meli A (1985) Comparison of the effects of substance P and substance K on blood pressure, salivation and urinary bladder motility in urethane-anaesthetized rats. Eur J Pharmacol 113(2): 291–294. https://doi.org/10.1016/0014-2999(85)90750-2
Revand R, Singh SK (2021) Ipsilateral somatic nerves mediate histamine-induced vasosensory reflex responses involving perivascular afferents in rat models. Scient Rep 11(1): 14648. https://doi.org/10.1038/s41598-021-94110-x
Matsuo N, Matsuo S, Nakamura Y, Ezomo FO, Kawai Y (2020) Regulatory effects of cervical sympathetic trunk and renal sympathetic nerve activities on cerebral blood flow during head-down postural rotations. Autonom Neurosci: Basic and Clin 229: 102738. https://doi.org/10.1016/j.autneu.2020.102738
Schläpfer M, Piegeler T, Dull RO, Schwartz DE, Mao M, Bonini MG, Z’Graggen BR, Beck-Schimmer B, Minshall RD (2015) Propofol increases morbidity and mortality in a rat model of sepsis. Crit Care (London England) 19(1): 45. https://doi.org/10.1186/s13054-015-0751-x
Stahl O, Löffler B, Haier J, Mardin WA, Mees ST (2013) Mimicry of human sepsis in a rat model–prospects and limitations. J Surgic Res 179(1): e167–e175. https://doi.org/10.1016/j.jss.2012.01.042
Palin K, Moreau ML, Sauvant J, Orcel H, Nadjar A, Duvoid-Guillou A, Dudit J, Rabié A, Moos F (2009) Interleukin-6 activates arginine vasopressin neurons in the supraoptic nucleus during immune challenge in rats. Am J Physiol Endocrinol and Metabolism 296(6): E1289–E1299. https://doi.org/10.1152/ajpendo.90489.2008
Aleksandrov VG, Gubarevich EA, Danilova GA, Tumanova TS (2020) Simulation of the systemic inflammatory response syndrome in anesthetized rats. Integrat Physiol 1(1): 51–60. https://doi.org/10.33910/2687-1270-2020-1-1-51-60
Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald WJ (1992) Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Confer Commit. Am Colleg Chest Physic/Soc Crit Care Med Chest 101(6): 1644–1655. https://doi.org/10.1378/chest.101.6.1644
Passaglia P, de Lima Faim F, Batalhão ME, Stabile AM, Bendhack LM, Antunes-Rodrigues J, Lacchini R, Capellari Carnio E (2021) Central Administration of Angiotensin-(1-7) Improves Vasopressin Impairment and Hypotensive Response in Experimental Endotoxemia. Cells 10(1): 105. https://doi.org/10.3390/cells10010105
Sturgess DJ, Morrison S, Haluska B, Gobe GC, Jones MA, Volante S, Venkatesh B (2021) Left Ventricular Impaired Relaxation and Interstitial Myocarditis Identified in Sepsis-Associated Cardiac Dysfunction: Use of a Rodent Model. Med Sci Monitor: Internat Med J Exp Clin Res 27 e929512.
Andersson U, Tracey KJ (2012) Neural reflexes in inflammation and immunity. J Exp Med 209(6): 1057–1068. https://doi.org/10.1084/jem.20120571
Hallemeesch MM, Janssen BJ, de Jonge WJ, Soeters PB, Lamers WH, Deutz NE (2003) NO production by cNOS and iNOS reflects blood pressure changes in LPS-challenged mice. Am J Physiol Endocrinol and Metabolism 285(4): E871–E875. https://doi.org/10.1152/ajpendo.00004.2002
Sallam MY, El-Gowilly SM, El-Mas MM (2021) Androgenic modulation of arterial baroreceptor dysfunction and neuroinflammation in endotoxic male rats. Brain Res 1756: 147330. https://doi.org/10.1016/j.brainres.2021.147330
Wehrwein EA, Joyner MJ (2013) Regulation of blood pressure by the arterial baroreflex and autonomic nervous system. Handb Clin Neurol 117: 89–102. https://doi.org/10.1016/B978-0-444-53491-0.00008-0
Marty V, El Hachmane M, Amédée T (2008) Dual modulation of synaptic transmission in the nucleus tractus solitarius by prostaglandin E2 synthesized downstream of IL-1beta. Eur J Neurosci 27(12): 3132–3150. https://doi.org/10.1111/j.1460-9568.2008.06296.x
Amorim MR, de Deus JL, Cazuza RA, Mota C, da Silva L, Borges GS, Batalhão ME, Cárnio EC, Branco L (2019) Neuroinflammation in the NTS is associated with changes in cardiovascular reflexes during systemic inflammation. J Neuroinflammat 16(1): 125. https://doi.org/10.1186/s12974-019-1512-6
Cechetto DF (2014) Cortical control of the autonomic nervous system. Exp Physiol 99(2): 326–331. https://doi.org/10.1113/expphysiol.2013.075192
Fisk GD, Wyss JM (2000) Descending projections of infralimbic cortex that mediate stimulation-evoked changes in arterial pressure. Brain Res 859(1): 83–95. https://doi.org/10.1016/s0006-8993(00)01935-1
Owens NC, Verberne AJ (2001) Regional haemodynamic responses to activation of the medial prefrontal cortex depressor region. Brain Res 919(2): 221–231. https://doi.org/10.1016/s0006-8993(01)03017-7
Aleksandrov VG, Tumanova TS, Aleksandrova NP (2018) Diclofenac eliminates respiratory effects of the tumor necrosis factor in rats. J Evol Biochem Physiol (54)4: 338–341.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


