Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 605-615
Функциональная оценка периферической холинергической нейротрансмиссии у крыс с фетальным вальпроатным синдромом
А. Ю. Архипов 1, Д. В. Самигуллин 1, И. И. Семина 2, А. И. Маломуж 1, *
1 Казанский институт биохимии и биофизики Казанского научного центра РАН
Казань, Россия
2 Казанский государственный медицинский университет
Казань, Россия
* E-mail: artur57@gmail.com
Поступила в редакцию 14.01.2021
После доработки 29.01.2021
Принята к публикации 01.02.2021
Аннотация
Одной из распространенных экспериментальных моделей для изучения развития расстройств аутистического спектра (РАС) и методов их терапии является модель вальпроатного синдрома у грызунов. Особи, рожденные от самок, получавших инъекции вальпроевой кислоты в периоде беременности, демонстрируют ряд нарушений, свойственных для РАС. Ранее было установлено, что вальпроевая кислота влияет на нервно-мышечную передачу и, более того, изменяет экспрессию набора генов при развитии нервно-мышечного синапса. Однако до последнего времени не было известно, изменяется ли нервно-мышечная нейротрансмиссия у животных с фетальным вальпроатным синдромом и если да, то как? С помощью функционального теста “вращающийся стержень” нами было установлено, что у крыс с выработанной моделью вальпроатного синдрома координация движений не отличалась от контрольных животных. С помощью методов микроэлектродной электрофизиологии анализировали (i) амплитудно-временные параметры одиночных постсинаптических сигналов; (ii) частоту спонтанного выделения квантов ацетилхолина; (iii) количество квантов ацетилхолина, выделившегося в ответ на стимул; (iv) амплитуды вызванных ответов в процессе ритмической стимуляции. Нами не было выявлено каких-либо изменений в процессах выделения ацетилхолина из нервного окончания и его рецепции на мембране мышечного волокна как в покое, так и при стимуляции нерва. Таким образом, можно заключить, что у крыс с фетальным вальпроатным синдромом периферическая холинергическая нейротрансмиссия не претерпевает каких-либо функционально-значимых изменений.
Аутизм относят к расстройствам аутистического спектра (РАС). РАС – это пожизненное расстройство психического развития, характеризующееся ранними нарушениями социальной коммуникации и социального взаимодействия, которые сопровождаются тревожностью и стереотипным поведением [1–3]. Кроме классических симптомов, при аутизме отмечается наличие целого спектра неврологических нарушений. Последние включают в себя нарушения в функционировании опорно-двигательного аппарата: мышечные дистония и гипотония, проблемы со статической и динамической координацией, неравномерное становление крупных и мелких моторных актов, проблемы с построением ритма и выдерживанием темпа в сложных повторяющихся движениях, и т.д. [4]. Несмотря на то, что причины большинства из этих нарушений, несомненно, лежат в области ЦНС, тем не менее, наличие изменений в периферическом отделе нервной системы (в том числе и в функционировании нервно-мышечной передачи) не отрицается. Более того, дефект в синаптической передаче сигнала действительно рассматривается как один из элементов в патогенезе аутизма [1]. Поскольку нервно-мышечный контакт является ключевым звеном в инициации любого двигательного акта – от произвольного движения тела или конечностей до дыхания и сокращения голосовых связок, то изучение процессов функционирования этого контакта в рамках аутистических расстройств является весьма актуальным.
Аутизм – это полиэтиологичное заболевание, поэтому только экспериментальные модели на животных позволяют комплексно изучать и получать новые сведения о его патогенезе, в который вовлекаются как центральные, так и периферические звенья нервной системы. Одной из наиболее популярных моделей РАС является экспериментальная модель фетального вальпроатного синдрома (ФВС) на грызунах, в которой используется введение вальпроевой кислоты в пренатальном периоде [5]. Потомство, полученное от таких крыс, демонстрирует поведение, имеющее общие черты с основными симптомами аутизма: дефицит социального поведения, нарушение коммуникации, наличие стереотипности и тревожности [6–8]. Данная модель признана учеными и клиническими специалистами во всем мире и считается одной из самых адекватных моделей РАС и по настоящее время [9].
На фоне множества данных о поведенческих нарушениях у грызунов с ФВС, обусловленных изменениями в функционировании ЦНС, до сих пор отсутствуют сведения о работе периферической нервной системы, и не изучены механизмы синаптической передачи у крыс с данной моделью РАС. При этом есть целый ряд экспериментальных данных, свидетельствующих в пользу того, что вальпроевая кислота влияет на функционирование нервно-мышечного контакта, снижая [10] или усиливая [11] силу сокращений мышцы. Кроме того, установлено, что вальпроевая кислота изменяет работу большого количества генов, участвующих в процессе развития нервно-мышечного синапса [12]. Все эти перечисленные факты и предопределили выполнение настоящего исследования, цель которого заключалась в проведении функциональной оценки нервно-мышечной нейротрансмиссии у крыс с ФВС. Среди показателей на уровне целого организма были выбраны функциональная оценка координации движений и устойчивость к физической утомляемости. На уровне нервно-мышечного контакта оценивали чувствительность мембраны мышечного волокна к ацетилхолину (АХ), интенсивность процессов выделения АХ из двигательного нервного окончания в покое и в ответ на одиночную и ритмическую стимуляцию.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные животные. Исследование проводили на крысах линии Вистар. До начала проведения экспериментов все животные содержались в стандартных условиях, в естественном световом режиме на полнорациональной сбалансированной диете (согласно ГОСТ Р 50258-92) с соблюдением международных требований Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях, и согласно правилам лабораторной практики при проведении доклинических исследований в РФ (согласно ГОСТ З 51000.3-96 и 510004-96). Все исследования были одобрены локальным этическим комитетом ФГБОУ ВО Казанского ГМУ Минздрава России, протокол заседания № 81 от 11.10.2017.
Экспериментальная модель РАС, фетальный вальпроатный синдром (ФВС). Для моделирования аутизма у крыс была использована вальпроевая модель [5]. Вальпроевую кислоту (Конвулекс; G.L.PHARMA, Австрия) вводили самкам крыс подкожно в дозе 500 мг/кг на 13-й день беременности, так как именно этот период является критическим для эмбрионального развития, и на него приходится пик нейрогенеза и экспрессии генов в нейромедиаторных системах. Эксперименты проведены на потомстве (самцах) этих крыс в возрасте 85–95 дней. Для данного исследования были выбраны самцы, поскольку, согласно эпидемиологическим данным, РАС встречается чаще у мальчиков, чем у девочек (примерно 4 : 1 в пользу мужского пола) [13].
В качестве контроля использовали самцов такого же возраста (85–95 дней), полученных от самок, которым вводили на 13-й день беременности такой же объем физиологического раствора, что и экспериментальным животным, но без вальпроевой кислоты.
Оценка развития вальпроатного синдрома. Для получения доказательства того, что у потомства крыс действительно развились аутистически-подобные нарушения, нами были проведены характерные поведенческие тесты. Учитывая то, что одним из значимых нарушений поведения у крыс с ФВС является тревожность, нами была проведена оценка этого показателя с использованием тестов “Приподнятый крестообразный лабиринт” (ПКЛ) и “Открытое поле” (ОП).
Тест ПКЛ позиционируется как один из наиболее чувствительных методов для исследования тревожности животного [14]. Установка (НПО “Открытая наука”, Россия) представляет собой квадратную площадку (14 × 14 см) и четыре перпендикулярно расположенных рукава: два закрытых и два открытых. Закрытые рукава являются аналогом норы, а открытые – потенциально опасной областью. Размер рукавов для крыс составляет 50 × 14 см. Лабиринт приподнят над полом на 70 см. Продолжительность теста для каждого животного составляла 3 мин. Крысу помещали в центр лабиринта, носом к открытому рукаву. Фиксировали продолжительность пребывания крысы в открытых рукавах лабиринта, уменьшение которой рассматривается как показатель развития тревожности.
Тест ОП мы использовали в качестве дополнительной оценки степени развития аутистически-подобных нарушений. Установка ОП представляет собой камеру круглой формы (диаметром 97 см) с непрозрачными стенами (высотой 42 см). Пол расчерчен на сектора для удобства визуальной регистрации и имеет на своей поверхности отверстия, имитирующие норы. Критерием перехода из одного сектора в другой являлось нахождение задних лап в новом секторе. За 3 мин тестирования регистрировали: число пересеченных линий, что отражает неспецифический уровень возбуждения (двигательная активность); количество обследованных отверстий, что является показателем исследовательской активности; число актов умывания (груминг), что отражает общую стереотипную активность животных; число актов дефекации, что отражает уровень эмоциональности (в том числе, тревожности) животных.
Фиксация поведенческих актов осуществлялась при помощи цифровой видеосистемы с использованием компьютерной программы Ethovision ХТ “Noldus” (Нидерланды) с автоматическим анализом треков. Это позволяло получить точную количественную оценку динамики формирования поведенческих навыков, стратегии поведения животного в ходе опыта, а также обнаруживать даже самые слабые различия в поведении на модели в сравнении с контрольной группой.
Функциональная оценка двигательной активности. Для выявления возможных нарушений координации, мышечной дистонии или других двигательных нарушений использовали методику тестирования “Вращающийся стержень”. Тестирование проводили на установке Ротарод (Нейроботикс, Россия). Перед тестированием крысы были помещены для адаптации на барабан, который вращался со скоростью 7 об/мин, где находились до первого падения, после чего животные удалялись в домашнюю клетку. Далее через 30 мин осуществляли тестирование при вращении барабана со скоростью 15 об/мин, при этом проводили регистрацию времени удержания животных на барабане.
Оценка функционирования нервно-мышечного синапса методами электрофизиологии. Исследование холинергической периферической нейротрансмиссии проводили на нервно-мышечном препарате n. facial – musculus levator auris longus (m. LAL), который хорошо зарекомендовал себя как удобная модель для изучения различных функциональных аспектов нервно-мышечной трансмиссии [15, 16].
Изолированный нервно-мышечный препарат выделяли из декапитированных под изофлурановым наркозом животных и помещали в экспериментальную ванночку, перфузируемую оксигенированным (95% O2 + 5% CO2) раствором Рингера–Кребса (ммоль/л): NaCl 137.0, KCl 5.0, CaCl2 2.0, MgCl2 1.0, NaHCO3 11.0, Na2HPO4 1.0, d-glucose 11.0; pH 7.3–7.4. Для предотвращения мышечных сокращений во время стимуляции и регистрации полноценного квантового выброса АХ препарат инкубировали с μ-конотоксином GIIIB (1 мкмоль/л, Peptide; Peptide Institute, Inc., Япония). Эксперименты проводили при 20.0 ± 0.3°C.
Процессы нейросекреции АХ из двигательной нервной терминали и чувствительность постсинаптической мембраны оценивали по изменениям потенциала на сарколемме вследствие активации ионотропных ацетилхолиновых рецепторов медиатором, выделяющемся как в покое (спонтанное выделение), так и при электрической стимуляции нерва (вызванное выделение). Мембранный потенциал покоя (МПП), миниатюрные потенциалы концевой пластинки (МПКП; результат выделения одиночных порций, квантов, АХ), и вызванные потенциалы концевой пластинки (ПКП; результат одновременного выделения множества квантов АХ в ответ на электрический стимул) регистрировались в синаптической зоне мышечного волокна стандартной микроэлектродной техникой. Стеклянные микроэлектроды (с сопротивлением кончика 20–30 MΩ) заполнялись раствором KCl в концентрации 3 моль/л.
Спонтанную квантовую секрецию АХ, ее уровень, оценивали по частоте возникновения МПКП.
Об изменениях в чувствительности постсинаптической мембраны к АХ судили, анализируя амплитуду и постоянную времени спада МПКП.
Вызванную квантовую секрецию АХ оценивали по величине квантового состава (количество порций медиатора, приведшее к возникновению конкретного вызванного постсинаптического ответа) при редкой частоте стимуляции (0.5 Гц). Квантовый состав рассчитывался путем деления средней амплитуды вызванного ответа на среднюю амплитуду МПКП, зарегистрированного в этой же синаптической области [17]. При стимуляции пачками импульсов (10 и 30 Гц) вызванную квантовую секрецию АХ оценивали по изменениям амплитуд ПКП в пачке. Для сравнения темпа снижения сигналов у разных животных амплитуду каждого сигнала нормализовали к амплитуде первого в пачке стимулов [18]. Оценивали отношение средней амплитуды от 10 последних сигналов к амплитуде первого в пачке [19].
Для регистрации синаптических сигналов использовали усилитель Axoclamp 900A (Molecular Devices, США), аналого-цифровой преобразователь Digidata 1440A (Molecular Devices, США) и программу pClamp 10.4 (Molecular Devices, США). Во всех экспериментах регистрация проводилась в синаптической зоне волокон с МПП от –60 и до –80 мВ. Данные экспериментов, в которых мембрана деполяризовалась более, чем на 5 мВ, исключались из обработки [20]. В каждом нервно-мышечном препарате регистрировали МПКП в течение 2-х мин и около 50 ПКП (при стимуляции в 0.5 Гц) в 5–15 синаптических контактах. Далее, регистрировали 50 ПКП при стимуляции нерва 10 и 30 Гц.
Статистика. Все результаты представлены как среднее значение ± ошибка среднего. В поведенческих тестах n – количество животных, в электрофизиологических исследованиях n – количество синапсов. Проверку выборки на нормальное распределение проводили во всех сериях экспериментов с помощью критерия Д’Агостино–Пирсона. В данном случае статистическую значимость выявляли с помощью критерия Стьюдента. Статистическую обработку данных по вызванной пачечной активности проводили с использованием критерия Манна–Уитни. Результаты считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На начальном этапе исследования была проведена оценка развития ФВС у экспериментальных животных. Поскольку именно повышенный уровень тревожности является одним из ключевых показателей развития вальпроатного синдрома и одним из “классических” атрибутов развития РАС [6–8], то оценивали ее у животных на установках ПКЛ и ОП.
Численные значения результатов экспериментов, проведенных на ПКЛ, представлены в табл. 1. Крысы, рожденные от самок, которым вводили вальпроевую кислоту, значительно меньше времени (на 45%, р < 0.05) проводили в открытых рукавах лабиринта по сравнению с животными контрольной группы, что свидетельствует о более высоком уровне их тревожности.
Таблица 1.
Параметры поведения крыс с фетальным вальпроатным синдромом (ФВС) в тесте “Приподнятый крестообразный лабиринт” (ПКЛ) и в тесте “Открытое поле” (ОП)
| Группа | Тест ПКЛ | Тест ОП | |||
|---|---|---|---|---|---|
| время нахождения в открытых рукавах ПКЛ, с | двигательная активность, (кол-во пересеченных линий) | груминг, кол-во |
кол-во актов дефекации | исследовательская
активность (число обследованных отверстий) |
|
| Контроль (n = 10) | 69.0 ± 21.6 | 43.2 ± 6.3 | 1.9 ± 0.7 | 1.3 ± 0.5 | 14 ± 2.5 |
| Крысы с ФВС (n = 8) | 37.9 ± 5.6* | 58.8 ± 8.7 | 6.6 ± 2.1* | 6.5 ± 1.8* | 7.9 ± 3.3 |
О развитии тревожности у крыс с ФВС также свидетельствует и значительное повышение (в 5 раз, р < 0.05) количества актов дефекации на установке ОП (табл. 1). Кроме того, о развитии другой, характерной для РАС черты поведения (а именно повышение стереотипной активности), свидетельствует увеличение количества актов груминга более чем в 3.5 раза (р < 0.05; табл. 1).
Таким образом, у экспериментальных крыс подтверждается наличие изменений в поведении, характерных для вальпроевой модели РАС, и эти животные были использованы в дальнейшем для функциональной оценки периферической холинергической нейротрансмиссии.
Для исследования возможных функциональных изменений со стороны периферической нервной системы и скелетной мускулатуры, нами была изучена способность крыс удерживаться на вращающемся стержне (установка Ротарод). Время удержания у контрольных животных составило 64.3 ± 7.8 с (n = 10), а у крыс с ФВС – 63.1 ± 7.6 с (n = 8).
На основании полученных результатов мы сделали вывод, что у крыс с ФВС отсутствуют какие-либо двигательные нарушения, изменение координации и мышечного тонуса, однако вопрос о возможных изменениях в функционировании нервно-мышечного синапса все же оставался открытым.
Подробное исследование функциональных аспектов периферической холинергической нейротрансмиссии было начато с анализа процесса спонтанной нейросекреции и чувствительности постсинаптической мембраны мышечного волокна к ацетилхолину.
Средняя частота регистрируемых МПКП, характеризующая уровень спонтанного выделения квантов АХ, в синапсах нервно-мышечного препарата контрольных животных составила 1.29 ± 0.16 с–1 (n = 32). Амплитуда и постоянная времени спада зарегистрированных сигналов, изменение которых свидетельствует как о чувствительности постсинаптической мембраны к АХ, так и о свойствах размера кванта медиатора, представлены в табл. 2. У животных с выработанным фетальным вальпроатным синдромом никаких изменений в регистрируемых параметрах МПКП отмечено не было (табл. 2, рис. 1, во всех случаях p > 0.05, n = 41). Следовательно, ни уровень спонтанного выделения АХ из двигательных нервных окончаний, ни чувствительность постсинаптических рецепторов к АХ у животных с ФВС не претерпевают изменений.
Таблица 2.
Параметры миниатюрных потенциалов концевой пластинки (МПКП) и вызванных потенциалов концевой пластинки (ПКП) в синапсах m. LAL у контрольных крыс и крыс с фетальным вальпроатным синдромом (ФВС)
| Группа | Параметры МПКП | Параметры ПКП | |||
|---|---|---|---|---|---|
| частота МПКП, с–1 | амплитуда, мВ | постоянная времени спада сигнала, мс | амплитуда, мВ | квантовый состав | |
| Контроль (n = 32) | 1.29 ± 0.16 | 0.82 ± 0.05 | 3.30 ± 0.12 | 21.8 ± 1.2 | 29.0 ± 1.7 |
| Крысы с ФВС (n = 41) | 1.29 ± 0.13 | 0.80 ± 0.05 | 3.44 ± 0.09 | 24.0 ± 1.2 | 34.0 ± 2.3 |
Рис. 1.
Миниатюрные потенциалы концевой пластинки (mEPPs) и вызванные потенциалы концевой пластинки (EPPs), зарегистрированные в нервно-мышечном синапсе m. LAL контрольной крысы (Control) и крысы с фетальным вальпроатным синдромом, моделью РАС (VPA model of ASDs). Представлены данные в рамках одного репрезентативного эксперимента (один синаптический контакт у контрольного животного и у животного с моделью РАС). Слева – фрагмент нативной записи миниатюрных потенциалов концевой пластинки и их суперпозиция (30 сигналов); справа – суперпозиция 30 вызванных потенциалов концевой пластинки (серым – нативные сигналы, черным – усредненный сигнал).

Поскольку в основе передачи возбуждения с нейрона на эффекторную клетку лежит вызванный стимулом процесс синхронного выделения множества квантов медиатора, то необходимо было оценить и данный вид нейросекреции у экспериментальных животных. Средние значения амплитуды и квантового состава ПКП при редкой стимуляции (0.5 Гц) нерва m. LAL представлены в табл. 2. В синапсах животных экспериментальной группы эти значения были схожими и достоверного отличия не наблюдалось (p > 0,05 для обоих параметров; табл. 2, рис. 1).
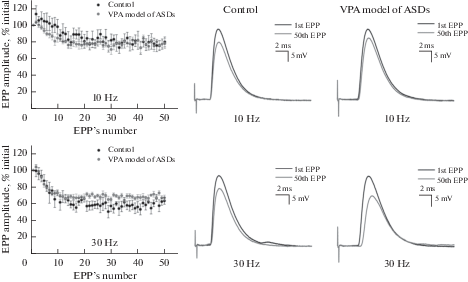
При эпизодах ритмической активности, когда нерв раздражают пачками стимулов, проявляется такой феномен как депрессия амплитуды ПКП, что является интегральной характеристикой таких процессов, как экзоцитоз, эндоцитоз, рециклирование и заполнение медиатором синаптических везикул [21].
Степень этой депрессии амплитуд зависит от частоты стимуляции. Так, в синапсах контрольных животных при частоте стимуляции в 10 и 30 Гц средняя амплитуда десяти последних ответов по отношению к первому снижалась на 22.0 ± 5.2% (n = 7) и 39.2 ± 5.3% (n = 5) соответственно. У животных с ФВС мы не наблюдали каких-либо изменений в динамике снижения постсинаптических сигналов (в обоих случаях p > 0.05; рис. 2). Так, средняя амплитуда последних десяти ПКП снижалась на 22.4 ± ± 4.9% (n = 7) и 30.5 ± 4.6% (n = 8), при частотах стимуляции 10 и 30 Гц соответственно. Таким образом, нами не было выявлено никаких функциональных изменений не только в процессах спонтанной, но и вызванной нейротрансмиссии в нервно-мышечных синапсах у крыс с ФВС.
Рис. 2.
Депрессия амплитуд потенциалов концевой пластинки (EPP) в синапсе m. LAL при стимуляции двигательного нерва с частотами 10 и 30 Гц у контрольной крысы (Control) и крысы с фетальным вальпроатным синдромом, моделью РАС (VPA model of ASDs). На левой панели представлено относительное изменение амплитуд постсинаптических ответов в ходе пачки импульсов. Данные представлены как % от амплитуды первого сигнала в пачке (средние значения ± стандартная ошибка среднего). Средняя и правая панели – запись нативных первого и пятидесятого сигналов в пачке, зарегистрированных в одном репрезентативном эксперименте (один синаптический контакт контрольного животного и животного с моделью РАС).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании мы установили, что у крыс с ФВС как одной из популярных экспериментальных моделей РАС, по крайне мере к трехмесячному возрасту, не обнаруживается значимых отличий от контрольных животных ни в координации движений, ни в параметрах нервно-мышечной трансмиссии. Необходимость получения этих данных была продиктована наличием целого ряда предпосылок, о которых стоит упомянуть подробнее.
На нервно-мышечном препарате крысы in vitro было продемонстрировано, что вальпроевая кислота обладает способностью частично блокировать мышечные сокращения при прямой или непрямой стимуляции [10]. При этом авторы приходят к следующему заключению: несмотря на то, что возникающий частичный блок вызван преимущественно прямым ингибирующим действием на мышцу, эффекты вальпроевой кислоты отражают прямое действие этого агента на нервно-мышечное соединение [10]. При введении же вальпроата in vivo, наоборот, наблюдалось быстрое и устойчивое увеличение силы сокращения скелетных мышц у трансгенных мышей с боковым амиотрофическим склерозом [11]. Более того, увеличение силы мышечного сокращения при терапии вальпроатом было отмечено у пациентов со спинальной мышечной атрофией III/IV типа [22]. Эти описанные эффекты совсем не означают, что вальпроат влияет только на мышцу. Например, в уже упомянутой работе [11] показано наличие нейропротекторного действия вальпроата непосредственно на холинергические мотонейроны, иннервирующие скелетную мышцу. Судя по всему, это действие вальпроата имеет многофакторную природу. В частности, выявлено, что вальпроат повышает уровень белка SMN (survival motor neuron protein) [23]. Кроме того, показано увеличение уровней антиапоптотических факторов Bcl-2 и Bcl-xL в нейронах спинного мозга при действии вальпроата [24].
Хотя вышеприведенные данные и относятся к эпизодическому или хроническому действию вальпроата на нервно-мышечный аппарат молодого или взрослого организма, тем не менее, имеются данные и о значительном, долговременном влиянии этого агента на развитие синаптических контактов на ранних этапах онтогенеза. Так, в возрасте 4 нед. животные с ФВС демонстрируют снижение уровня глутаматдекарбоксилазы (маркера ГАМКергической сигнализации) [25]. При этом имеет место увеличение экспрессии везикулярного транспортера глутамата (маркера глутаматергической сигнализации) [25]. К настоящему моменту в холинергическом нервно-мышечном синапсе позвоночных выявлены как глутаматергический, так и ГАМКергический сигнальные пути [26, 27]. Поскольку их функционирование отражается как на процессах выделения АХ [28, 29], так и на сократительной функции скелетной мускулатуры [30, 31], то возможные изменения в глутаматергической и ГАМКергической сигнализации у экспериментальных животных вполне могли быть выявлены используемыми нами методами исследования. О значительных изменениях в развивающемся синаптическом контакте при действии вальпроата свидетельствуют и результаты работы Yoshida с соавт. [12], которые демонстрируют, что данный фармакологический агент приводит к изменениям экспрессии целого ряда генов в культивируемых мотонейронах и миотрубках. Так, в частности, в культивируемых мотонейронах 227 генов увеличивают свою экспрессию более чем в два раза при действии вальпроата [12].
Таким образом, подводя итог вышесказанному, можно было полагать, что системное воздействие вальпроата на ранних стадиях онтогенеза (на пренатальном этапе развития) вполне могло сказаться и на функционировании нервно-мышечного контакта в зрелом организме. Однако, как показывают результаты наших исследований, в зрелом организме крыс с ФВС не наблюдается каких-либо функциональных изменений в процессе холинергической сигнализации на уровне периферического синаптического контакта.
Полученные результаты не исключают возможных изменений в работе других молекулярных сигнальных систем, что диктует необходимость продолжения комплексного изучения синаптической функции периферической нервной системы на моделях РАС.
Список литературы
Abrahams B.S., Geschwind D.H. (2008) Advances in autism genetics: On the threshold of a new neurobiology. Nat. Rev. Genet. 9: 341–355. https://doi.org/10.1038/nrg2346
American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders. 5th ed. Am. Psychiatr Associat Arlington. 2013.
Lai M.C., Lombardo M.V., Baron-Cohen S. (2014) Autism. Lancet. 383: 896–910. https://doi.org/10.1016/S0140-6736(13)61539-1
Zavadenko N.N., Pechatnikova N.L., Semashkova N.V., Zavadenko A.N. Orlova K.A. (2015) Neurological disorders in children with autism. Ros. Vestn Perinatol i Pediatr [(Russ. Bull. Perinatol. Pediatr) 60: 14–21 (In Russ)].
Schneider T., Roman A., Basta-Kaim A., Kubera M., Budziszewska B., Schneider K., Przewłocki R. (2008) Gender-specific behavioral and immunological alterations in an animal model of autism induced by prenatal exposure to valproic acid. Psychoneuroendocrinology. 33: 728–740.https://doi.org/10.1016/j.psyneuen.2008.02.011
Christensen J., Grønborg T.K., Sørensen J., Schendel D., Parner E.T., Pedersen L., Vestergaard M. (2013) Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 309: 696–703. https://doi.org/10.1001/jama.2013.2270
Chomiak T., Turner N., Hu B. (2013) What We Have Learned about Autism Spectrum Disorder from Valproic Acid. Patholog, Res. Int. 2013: 712–758. https://doi.org/10.1155/2013/712758
Baronio D., Castro K., Gonchoroski, de Melo G.M., Nunes G.D.F., Bambini-Junior V., Riesgo R. (2015) Effects of an H3R antagonist on the animal model of autism induced by prenatal exposure to valproic acid. PLoS One. 10: 1–11. https://doi.org/10.1371/journal.pone.0116363
Nicolini C., Fahnestock M. (2018) The valproic acid-induced rodent model of autism. Exp. Neurol. 299(Pt A): 217–227. https://doi.org/10.1016/j.expneurol.2017.04.017
Nguyen A., Ramzan I. (1997) In vitro neuromuscular effects of valproic acid. Br. J. Anaesth. 78: 197–200.https://doi.org/10.1093/bja/78.2.197
Rouaux C., Panteleeva I., René F., Gonzalez de Aguilar J.L., Echaniz-Laguna A., Dupuis L., Menger Y., Boutillier A.L., Loeffler J.P. (2007) Sodium valproate exerts neuroprotective effects in vivo through CREB-binding protein-dependent mechanisms but does not improve survival in an amyotrophic lateral sclerosis mouse model. J. Neurosci. 27: 5535–5545.https://doi.org/10.1523/JNEUROSCI.1139-07.2007
Yoshida M., Kitaoka S., Egawa N., Yamane M., Ikeda R., Tsukita K., Amano N., Watanabe A., Morimoto M., Takahashi J., Hosoi H., Nakahata T., Inoue H., Saito M.K. (2015) Modeling the early phenotype at the neuromuscular junction of spinal muscular atrophy using patient-derived iPSCs Stem. Cell Rep. 4: 561–568.https://doi.org/10.1016/j.stemcr.2015.02.010
Newschaffer C.J., Croen L.A., Daniels J., Giarelli E., Grether J.K., Levy S.E., Mandell D.S., Miller L.A., Pinto-Martin J., Reaven J., Reynolds A.M., Rice C.E., Schendel D., Windham G.C. (2007) The epidemiology of autism spectrum disorders. Annu. Rev. Public. Health. 28: 235–258. https://doi.org/10.1146/annurev.publhealth.28.021406.144007
Walf A.A., Frye C.A. (2007) The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat. Protoc. 2: 322–328.https://doi.org/10.1038/nprot.2007.44
Angaut-Petit D., Molgo J., Connold A.L., Faille L. (1987) The levator auris longus muscle of the mouse: a convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. Neurosci Lett. 82: 83–88. https://doi.org/10.1016/0304-3940(87)90175-3
Burke S.R.A., Reed E.J. Romer S.H., Voss A.A. (2018) Levator Auris Longus Preparation for Examination of Mammalian Neuromuscular Transmission Under Voltage Clamp Conditions. J. Vis. Exp. 135: 57482. https://doi.org/10.3791/57482
Grubb B.D., Harris J.B., Schofield I.S. (1991) Neuromuscular transmission at newly formed neuromuscular junctions in the regenerating soleus muscle of the rat. J. Physiol. 441: 405–421. https://doi.org/10.1113/jphysiol.1991.sp018758
Moyer M., van Lunteren E. (2001) Effect of temperature on endplate potential rundown and recovery in rat diaphragm. J. Neurophysiol. 85: 2070–2075. https://doi.org/10.1152/jn.2001.85.5.2070
Miteva A., Gaydukov A., Balezina O. (2020) Interaction between Calcium Chelators and the Activity of P2X7 Receptors in Mouse Motor Synapses. Int. J. Mol. Sci. 21: 2034.
Gaydukov A.E., Bogacheva P.O., Balezina O.P. (2016) Calcitonin gene-related peptide increases acetylcholine quantal size in neuromuscular junctions of mice. Neurosci. Lett. 628: 17–23. https://doi.org/10.1016/j.neulet.2016.06.014
Ruiz R., Cano R., Casañas J.J., Gaffield M.A., Betz W.J., Tabares L. (2011) Active zones and the readily releasable pool of synaptic vesicles at the neuromuscular junction of the mouse. J. Neurosci. 31: 2000–2008.https://doi.org/10.1523/JNEUROSCI.4663-10.2011
Weihl C.C., Connolly A.M., Pestronk A. (2006) Valproate may improve strength and function in patients with type III/IV spinal muscle atrophy. Neurology. 67: 500–501. https://doi.org/10.1212/01.wnl.0000231139.26253.d0
Sumner C., Huynh T., Markowitz J., Perhac J., Hill B., Coovert D., Schussler K., Chen X., Jarecki J., Burghes A., Taylor J., Fischbeck K. (2003) Valproic acid increases SMN levels in spinal muscular atrophy patient cells. Ann. Neurol. 54: 647–654. https://doi.org/10.1002/ana.10743
Tsai L.K., Tsai M.S., Ting C.H., Li H. (2008) Multiple therapeutic effects of valproic acid in spinal muscular atrophy model mice. J. Mol. Med. (Berl) 86: 1243–1254. https://doi.org/10.1007/s00109-008-0388-1
Kim K.C., Kim P., Go H.S., Choi C.S., Park J.H., Kim H.J., Jeon S.J., Dela Pena I.C., Han S.H., Cheong J.H., Ryu J.H., Shin C.Y. (2013) Male-specific alteration in excitatory post-synaptic development and social interaction in pre-natal valproic acid exposure model of autism spectrum disorder. J. Neurochem. 124: 832–843. https://doi.org/10.1111/jnc.12147
Colombo M.N., Francolini M. (2019) Glutamate at the Vertebrate Neuromuscular Junction: From Modulation to Neurotransmission. Cells. 8: 996. https://doi.org/10.3390/cells8090996
Malomouzh A., Ilyin V., Nikolsky E. (2019) Components of the GABAergic signaling in the peripheral cholinergic synapses of vertebrates: a review. Amino Acids 51: 1093–1102. https://doi.org/10.1007/s00726-019-02754-x
Malomouzh A.I., Mukhtarov M.R., Nikolsky E.E., Vyskocil F., Lieberman E.M., Urazaev A.K. (2003) Glutamate regulation of non-quantal release of acetylcholine in the rat neuromuscular junction. J. Neurochem. 85: 206–213. https://doi.org/10.1046/j.1471-4159.2003.01660.x
Malomouzh A.I., Petrov K.A., Nurullin L.F., Nikolsky E.E. (2015) Metabotropic GABAB receptors mediate GABA inhibition of acetylcholine release in the rat neuromuscular junction. J. Neurochem. 135: 1149–1160. https://doi.org/10.1111/jnc.13373
Koyuncuoğlu H., Kara I., Günel M.A., Nurten A., Yamantürk P. (1998) N-methyl-D-aspartate antagonists, glutamate release inhibitors, 4-aminopyridine at neuromuscular transmission. Pharmacol. Res. 37: 485–491. https://doi.org/10.1006/phrs.1998.0318
Lenina O., Petrov K., Kovyazina I., Malomouzh A. (2019) Enhancement of mouse diaphragm contractility in the presence of antagonists of GABAA and GABAB receptors. Exp. Physiol. 104: 1004–1010. https://doi.org/10.1113/EP087611
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


