Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 584-604
Искусственный пептидный лиганд калиевого канала KV1.1 с высокой селективностью
В. М. Табакмахер 1, 2, А. И. Кузьменков 1, А. М. Гиголаев 1, Э. Л. Пиньейро-Жуниор 3, С. Пеньёр 3, Р. Г. Ефремов 1, 4, 5, Я. Титгат 3, А. А. Василевский 1, 5, *
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
2 Школа биомедицины, Дальневосточный федеральный университет
Владивосток, Россия
3 Лёвенский университет
Лёвен, Бельгия
4 Национальный исследовательский университет Высшая школа экономики
Москва, Россия
5 Московский физико-технический институт (государственный университет)
Долгопрудный, Россия
* E-mail: avas@ibch.ru
Поступила в редакцию 27.11.2020
После доработки 07.12.2020
Принята к публикации 13.02.2021
Аннотация
У млекопитающих обнаружено порядка 40 изоформ потенциал-чувствительных калиевых каналов (KV). Для изучения такого разнообразия KV необходимы вещества, которые способны селективно с ними связываться и изменять их свойства. Ранее мы сообщали о выделении и фармакологической характеристике MeKTx13-3 – пептидного токсина из яда скорпиона Mesobuthus eupeus. Этот токсин обладал высокой аффинностью к ряду KV с незначительной селективностью в отношении изоформы KV1.1. В настоящей работе мы докладываем о получении методом рационального дизайна искусственного производного MeKTx13-3, названного MeKTx13-3_RMRH. Селективность MeKTx13-3_RMRH по отношению к KV1.1 была увеличена на порядок, что делает его одним из самых специфичных лигандов данной изоформы KV. Наконец, используя компьютерное моделирование, мы продемонстрировали, что избирательность нового лиганда KV1.1 может реализовываться за счет специфического положения токсина в комплексе с каналом.
ВВЕДЕНИЕ
Потенциал-чувствительные калиевые каналы (KV) – трансмембранные (ТМ) белки, обеспечивающие пассивный селективный ток ионов калия через мембрану в ответ на изменение мембранного потенциала [1]. Зрелый ионный канал представляет собой тетрамер α-субъединиц, каждая из которых сформирована шестью ТМ сегментами (S1–S6) с одним поровым участком (P) между S5 и S6 [2]. Поровый домен канала образуется сближенными S5 и S6 всех четырех α-субъединиц. Кроме того, в составе KV могут быть вспомогательные β-субъединицы, которые способны модифицировать свойства канала [3]. Отличительной особенностью KV является наличие потенциал-чувствительных доменов, образованных четырьмя ТМ сегментами (S1–S4) каждой из α-субъединиц [4, 5]. Согласно последнему руководству Международного союза фундаментальной и клинической фармакологии (IUPHAR), у человека известно порядка 40 генов α-субъединиц KV, которые называют изоформами [6]. В зависимости от локализации, а также выполняемых функций, KV могут быть сформированы одинаковыми или разными α-субъединицами, то есть представлять собой гомо- или гетеромеры [7, 8].
Изучение структурных особенностей, физиологических и фармакологических характеристик KV тесно сопряжено с применением их лигандов [9–11], которые можно разделить на несколько групп. Перечислим основные: (а) ионы металлов, например Cs+ и Ba2+ [12, 13]; (б) небольшие органические молекулы, такие как 4-аминопиридин и тетраэтиламмоний [14]; и (в) полипептидные токсины, например, харибдотоксин (ChTx) и дендротоксин [15]. Пожалуй, самым богатым источником лигандов KV выступают яды различных животных, таких как змеи, морские анемоны, улитки конусы, пауки и скорпионы [16]. Токсины скорпионов, несомненно, сыграли ключевую роль в изучении KV: от пионерских работ по ингибированию калиевого тока в гигантском аксоне кальмара с помощью ноксиустоксина из яда скорпиона Centruroides noxius [17, 18] до получения кристаллической структуры комплекса KV c ChTx из яда скорпиона Leiurus quinquestriatus hebraeus [19, 20]. В настоящий момент, согласно базе данных Kalium (https://kaliumdb.org/), известно и охарактеризовано приблизительно 350 полипептидных лигандов калиевых каналов, более половины (~200) из которых – это токсины, выделенные из яда скорпионов [21, 22].
Большинство токсинов скорпионов, действующих на KV, состоят из 30–50 аминокислотных остатков, 6 или 8 из которых – остатки цистеина, образующие 3 или 4 внутримолекулярные дисульфидные связи соответственно [16, 23]. При этом в пространстве формируется характерная укладка, получившая название CSα/β (цистеин-стабилизированные α-спираль и β-слой) [24, 25]. Несмотря на общность пространственной структуры, токсины могут проявлять различные фармакологические характеристики, избирательно действуя на ту или иную изоформу KV. Считается, что селективность определяется конкретными аминокислотными остатками токсина, которые формируют специфические контакты с поровым доменом канала [26–28]. В свою очередь, эти особенности могут быть использованы для рационального дизайна искусственных производных с заданными свойствами на базе общего молекулярного каркаса [29–31].
Ранее мы сообщали об идентификации и характеристике токсина MeKTx13-3 (Kalium ID: α-KTx 3.19, UniProt ID: C0HJQ6, 37 аминокислотных остатков, три дисульфидные связи) из яда среднеазиатского скорпиона Mesobuthus eupeus [32]. Мы провели фармакологическую характеристику этого полипептида и с помощью электрофизиологических методов установили, что он способен ингибировать калиевый ток через некоторые гомотетрамерные KV, а именно: KV1.1, 1.2, 1.3 и 1.6 c концентрациями полуингибирования (IC50) ~ 2, 100, 10 и 60 нМ соответственно. У этого токсина была обнаружена селективность действия в отношении KV1.1, а не KV1.2 или 1.3, что является достаточно редким свойством полипептидных лигандов KV [23]. Теперь мы докладываем, что внесение ряда замен в аминокислотную последовательность MeKTx13-3 позволило нам получить более селективный по отношению к KV1.1 пептид – MeKTx13-3_RMRH. С помощью методов молекулярного моделирования структуры и динамики комплексов этого производного MeKTx13-3 с гомотетрамерами KV1.1–1.3 мы установили, что избирательность его действия может реализовываться за счет специфического положения токсина в комплексе с каналом.
МЕТОДЫ ИССЛЕДОВАНИЯ
Заявление об этике. Наше исследование строго соответствовало Международным методическим рекомендациям по биомедицинским исследованиям с использованием животных Всемирной организации здравоохранения. Исследование проводилось в организации, аккредитованной AAALAC, в соответствии со стандартами Руководства по уходу и использованию лабораторных животных (8-е издание, Институт лабораторных исследований животных). Лягушки Xenopus laevis использовались в лаборатории токсикологии и фармакологии в соответствии с лицензией LA1210239, что было одобрено этическим комитетом по экспериментам на животных Лёвенского университета (P186/2019). Уход за животными и экспериментальные процедуры проводились в соответствии с методическими рекомендациями Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях (Страсбург, 18.III.1986).
Получение рекомбинантных пептидов. Рекомбинантный MeKTx13-3_RMRH был получен по общей схеме, использованной нами ранее [31]. Целевой пептид получали в бактериальной системе экспрессии в виде слитного белка с тиоредоксином (Trx) [33], который расщепляли рекомбинантной легкой цепью энтеропептидазы человека [34]. Последовательность ДНК, кодирующая MeKTx13-3_RMRH, была сконструирована из частично комплементарных синтетических олигонуклеотидов с помощью ПЦР за два этапа. Сначала в течение пяти циклов использовали четыре олигонуклеотида (F1, F2, R1 и R2, см. табл. 1) для сборки полной последовательности гена. Затем с использованием краевых олигонуклеотидов (F1 и R1) и разбавленной реакционной смеси из первого раунда в качестве матрицы во втором раунде ПЦР был амплифицирован целевой фрагмент ДНК.
Полученный в результате ПЦР фрагмент клонировали в экспрессионный вектор pET-32b (Novagen) по сайтам рестрикции KpnI и BamHI. Штамм Escherichia coli SHuffle T7 Express (New England Biolabs) трансформировали вектором со вставкой целевого гена и культивировали при 30°C в среде LB до OD600 ~ 0.6. Экспрессию трансгена индуцировали добавлением 0.2 мМ изопропил-β-D-1-тиогалактопиранозида. Культуру культивировали при комнатной температуре (24°C) в течение ночи (16 ч), после чего клеточную массу осаждали центрифугированием. Осадок клеток ресуспендировали в буферном растворе, содержащем 300 мМ NaCl и 50 мМ Трис-HCl (pH 8.0), и обрабатывали ультразвуком. Лизат наносили на металл-хелатную колонку HisPur (ThermoFisher Scientific); слитный белок с Trx очищали в соответствии с протоколом производителя.
Очищенный слитный белок растворяли в 50 мМ Трис-HCl (pH 8.0) в концентрации 1 мг/мл и гидролизовали в течение ночи (16 ч) при 37°C легкой цепью энтеропептидазы человека (1 ед. фермента на 1 мг субстрата). MeKTx13-3_RMRH очищали обращенно-фазовой (ОФ) ВЭЖХ в линейном градиенте концентрации ацетонитрила (0–60% за 60 мин) в присутствии 0.1%-ной трифторуксусной кислоты на колонке Jupiter C5 (4.6 × 250 мм; Phenomenex). Чистоту целевого пептида проверяли с использованием масс-спектрометрии и аналитической хроматографии на колонке Vydac C18 (4.6 × 250 мм; Separations Group) в том же градиенте ацетонитрила.
Масс-спектрометрия. Измерение молекулярной массы пептида проводили с использованием МАЛДИ масс-спектрометрии с времяпролетным масс-анализатором на приборе Ultraflex TOF-TOF (Bruker Daltonik), как описано ранее [35]. В качестве матрицы была использована 2,5-дигидроксибензойная кислота (Sigma-Aldrich). Измерения проводили как в линейном, так и в рефлекторном режимах. Масс-спектры анализировали с помощью программного обеспечения Data Analysis 4.3 и Data Analysis Viewer 4.3 (Bruker).
Экспрессия ионных каналов. Подробно общий подход к экспрессии ионных каналов в ооцитах был описан ранее [36]. Для экспрессии генов KV (крысы (r)KV1.1, rKV1.2, человека (h)KV1.3, rKV1.4, rKV1.5 и rKV1.6) в ооцитах X. laevis линеаризованные плазмиды, содержащие соответствующие нуклеотидные последовательности генов, были транскрибированы с использованием набора T7 mMESSAGE-mMACHINE (Ambion). 50 нл раствора кРНК (1 нг/нл) вводили в ооциты с помощью микроинжектора (Drummond Scientific). Ооциты инкубировали в растворе ND96, содержащем: (мМ) 96 NaCl, 2 KCl, 1.8 CaCl2, 2 MgCl2 и 5 HEPES, pH 7.4, с добавлением сульфата гентамицина (50 мг/л).
Электрофизиологические исследования. Измерения токов через мембрану ооцитов проводились методом двухэлектродной фиксации потенциала при комнатной температуре (18–22°C) с использованием усилителя Geneclamp 500 (Molecular Devices) под управлением системы сбора данных pClamp (Axon Instruments), как описано ранее [36]. В качестве омывающего раствора использовали ND96, потенциал покоя выставляли равным –90 мВ. Токи, опосредованные KV, индуцировали деполяризацией до 0 мВ в течение 250 мс, после чего потенциал удерживали при –50 мВ в течение 250 мс. Для исследования вольтамперной характеристики токи вызывали последовательной деполяризацией мембраны с шагом в 10 мВ. Для оценки концентрационной зависимости эффектов были построены кривые доза–эффект, где процент ингибирования тока выражен как функция концентрации токсина. Кривые были построены по уравнению Хилла:
Молекулярное моделирование. Структурная модель MeKTx13-3_RMRH была построена в программе PyMOL Molecular Graphics System, версия 1.8 (Schrödinger, LLC), с использованием процедуры in silico мутагенеза. Поскольку аминокислотная последовательность MeKTx13-3 идентична BmKTX [37], пространственная структура последнего (PDB ID: 1BKT) [38] была использована в качестве шаблона. Модели KV1.1 и 1.3 были сгенерированы ранее [31, 39–41] в программе MODELLER [42] с использованием структуры KV1.2 (3LUT) [43] в качестве шаблона.
Комплексы MeKTx13-3_RMRH с калиевыми каналами моделировали согласно процедуре, описанной в предыдущих работах [31, 39–41], предполагая, что токсин взаимодействует с KV аналогично ChTx [44]. Модель комплекса MeKTx13-3_RMRH с KV1.2 была построена на основе структуры комплекса KV1.2/2.1–ChTx (4JTA) [20]: пептид пространственно выравнивали со структурой ChTx в комплексе с каналом, затем удаляли ChTx, оставляя выровненный токсин. Комплексы с KV1.1 и 1.3 были созданы аналогичным образом, однако первым шагом было пространственное выравнивание моделей каналов с химерой KV1.2/2.1 [31, 39–41].
Молекулярная динамика. Подготовку исследуемых молекулярных систем к моделированию молекулярной динамики (МД) проводили автоматически, с использованием оригинального программного пакета IMPULSE (Крылов и др., готовится к печати). Процедура включала несколько этапов. Полученные комплексы MeKTx13-3_RMRH с KV помещали внутрь липидного бислоя, имитирующего мембрану нейронов. Был использован предварительно уравновешенный фрагмент бислоя (7.0 × 7.0 × 13.5 нм3; 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолин/1-пальмитоил-2-олеил-sn-глицеро-3-фосфоэтаноламин/холестерин, POPC : POPE : Chl; 100 : 50 : 50 молекул соответственно, сольватированных 14172 молекулами воды), что подробно описано в предыдущих работах [41, 45, 46]; некоторые молекулы фосфолипидов и холестерина были удалены, чтобы освободить место для белка. Для сольватации использовали модель воды TIP3P [47] и ионы Na+/Cl– в количестве, необходимом для поддержания электронейтральности системы.
Все системы были уравновешены (нагреты до 37°C) в течение 100 пс моделирования МД. Положения Cα-атомов остатков канала, не формирующих вестибюль его поры, а также Nε-атом остатка Lys26 у MeKTx13-3_RMRH фиксировали во время уравновешивания для предотвращения дестабилизации исходного комплекса. Затем рассчитывали МД систем длительностью 500 нс. Все молекулярно-динамические эксперименты были выполнены с помощью программного обеспечения GROMACS [48] (версия 2018) с использованием набора параметров AMBER99SB-ILDN [49]. Моделирование проводили с шагом по времени 2 фс с использованием трехмерных периодических граничных условий, в изотермическом-изобарическом (NPT) ансамбле с полуизотропным давлением 1 бар и при температуре 37°C. Использовали алгоритмы баростата Берендсена [50] и термостата V-rescale [51]. Ван-дер-ваальсовы взаимодействия рассчитывали с применением сферической функции обрезания потенциала с отсечкой 1.4 нм. Электростатические взаимодействия учитывали с помощью алгоритма PME. Во время моделирования положение Nε-атома остатка Lys26 токсина в каждом комплексе фиксировали внутри поры канала.
Анализ межмолекулярных контактов и оценку вкладов аминокислотных остатков в энергию межмолекулярного взаимодействия в ходе МД выполняли с использованием программного пакета IMPULSE (Крылов и др., готовится к печати) аналогично процедурам, подробно описанным в предыдущих исследованиях [31, 41]. Водородные связи оценивали с использованием параметров утилиты hbond пакета GROMACS [48] (расстояние D–A ≤ 0.35 нм и угол D–H–A ≥ 150° для водородной связи D–H···A, где D и A – донор и акцептор водородной связи соответственно); солевые мостики, π-катионные и стэкинг-взаимодействия, а также гидрофобные контакты рассчитывали, как описано ранее [52, 53]. Оценку энергии межмолекулярных невалентных взаимодействий осуществляли с использованием силового поля AMBER99SB-ILDN [49] с отсечкой по расстоянию 1.4 нм. Для визуализации молекул использовали программу PyMOL. Графики профилей энергии взаимодействия строили с помощью стандартных библиотек Python и пакета NumPy.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Стратегия создания нового лиганда KV. Благодаря ряду предыдущих исследований были выявлены ключевые аминокислотные остатки токсинов семейства α-KTx 3, обусловливающие высокое сродство к изоформе KV1.3. Так, мутагенез BmKTX, имеющего ту же аминокислотную последовательность, что и MeKTx13-3, показал, что замена Asp33His в несколько раз усиливает его активность в отношении KV1.3 [54]. Другой мутантный вариант BmKTX, названный ADWX-1 и содержащий остатки Arg11 и His33, блокирует KV в субнаномолярных концентрациях [29], тогда как замена этих остатков (Arg11Ala или His33Ala) приводит к значительному снижению активности. Кроме того, AgTx-2 [30, 55], OSK-1 [56] и некоторые другие токсины, которые имеют остатки Arg12, Met29, Arg31 и His34 (соответствуют Arg11, Met28, Arg30 и His33 в токсинах α-KTx 3, лишенных N-концевого остатка глицина), также были описаны как высокоэффективные блокаторы KV1.3 (табл. 2). Мы решили внести соответствующие четыре замены в структуру MeKTx13-3 (Gly11Arg, Ile28Met, Gly30Arg и Asp33His), ожидая получить при этом новый высокоселективный блокатор KV1.3. Неожиданно полученный пептид MeKTx13-3_RMRH продемонстрировал высокое сродство к KV1.1, в то время как его активность в отношении KV1.3 не изменилась.
Таблица 2.
Аминокислотные последовательности токсинов семейства α-KTx 3, их мутантов и синтетических аналогов с активностью, изученной на KV
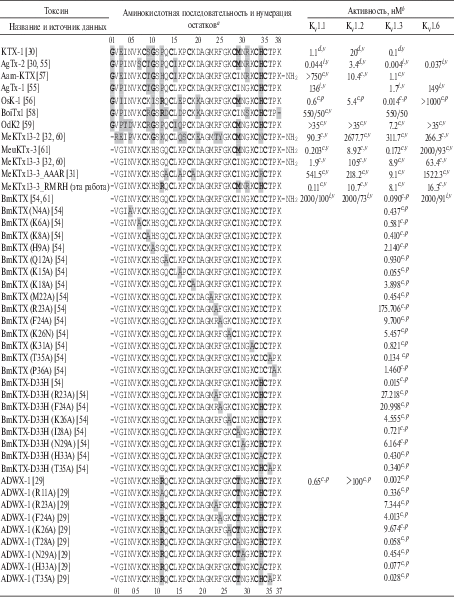
a – нумерация остатков для пептидов с N-концевым остатком глицина показана над последовательностями, нумерация для остальных пептидов показана под последовательностями; –NH2 указывает на C-концевое амидирование природного токсина. Консервативные остатки цистеина показаны жирным шрифтом; остатки, которые отличают пептиды от MeKTx13-3, показаны на сером фоне; наиболее частые замены выделены жирным шрифтом на сером фоне. b – значения показаны в следующих форматах: X – значение Kd, Ki или IC50 в нМ; >X – токсин не действовал до значения X; X/Y – означает, что токсин в концентрации X снижает ионный ток через канал на Y процентов. Тип данных: c – полумаксимальная ингибирующая концентрация (IC50); d – константа диссоциации (Kd); i – константа ингибирования (Ki). Примененные экспериментальные методы: v – электрофизиология с использованием метода двухэлектродной фиксации потенциала; р – электрофизиология с использованием техники локальной фиксации потенциала. Данные об аминокислотных последовательностях, N-концевом амидировании и активности токсинов получены с использованием базы данных Kalium [22].
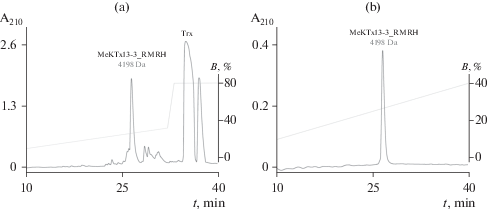
Получение рекомбинантного токсина. Рекомбинантный MeKTx13-3_RMRH получали в штамме E. coli SHuffle B по нашему стандартному протоколу. Кодирующую токсин последовательность ДНК клонировали в экспрессионный вектор pET-32b по сайтам рестрикции KpnI и BamHI. Trx был использован в качестве белка-помощника для обеспечения правильного расположения дисульфидных связей. После гидролиза слитного белка целевой пептид был очищен с помощью ОФ-ВЭЖХ (рис. 1) и идентифицирован с использованием МАЛДИ масс-спектрометрии и сравнения расчетной и экспериментально установленной молекулярной массы. Конечный выход пептида составил ~3.5 мг с одного литра бактериальной культуры.
Рис. 1.
Получение MeKTx13-3_RMRH. (a) – ОФ-ВЭЖХ: выделение рекомбинантного MeKTx13-3_RMRH из гидролизата слитного белка, расщепленного легкой цепью энтерокиназы человека. (b) – очистка целевого пептида с помощью ОФ-ВЭЖХ.
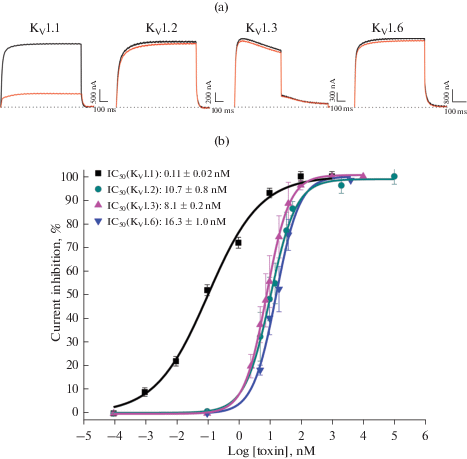
Электрофизиологическое исследование MeKTx13-3_RMRH. Характеристика фармакологической активности MeKTx13-3_RMRH проводилась посредством электрофизиологического исследования на ряде изоформ KV методом двухэлектродной фиксации потенциала. На рис. 2 приведены записи токов через гомотетрамерные калиевые каналы различных изоформ (KV1.1–1.3) до и после добавления токсина в концентрации 1 нМ. Хорошо видно, что MeKTx13-3_RMRH проявляет высокую селективность в отношении KV1.1. В бóльших концентрациях он также ингибировал изоформы KV1.2, 1.3 и 1.6, в то время как на KV1.4 и 1.5 эффект отсутствовал вплоть до концентрации 1 мкМ (данные не показаны). Для всех изоформ KV, на которых наблюдался эффект, были построены кривые концентрационной зависимости ингибирования (рис. 2, снизу) и рассчитаны значения IC50, составившие 0.11 ± 0.02, 10.7 ± 0.8, 8.1 ± 0.2 и 16.3 ± 1.0 нМ для KV1.1, 1.2, 1.3 и 1.6 соответственно.
Рис. 2.
Фармакологическая характеристика MeKTx13-3_RMRH. (a) – записи тока через мембрану ооцитов X. laevis, опосредованного каналами KV, в контроле (черные кривые) и после добавления 1 нМ пептида (красные кривые). (b) – зависимость уровня ингибирования каналов KV1.1–1.3 и 1.6 от концентрации токсина по результатам электрофизиологических экспериментов.
Молекулярное моделирование. В нашем недавнем исследовании, посвященном молекулярному дизайну селективного блокатора KV1.3, были проанализированы структурные и динамические детали взаимодействия MeKTx13-3 с KV [31]. В текущей работе мы выполнили компьютерное исследование комплексов мутированного варианта этого пептида, названного MeKTx13-3_RMRH, с калиевыми каналами, для выяснения причин неожиданной специфичности к KV1.1. Мы построили модели пространственной структуры комплексов MeKTx13-3_RMRH с KV1.1–1.3, рассчитали траектории МД комплексов, встроенных в липидный бислой, проанализировали межмолекулярные контакты и вклады остатков в энергию взаимодействия канал–токсин, а также сравнили результаты с данными для MeKTx13-3 (см. рис. 3, 4b–d, 5, табл. 3).
Рис. 3.
Профили энергии взаимодействия пептидных токсинов в комплексах с KV1.1–1.3. (a) – профиль MeKTx13-3; (b) – MeKTx13-3_RMRH. Гистограммы показывают вклады остатков в энергию взаимодействия, усредненные по траектории МД. Планки погрешностей отражают стандартные отклонения. Аминокислотные последовательности показаны над номерами остатков; замены в MeKTx13-3_RMRH показаны красным шрифтом. Данные для MeKTx13-3 были описаны в предыдущем исследовании [31].
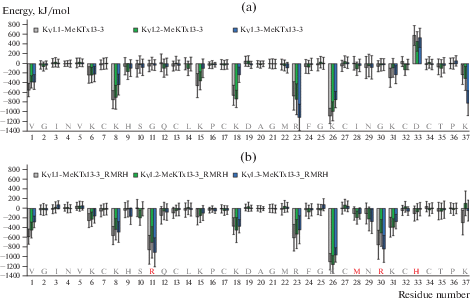
Рис. 4.
Модель структуры MeKTx13-3_RMRH в комплексе с KV1.1. (a) – выравнивание аминокислотных последовательностей внеклеточных участков поры каналов KV1.1–1.3. Индексы “h” и “r” перед названиями каналов указывают на организм – источник (человек и крыса соответственно). Нумерация остатков указана над каждой последовательностью; отличающиеся остатки показаны на сером фоне. (b) – общая структура комплекса KV1.1–MeKTx13-3_RMRH в гидратированном липидном бислое после 500 нс МД. Субъединицы KV1.1 показаны в виде ленточной модели (серым, коричневым, голубым и синим); спирали порового домена субъединицы канала на переднем плане и потенциал-чувствительный домен соседней субъединицы, а также длинные внеклеточные петли не показаны для ясности визуального восприятия. Липиды показаны в виде полупрозрачных шаровых моделей; цвета атомов: кислород – красный; фосфор – оранжевый; азот – синий; водород амино- и гидроксигруппы – белый; углерод POPC – светло-желтый; углерод POPE – желтый; углерод холестерина – бежевый. Некоторые липиды не показаны для ясности визуального восприятия. MeKTx13-3_RMRH показан розовым цветом; остаток Lys26 (закупоривает пору канала) показан в виде стержневой модели. (c, d) – крупный план (вид слева и справа соответственно) вестибюля поры канала, показанной на панели b. Канал показан в полупрозрачном виде. Липиды не показаны. Боковые цепи Lys26 и других остатков, участвующих в межмолекулярных контактах, показаны в виде стержневых моделей; для остатков Pro36, Lys37 и Gly376 показаны некоторые атомы основной цепи. Полярные контакты (водородные связи и солевые мостики) показаны зелеными пунктирными линиями. В момент, показанный на панели d, His9 не образует контакт с Glu353.

Рис. 5.
(a, b) – изменение расстояния между фрагментами канала и токсинов в течение МД: (a) – между фрагментом Phe356–Asp361 KV1.1 и остатком Gly30/Arg30 у MeKTx13-3/MeKTx13-3_RMRH, (b) – между фрагментом Glu353–His355 KV1.1 и остатком Lys31 токсинов. Расстояние рассчитано между геометрическими центрами полипептидных фрагментов канала и атомами основной цепи соответствующих остатков токсинов. (c, d) – среднеквадратичное отклонение (RMSD) положения фрагментов Kv1.1 в комплексе с MeKTx13-3/MeKTx13-3_RMRH в течение МД: (c) – RMSD фрагмента Phe356–Asp361 KV1.1, (d) – фрагмента Glu353–His355.
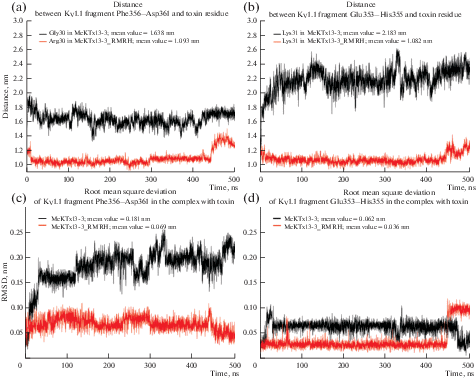
Таблица 3.
Межмолекулярные контакты, наблюдаемые в комплексах MeKTx13-3 и MeKTx13-3_RMRH с KV на протяжении траектории МД
| Контакты a | Число контактов в комплексах | |||||
|---|---|---|---|---|---|---|
| KV1.1 | KV1.2 | KV1.3 | ||||
| MeKTx13-3 | MeKTx13-3_RMRH | MeKTx13-3 | MeKTx13-3_RMRH | MeKTx13-3 | MeKTx13-3_RMRH | |
| Все специфические взаимодействия b | ||||||
| Долгоживущие | 7 | 17 | 9 | 9 | 15 | 17 |
| Среднеживущие | 21 | 23 | 10 | 17 | 11 | 4 |
| Короткоживущие | 4 | 5 | 3 | 3 | 4 | 2 |
| Общее число | 32 | 45 (10) c | 22 | 29 (8) | 30 | 23 (3) |
| Водородные связи | ||||||
| Долгоживущие | 5 | 8 | 8 | 7 | 8 | 10 |
| Среднеживущие | 10 | 14 | 8 | 14 | 7 | 3 |
| Короткоживущие | 2 | 3 | 3 | 2 | 3 | 2 |
| Общее число | 17 | 25 (7) | 19 | 23 (8) | 18 | 15 (3) |
| Солевые мостики | ||||||
| Долгоживущие | 1 | 5 | 1 | 2 | 4 | 5 |
| Среднеживущие | 3 | 2 | 2 | 2 | 2 | – |
| Короткоживущие | – | – | – | 1 | 1 | – |
| Общее число | 4 | 7 (1) | 3 | 5 (0) | 7 | 5 (0) |
| Стэкинг/π-π-взаимодействия | ||||||
| Долгоживущие | – | 2 | – | – | 2 | – |
| Среднеживущие | 3 | 2 | – | – | 1 | 1 |
| Короткоживущие | 1 | 1 | – | – | – | – |
| Общее число | 4 | 5 (1) | – | – | 3 | 1 (0) |
| π-катионные взаимодействия | ||||||
| Долгоживущие | 1 | 2 | – | – | 1 | 2 |
| Среднеживущие | 5 | 5 | – | 1 | 1 | – |
| Короткоживущие | 1 | 1 | – | – | – | – |
| Общее число | 7 | 8 (1) | – | 1 (0) | 2 | 2 (0) |
| Все неспецифические (гидрофобные) взаимодействия | ||||||
| Долгоживущие | 154 | 188 | 162 | 169 | 149 | 168 |
| Среднеживущие | 92 | 86 | 68 | 113 | 94 | 66 |
| Короткоживущие | 18 | 10 | 9 | 25 | 20 | 11 |
| Общее число | 264 | 284 | 239 | 307 | 263 | 245 |
| Гидрофобные взаимодействия Ile28/Met28 | ||||||
| Долгоживущие | 19 | 13 | 10 | 14 | 12 | 13 |
| Среднеживущие | 1 | 5 | 5 | 5 | 7 | 2 |
| Короткоживущие | – | – | – | – | 1 | 1 |
| Общее число | 20 | 18 (9) | 15 | 19 (14) | 20 | 16 (13) |
a – время жизни каждого контакта, учитываемое как часть времени траектории МД (всего 300 нс, начиная с 200 нс: первые 200 нс не учитывали для получения репрезентативных данных). Короткоживущие контакты: время жизни более 7%, но менее 10%; среднеживущие контакты: время жизни менее 50%; долгоживущие контакты: время жизни более 50%. b – водородные связи, солевые мостики, стэкинг/π-π-взаимодействия и π-катионные взаимодействия. с – число идентичных контактов в комплексах с MeKTx13-3_RMRH и MeKTx13-3 указано в скобках.
Согласно результатам компьютерного исследования, замена Ile28Met не приводит к заметному изменению межмолекулярных контактов или энергии межмолекулярных взаимодействий (рис. 3). Число и качество межмолекулярных контактов, образованных остатком 28 в комплексах MeKTx13-3 и MeKTx13-3_RMRH, различаются незначительно (табл. 3). Это наблюдение хорошо согласуется с экспериментальными данными, демонстрирующими, что мутация Ile28Met не приводит к функциональным изменениям токсина при переходе от BmKTx к MeuKTx-3 (табл. 2) [61].
Как было отмечено в нашей предыдущей работе [31], остаток Asp33 у MeKTx13-3 вносит значительный положительный вклад в энергию взаимодействия (снижает аффинность) (рис. 3) из-за электростатического отталкивания от консервативного отрицательно заряженного остатка в вестибюле канала (Asp377/375/399 у KV1.1/1.2/1.3, см. рис. 4a). Неудивительно, что замена Asp33His в MeKTx13-3_RMRH нивелирует неблагоприятный энергетический вклад. Кроме того, His33 образует водородную связь в комплексе с KV1.1 (His33-Gly376, см. рис. 4c). Таким образом, преимущества замены Asp33His для стабилизации комплекса MeKTx13-3_RMRH–KV1.1 не подлежат сомнению. Однако маловероятно, что этот остаток является существенным для увеличения специфичности к KV1.1, наблюдаемом при переходе от MeKTx13-3 к MeKTx13-3_RMRH, поскольку (а) His9 образует две водородные связи с KV1.2, что может вносить вклад в увеличение сродства к этому каналу (табл. 2); (б) замена Asp33Arg в MeKTx13-3_AAAR [31] (привносит благоприятный вклад в энергию взаимодействия и обеспечивает множество возможностей для образования полярных контактов) не предотвратила уменьшение сродства к KV1.1, вызванное другими заменами.
Другие замененные остатки у MeKTx13-3_RMRH, Arg11 и Arg30, вносят значительный благоприятный вклад в энергию взаимодействия (рис. 3). Более того, эти модификации приводят к образованию двенадцати (четверть от общего числа) межмолекулярных контактов (табл. 3): трех водородных связей и трех солевых мостиков (Arg11–Asp361, Arg11–Asp377, Arg30–Asp361, см. рис. 4c, d), а также трех π-π- и трех π-катионных взаимодействий (Arg11–His355, Arg11–Phe356, Arg30–Phe356) в комплексе с KV1.1. Стоит отметить, что аналогичные контакты невозможны в комплексах MeKTx13-3 с KV, поскольку остатки Gly11 и Gly30 не имеют боковых цепей.
Тем не менее, контакты, образованные Arg11 и Arg30, сами по себе не объясняют высокую специфичность MeKTx13-3_RMRH к KV1.1. Эти замены не вызывают столь значительного увеличения сродства к KV1.2 и 1.3, хотя они также участвуют во множестве взаимодействий с этими двумя каналами. Очевидно, что контакты Arg11 и Arg30 способствуют оптимальному положению токсина и ориентации участков канала для возникновения других взаимодействий в комплексе с KV1.1, что в конечном итоге и обусловливает специфичность пептида. В частности, контакты Arg30–Asp361 и Arg30–Phe356 фиксируют участок канального белка между остатками Phe356 и Asp361 рядом с токсином в комплексе MeKTx13-3_RMRH–KV1.1. Такая фиксация может ограничивать подвижность соседнего фрагмента канала между остатками Glu353 и His355, обеспечивая оптимальное положение Glu353 для образования водородной связи и солевого мостика с остатком пептида Lys31 (рис. 4, 5). Аналогичные контакты не реализуются в комплексах с KV1.2/1.3, поскольку боковые цепи соответствующих остатков Asp351/Thr375 не могут достичь ε-аминогруппы Lys31.
Контакт Pro36–Tyr379 также возникает благодаря особому положению токсина в комплексе с KV1.1. Основная цепь Pro36 у MeKTx13-3_RMRH образует водородную связь с боковой цепью KV1.1-специфичного остатка Tyr379 (рис. 4c), чего не происходит в комплексе MeKTx13-3–KV1.1. Аналогичные контакты не наблюдаются в комплексах с другими каналами: боковая цепь Val377 у KV1.2 слишком коротка и не имеет соответствующей функциональной группы, а боковая цепь His401 у KV1.3 не может достичь основной цепи Pro36.
Очевидно, что формирование двух водородных связей и двух солевых мостиков Lys37–Asp361 и Lys37–Asp377, а также “среднеживущих” водородных связей His9–Glu353 и Gln12–Glu353 (рис. 4d) также становится возможными в комплексе MeKTx13-3_RMRH–KV1.1 в результате особого пространственного расположения токсина относительно канального белка. Следует отметить, что аналогичные контакты, образованные Lys37, наблюдаются в комплексе MeKTx13-3 с KV1.3 (Lys37–Asp383, Lys37–Asp399), и такие же контакты, образованные His9 и Gln12, обнаружены в комплексе MeKTx13-3 с KV1.2 (His9–Asp351, Gln12–Asp351) [31], но не в комплексах MeKTx13-3_RMRH с любым из этих двух каналов. Потеря этих контактов также может быть объяснена несколько различающимся положением токсина дикого типа и его мутанта в комплексах с KV1.2 и 1.3.
Особое расположение MeKTx13-3_RMRH, стабилизируемое взаимодействиями Arg11 и Arg30 в исследуемых комплексах, приводит не только к исчезновению некоторых контактов, наблюдаемых в комплексах токсина дикого типа, но и появлению новых взаимодействий. Так, в комплексах MeKTx13-3_RMRH с KV1.1, 1.2 и 1.3 наблюдаются 45, 29 и 23 специфичных контакта соответственно, и лишь 10, 8 и 3 из них идентичны для MeKTx13-3 и MeKTx13-3_RMRH. По-видимому, при переходе от MeKTx13-3 к MeKTx13-3_RMRH увеличение числа контактов приводит к увеличению сродства к KV1.1 и 1.2 (поскольку мутант образует больше контактов в этих двух комплексах), но не влияет на сродство к KV1.3. (табл. 2, 3).
Согласно результатам компьютерного анализа межмолекулярных контактов, MeKTx13-3_RMRH образует 23 специфических и 245 гидрофобных контактов с KV1.3, а MeKTx13-3 – 30 и 263 соответственно. Однако число долгоживущих водородных связей и солевых мостиков в комплексе с MeKTx13-3_RMRH (10 и 5 соответственно) больше, чем в комплексе с токсином дикого типа (8 и 4). Предположительно, сходная активность токсинов в отношении KV1.3 связана с перераспределением количества и качества контактов (табл. 3).
Обобщая результаты вычислительного анализа, можно сделать вывод, что Arg11 и Arg30 играют существенную роль в селективном связывании MeKTx13-3_RMRH с KV1.1. В комплексах с KV эти остатки стабилизируют специфическое положение токсина относительно канального белка за счет большого количества межмолекулярных взаимодействий. Особое расположение токсина обеспечивает формирование дополнительных контактов (остатками Lys31, Pro36, Lys37, а также His9 и Gln12) в комплексе с KV1.1, что, как мы полагаем, лежит в основе высокого сродства к этой изоформе.
Селективные лиганды KV1.1 редко встречаются среди токсинов животных. В результате анализа имеющихся данных об известных лигандах калиевых каналов, проведенного с использованием базы данных Kalium [22], было установлено, что лишь небольшое число природных полипептидных токсинов обладает селективностью к KV1.1. Среди них всего три токсина скорпионов: хонготоксин-1 (HgTX1; α‑KTx 2.5, P59847) из яда Centruroides limbatus, MeKTx13-2 (α-KTx 3.18, C0HJQ4) и MeKTx13-3 (α-KTx 3.19, C0HJQ6) из яда M. eupeus [32, 62]. В яде других животных KV1.1-селективные токсины также являются весьма редкими компонентами. Были обнаружены и выделены лишь две такие молекулы: BgK (κ-actitoxin-Bgr1a, P29186) и APEKTx1 (κPI-actitoxin-Ael3a, P86862) из морских анемон Bunodosoma granuliferum и Anthopleura elegantissima соответственно [36, 63]. В настоящее время APEKTx1 является бесспорным лидером среди KV1.1-селективных лигандов, демонстрируя значение IC50 около 1 нМ и не проявляя перекрестной активности на других изоформах KV вплоть до концентрации 1 мкМ [36].
Для количественной оценки специфичности лиганда в отношении различных изоформ ионных каналов, в частности KV1.1, был использован коэффициент селективности: соотношение значений IC50 (или Kd) для двух каналов [40]. Этот параметр наглядно отражает специфичность каждого токсина в отношении KV1.1 (табл. 4). Как и предполагалось, APEKTx1 имеет самый высокий коэффициент селективности (более 1000 для каждой пары калиевых каналов). MeKTx13-2 и MeKTx13-3 – природные токсины из яда скорпиона, демонстрирующие специфичность к KV1.1 по сравнению с KV1.3, но для MeKTx13-3_RMRH этот параметр на порядок выше. Таким образом, в настоящее время MeKTx13-3_RMRH является наиболее селективным лигандом KV1.1, созданным на основе структуры токсина из яда скорпиона (табл. 4).
Таблица 4.
Пептидные токсины с наибольшей селективностью в отношении KV1.1. Для перечисленных токсинов соотношение IC50 (или Kd) показано для указанных пар каналов
Подавляющее большинство полипептидных лигандов могут ингибировать несколько сходных изоформ гомотетрамерных калиевых каналов [16, 64, 65]. Иногда у токсинов наблюдают специфичность в отношении одной или двух определенных изоформ. Например, OSK1 (α-KTx 3.7, P55896) из яда скорпиона Orthochirus scrobiculosus селективен по отношению к KV1.3, тогда как OSK3 (α-KTx 8.8, A0A1L2FZD4) из яда того же скорпиона действует на KV1.2 и 1.3 в сопоставимых концентрациях [39, 56]. Большинство работ по идентификации и дизайну селективных полипептидов, действующих на калиевые каналы, сосредоточено на лигандах KV1.3 [10]. Эта изоформа KV считается одной из важнейших фармакологических мишеней в развитии ряда аутоиммунных заболеваний [66], поэтому селективные пептидные ингибиторы, например moka1 [30], ShK-186 [67] и HsTX1 [R14A] [68], рассматриваются в качестве потенциальных терапевтических средств [69]. Ряд пептидов, таких как конотоксин κM-RIIIJ (κ-conotoxin RIIIJ, P0CG45) [70] и актинотоксин BcsTx1 (κ-actitoxin-Bcs3a, C0HJC2) [71], а также токсины скорпионов MeKTx11-1 (α-KTx 1.16, C0HJQ7) [40] и MMTX (α-KTx 26.4, P0DL65) [72], обладают высокой селективностью в отношении KV1.2. Для родственной изоформы KV1.1 список селективных лигандов намного короче (см. выше).
Существует несколько общих ограничений для исследований, направленных на создание и характеристику новых изоформ-специфичных лигандов, включая производные токсинов. Во-первых, субъединичный состав тетрамеров KV может быть весьма различным, а гетеромерные каналы гораздо чаще экспрессируются in vivo, включая каналы, содержащие комплексы KV1.1 и 1.2 [73]. При этом стехиометрия подобных комплексов пока не установлена и неизвестно, где конкретно в организме происходит их экспрессия. Второе ограничение связано с недостатком фармакологических данных для большого количества известных лигандов. К сожалению, полномасштабные измерения, включая определение IC50 и Kd, к настоящему времени были выполнены для небольшого числа полипептидных токсинов. Наконец, дальнейшая разработка новых лигандов KV в значительной степени связана с исследованиями пространственной структуры комплексов канал–токсин [20], поэтому решение задач этого направления структурной биологии имеет приоритетное значение. Стоит отметить, что KV1.1 и 1.2 считаются одними из наиболее распространенных изоформ KV в центральной нервной системе, где они локализуются преимущественно в аксонах и окончаниях нейронов [7]. Использование селективных лигандов, подобных описанному нами MeKTx13-3_RMRH, позволит разобраться в специфических функциях этих каналов.
Список литературы
Hille B. (2001) Ion channels of excitable membranes, 3rd edn. Sinauer Associates: Sunderland MA, Chicago.
Long S.B., Campbell E.B., MacKinnon R. (2005) Crystal structure of a mammalian voltage-dependent Shaker family K + channel. Science. 309: 897–903. https://doi.org/10.1126/science.1116269
Pongs O., Leicher T., Berger M., Roeper J., Bähring R., Wray D., Giese K.P., Silva A.J., Storm J.F. (1999) Functional and molecular aspects of voltage-gated K+ channel β subunits. Ann. N.Y. Acad. Sci. e868: 344–355. https://doi.org/10.1111/j.1749-6632.1999.tb11296.x
Catterall W.A. (2010) Ion channel voltage sensors: Structure, function, and pathophysiology. Neuron. 67: 915–928. https://doi.org/10.1016/j.neuron.2010.08.021
Sansom M.S.P. (2000) Potassium channels: Watching a voltage-sensor tilt and twist. Curr. Biol. 10: R206–R209. https://doi.org/10.1016/S0960-9822(00)00354-7
Alexander S.P.H., Mathie A., Peters J.A., Veale E.L., Striessnig J., Kelly E., Armstrong J.F., Faccenda E., Harding S.D., Pawson A.J., Sharman J.L., Southan C., Davies J.A., Aldrich R.W., Becirovic E., Biel M., Catterall W.A., Conner A.C., Davies P., Delling M., Virgilio F. Di, Falzoni S., George C., Goldstein S.A.N., Grissmer S., Ha K., Hammelmann V., Hanukoglu I., Jarvis M., Jensen A.A., Kaczmarek L.K., Kellenberger S., Kennedy C., King B., Lynch J.W., Perez-Reyes E., Plant L.D., Rash L.D., Ren D., Sivilotti L.G., Smart T.G., Snutch T.P., Tian J., Van den Eynde C., Vriens J., Wei A.D., Winn B.T., Wulff H., Xu H., Yue L., Zhang X., Zhu M. (2019) The Concise Guide to Pharmacology 2019/20: Ion channels. Br. J. Pharmacol. 176: S142–S228. https://doi.org/10.1111/bph.14749
Vacher H., Mohapatra D.P., Trimmer J.S. (2008) Localization and targeting of voltage-dependent ion channels in mammalian central neurons. Physiol. Rev. 88: 1407–1447. https://doi.org/10.1152/physrev.00002.2008
Manganas L.N., Trimmer J.S. (2000) Subunit composition determines Kv1 potassium channel surface expression. J. Biol. Chem. 275: 29685–29693. https://doi.org/10.1074/jbc.M005010200
Garcia M.L., Galvez A., Garcia-Calvo M., King V.F., Vazquez J., Kaczorowski G.J. (1991) Use of toxins to study potassium channels. J. Bioenerg. Biomembr. 23: 615–646. https://doi.org/10.1007/BF00785814
Wulff H., Castle N.A., Pardo L.A. (2009) Voltage-gated potassium channels as therapeutic targets. Nat. Rev. Drug. Discov. 8: 982–1001. https://doi.org/10.1038/nrd2983
Norton R.S., Chandy K.G. (2017) Venom-derived peptide inhibitors of voltage-gated potassium channels. Neuropharmacology. 127: 124–138. https://doi.org/10.1016/j.neuropharm.2017.07.002
Hagiwara S., Miyazaki S., Rosenthal N.P. (1976) Potassium current and the effect of cesium on this current during anomalous rectification of the egg cell membrane of a starfish. J. Gen. Physiol. 67: 621–638. https://doi.org/10.1085/jgp.67.6.621
Ludwig J., Terlau H., Wunder F., Bruggemann A., Pardo L.A., Marquardt A., Stuhmer W., Pongs O. (1994) Functional expression of a rat homologue of the voltage gated ether a go-go potassium channel reveals differences in selectivity and activation kinetics between the Drosophila channel and its mammalian counterpart. EMBO J. 13: 4451–4458. https://doi.org/10.1002/j.1460-2075.1994.tb06767.x
Robertson D.W., Steinberg M.I. (1990) Potassium channel modulators: Scientific applications and therapeutic promise. J. Med. Chem. 33: 1529–1541. https://doi.org/10.1021/jm00168a001
Moczydlowski E., Lucchesi K., Ravindran A. (1988) An emerging pharmacology of peptide toxins targeted against potassium channels. J. Membr. Biol. 105: 95–111. https://doi.org/10.1007/BF02009164
Kuzmenkov A.I., Grishin E.V., Vassilevski A.A. (2015) Diversity of potassium channel ligands: Focus on scorpion toxins. Biochemistry (Mosc.). 80: 1764–1799. https://doi.org/10.1134/S0006297915130118
Domingos Possani L., Martin B.M., Svendsen I.B. (1982) The primary structure of noxiustoxin: A K+ channel blocking peptide, purified from the venom of the scorpion Centruroides noxius Hoffmann. Carlsberg Res. Commun. 47: 285–289. https://doi.org/10.1007/BF02907789
Carbone E., Wanke E., Prestipino G., Possani L.D., Maelicke A. (1982) Selective blockage of voltage-dependent K+ channels by a novel scorpion toxin. Nature. 296: 90–91. https://doi.org/10.1038/296090a0
Miller C., Moczydlowski E., Latorre R., Phillips M. (1985) Charybdotoxin, a protein inhibitor of single Ca2+-activated K+ channels from mammalian skeletal muscle. Nature. 313: 316–318. https://doi.org/10.1038/313316a0
Banerjee A., Lee A., Campbell E., Mackinnon R. (2013) Structure of a pore-blocking toxin in complex with a eukaryotic voltage-dependent K(+) channel. Elife. 2: e00594. https://doi.org/10.7554/eLife.00594
Kuzmenkov A.I., Krylov N.A., Chugunov A.O., Grishin E.V., Vassilevski A.A. (2016) Kalium: a database of potassium channel toxins from scorpion venom. Database (Oxford). 2016: baw056. https://doi.org/10.1093/database/baw056
Tabakmakher V.M., Krylov N.A., Kuzmenkov A.I., Efremov R.G., Vassilevski A.A. (2019) Kalium 2.0, a comprehensive database of polypeptide ligands of potassium channels. Sci. Data 6: 73. https://doi.org/10.1038/s41597-019-0074-x
Bergeron Z.L., Bingham J.P. (2012) Scorpion toxins specific for potassium (K+) channels: A historical overview of peptide bioengineering. Toxins (Basel). 4: 1082–1119. https://doi.org/10.3390/toxins4111082
Mouhat S., Andreotti N., Jouirou B., Sabatier J.-M. (2008) Animal toxins acting on voltage-gated potassium channels. Curr. Pharm. Des. 14: 2503–2518. https://doi.org/10.2174/138161208785777441
Mouhat S., Jouirou B., Mosbah A., De Waard M., Sabatier J.M. (2004) Diversity of folds in animal toxins acting on ion channels. Biochem. J. 378: 717–726. https://doi.org/10.1042/bj20031860
Jouirou B., Mouhat S., Andreotti N., De Waard M., Sabatier J.M. (2004) Toxin determinants required for interaction with voltage-gated K+ channels. Toxicon. 43: 909–914. https://doi.org/10.1016/j.toxicon.2004.03.024
Giangiacomo K.M., Ceralde Y., Mullmann T.J. (2004) Molecular basis of α-KTx specificity. Toxicon. 43: 877–886. https://doi.org/10.1016/j.toxicon.2003.11.029
Rodríguez De La Vega R.C., Merino E., Becerril B., Possani L.D. (2003) Novel interactions between K+ channels and scorpion toxins. Trends Pharmacol. Sci. 24: 222–227. https://doi.org/10.1016/S0165-6147(03)00080-4
Han S., Yi H., Yin S.J., Chen Z.Y., Liu H., Cao Z.J., Wu Y.L., Li W.X. (2008) Structural basis of a potent peptide inhibitor designed for Kv1.3 channel, a therapeutic target of autoimmune disease. J. Biol. Chem. 283: 19058–19065. https://doi.org/10.1074/jbc.M802054200
Takacs Z., Toups M., Kollewe A, Johnson E., Cuello L.G., Driessens G., Biancalana M., Koide A., Ponte C.G., Perozo E., Gajewski T.F., Suarez-Kurtz G., Koide S., Goldstein S.A.N. (2009) A designer ligand specific for Kv1.3 channels from a scorpion neurotoxin-based library. Proc. Natl. Acad. Sci. USA. 106: 22211–22216. https://doi.org/10.1073/pnas.0910123106
Gigolaev A.M., Kuzmenkov A.I., Peigneur S., Tabakmakher V.M., Pinheiro-Junior E.L., Chugunov A.O., Efremov R.G., Tytgat J., Vassilevski A.A. (2020) Tuning scorpion toxin selectivity: Switching from KV1.1 to KV1.3. Front. Pharmacol. 11: 1010.https://doi.org/10.3389/fphar.2020.01010
Kuzmenkov A.I., Peigneur S., Tytgat J., Vassilevski A.A. (2019) Pharmacological characterisation of MeKTx13-2 and MeKTx13-3, peptide ligands of potassium channels from the scorpion Mesobuthus eupeus venom. Russ. J. Physiol. 105: 1452–1462. https://doi.org/10.1134/S0869813919110074
McCoy J., Lavallie E. (2001) Expression and purification of thioredoxin fusion proteins. Curr. Protoc. Mol. Biol. Chapter. 16: Unit16.8. https://doi.org/10.1002/0471142727.mb1608s28
Gasparian M.E., Bychkov M.L., Dolgikh D.A., Kirpichnikov M.P. (2011) Strategy for improvement of enteropeptidase efficiency in tag removal processes. Protein. Expr. Purif. 79: 191–196. https://doi.org/10.1016/j.pep.2011.04.005
Kuzmenkov A.I., Sachkova M.Y., Kovalchuk S.I., Grishin E.V., Vassilevski A.A. (2016) Lachesana tarabaevi, an expert in membrane-active toxins. Biochem. J. 473: 2495–2506. https://doi.org/10.1042/BCJ20160436
Peigneur S., Billen B., Derua R., Waelkens E., Debaveye S., Béress L., Tytgat J. (2011) A bifunctional sea anemone peptide with Kunitz type protease and potassium channel inhibiting properties. Biochem. Pharmacol. 82: 81–90. https://doi.org/10.1016/j.bcp.2011.03.023
Romi-Lebrun R., Lebrun B., Martin-Eauclaire M.-F., Ishiguro M., Escoubas P., Wu F.Q., Hisada M., Pongs O., Nakajima T. (1997) Purification, characterization, and synthesis of three novel toxins from the Chinese scorpion Buthus martensi, which act on K+ channels. Biochemistry. 36: 13473–13482. https://doi.org/10.1021/bi971044w
Renisio J.G., Romi-Lebrun R., Blanc E., Bornet O., Nakajima T., Darbon H. (2000) Solution structure of BmKTX, a K+ blocker toxin from the Chinese scorpion Buthus martensi. Proteins. 38: 70–78. https://doi.org/10.1002/(SICI)1097-0134(20000101)38:1<70::AID-PROT8>3.0.CO;2-5
Kuzmenkov A.I., Peigneur S., Chugunov A.O., Tabakmakher V.M., Efremov R.G., Tytgat J., Grishin E.V., Vassilevski A.A. (2017) C-Terminal residues in small potassium channel blockers OdK1 and OSK3 from scorpion venom fine-tune the selectivity. Biochim. Biophys. Acta. – Proteins Proteomics. 1865: 465–472. https://doi.org/10.1016/j.bbapap.2017.02.001
Kuzmenkov A.I., Nekrasova O.V., Peigneur S., Tabakmakher V.M., Gigolaev A.M., Fradkov A.F., Kudryashova K.S., Chugunov A.O., Efremov R.G., Tytgat J., Feofanov A.V., Vassilevski A.A. (2018) KV1.2 channel-specific blocker from Mesobuthus eupeus scorpion venom: Structural basis of selectivity. Neuropharmacology. 143: 228–238. https://doi.org/10.1016/j.neuropharm.2018.09.030
Berkut A.A., Chugunov A.O., Mineev K.S., Peigneur S., Tabakmakher V.M., Krylov N.A., Oparin P.B., Lihonosova A.F., Novikova E.V., Arseniev A.S., Grishin E.V., Tytgat J., Efremov R.G., Vassilevski A.A. (2019) Protein surface topography as a tool to enhance the selective activity of a potassium channel blocker. J. Biol. Chem. 294: 18349–18359. https://doi.org/10.1074/jbc.RA119.010494
Webb B., Sali A. (2016) Comparative protein structure modeling using MODELLER. In: Current Protocols in Bioinformatics. John Wiley & Sons, Inc., Hoboken, N.J., USA. 5.6.1-5.6.37. https://doi.org/10.1002/cpbi.3
Chen X., Wang Q., Ni F, Ma J. (2010) Structure of the full-length Shaker potassium channel Kv1.2 by normal-mode-based X-ray crystallographic refinement. Proc. Natl. Acad. Sci. USA. 107: 11352–11357. https://doi.org/10.1073/pnas.1000142107
Goldstein S.A., Pheasant D.J., Miller C. (1994) The charybdotoxin receptor of a Shaker K+ channel: peptide and channel residues mediating molecular recognition. Neuron. 12: 1377–88.https://doi.org/10.1016/0896-6273(94)90452-9
Lyukmanova E.N., Shenkarev Z.O., Shulepko M.A., Paramonov A.S., Chugunov A.O., Janickova H., Dolejsi E., Dolezal V., Utkin Y.N., Tsetlin V.I., Arseniev A.S., Efremov R.G., Dolgikh D.A., Kirpichnikov M.P. (2015) Structural insight into specificity of interactions between nonconventional three-finger weak toxin from Naja kaouthia (WTX) and muscarinic acetylcholine receptors. J. Biol. Chem. 290: 23616–23630. https://doi.org/10.1074/jbc.M115.656595
Chugunov A.O., Volynsky P.E., Krylov N.A., Nolde D.E., Efremov R.G. (2016) Temperature-sensitive gating of TRPV1 channel as probed by atomistic simulations of its trans- and juxtamembrane domains. Sci. Rep. 6: 33112. https://doi.org/10.1038/srep33112
Jorgensen W.L., Chandrasekhar J., Madura J.D., Impey R.W., Klein M.L. (1983) Comparison of simple potential functions for simulating liquid water. J. Chem. Phys. 79: 926–935. https://doi.org/10.1063/1.445869
Abraham M.J., Murtola T., Schulz R., Páll S., Smith J.C., Hess B., Lindahl E. (2015) GROMACS: High performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX. 1: 19–25. https://doi.org/10.1016/j.softx.2015.06.001
Klepeis J.L., Lindorff-Larsen K., Shaw D.E., Palmo K., Dror R.O., Maragakis P., Piana S. (2010) Improved side-chain torsion potentials for the Amber ff99SB protein force field. Proteins. 78: 1950–1958. https://doi.org/10.1002/prot.22711
Berendsen H.J.C., Postma J.P.M., van Gunsteren W.F., DiNola A., Haak J.R. (1984) Molecular dynamics with coupling to an external bath. J. Chem. Phys. 81: 3684–3690. https://doi.org/10.1063/1.448118
Bussi G., Donadio D., Parrinello M. (2007) Canonical sampling through velocity rescaling. J. Chem. Phys. 126: 014101. https://doi.org/10.1063/1.2408420
Pyrkov T.V., Chugunov A.O., Krylov N.A., Nolde D.E., Efremov R.G. (2009) PLATINUM: a web tool for analysis of hydrophobic/hydrophilic organization of biomolecular complexes. Bioinformatics. 25: 1201–1202. https://doi.org/10.1093/bioinformatics/btp111
Pyrkov T., Efremov R. (2007) A fragment-based scoring function to re-rank ATP docking results. Int. J. Mol. Sci. 8: 1083–1094. https://doi.org/10.3390/i8111083
Chen Z., Hu Y., Hu J., Yang W., Sabatier J.M., De Waard M., Cao Z., Li W., Han S., Wu Y. (2014) Unusual binding mode of scorpion toxin BmKTX onto potassium channels relies on its distribution of acidic residues. Biochem. Biophys. Res. Commun. 447: 70–76. https://doi.org/10.1016/j.bbrc.2014.03.101
Garcia M.L., Garcia-Calvo M., Hidalgo P., Lee A., MacKinnon R. (1994) Purification and characterization of three inhibitors of voltage-dependent K+ channels from Leiurus quinquestriatus var. hebraeus venom. Biochemistry. 33: 6834–6839. https://doi.org/10.1021/bi00188a012
Mouhat S., Visan V., Ananthakrishnan S., Wulff H, Andreotti N., Grissmer S., Darbon H., De Waard M., Sabatier J.M. (2005) K+ channel types targeted by synthetic OSK1, a toxin from Orthochirus scrobiculosus scorpion venom. Biochem. J. 385: 95–104. https://doi.org/10.1042/BJ20041379
Abbas N., Belghazi M., Abdel-Mottaleb Y., Tytgat J., Bougis P.E., Martin-Eauclaire M.F. (2008) A new Kaliotoxin selective towards Kv1.3 and Kv1.2 but not Kv1.1 channels expressed in oocytes. Biochem. Biophys. Res. Commun. 376: 525–530. https://doi.org/10.1016/j.bbrc.2008.09.033
Kozminsky-Atias A., Somech E., Zilberberg N. (2007) Isolation of the first toxin from the scorpion Buthus occitanus israelis showing preference for Shaker potassium channels. FEBS Lett. 581: 2478–2484. https://doi.org/10.1016/j.febslet.2007.04.065
Abdel-Mottaleb Y., Vandendriessche T., Clynen E., Landuyt B., Jalali A., Vatanpour H., Schoofs L., Tytgat J. (2008) OdK2, a Kv1.3 channel-selective toxin from the venom of the Iranian scorpion Odonthobuthus doriae. Toxicon. 51: 1424–1430. https://doi.org/10.1016/j.toxicon.2008.03.027
Kuzmenkov A.I., Vassilevski A.A., Kudryashova K.S., Nekrasova O.V., Peigneur S., Tytgat J., Feofanov A.V., Kirpichnikov M.P., Grishin E.V. (2015) Variability of potassium channel blockers in Mesobuthus eupeus scorpion venom with focus on Kv1.1: An integrated transcriptomic and proteomic study. J. Biol. Chem. 290(19): 12195–12209. https://doi.org/10.1074/jbc.M115.637611
Gao B., Peigneur S., Tytgat J., Zhu S. (2010) A potent potassium channel blocker from Mesobuthus eupeus scorpion venom. Biochimie. 92: 1847–1853. https://doi.org/10.1016/j.biochi.2010.08.003
Koschak A., Bugianesi R.M., Mitterdorfer J., Kaczorowski G.J., Garcia M.L., Knaus H.G. (1998) Subunit composition of brain voltage-gated potassium channels determined by hongotoxin-1, a novel peptide derived from Centruroides limbatus venom. J. Biol. Chem. 273: 2639–2644. https://doi.org/10.1074/jbc.273.5.2639
Cotton J., Crest M., Bouet F., Alessandri N., Gola M., Forest E., Karlsson E., Castañeda O., Harvey A.L., Vita C., Ménez A. (1997) A potassium-channel toxin from the sea anemone Bunodosoma granulifera, an inhibitor for Kv1 channels. Revision of the amino acid sequence, disulfide-bridge assignment, chemical synthesis, and biological activity. Eur. J. Biochem. 244:192–202. https://doi.org/10.1111/j.1432-1033.1997.00192.x
Peigneur S., Orts D.J.B., Prieto da Silva A.R., Oguiura N., Boni-Mitake M., de Oliveira E.B, Zaharenko A.J., de Freitas J.C., Tytgat J. (2012) Crotamine pharmacology revisited: Novel insights based on the inhibition of KV channels. Mol. Pharmacol. 82: 90–96. https://doi.org/10.1124/mol.112.078188
Grissmer S., Nguyen A.N., Aiyar J., Hanson D.C., Mather R.J., Gutman G.A., Karmilowicz M.J., Auperin D.D., Chandy K.G. (1994) Pharmacological characterization of five cloned voltage-gated K+ channels, types Kv1.1, 1.2, 1.3, 1.5, and 3.1, stably expressed in mammalian cell lines. Mol. Pharmacol. 45(6): 1227–1234.
Chandy K.G., Norton R.S. (2017) Peptide blockers of Kv1.3 channels in T cells as therapeutics for autoimmune disease. Curr. Opin. Chem. Biol. 38:97–107. https://doi.org/10.1016/j.cbpa.2017.02.015
Beeton C., Pennington M.W., Wulff H., Singh S., Nugent D., Crossley G., Khaytin I., Calabresi P.A., Chen C.Y., Gutman G.A., Chandy K.G. (2005) Targeting effector memory T cells with a selective peptide inhibitor of Kv1.3 channels for therapy of autoimmune diseases. Mol. Pharmacol. 67: 1369–1381. https://doi.org/10.1124/mol.104.008193
Rashid M.H., Huq R., Tanner M.R., Chhabra S., Khoo K.K., Estrada R., Dhawan V., Chauhan S., Pennington M.W., Beeton C., Kuyucak S., Norton R.S. (2015) A potent and Kv1.3-selective analogue of the scorpion toxin HsTX1 as a potential therapeutic for autoimmune diseases. Sci. Rep. 4: 4509. https://doi.org/10.1038/srep04509
Tajti G., Wai D.C.C., Panyi G., Norton R.S. (2020) The voltage-gated potassium channel KV1.3 as a therapeutic target for venom-derived peptides. Biochem. Pharmacol. 181: 114146. https://doi.org/10.1016/j.bcp.2020.114146
Chen P., Dendorfer A., Finol-Urdaneta R.K., Terlau H., Olivera B.M. (2010) Biochemical characterization of κM-RIIIJ, a Kv1.2 channel blocker. J. Biol. Chem. 285: 14882–14889. https://doi.org/10.1074/jbc.M109.068486
Orts D.J.B., Peigneur S., Madio B., Cassoli J.S., Montandon G.G., Pimenta A.M.C., Bicudo J.E.P.W., Freitas J.C., Zaharenko A.J., Tytgat J. (2013) Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Mar. Drugs. 11: 655–679. https://doi.org/10.3390/md11030655
Wang X., Umetsu Y., Gao B., Ohki S., Zhu S. (2015) Mesomartoxin, a new Kv1.2-selective scorpion toxin interacting with the channel selectivity filter. Biochem. Pharmacol. 93:232–239. https://doi.org/10.1016/j.bcp.2014.12.002
Koch R.O., Wanner S.G., Koschak A., Hanner M., Schwarzer C., Kaczorowski G.J., Slaughter R.S., Garcia M.L., Knaus H.G. (1997) Complex subunit assembly of neuronal voltage-gated K+ channels. Basis for high-affinity toxin interactions and pharmacology. J. Biol. Chem. 272: 27577–27581. https://doi.org/10.1074/jbc.272.44.27577
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова



