Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 616-628
Изучение роли С-концевого внутриклеточного домена на функционирование ионного канала ASIC3
Д. И. Осмаков 1, 2, Ю. В. Королькова 1, К. И. Лубова 1, Е. Е. Малеева 1, Я. А. Андреев 1, 2, С. А. Козлов 1, *
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
2 Институт молекулярной медицины Первого МГМУ им. И.М. Сеченова
Москва, Россия
* E-mail: serg@ibch.ru
Поступила в редакцию 15.01.2021
После доработки 01.02.2021
Принята к публикации 01.02.2021
Аннотация
Повышение концентрации протонов в синаптической щели при выбросе нейромедиаторов считается одним из возможных способов сенсибилизации постсинаптической мембраны. Одними из основных сенсоров закисления являются представители семейства кислоточувствительных ионных каналов (ASIC). Канал ASIC3, представленный на мембране чувствительных нейронов, вносит большой вклад в восприятие болевых ощущений и считается перспективной мишенью для разработки терапевтических средств. Несмотря на высокую степень идентичности, между ортологами ASIC3-каналов млекопитающих имеется ряд различий. Наиболее важное отличие заключается в том, что при физиологическом значении внеклеточного рН 7.4 человеческий ASIC3 отвечает на кислотный стимул практически только длительной компонентой, в то время как крысиный ASIC3 имеет длительную компоненту тока и намного превосходящую ее по амплитуде транзиентную компоненту тока. В данной работе нам удалось показать, что С-концевой внутриклеточный домен (CTD) канала является регуляторной последовательностью, и его модификация оказывает значительное воздействие на транзиентный ток у ASIC3 человека и крысы. Укорочение CTD на 20 аминокислотных остатков приводит к росту транзиентной и ослаблению длительной компонент тока, а модификация CTD у hASIC3 приводит к появлению тока аналогичного rASIC3, что было продемонстрировано в экспериментах whole-cell на гетерологически экспрессированных каналах. Также делеция 20 аминокислотных остатков в CTD на порядок увеличивает амплитуду регистрируемых токов как у rASIC3, так и у hASIC3. Полученные результаты демонстрируют особую роль CTD во внутриклеточной регуляции каналов ASIC3.
ВВЕДЕНИЕ
Регуляция синаптической передачи – сложный многокомпонентный процесс, в который вовлечено множество структурных, ферментативных и рецепторных белков. Несмотря на то, что кислоточувствительные каналы семейства амилорид-чувствительных эпителиальных натриевых каналов (ASIC) не относят к основным рецепторам на пресинаптической и постсинаптической мембране, последние исследования выявили определенную роль этих рецепторов в синаптической передаче. Две основные изоформы канала – ASIC1 и ASIC2 – хорошо представлены в областях ЦНС с высокой синаптической плотностью, а их солокализация является обычным явлением [1]. ASIC1 и ASIC2 экспрессируются во многих отделах мозга, среди которых амигдала, гиппокамп, кора головного мозга и мозжечок. Внутри нервных клеток ASICs были обнаружены по всей соме и вдоль ветвей аксонов и дендритов [2, 3].
Ранее было показано преимущественное расположение ASIC1a на постсинаптической мембране [4], но последние данные с использованием селективных флуоресцентных зондов и иммуноокрашивания доказали, что субъединицы ASIC1a и ASIC2a локализованы по всей аксональной зоне и имеют к тому же и пресинаптическое расположение [5]. Пресинаптическое расположение хорошо объясняет ранее наблюдавшиеся эффекты, когда фармакологическое и генетическое нарушение активности ASIC1a усиливало высвобождение трансмиттера [6] и, напротив, активация ASIC1a отрицательно коррелировала с высвобождением пресинаптических нейромедиаторов [7].
Долгое время постсинаптические ASIC-генерируемые токи не могли зафиксировать во время синаптической передачи нейромедиаторов, однако, как оказалось, это возможно сделать при использовании селективных ингибиторов основных постсинаптических лиганд-управляемых каналов. В итоге, токи, опосредованные ASIC1a- и/или ASIC2-активацией, были выявлены после фармакологической блокировки рецепторов AMPA, NMDA и GABAA [8, 9]. Выявленный ток имел малую амплитуду, и поэтому не мог быть детектирован прямой активацией синапса кислотой, с учетом того, что сами протоны ингибируют NMDA- и AMPA-рецепторы, причем значения ингибирующей концентрации сопоставимо со значениями активирующей концентрации для ASIC-каналов [10–13]. ASIC1a облегчает активацию NMDA-рецептора, возникающую при индукции долгосрочной потенциации (LTP), предполагая функциональное взаимодействие между этими рецепторами в регуляции синаптической пластичности гиппокампа [14–16]. Также в гиппокампе ASIC1a участвует в увеличении потенциала действия, вызываемым при участии метаботропного рецептора mGlu I группы, и участвует в индуцированной долгосрочной депрессии (LTD) через этот рецептор [17]. В нейронах MNTB каликса грызунов вызываемые ASICs токи имеют настолько значительную амплитуду, что способны вызывать потенциалы действия в отсутствие глутаматергической передачи [18].
Помимо ЦНС, были изучены синаптические контакты в периферической нервной системе (ПНС), и показана роль протонов как дополнительных нейромодуляторов [19]. В ПНС помимо ASIC1a широко представлена изоформа ASIC3, при активации которой протонами формируется двухкомпонентный ответ из быстро десенситизируемого (транзиентного) и постоянного (длительного) тока. Баланс между быстрой и постоянной компонентой тока в ASIC3 отличен у каналов грызунов и человека. Помимо этого, лиганды могут по-разному влиять на ту или иную компоненту [20–23]. Все это делает ASIC3 интересным объектом для изучения. Изучая синапс, образованный вестибулярными волосковыми клетками внутреннего уха типа I и постсинаптическими нервными окончаниями каликса, Highstein с соавт. [24] представили доказательства того, что протоны действуют как неквантовые нейромедиаторы и подолгу находятся в синаптической щели. Это подразумевает, что постсинаптический ответ может быть следствием активации ASIC3, так как остальные кислото-чувствительные каналы быстро десенситизируются кислотой.
Особенности пространственной организации каналов ASIC в целом, так же, как и структурно-функциональная взаимосвязь отдельных остатков внеклеточного домена, составляющего большую часть молекулы, были подробно проанализированы в обзоре [22]. Структура гомотримерного комплекса куриного канала ASIC была получена ранее не один раз в различных условиях, но всегда в качестве объекта выбирался мутант с усеченными внутриклеточными N- и C-концевыми последовательностями. В электрофизиологических экспериментах такой мутант сохранял способность активироваться при действии протонов так же, как и полноразмерный канал [25]. В данной работе мы впервые демонстрируем, что С-концевой внутриклеточный домен (CTD) у ASIC3 человека определяет чувствительность канала к протонам, а также форму и кинетику ответа на кислотный стимул.
МЕТОДЫ ИССЛЕДОВАНИЯ
Этическое заявление. Данное исследование строго соответствовало принципам Всемирной организации по охране здоровья животных. Все эксперименты были одобрены институциональной политикой использования лабораторных животных Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук (протокол № 267/2018; дата утверждения: 2 октября 2018 г.).
Реактивы. В работе использованы соли и растворители подходящего качества фирмы Merck приобретенные в Sigma-Aldrich Rus. Для активации каналов, помимо кислых буферных растворов, использовали рекомбинантный ноцистатин крысы (аминокислотная последовательность, аналогичная остаткам 98–132 в Q62923(Uniprot)), полученный при экспрессии в клетках Esherichia coli конструкции, собранной на основе вектора pET32b (Merck, Германия).
Молекулярное клонирование и направленный мутагенез ионных каналов. Гены rASIC3 и hASIC3, ранее использованные в работе [21], были амплифицированы с использованием праймеров hA3-Hind3_frw (5'-ATCAAGCTTTAAATAATATGAAGCCCACCTCAGGCC-3'), hA3-EcoR1_rev (5'-ATTGGATTCCTAGAGCTGTGTGACAAGGTAGCAG-3') для hASIC3, и rA3-Hind3_frw (5'-ATCAAGCTTTAAATAATATGAAACCTCGCTCCGGACTG-3'), rA3-EcoR1_rev (5'-ATTGAATTCCTAGAGCCTTGTGACGAGGTAACAG-3') для rASIC3 и клонированы в плазмидный вектор pVAX1 (Thermo Fisher Scientific, США) по сайтам EcoRI/HindIII. Мутации вводили в полученные верифицированные конструкции с помощью набора Phusion SiteDirected Mutagenesis Kit (Thermo Fisher Scientific, США) в соответствии с протоколом производителя. Были использованы следующие праймеры: hA3_FLH6_frw (5'-GATCACGATATCCATCACCATCACCATCACTAGGAATTCTGCAGATATCCAGCACAG-3'), hA3_FLH6_rev (5'-CTTGTAATCGCCATCGTGATCCTTGTAGTCGAGCTGTGTGACAAGGTAGCAGGTG-3'), hA3d20_FLH6_rev (5'-CTTGTAATCGCCATCGTGATCCTTGTAGTCGGGAGGGGTGGGAGGTCTG-3'), A3_d20_frw (5'-TAGGAATTCTGCAGATATCCAGCACAG-3'), hA3_d20H6_frw (5'-CATCACCATCACCATCACTAGGAATTCT-3'), hA3_d20_rev (5'-GGGAGGGGTGGGAGGTCTG-3'), rA3_d20_rev (5'-GGGAGTGGTAGGAGGCCTG-3') в следующих комбинациях: hA3_FLH6_frw/hA3_FLH6_rev (конструкция hASIC3 + FLAG + H6), hA3_FLH6_frw/ hA3d20_FLH6_rev (конструкция h-ASIC3-Δ20 + FLAG + H6), A3_d20_frw/hA3_d20_rev (конструкция hASIC3-Δ20), A3_d20_frw/rA3_d20_rev (конструкция rASIC3-Δ20). Правильность сборки проверяли секвенированием ДНК.
Синтез кэпированной мРНК. Плазмидные конструкции с дикими и мутантными генами hASIC3 и rASIC3 были линеаризованы с использованием рестриктаз NdeI и MluI для hASIC3 и rASIC3, соответственно. мРНК была синтезирована с использованием набора mMACHINE™ T7 Transcription Kit (Thermo Fisher Scientific, США) в соответствии со стандартным протоколом для кэпированных транскриптов. Конечную мРНК ресуспендировали в воде, свободной от РНКазы, до концентрации 50 нг/мкл и хранили при –70°C.
Электрофизиологические эксперименты. Электрофизиологические эксперименты проводили на неоплодотворенных ооцитах лягушки вида Xenopus laevis. Этил-т-аминобензонат метасульфона (MS222) (0.17%-ный раствор) использовался для анестезии лягушек, которые после операции содержались в отдельном резервуаре до полного восстановления от наркоза. Слои фолликулярных клеток удаляли с поверхности ооцитов обработкой коллагеназой тип I или тип II (Sigma-Aldrich, США) в концентрации 1 мг/мл при комнатной температуре в течение 1.5–2 ч в среде ND96 (мМ: 96 NaCl, 2 KCl, 1 MgCl2 и 5 HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), титрованная до рН 7.4 с помощью NaOH) без кальция. В отобранные здоровые ооциты стадии IV и V вводили 5–10 нг мРНК, содержащей соответствующие гены каналов, с использованием системы микроинъекции Nanoliter 2000 (World Precision Instruments, США). Инъецированные ооциты выдерживали 48–72 ч при 19°C, а затем до 5 дней при 15°C в среде ND96 с добавлением антибиотика (гентамицин, 50 мкг/мл) и пирувата (5 мМ). Записи токов производились методом двухэлектродной фиксации потенциала при удерживающем потенциале –50 мВ с использованием усилителя GeneClamp500 (AxonInstruments, Inverurie, Великобритания). Микроэлектроды заполнялись 3 М KCl. Данные были отфильтрованы и оцифрованы при 20 и 100 Гц, соответственно, с использованием преобразователя L780 AD (L-Card, Москва, Россия). Для внешнего базового раствора использовали буфер ND96 с pH 7.4 или 7.8. Активирующим раствором служил ND96 с рН 5.5, в котором HEPES был заменен на 10 мМ MES (2- (N-морфолино)-этансульфоновая кислота). Клапанная система с регулируемым давлением с компьютерным управлением использовалась для достижения скорости обмена растворов около 60 мл/мин в записывающей камере.
Математическая обработка и статистический анализ. Анализ электрофизиологических данных проводили с помощью программы OriginPro 8.6 (OriginLab, Нортгемптон, Массачусетс, США). Временной ход затухания кривой тока был аппроксимирован с использованием моноэкспоненциального уравнения: $F\left( x \right) = {\text{A}}1 \times {{e}^{{(--x/{{\tau }_{{{\text{des}}}}})}}} + {\text{A}}0,$ где F(x) – амплитуда тока в момент времени x, A1 – максимальная амплитуда тока, A0 – его установившееся значение, τdes – константа времени десенситизации.
Все данные представлены как среднее значение ±SEM. Достоверность различий в нормализованных данных определялась с помощью теста Тьюки ANOVA с уровнем значимости *p < 0.05, **p < 0.01 и ***p < 0.005; ns незначимо.
Предсказание элементов вторичной структуры для внутриклеточных доменов ионного канала проводили с привлечением on-line RaptorX Property Prediction Server [26].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Токи каналов ASIC3 человека (hASIC3), активирующиеся в условиях физиологических значений рН внеклеточной среды (рН 7.3–7.4), характеризуются практически отсутствующей транзиентной компонентой. Повышение базового рН среды до слабо щелочных значений (рН 7.8) позволяет детектировать слабо выраженную транзиентную компоненту, за которой следует ярко выраженная длительная компонента, превосходящая первую во много раз (рис. 1a, левая панель). Такая картина является нетипичной и в большой степени отличает hASIC3 от остальных изоформ каналов ASIC, а также от его ортологов из других видов млекопитающих.
Рис. 1.
Профили токов через каналы hASIC3, экспрессированные в ооцитах лягушки X. laevis. (a) Контрольные токи через канал ASIC3 дикого типа (hASIC3, левая панель) и его мутантный аналог, укороченный с C-конца на 20 аминокислотных остатков (hASIC3-Δ20, правая панель). (b) Действие на hASIC3-Δ20 эндогенного нейропептида крысы ноцистатина (rNS), в концентрации 1 мМ (зеленая линия); для сравнения показан контрольный ток через hASIC3-Δ20 (черная линия). Активацию проводили быстрой сменой буферного раствора с рН 7.8 на раствор с рН 5.5.
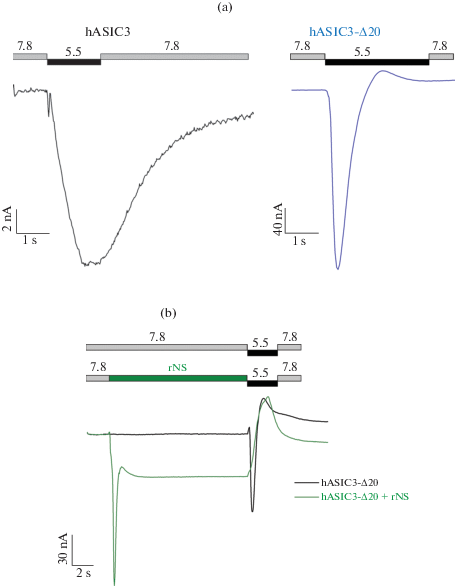
Недавно было показано, что С-концевой домен ответствен за уменьшение транзиентного тока у каналов ASIC3 крысы (rASIC3) [27]. Мы предположили, что подобная ситуация может быть и в случае hASIC3. Используя сайт-направленный мутагенез, мы удалили 20 С-концевых аминокислотных остатков (а.о.) последовательности каналов rASIC3 и hASIC3, получив укороченные аналоги rASIC3-Δ20 и hASIC3-Δ20, и проанализировали профиль активации каналов, экспрессированных в ооцитах шпорцевой лягушки Xenopus laevis.
Действительно, делеция 20 а.о. hASIC3 привела к изменению формы ответа канала на изменение рН, при этом наблюдалось возникновение ярко выраженного транзиентного тока (рис. 1a, правая панель), а длительная компонента практически отсутствовала. Интересно, что подобный ответ и отсутствие длительной компоненты наблюдалось при активации hASIC3-Δ20 протонами. Однако ноцистатин крысы (rNS) вызывает двухкомпонентный ток, состоящий из транзиентной и длительной компонент (рис. 1b, зеленая линия). Ноцистатин – это нейропептид, который способен активировать любые ASICs [28].
Для hASIC3 были собраны дополнительные мутантные конструкции. Одна из конструкций (hASIC3 + FLAG + H6) представляла собой полноразмерный канал с увеличенной на 20 а.о. С-концевой последовательностью (DYKDHDGDYKDHDIHHHHHH), которая включала два последовательно соединенных через остаток глицина аффинных FLAG-тага (DYKDHD) и 6 а.о., формирующих His-таг. Вторая конструкция (hASIC3-Δ20 + FLAG + H6) являлась аналогичной FLAG и His меченой формой мутанта hASIC3-Δ20. Данные конструкции имели прикладное значение, поскольку позволяли, при необходимости, выделять из клеточного лизата экспрессированные ионные каналы с использованием аффинной хроматографии.
Оба дополнительных варианта мутантных каналов значительно отличались от hASIC3-канала дикого типа по форме ответа на закисление. Для представленных на рис. 2 входящих токов каналов hASIC3, hASIC3 + FLAG + H6 и hASIC3-Δ20 + + FLAG + H6, в месте перехода от транзиентной к длительной компоненте заметен явный минимум, который может свидетельствовать о протекании двух независимых процессов: десенситизации транзиентной компоненты тока и медленного роста длительной компоненты тока, которая наблюдается на всем протяжении действия импульса. Ранее такой феномен уже был описан в работе для ASIC3 крысы [29].
Рис. 2.
Профили токов через канал hASIC3 дикого типа (левая панель), удлиненный на 20 а.о. канал h-ASIC3 + FLAG + H6 (средняя панель), а также канал hASIC3-Δ20 + FLAG + H6, в котором последние 20 а.о. на С-конце заменены на (FLAG + H6)-последовательность (правая панель). Активацию проводили буфером с рН 5.5 из базового внеклеточного раствора с рН 7.4 (черные линии) и рН 7.8 (синие линии).

Было проведено сравнение каналов по эффективности их активации раствором с pH 5.5 из двух различных стартовых условий – нейтрального pH 7.4 и слабощелочного рН 7.8 в омывающем клетку растворе. Активация из слабощелочного буфера всегда приводила к более выраженной транзиентной компоненте тока и существенно не влияла на длительный ток (рис. 2). Добавление дополнительной последовательности к каналу дикого типа (конструкт hASIC3 + FLAG + H6) привело к появлению выраженной транзиентной компоненты тока с амплитудой, сопоставимой с амплитудой следующей за ней длительной компоненты (рис. 2, средняя панель). Для hASIC3-Δ20 + FLAG + H6 транзиентная компонента превосходила по амплитуде транзиентные компоненты как hASIC3, так и его FLAG + His меченого аналога hASIC3 + FLAG + H6 уже на порядок (рис. 2, правая панель).
У мутантного канала hASIC3-Δ20 практически не наблюдали недесенситизируемого тока при активации протонами (рис. 3a), однако по абсолютной амплитуде транзиентного тока он показал наибольшую проводимость (рис. 3b). Амплитуды токов для канала hASIC3 и его мутантных форм hASIC3-Δ20 + FLAG + H6 и hASIC3-Δ20, активированных рН 5.5 со значения базового рН 7.4 (рис. 3b), составляли 1.9 ± 0.3, 28.3 ± 7.1 и 64.6 ± 22.1 нА соответственно. Значимое расхождение наблюдалось между величинами амплитуд токов hASIC3 и hASIC3-Δ20 + FLAG + H6 и hASIC3 и hASIC3-Δ20 каналов (р < 0.05), тогда как между самими мутантными формами, при видимой тенденции, значимого расхождения не было (р = 0.23). Аналогичная ситуация сохранялась и в условиях активации данных каналов с рН 7.8 до 5.5: значения амплитуд для hASIC3, hASIC3-Δ20 + FLAG + H6 и hASIC3-Δ20 составили 3.68 ± 0.45, 79.6 ± 29.6 и 259.7 ± 91.6 нА соответственно; значимые отличия величин амплитуд наблюдались только между hASIC3 и его мутантными формами (р < 0.05), тогда как между hASIC3-Δ20 + FLAG + H6 и hASIC3-Δ20 значимого расхождения также не было (р = 0.17). Как уже отмечалось выше, амплитуда транзиентного тока возрастала в зависимости от рН базового раствора, с которого производилась активация. Так, во всех вышеперечисленных каналах при повышении рН базового раствора с 7.4 до 7.8 амплитуда возрастала в 2.1 ± 0.3 раза для hASIC3 и в 2.7 ± 0.4 раза для hASIC3-Δ20 + FLAG + H6 и более значительно – в 4.04 ± 0.13 раза для hASIC3-Δ20.
Рис. 3.
Сравнение параметров токов исходного hASIC3-канала с параметрами hASIC3-Δ20- и hASIC3-Δ20 + FLAG + H6-мутантных каналов. (a) Профили нормализованных токов через hASIC3-Δ20 (черные линии) и hASIC3-Δ20 + FLAG + H6 (синие линии), активированные раствором с рН 5.5 из базовых растворов с рН 7.4 (левая панель) и рН 7.8 (правая панель). (b) Амплитуды (в наноамперах, нА) транзиентных компонент токов hASIC-, hASIC3-Δ20- и hASIC3-Δ20 + FLAG + H6-каналов, активированных при рН 5.5 из базовых растворов с рН 7.4 (левая панель) и рН 7.8 (правая панель). (c) Подгонка транзиентной компоненты тока hASIC3-Δ20 + FLAG + H6 моноэкспоненциальной функцией для ответа (серая сплошная линия) на стимул с рН 5.5 из базового внеклеточного раствора с рН 7.8. Аппроксимация моноэкспоненциальной функцией (сплошная синяя линия) проводилась для индивидуальной выведенной транзиентной компоненты (точечная линия), полученной в результате вычитания длительной компоненты (пунктирная линия) из начального двухфазного тока. (d) Константы времени десенситизации (в миллисекундах, мс) транзиентных компонент токов hASIC3-Δ20- и hASIC-3-Δ20 + FLAG + H6-каналов, активированных при рН 5.5 из базовых растворов с рН 7.4 (левая панель) и рН 7.8 (правая панель). Каждый столбец на графике представлен как среднее значение ± SEM 4–7 измерений. *p < 0,05 и ***p < 0.001; ns – незначимое различие; Тьюки ANOVA.
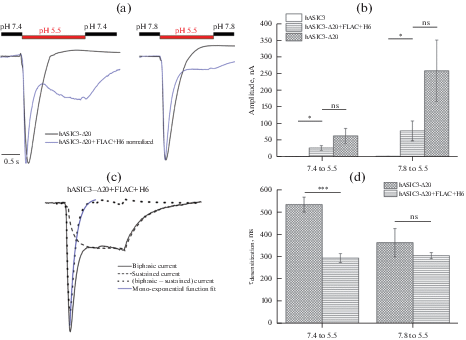
Для Δ20-мутантных каналов с делетированной С-концевой последовательностью была рассчитана скорость десенситизации транзиентного тока (рис. 3c). Константа времени десенситизации (τdes) у транзиентной компоненты тока при активации рН 5.5 раствором с базового рН 7.4 значительно различалась у мутантов h-ASIC3-Δ20 + FLAG + H6 и hASIC3-Δ20 (0.29 ± 0.02 и 0.53 ± 0.03 с соответственно) (р < 0.001). Однако это отличие нивелировалось при повышении значения рН базового раствора до рН 7.8: τdes для hASIC3-Δ20 + FLAG + H6 и hASIC3-Δ20 составило значимо не различимые 0.30 ± 0.01 и 0.36 ± 0.06 с соответственно (р = 0.4) (рис. 3d). Стоит отметить, что вне зависимости от значений рН базового раствора, при котором проводилась активация каналов, значения τdes у данных мутантных каналов наименьшие из всех ранее опубликованных данных [28, 30], что позволяет характеризовать Δ20-мутанты hASIC3 как одни из самых быстро десенситизируемых каналов среди всех ASIC-каналов.
Аналогичная мутантная конструкция с делецией 20-ти С-концевых а.о. была получена для канала ASIC3 крысы (rASIC3-Δ20). Сравнение параметров активации нативного и мутантного ASIC3-каналов крысы показало, что делеция 20 а.о. в CTD (rASIC3-Δ20) приводит к значительному увеличению амплитуды транзиентного тока и уменьшению амплитуды длительной компоненты (рис. 4a–c). Амплитуды транзиентного токов для rASIC3 и rASIC3-Δ20, активированных при рН 5.5 со значения базового рН 7.4, демонстрировали значимое расхождение и составляли 87.7 ± 22.7 и 649.9 ± 100.8 нА соответственно (р < 0.01). При базовом рН 7.8 значения амплитуды транзиентного токов для rASIC3 и rASIC3-Δ20 также значимо расходились и составляли 105.7 ± 27.2 и 868.7 ± 140.6 нА соответственно (р < 0.01) (рис. 4b). В отличие от hASIC3 увеличение базового рН раствора не приводило к значимому увеличению амплитуды транзиентного тока.
Рис. 4.
Сравнение параметров токов для ASIC3-канала крысы дикого типа (rASIC3) и мутантного канала с делецией 20 а.о. на C-конце (rASIC3-Δ20). (a) Профили нормализованных токов через rASIC3 (черные линии) и rASIC3-Δ20 (синие линии), активированные раствором с рН 5.5 из базовых растворов с рН 7.4 (левая панель) и рН 7.8 (правая панель). (b) Амплитуды (в нА) транзиентных компонент токов rASIC3 и rASIC3-Δ20, активированных при рН 5.5 из базовых растворов с рН 7.4 (левая панель) и рН 7.8 (правая панель). (c) Соотношение амплитуды длительной компоненты к амплитуде транзиентной компоненты тока rASIC3 и rASIC3-Δ20, а также hASIC3-Δ20 + FLAG + H6 каналов. (d) Константы времени десенситизации (в мс) транзиентных компонент токов rASIC3- и rASIC3-Δ20-, а также hASIC3-Δ20-каналов, активированных при рН 5.5 из базовых растворов с рН 7.4 (левая панель) и рН 7.8 (правая панель). Каждый столбик на графике представлен как среднее значение ± SEM 4–7 измерений. * p < 0.05 и ** p < 0.01; ns – незначимое различие; Тьюки ANOVA.
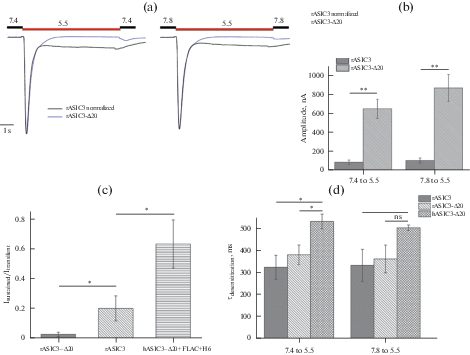
Сравнение относительных величин амплитуд компонент (Isustained/Itransient) для каналов rASIC3 и rASIC3-Δ20 показало тенденцию к уменьшению этого значения у мутантной формы, которая наблюдалась и в случае ортологов человека hASIC3 и hASIC3-Δ20. Значения Isustained/Itransient для rASIC3 и rASIC3-Δ20 значимо отличались и составляли 0.20 ± 0.08 и 0.03 ± 0.01 соответственно (р < 0.05). Однако данный параметр был более чем в 3 раза меньше, чем у мутанта hASIC3-Δ20 + FLAG + H6, который соответствовал значению 0.63 ± 0.16 (рис. 4c).
Константы τdes у транзиентной компоненты тока при активации раствором рН 5.5 с базового рН 7.4 не значимо различались между rASIC3 и rASIC3-Δ20 и составляли 0.33 ± 0.05 и 0.38 ± 0.04 с соответственно. Такая же ситуация наблюдалась и при базовом рН 7.8: значения τdes rASIC3 и rASIC3-Δ20 различались не значимо и составляли 0.33 ± 0.07 и 0.36 ± 0.06 с соответственно. При этом в условиях базового рН 7.4 rASIC3-Δ20-каналы оказались значимо более быстро десенситизируемыми, чем hASIC3-Δ20-каналы (р < 0.05) (рис. 4d, левая панель); однако при слабо щелочных условиях (рН 7.8) разница в скорости десенситизации нивелирована (р = 0.07) (рис. 4d, правая панель).
Функциональный ASIC3-канал образован тремя субъединицами, каждая из которых имеет внутриклеточный N-концевой и С-концевой домены, два трансмембранных спиральных домена и протяженную сложно организованную внеклеточную часть (рис. 5). Гомология аминокислотных остатков внутриклеточных доменов между rASIC3 и hASIC3 значительна. 4 остатка цистеина располагаются во внутриклеточной части канала, но идет ли образование внутри- или межсубъединичных дисульфидных связей и их возможная схема замыкания пока не установлены. Как видно из рис. 5, N-концевой домен склонен к образованию спиральных структур, и единственный остаток цистеина располагается на значительном расстоянии от трансмембранного участка. В CTD один из остатков цистеина расположен в непосредственной близости от трансмембранного участка, а два других удалены от него на значительное расстояние. Также для CTD наблюдается склонность к укладке с образованием β-листового слоя, в которую, предположительно, вовлечены последние аминокислотные остатки. При удалении 20 С-концевых а.о. rASIC3 и hASIC3, вероятно, происходит разрушение β-укладки, а удаление двух остатков цистеина приводит к дестабилизации внутриклеточных доменов за счет дисульфидных связей, что, по-видимому, определяет изменение параметров десенситизации канала ASIC3.
Рис. 5.
Аминокислотные последовательности внутриклеточных доменов ионных каналов ASIC3 человека и крысы. Элементы вторичной структуры, предсказанные по оn-line сервису RaptorX-Property, обозначены спиралью для α-спиральных элементов и стрелкой для β-листовых участков. Аминокислотные остатки цистеина выделены желтым цветом, красным выделены аминокислотные остатки, различные между двумя ортологами.

ЗАКЛЮЧЕНИЕ
Результаты данного исследования являются наглядной демонстрацией роли CTD в процессе функционирования ASIC3-канала. Для ASIC3 крысы ранее было показано, что связывание внутриклеточного интегрального мембранного белка стоматина с С-концом канала оказывает существенное негативное влияние на активность канала [27, 31]. Подобное взаимодействие, по-видимому, является универсальным: известны примеры аналогичной регуляции стоматин-подобным белком МЕС-2 гомолога ASIC-каналов у Caenorhabditis elegans [32]. В ходе работы мы показали, что делеция С-концевого участка CTD способствует значительному изменению проводимости канала ASIC3 крысы и человека. Также на примере мутантного канала hASIC3 + FLAG + H6 нами показано, что вмешательство в CTD может оказывать эффект потенцирования транзиентной компоненты тока. Стоит отметить, что у мутанта hASIC3-Δ20 + FLAG + H6, в отличие от hASIC3-Δ20, длительная компонента сохранялась (рис. 3a), и, наоборот, у канала rASIC3-Δ20 длительная компонента практически полностью пропадала. Таким образом, присутствие какой-либо аминокислотной последовательности в С-концевой части канала (при этом не обязательно содержащей остатки цистеина и/или сайт узнавания регуляторных белков) играет важную роль в генерации длительной компоненты тока при активации канала протонами. Вероятно, изменение конформации CTD, происходящее при делеции или добавлении а.о., приводит к уменьшению скорости десенситизации канала и появлению соответствующей транзиентной компоненты тока. Структурные фрагменты канала, задействованные в формировании длительной компоненты ответа на действие протонов, по-видимому, не связаны с внутриклеточной частью канала ASIC, что также подтверждают ранние исследования по сравнению полноразмерных каналов и их укороченных аналогов [25].
Список литературы
Price M.P., Gong H., Parsons M.G., Kundert J.R., Reznikov L.R., Bernardinelli L., Chaloner K., Buchanan G.F., Wemmie J.A., Richerson G.B., Cassell M.D., Welsh M.J. (2014) Localization and behaviors in null mice suggest that ASIC1 and ASIC2 modulate responses to aversive stimuli. Genes. Brain. Behav. 13: 179–194. https://doi.org/10.1111/gbb.12108
Wemmie J.A., Askwith C.C., Lamani E., Cassell M.D., Freeman J.H., Welsh M.J. (2003) Acid-Sensing Ion Channel 1 Is Localized in Brain Regions with High Synaptic Density and Contributes to Fear Conditioning. J. Neurosci. 23: 5496–5502. https://doi.org/10.1523/JNEUROSCI.23-13-05496.2003
Alvarez de la Rosa D., Zhang P., Shao D., White F., Canessa C.M. (2002) Functional implications of the localization and activity of acid-sensitive channels in rat peripheral nervous system. Proc. Natl. Acad. Sci. 99: 2326–2331. https://doi.org/10.1073/pnas.042688199
Zha X.-M., Wemmie J.A., Green S.H., Welsh M.J. (2006) Acid-sensing ion channel 1a is a postsynaptic proton receptor that affects the density of dendritic spines. Proc. Natl. Acad. Sci. 103: 16556–16561. https://doi.org/10.1073/pnas.0608018103
Liu X., Liu C., Ye J., Zhang S., Wang K., Su R. (2020) Distribution of Acid Sensing Ion Channels in Axonal Growth Cones and Presynaptic Membrane of Cultured Hippocampal Neurons. Front. Cell Neurosci. 14: 205. https://doi.org/10.3389/fncel.2020.00205
Urbano F.J., Lino N.G., González-Inchauspe C.M.F., González L.E., Colettis N., Vattino L.G., Wunsch A.M., Wemmie J.A., Uchitel O.D. (2014) Acid-sensing ion channels 1a (ASIC1a) inhibit neuromuscular transmission in female mice. Am. J. Physiol. Physiol. 306: C396–C406. https://doi.org/10.1152/ajpcell.00301.2013
Cho J.-H., Askwith C.C. (2008) Presynaptic Release Probability Is Increased in Hippocampal Neurons From ASIC1 Knockout Mice. J. Neurophysiol. 99: 426–441. https://doi.org/10.1152/jn.00940.2007
Du J., Reznikov L.R., Price M.P., Zha X.-m., Lu Y., Moninger T.O., Wemmie J.A., Welsh M.J. (2014) Protons are a neurotransmitter that regulates synaptic plasticity in the lateral amygdala. Proc. Natl. Acad. Sci. 111: 8961–8966. https://doi.org/10.1073/pnas.1407018111
Kreple C.J., Lu Y., Taugher R.J., Schwager-Gutman A.L., Du J., Stump M., Wang Y., Ghobbeh A., Fan R., Cosme C.V., Sowers L.P., Welsh M.J., Radley J.J., LaLumiere R.T., Wemmie J.A. (2014) Acid-sensing ion channels contribute to synaptic transmission and inhibit cocaine-evoked plasticity. Nat. Neurosci. 17: 1083–1091. https://doi.org/10.1038/nn.3750
Giffard R.G., Monyer H., Christine C.W., Choi D.W. (1990) Acidosis reduces NMDA receptor activation, glutamate neurotoxicity, and oxygen-glucose deprivation neuronal injury in cortical cultures. Brain. Res. 506: 339–342. https://doi.org/10.1016/0006-8993(90)91276-M
Traynelis S.F., Cull-Candy S.G. (1990) Proton inhibition of N-methyl-D-aspartate receptors in cerebellar neurons. Nature. 345: 347–350. https://doi.org/10.1038/345347a0
Tang C.M., Dichter M., Morad M. (1990) Modulation of the N-methyl-D-aspartate channel by extracellular H+. Proc. Natl. Acad. Sci. 87: 6445–6449. https://doi.org/10.1073/pnas.87.16.6445
Lei S., Orser B.A., Thatcher G.R.L., Reynolds J.N., MacDonald J.F. (2001) Positive Allosteric Modulators of AMPA Receptors Reduce Proton-Induced Receptor Desensitization in Rat Hippocampal Neurons. J. Neurophysiol. 85: 2030–2038. https://doi.org/10.1152/jn.2001.85.5.2030
Buta A., Maximyuk O., Kovalskyy D., Sukach V., Vovk M., Ievglevskyi O., Isaeva E., Isaev D., Savotchenko A., Krishtal O. (2015) Novel Potent Orthosteric Antagonist of ASIC1a Prevents NMDAR-Dependent LTP Induction. J. Med. Chem. 58: 4449–4461. https://doi.org/10.1021/jm5017329
Liu M.-G., Li H.-S., Li W.-G., Wu Y.-J., Deng S.-N., Huang C., Maximyuk O., Sukach V., Krishtal O., Zhu M.X., Xu T.-L. (2016) Acid-sensing ion channel 1a contributes to hippocampal LTP inducibility through multiple mechanisms. Sci. Rep. 6: 23350. https://doi.org/10.1038/srep23350
Ma C.-L., Sun H., Yang L., Wang X.-T., Gao S., Chen X.-W., Ma Z.-Y., Wang G., Shi Z., Zheng Q.-Y. (2019) Acid-Sensing Ion Channel 1a Modulates NMDA Receptor Function Through Targeting NR1/NR2A/NR2B Triheteromeric Receptors. Neuroscience. 406: 389–404. https://doi.org/10.1016/j.neuroscience.2019.03.044
Mango D., Braksator E., Battaglia G., Marcelli S., Mercuri N.B., Feligioni M., Nicoletti F., Bashir Z.I., Nisticò R. (2017) Acid-sensing ion channel 1a is required for mGlu receptor dependent long-term depression in the hippocampus. Pharmacol. Res. 119: 12–19. https://doi.org/10.1016/j.phrs.2017.01.028
González-Inchauspe C., Urbano F.J., Di Guilmi M.N., Uchitel O.D. (2017) Acid-Sensing Ion Channels Activated by Evoked Released Protons Modulate Synaptic Transmission at the Mouse Calyx of Held Synapse. J. Neurosci. 37: 2589–2599. https://doi.org/10.1523/JNEUROSCI.2566-16.2017
Blaustein M., Wirth S., Saldaña G., Piantanida A.P., Bogetti M.E., Martin M.E., Colman-Lerner A., Uchitel O.D. (2020) A new tool to sense pH changes at the neuromuscular junction synaptic cleft. Sci. Rep. 10: 20480. https://doi.org/10.1038/s41598-020-77154-3
Osmakov D.I., Koshelev S.G., Andreev Y.A., Kozlov S.A. (2017) Endogenous isoquinoline alkaloids agonists of acid-sensing ion channel type 3. Front. Mol. Neurosci. 10: 282. https://doi.org/10.3389/FNMOL.2017.00282
Osmakov D.I., Koshelev S.G., Andreev Y.A., Dubinnyi M.A., Kublitski V.S., Efremov R.G. Sobolevsky A.I., Kozlov S.A. (2018) Proton-independent activation of acid-sensing ion channel 3 by an alkaloid, lindoldhamine, from Laurus nobilis. Br. J. Pharmacol. 175: 924–937. https://doi.org/10.1111/bph.14134
Osmakov D.I., Khasanov T.A., Andreev Y.A., Lyukmanova E.N., Kozlov S.A. (2020) Animal, Herb, and Microbial Toxins for Structural and Pharmacological Study of Acid-Sensing Ion Channels. Front. Pharmacol. 11: 991.https://doi.org/10.3389/fphar.2020.00991
Shteinikov V., Potapieva N., Gmiro V., Tikhonov D. (2019) Hydrophobic Amines and Their Guanidine Analogues Modulate Activation and Desensitization of ASIC3. Int. J. Mol. Sci. 20: 1713. https://doi.org/10.3390/ijms20071713
Highstein S.M., Holstein G.R, Mann M.A., Rabbitt R.D. (2014) Evidence that protons act as neurotransmitters at vestibular hair cell-calyx afferent synapses. Proc. Natl. Acad. Sci. 111: 5421–5426. https://doi.org/10.1073/pnas.1319561111
Yoder N., Yoshioka C., Gouaux E. (2018) Gating mechanisms of acid-sensing ion channels. Nature. 555: 397–401. https://doi.org/10.1038/nature25782
Wang S., Peng J., Ma J., Xu J. (2016) Protein Secondary Structure Prediction Using Deep Convolutional Neural Fields. Sci. Rep. 6: 18962. https://doi.org/10.1038/srep18962
Klipp R.C., Cullinan M.M., Bankston J.R. (2020) Insights into the molecular mechanisms underlying the inhibition of acid-sensing ion channel 3 gating by stomatin. J. Gen. Physiol. 152: (3): e201912471. https://doi.org/10.1085/jgp.201912471
Osmakov D.I., Koshelev S.G., Ivanov I.A., Andreev Y.A., Kozlov S.A. (2019) Endogenous neuropeptide nocistatin is a direct agonist of acid-sensing ion channels (ASIC1, ASIC2 and ASIC3). Biomolecules. 9 (9): 401. https://doi.org/10.3390/biom9090401
Waldmann R., Bassilana F., de Weille J., Champigny G., Heurteaux C., Lazdunski M. (1997) Molecular Cloning of a Non-inactivating Proton-gated Na+ Channel Specific for Sensory Neurons. J. Biol. Chem. 272: 20975–20978. https://doi.org/10.1074/jbc.272.34.20975
Gründer S., Pusch M. (2015) Biophysical properties of acid-sensing ion channels (ASICs). Neuropharmacology. 94: 9–18. https://doi.org/10.1016/j.neuropharm.2014.12.016
Price M.P., Thompson R.J., Eshcol J.O., Wemmie J.A., Benson C.J. (2004) Stomatin Modulates Gating of Acid-sensing Ion Channels. J. Biol. Chem. 279: 53886–53891. https://doi.org/10.1074/jbc.M407708200
Goodman M.B., Ernstrom G.G., Chelur D.S., O’Hagan R., Yao C.A., Chalfie M. (2002) MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415: 1039–1042. https://doi.org/10.1038/4151039a
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


