Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 436-457
Фотохромная модуляция Цис-петельных рецептор-управляемых каналов
П. Д. Брежестовский 1, 2, *, Д. Н. Пономарева 1, 2
1 Институт нейронаук, Казанский государственный медицинский университет
Казань, Россия
2 Институт системных нейронаук, Университет Экс-Марсель
Марсель, Франция
* E-mail: pbreges@gmail.com
Поступила в редакцию 19.01.2021
После доработки 31.01.2021
Принята к публикации 09.02.2021
Аннотация
Благодаря успехам молекулярной и клеточной биологии, развитию химического синтеза и современных технологий, экспериментальная база современных исследований обогатились новыми направлениями, в которых свет играет ключевую роль как инструмент модуляции функций организмов. Одним из них является фотофармакология – направление, в котором используются химически синтезируемые светоуправляемые соединения, способные контролировать функции биологических молекул. При освещении определенными длинами световых волн эти фотохромные модуляторы переключаются между активной и неактивной формой и изменяют активность функционально важных белковых молекул – рецепторов, ионных каналов, ферментов и др. В данном обзоре кратко представлены соединения, модулирующие функции ионотропных Цис-петельных рецепторов ацетилхолина, ГАМК и глицина. Первым рецептор-управляемым каналом, для которого был открыт способ управления с помощью светоуправляемых молекул, является никотиновый рецептор ацетилхолина (нАХР). В 1970-х–80-х годах были созданы блокаторы и активаторы нАХР, состоящие из азобензола (светоуправляемого переключателя) и агонистов. В нынешнем тысячелетии создано новое поколение соединений, обеспечивающих светоуправляемый контроль активности нАХР. Прикрепляющиеся фотохромные лиганды состоят из малеимида для связывания с цистеиновыми группами аминокислот, фотопереключателя азобензола и лиганда для взаимодействия с рецептором. Новые фотохромы избирательно активируют или блокируют мышечные и нейрональные рецепторы и являются перспективными для изучения физиологической роли нАХР в нервной системе. Для светоуправляемого контроля активностью ГАМК-рецепторов создана обширная библиотека фотохромных соединений. Некоторые из них модулируют активность, взаимодействуя с активным центром рецептора, другие являются светоуправляемыми блокаторами хлор-избирательных ионных каналов. Недавно создано также два первых фотохромных модулятора активности глициновых рецепторов. В целом, фотофармакология является перспективным направлением, открывающим уникальные возможности для дистанционного управления физиологическими функциями, а также исследования процессов торможения и возбуждения в нейронных сетях и моделях нейрональных патологий.
Направления многолетней и многоплановой деятельности Л.Г. Магазаника посвящены, в огромной степени, исследованию функций рецепторов, активируемых ацетилхолином и глутаматом – нейромедиаторами, осуществляющими быструю синаптическую передачу в нервной системе позвоночных. Многие работы прошлого столетия посвящены исследованию никотиновых рецепторов ацетилхолина: процессов десенситизации [1–3], анализу миниатюрных потенциалов, вызванных спонтанным выбросом квантов нейромедиатора и постсинаптических событий, вызванных стимуляцией нерва [4, 5], а также других функциональных свойств нервно-мышечных холинергических синапсов [6]. Эти работы вошли в классику синаптологии. В исследованиях последних лет много работ посвящено выяснению механизмов процессов, вызываемых действием глутамата – основного возбуждающего нейромедиатора в нервной системе позвоночных, а также изучению молекулярной организации и функциональных свойств ионотропных глутаматных рецепторов [7–12]. Данный обзор посвящен краткому описанию подходов, обеспечивающих c помощью света управление работой рецепторных белков и формируемых ими ионных каналов, осуществляющих быструю синаптическую передачу в нервной системе позвоночных: рецепторов, активируемых ацетилхолином, а также тормозных рецепторов ГАМК и глицина. Информация о фотохромных модуляторах глутаматных рецепторов частично изложена в недавних обзорах [13, 14].
Развитие химического синтеза, успехи молекулярной биологии и современных технологий обеспечили появление трех основных направлений, в которых главным инструментом является свет. Оказалось, что с помощью света можно исследовать функции клеток и клеточных ансамблей [15, 16], модулировать проводимость и кинетику ионных каналов [13, 17], измерять концентрации ионов [18, 19], внутриклеточных концентраций АТФ [20, 21], циклических нуклеотидов [22], активных форм кислорода [23, 24], а также контролировать поведение организмов [25, 26].
Одним из этих перспективных направлений является фотофармакология [27] – направление, в котором используются химически синтезируемые светоуправляемые (фотохромные) соединения, способные при действии определенных длин волн света избирательно усиливать или тормозить активность биологических молекул (рецепторов, ионных каналов, ферментов) в клетках организмов.
СВЕТОУПРАВЛЯЕМЫЕ МОЛЕКУЛЯРНЫЕ ПЕРЕКЛЮЧАТЕЛИ
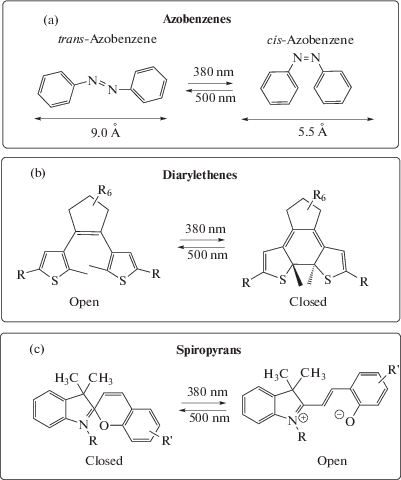
Основу химических светоуправляемых модуляторов биологических процессов составляют молекулярные переключатели – фотохромные молекулы, способные под действием света осуществлять конформационные преобразования, сопровождающиеся изменением спектральных свойств молекул. На рис. 1 представлены наиболее распространенные фотопереключатели, которые используются, в частности, для фоторегуляции функций биологических молекул: азобензолы, диарилэтены и спиропираны. При освещении определенными длинами волн, азобензолы подвергаются цис-транс изомеризации, в то время как у диарилэтенов и спиропиранов происходят превращения между открытыми и закрытыми формами.
Азобензолы (рис. 1a) были впервые описаны в 1834 г. [28], а столетие спустя, в 1937 г., Hartley опубликовал исследование влияния света на конфигурацию двойных связей N=N [29]. В настоящее время эти молекулы являются наиболее широко используемыми фотопереключателями в биологических исследованиях. Это связано с тем, что молекула азобензола: (i) удобна для синтеза при создании различных химических конструкций; (ii) имеет высокую стабильность; (iii) проявляет сильное увеличение дипольного момента при переходе из транс- в цис-конфигурацию (m = = 2–3 деб); (iv) способна к быстрым переключениям между конформационными состояниями. Очень важным свойством является изменение длины молекулы при изомеризации. При видимом свете или в темноте молекула находится в транс-конфигурации и имеет длину примерно 9.0 Å. Облучение ультрафиолетом с длиной волны 350–380 нм вызывает цис-изомеризацию азобензола, приводящую к скручиванию молекулы и укорочению почти в 2 раза: до 5.5 Å [30, 31] (рис. 1a). Многие модуляторы активности рецептор-управляемых каналов построены на базе азобензола. Некоторые из них будут представлены ниже.
Диарилэтены (рис. 1b) – это класс соединений стильбенового типа, в которых орто-атомы водорода замещены для подавления необратимого окисления после фотоциклизации [32]. Наиболее часто используемые диарилэтены – это триметилтиофенмалеиновые ангидриды и диарилперфторциклопентены [32, 33]. При переключении света из диапазона видимого света к ультрафиолетовому происходит рециклизация от открытой к закрытой форме (рис. 1b) с небольшим изменением длины молекулы и дипольного момента. Важным качеством диарилэтенов является их высокая устойчивость к переключениям: циклы переходов из открытого в закрытое состояние могут повторяться сотни раз. С другой стороны, диарилэтены не идеальны для создания специализированных светопереключателей, поскольку их изомеризация сопровождается относительно небольшими изменениями молекулярной конформации и дипольного заряда.
Спиропираны (рис. 1c) – это фотохроматические молекулы, состоящие из двух гетероциклических функциональных групп в ортогональных плоскостях, связанных атомом углерода. Облучение спиропиранов УФ-светом с длиной волны 360–380 нм приводит к разрыву связи CO, в результате структура исходной молекулы изменяется, и образуется планарная мероцианиновая форма (рис. 1c). Открытие кольца вызывает большое изменение дипольного момента (m = 7–15 деб). Из-за того, что две формы спиропиранов имеют сильно различающиеся свойства, эти молекулы нашли широкое применение в различных областях. Спиропираны используются в фотоуправляемом переносе аминокислот через бислойные мембраны, фотоконтроле ферментаивной активности, измерениях трансмембанных потенциалов [34].
В общем, в фотохромных молекулах фотоизомеризация основана либо на цис-транс- переходах (например, в азобензене) или открытии/циклизации связи (например, в спиропиранах или диарилэтенах). В разных конформационных состояниях фотохромные молекулы имеют разные геометрические формы и полярности, что может быть идеальным для управления активностью биологических молекул.
ФОТОХРОМНЫЕ МОДУЛЯТОРЫ ИОННЫХ КАНАЛОВ И РЕЦЕПТОРОВ
Для создания избирательно действующего фотохромного соединения лиганд подсоединяется ковалентно к фотохрому. В результате химического синтеза создается молекула, способная изменять конфигурацию и положение агониста под действием света. Таким образом, фотохромные модуляторы ионных каналов и рецепторных белков представляют собой модульные лиганды, способные переключаться между активной и неактивной формой при освещении определенными длинами световых волн.
Фотохромные модуляторы можно разделить на два основных класса: (i) растворимые фотохромные лиганды, состоящие из фотопереключателя и лиганда, соединенных между собой линкером определенной длины и (ii) прикрепляющиеся фотохромные лиганды – соединения, состоящие из фотопереключателя, лиганда, линкера, а также молекулярного компонента, обеспечивающего ковалентное связывание с белком-мишенью [13, 35].
Каждый класс имеет свои преимущества и ограничения. Растворимые фотохромные лиганды удобны и просты для работы с эндогенными рецепторами, поскольку не требуют молекулярной модификации белков-мишеней. Прикрепляющиеся фотохромные лиганды позволяют контролировать активность молекул мишеней с очень высокой избирательностью благодаря необратимому ковалентному связыванию молекулы в участке, близко расположенном к сайту действия агонистов. Ковалентное связывание фотохромных лигандов, содержащих малеимид, осуществляется, как правило, с остатками цистеина. В редких случаях, в естественной молекуле белка-мишени, цистеины могут быть расположенными на удобном расстоянии от активной зоны действия агониста. Поэтому, в большинстве случаев, для эффективного действия привязывающихся фотохромных лигандов требуются генетические модификации.
В последние годы были созданы фотоуправляемые химические соединения, обеспечивающие модуляцию нескольких видов потенциал-зависимых ионных каналов [36–38]. Также получены и исследованы растворимые и прикрепляющиеся фотохромные лиганды некоторых нейрональных рецепторов: глутамата [39–41], допамина [42]; АТФ-активируемых PX2 рецепторов [43]; никотиноновых рецепторов ацетилхолина [44]; рецепторов ГАМК [45–48] и рецепторов глицина [49, 50].
В данном обзоре будут кратко представлены фотохромные соединения, модулирующие функции ионотропных Цис-петельных рецепторов ацетилхолина, ГАМК и глицина.
ЦИС-ПЕТЕЛЬНЫЕ РЕЦЕПТОРЫ
Рецептор-управляемые Цис-петельные рецепторы (Cys-loop receptors) представляют собой трансмембранные белки, которые отвечают за быструю возбуждающую и тормозную синаптическую передачу в центральной и периферической нервной системе. К членам этого семейства позвоночных относятся никотиновые рецепторы ацетилхолина (нАХР), рецепторы серотонина (5-HT3Р), глицина (ГлиР) и гамма-аминомасляной кислоты (ГАМКАР и ГАМКСР) [51].
Название “Цис-петельные рецепторы” это семейство получило из-за наличия во внеклеточном домене петли, формируемой 13 аминокислотами, заключенными между двумя цистеинами, остатки которых формируют дисульфидную связь [52, 53]. Члены этого семейства имеют общую структуру, состоящую из пяти субъединиц, формирующих центральную ионопроводящую пору. В каждой субъединице выделяют большой экстраклеточный N-концевой домен (примерно 200 аминокислот), четыре альфа-спиральных трансмембранных домена (ТМ1–ТМ4, около 20 аминокислот), соединенных петлями разной длины (цитоплазматическая петля, соединяющая ТМ3- и ТМ4-домены в разных субъединицах состоит из 80–270 аминокислотных остатков) и короткого внеклеточного С-домена (примерно 10 аминокислот) [54, 55]. Пять субъединиц, из которых состоит каждый рецептор, сориентированы таким образом, что их ТМ2-домены образуют ион-избирательный канал, а ТМ1, ТМ3 и ТМ4 окружают ТМ2 и взаимодействуют с липидами цитоплазматической мембраны. В нервной системе позвоночных ионные поры, формируемые ТМ2-доменами, являются избирательными либо для катионов (нАХР и 5-HT3Р), либо для анионов (ГАМКР и ГлиР). Эти свойства определяют их функциональную значимость в возбуждающих или тормозных синаптических процессах.
Большинство рецепторов являются гетеромерами, т.е. формируются из нескольких типов субъединиц. Они могут сочетаться в различных комбинациях, давая сложный набор рецепторов с различными физиологическими и фармакологическими свойствами.
РЕЦЕПТОРЫ АЦЕТИЛХОЛИНА
В нервной системе позвоночных идентифицировано 5 основных типов трансмембранных субъединиц: α, β, δ, γ и ε. Вместе с подтипами (α1–10 и β1–4) это подсемейство состоит из 17-ти субъединиц [56]. Комбинации этого множества субъединиц обеспечивают формирование большого количества нАХР, различающихся по своим свойствам и функциональным характеристикам, включая чувствительность к агонистам, проницаемость для кальция и кинетику десенситизации [57, 58].
На периферии мышечные нАХР локализуются на постсинаптических мембранах нервно-мышечных соединений, обеспечивая быстрое управление сократимостью мышц [1, 59]. Мышечные пентамерные рецепторы имеют состав (α1)2β1γδ или (α1)2β1εδ. Уровень экспрессии и субъединичный состав нАХР изменяется в процессе развития скелетных мышц. Рецепторы эмбрионального типа состоят из субъединиц (α1)2β1γδ, а по мере развития организма субъединица γ заменяется на ε, формируя нАХР взрослого типа, (α1)2β1εδ [60, 61].
Нейрональные нАХР могут формировать гетеромерные макромолекулярные блоки, состоящие из α и β (α2–α10 и β2–β4) субъединиц, а также могут быть гомопентамерами, формируемыми α7–α9-субъединицами, и α9 в комбинации с α10 субъединицей [62, 63].
В головном мозге нейрональные нАХР локализуются преимущественно в пресинаптических участках нервных окончаний, где они регулируют высвобождение нейромедиаторов в возбуждающих и тормозных синапсах [64]. Рецепторы экспрессируются также постсинаптически и участвуют во многих функциях мозга и регуляции поведения организмов, включая обучение и память, возбуждение, вознаграждение, моторный контроль болевую чувствительность, чувство голода и сон [65]. нАХР также являются мишенью для никотина, основного вызывающего привыкание агента, доставляемого сигаретным дымом [66]. Помимо значимой роли в физиопатологии никотиновой зависимости [67], нАХР связан с развитием многих неврологических заболеваний, включая болезнь Альцгеймера, болезнь Паркинсона, шизофрению, депрессию и эпилепсию [68].
Фотохромная модуляция нАХ рецепторов
Никотиновый рецептор ацетилхолина является первым каналом, для которого был открыт способ управления с помощью светоуправляемых молекул. Более 50 лет тому назад в лаборатории Nachmansohn было показано, что химическое соединение Azo-CCh, состоящее из азобензола и карбахолина, негидролизуемого холинэстеразой агониста нАХР, а также Azo-PTA – соединения, представляющего азобензол и фенилтриметиламмоний (табл. 1), являются светоуправляемыми модуляторами активности нАХ рецепторов. Оба соединения оказались обратимыми антагонистами. При этом транс-изомер (освещение видимым светом) был сильным блокатором, а при изомеризации в цис-конформацию, вызываемую ультрафиолетовым светом, ингибирование значительно ослаблялось [69]. Эксперименты были проведены на клетках электрического угря (Elecrtophorus electricus), содержащего нАХР мышечного типа с субъединичным составом α2βγδ [70].
Таблица 1.
Фотохромные модуляторы никотиновых рецепторов ацетилхолина
| Фотохром | Структурная формула | Год | Действие | Ссылка |
|---|---|---|---|---|
| Azo-CCh | 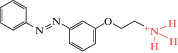 |
1969 | Trans-агонист нАХР | [69] |
| Azo-PTA | 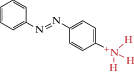 |
1969 | Trans-агонист нАХР | [69] |
| Bis-Q |  |
1971 | Trans-агонист мышечных нАХР | [71] |
| QBr |  |
1971 | Прикрепляющийся trans-агонист нАХР | [71] |
| MAACh | 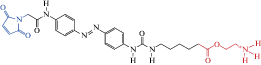 |
2012 | Прикрепляющийся cis-агонист нАХР | [44] |
| MAHoCh | 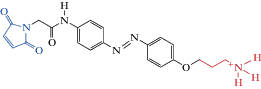 |
2012 | Прикрепляющийся trans-агонист нАХР | [44] |
| Azo-Ch |  |
2015 | Trans-агонист α7 нАХР | [72] |
В последующие годы были синтезированы производные азобензола, которые взаимодействовали с нАХР [71]. Оказалось, что соединение Bis-Q (табл. 1) в транс-конфигурации является мощным агонистом нАХР, эффективная концентрация которого в 500 раз меньше, чем карбахолина. При этом цис-изомер проявлял низкую активность. Намного позднее было показано, что Bis-Q не активирует гомомерный α7 нАХР, экспрессируемый в клетках HEK293 [72], указывая на избирательность этого фотохрома в отношении мышечного типа нАХР.
Красным выделены молекулярные участки агонистов, а синим – группа малеимида, обеспечивающая “заякоривание”, т.е. связывание фотохрома с цистеиновыми группами аминокислот.
Недавно был синтезирован фотопереключаемый агонист, азохолин (Azo-Ch) (табл. 1), который проявлял свойства противоположные Bis-Q. Этот фотохром в транс-конфигурации (транс-Azo-Ch) оказался агонистом нейронального α7 нАХР, но не проявлял активности в отношении мышечного типа нАХР [72]. Таким образом, были созданы фотохромные переключатели, избирательно модулирующие активность мышечных и нейрональных АХ-рецепторов. Соединение Bis-Q является свето-индуцируемым агонистом гетеромерных нАХ, экспрессируемых в нервно-мышечных синапсах, а Azo-Ch – агонистом нейрональных α7-рецепторов АХ.
Прикрепляющиеся фотохромные модуляторы активности нАХР. Другое соединение – QBr (табл. 1) в транс-конфигурации вызывало небольшую деполяризацию мембраны клеток Elecrtophorus electricus. После обработки клеток дитиотреитолом, агентом, вызывающим восстановление дисульфидных (S─S) связей и образование свободных сульфгидрильных (SH) групп [73, 74], транс-QBr необратимо связывался с ними в участках, близко расположенных к сайту взаимодействия агонистов с рецептором. В цис-конфигурации QBr был неактивен, а в транс-конфигурации QBr вызывал слабую активацию ионных каналов нАХР и конкурировал с карбахолином, вызывая угнетение ответов на аппликацию этого агониста [71, 75, 76]. QBr и его аналоги, называемые прикрепляющимися агонистами, были успешно использованы для анализа кинетики открытия и закрытия каналов нАХР [76–79].
В нынешнем тысячелетии создано новое поколение соединений для эффективной светоуправляемой модуляции нАХР. Новые прикрепляющиеся фотохромы обычно состоят из малеимида – для связывания с цистеиновыми группами аминокислот, фотопереключателя азобензола и лиганда для взаимодействия с рецептором (см. MAACh, табл. 1).
На основе рентгеновской структуры АХ-связывающего белка в комплексе с карбахолином [80] и определения расстояний между аминокислотными остатками в белковых структурах, в β-субъединице нАХР было выявлено несколько положений аминокислот, близко расположенных к сайту связывания лиганда и представляющих потенциальные места для присоединения агонистов и антагонистов. Это позволило осуществить целенаправленную замену на цистеины аминокислот в местах β2- и β4-субъединиц нАХР, чтобы к ним могли привязываться светоуправляемые агонисты [44].
Были синтезированы фотохромы малеимид–азобензол–ацетилхолин (MAACh) и малеимид–азобензол–гомохолин (MAHoCh) (табл. 1). Действие фотохромов было исследовано на ооцитах Xenopus, экспрессирующих мутантные субъединицы β4 в составе гетеропентамера α3β4, используя электрофизиологическую регистрацию ионных токов. В транс-конфигурации прикрепляющийся фотохром MAACh был неактивен. При освещении УФ светом (380 нм), вызывающим цис-изомеризацию МААСh, регистрировали фотоактивируемый ток через нАХР-каналы, который прекращался при облучении светом 500 нм, возвращающим фотохром в транс-конфигурацию. Прикрепляющийся MAHoCh обладал противоположным действием, проявляя свойства фотоуправляемого конкурентного антагониста. В транс-конфигурации он был неактивен, а при цис-изомеризации, вызванной УФ (380 нм), ингибировал амплитуду ацетилхолин-активируемых токов.
Таким образом, было показано, что MAACh является цис-агонистом нАХР, а MAHoCh – цис-антагонистом нАХР [44]. Создание этих фотопереключателей является перспективным для изучения физиологической и патологической роли гетеромерных нАХР в мозге.
РЕЦЕПТОРЫ ГАМК
Ионотропные ГАМК-рецепторы являются основными рецепторами, обеспечивающими быструю тормозную синаптическую передачу в ЦНС позвоночных [81]. Выброс ГАМК из пресинаптических окончаний стимулируют открытие анион-избирательных ионных каналов. При низкой концентрации внутриклеточного хлора, наблюдаемой, как правило у взрослых млекопитающих, открытие ионных каналов приводит к гиперполяризации постсинаптической мембраны и снижению нейрональной активности [82].
Из клеток ЦНС млекопитающих было клонировано 19 субъединиц ГАМК-рецепторов (α1–6, β1–3, γ1–3, δ, ε, θ, π и ρ1–3) [83]. Комбинаторная сборка пентамеров этих различных субъединиц обеспечивает потенциально огромную молекулярную гетерогенность подтипов рецепторов ГАМК. В ЦНС наиболее распространены рецепторы ГАМКА, состоящие из субъединиц α1, β2 и γ2 с определенной стехиометрией 2α:/2β/1γ (~43% всех ГАМКAР). В зависимости от субъединичного состава, подтипы рецепторов проявляют различные электрофизиологические и фармакологические свойства и модулируются множеством фармакологических препаратов, таких как бензодиазепины, барбитураты, нейроактивные стероиды, анестетики и судорожные средства [81]. Важными фармакологическими модуляторами ГАМК-рецепторов в экспериментальных исследованиях являются такие соединения, как агонист мусцимол, антаготисты – бикукуллин и габазин, блокатор хлорных каналов – пикротоксин, а также соединения из семейства бензодиазепинов и барбитуратов, которые потенцируют активность ГАМКAР, связываясь с различными аллостерическими участками на субъединицах рецепторов.
В головном мозге 17–20% всех нейронов являются ГАМКергическими, которые взаимодействуют с огромным числом различных типов нейронов [84]. Рецепторы ГАМКА модулируют тревогу, возбудимость мозга, мышечный тонус, бдительность, циркадные ритмы, обучение и память [81]. Нарушение их функционирования приводит к серьезным болезням, включая эпилепсию, депрессию, дисбаланс артериального давления, нарушение сна, шизофрению [83].
В качестве лекарственных средств используются прежде всего бензодиазепины, такие как алпразолам, клоназепам, диазепам и лоразепам, которые усиливают работу ГАМКАР, стимулируя их тормозную активность. Эти соединения являются одними из наиболее часто назначаемых лекарств [85]. Например, диазепам в период с 1968 по 1982 г. был самым продаваемым препаратом в США [86].
Однако действие этих фармакологических соединений из-за неизбирательного действия на многие участки ЦНС имеет ряд побочных эффектов. Использование фотоуправляемых агонистов и антагонистов создает основу для более специфического контроля активности ГАМК-рецепторов.
Фотоуправляемая модуляция ГАМК-рецепторов
Несколько типов фотоуправляемых модуляторов активности ионотропных ГАМК-рецепторов было создано в последние годы. Одним из первых является соединение MPC088, созданное на основе пропофола и фотоизомеризуемой группы азобензола (табл. 2). Пропофол является липофильным анестетиком, который потенцирует ГАМК-рецепторы, а при высоких концентрациях способен их активировать, взаимодействуя с β-субъединицей [87, 88].
Таблица 2.
Фотохромные модуляторы ГАМК рецепторов
| Фотохром | Структурная формула | Год | Действие | Ссылка |
|---|---|---|---|---|
| MPC088 | 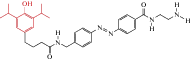 |
2012 | Trans-агонист α1β2γ2-ГАМКА рецепторов экспрессирующихся в ооцитах ксенопуса, в клетках Пуркинье и сетчатки | [46] |
| AP2 | 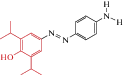 |
2012 | Trans-агонист α1β2γ2-ГАМКА рецепторов экспрессирующихся в ооцитах ксенопуса и в HEK-клетках |
[45] |
| MAM-6 | 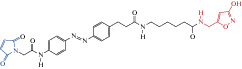 |
2014 | Trans-антагонист α1(T125C)β2γ2-GABAА рецепторов экспрессирующихся в ооцитах ксенопуса | [95] |
| MAB-0 | 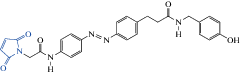 |
2014 | Cis-агонист мутантных α1(T125C)β2γ2 рецепторов экспрессирующихся в HEK-клетках |
[95] |
| PAG-1C | 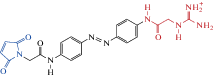 |
2015 | Trans- антагонист мутантных α1(T125C)β2γ2 ГАМКА рецепторов экспрессирующихся в HEK-клетках и нейронах гиппокампа |
[96] |
| PAG-2A | 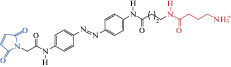 |
2015 | Cis- антагонист мутантных α1(T125C)β2γ2 ГАМКА рецепторов экспрессирующихся в HEK-клетках |
[96] |
| Azo-gabazine | 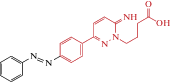 |
2016 | Trans-антагонист α1β2γ2-ГАМКА рецепторов экспрессирующихся в HEK-клетках. | [46] |
| Azo-NZ1 | 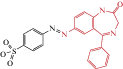 |
2018 | Trans-блокатор каналов α1β2γ2-ГАМКА и ρ2 ГАМКС экспрессирующихся в СНО клетках и нейронах срезов гиппокампа. | [47] |
| dMPC1 |  |
2018 | Trans-антагонист α1β2γ2-ГАМКА-рецепторов экспрессирующихся в HEK-клетках |
[99] |
| Fulgazepam | 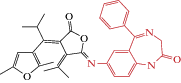 |
2020 | Аллостерический
cis-потенциатор
α1β2γ2-GABAА-рецеторов экспрессирующихся в СНО клетках и в личинках зебра рыбки in vivo |
[48] |
Используя электрофизиологическую регистрацию ионных токов в ооцитах X-enopus laevis экспрессирующих ГАМКАР в субъединичной комбинации α1β2γ2, было показано, что транс-MPC088 в низких концентрациях (1 мкМ) потенцирует ГАМК-индуцируемые токи. В дополнение к потенциации, транс-MPC088 при более высоких концентрациях функционировал как агонист, активируя ГАМКА рецепторы. Сравнительный анализ концентрационных зависимостей показал, что транс-MPC088 примерно в 25 раз эффективнее, чем пропофол [46]. В цис-конформации, вызываемой УФ-освещением (380 нм), MPC088 мало влиял на амплитуду ГАМК-индуцированных токов. Действие фотохрома MPC088 было также протестировано на нейронах Пуркинье в срезах мозжечка, которые экспрессируют преимущественно α1β2/3γ2 ГАМК-рецепторы [89]. Результаты подтвердили фотоуправляемую модуляцию ионных токов и активности потенциалов действия в клетках Пуркинье [46].
Таким образом, эти исследования показали, что MPC088 является светоуправляемым модулятором активности ГАМКАР. Широкое распространение формируемых α1β2γ2 субъединицами ГАМКАР нейронов головного мозга предполагает, что созданный на основе пропофола MPC088 может быть важным фармакологическим инструментом в исследованиях нервных цепей ЦНС.
На основе пропофола было синтезировано еще одно фотоуправляемое соединение – АР2 (табл. 2), которое в транс-конфигурации вызывало потенцирование ГАМК-ергических токов, опосредованных α1β2γ2-ГАМКА-рецепторами, экспрессируемыми в ооцитах Xenopus и HEK-клетках, в то время как цис-АР2 при облучении УФ предотвращал развитие этого эффекта потенцирования [45].
Пропофол известен как анальгетик, седативное средство, а также лекарство, облегчающее эпилептические приступы, особенно у пациентов с лекарственно устойчивой эпилепсией. Однако пропофол не является высокоизбирательным ГАМК-модулирующим соединением. Он также действует на натриевые и кальциевые каналы и является антагонистом NMDA-рецепторов [91–93]. В силу низкой избирательности он обладает рядом побочных эффектов, таких как артериальная гипотензия, брадикардия, дыхательная недостаточность и в некоторых случаях может стимулировать судороги [90, 94].
Фотопереключаемые аналоги пропофола в сочетании с локальной оптической стимуляцией и соответствующим электрическим мониторингом могут создать в будущем способы снижения побочных эффектов при лечении эпилепсии за счет использования пространственно точных оптических средств, регулирующих модуляцию рецепторов. Фокусно направленное освещение может позволить пространственно ограниченное действие фотохромных модуляторов рецепторов в локальных областях эпилептических очагов.
Было сконструировано также несколько прикрепляющихся фотопереключателей, модулирующих активность ГАМК-рецепторов. МАМ-6 (табл. 2) состоит из малеимида, который обеспечивает ковалентное связывание фотохрома с SH группами, фотопереключателя азобензена и присоединенного к азобензену через углеродный ((СН2)6) линкер мусцимола, последний является мощным селективным агонистом ГАМКАР. Для обеспечения связывания фотохрома с аминокислотным участком, близким к активному центру ГАМК-рецептора, в альфа-субъединице была произведена точечная мутация α1(T125C). Электрофизиологический анализ проводился на ооцитах Xenopus laevis, экспрессирующих α1(T125C)β2 конфигурацию ГАМКAР. Ковалентное связывание фотохрома с α1(T125C)-субъединицей не вызывало активации ГАМК-рецепторов. Однако в транс-конфигурации (освещение 500 нм), МАМ-6 ингибировал амплитуду ГАМК-активируемых токов, связываясь c активным центром рецептора и блокируя действие нейромедиатора. В цис-конфигурации (освещение 380 нм), сайт связывания с агонистом освобождался и наблюдалось повышение амплитуды ГАМК-активируемых токов [95].
Другое соединение, малеимид-азобензол-4-гидроксибензиламин (МАB-0), которое содержит нейтральный аналог мусцимола и не имеет углеродного линкера (табл. 2), было даже более эффективным светочувствительным ингибитором ГАМКАР. После обработки MAB-0 культивируемые нейроны гиппокампа, экспрессирующие α1(T125C)β2 ГАМК-рецепторы, эффективно модулировались светом [95].
Таким образом, соединения МАМ-6 и МАB-0, созданные на основе мусцимола, проявляли свойства светоуправляемых транс-антагонистов ГАМКАР. Однако слабая эффективность и низкая растворимость (<50 мМ) затрудняла их экспериментальное использование, особенно in vivo. Для повышения эффективности были созданы новые фотохромные модуляторы ГАМКАР, где в качестве лиганда использовалась ГАМК или ее гуанидиниевые аналоги (серия PAG) (табл. 2) [96].
Соединения были исследованы in vitro на рецепторах, формируемых из разных α-ГАМК-субъединиц, а также in vivo. Было показано, что в темноте или при освещении видимым светом (480–560 нм) транс-изомеры не активны, а при УФ-освещении (380 нм), в цис-конфигурации фотохромы блокируют ГАМК-рецепторы, являясь антагонистами естественного нейромедиатора, выделяющегося из пресинаптических окончаний [96].
Еще один светоуправляемый антагонист ГАМК-рецепторов, азогабазин (табл. 2) [97], был создан путем объединения фотопереключателя азобензола с габазином, высокоизбирательным конкурентным антагонистом ГАМКАР [98]. Электрофизиологический анализ на культивируемых клетках HEK293, экспрессирующих α1β2γ2 ГАМКАР, показал, что азогабазин является одним из наиболее сильных антагонистов с IC50 = 23 nM. Блокирующее действие проявлял транс-азогабазин (освещение 470 нм), в то время как цис-азогабазин (освещение 365 нм) был не эффективным. Таким образом, этот фотохром является мощным, высокоизбирательным и светоуправляемым антагонистом ГАМКАР, представляющим большой интерес для исследования в различных экспериментальных моделях.
Фотохромные соединения, созданные на основе азобензола, не способны находиться длительное время в метастабильном состоянии при транс/цис-изомеризации, что затрудняет их использование в некоторых экспериментальных моделях. Эта проблема была решена в недавней работе из лаборатории Kramer [99]. Было синтезировано соединение dMPC1 (табл. 2), которое позволяет двунаправленное управление рецепторами с помощью света с длиной волны 380 и 500 нм. На НЕК-клетках, экспрессирующих ГАМКАР, было показано, что фотохром dMPC1 может на длительное время заблокировать рецепторы в активном или неактивном состоянии в темноте после короткого импульса света [99]. Таким образом, эта стратегия обеспечивает как быстрое, так и длительное манипулирование тормозной синаптической передачей, позволяя исследовать функции нейрональных сетей в широком диапазоне временных интервалов.
Как уже отмечалось, одним из наиболее используемых фармакологических соединений, усиливающих активность ионотропных ГАМКАР, является диазепам, классическое соединение, вызывающее потенциацию ГАМК-рецепторов через аллостерический сайт и широко используемое для предотвращения эпилептических кризов [85, 86, 100–102]. В предположении получить управляемый светом потенцирующий агент, который будет аллостерически взаимодействовать с бензодиазепиновым сайтом ГАМКАР, было синтезировано соединение азобензол-нитразепам (Азо-NZ1), состоящее из фрагмента нитразепама, слитого с фотоизомеризуемой группой азобензола (табл. 2) [47]. Однако экспериментальный анализ на СHO-клетках, экспрессирующих в условиях культуры ткани рецепторы известного субъединичного состава, показал, что Аzо-NZ1 является не потенциатором, а светоуправляемым антагонистом ГАМК-индуцируемых токов. Транс-Azo-NZ1 (освещение видимым светом 460–560 нм) блокировал анион-избирательные каналы гетеромерных ГАМКАР (α1/β2/γ2), а также одного из подтипов гомомерных ГАМКС (ρ2). Было показано, что транс-Azo-NZ1 взаимодействует с 2'-уровнем трансмембранного домена (TM2), формирующего анионную пору. В цис-конфигурации Azo-NZ1 освобождал пору, был неактивен и амплитуда ГАМК-активируемых токов восстанавливалась. Было также показано, что Azo-NZ1 модулирует светозависимым образом синаптические ГАМКергические токи в нейронах срезов гиппокампа мышей, вызывая их ингибирование в транс-конфигурации [47].
Таким образом, Azo-NZ1 проявляет свойства фотоуправляемого неконкурентного антагониста рецепторов GABAA, взаимодействуя с аминокислотными остатками, формирующими анионный канал.
Другой фотохром, фульгазепам (Fulgazepam, табл. 2), созданный на базе диазепама и фульгимида (из семейства диарилитенов, рис. 1), оказался потенцирующим соединением. Электрофизиологический in vitro анализ на линии культивируемых клеток, гетерологически экспрессирующих α1/β2/γ2 субъединицы ГАМКАР, показал, что аппликация фульгазепама (10 мкМ) в открытой форме (освещение видимым светом) практически не влияла на амплитуду токов, индуцируемых ГАМК (0.5 мкМ). Однако при УФ-освещении, переводящим фульгазепам в закрытую форму, наблюдалось повышение амплитуды ГАМК-индуцируемых токов в 200–300 раз. Анализ концентрационных зависимостей показал, что EC50 для фульгазепама в закрытой форме составляет 13 мкМ [48].
Таким образом, создан новый фотоуправляемый потенциатор ГАМКАР, обладающий уникальными свойствами: а) под действием соответствующих длин волн обеспечивается обратимое переключение соединения из открытого в закрытое состояние; б) оба состояния стабильны; в) в открытой форме соединение является нейтральным. Эти свойства указывают на потенциальную важность фульгазепама, как фотоуправляемого аллостерического потенциатора ГАМК-рецепторов.
В общем, “библиотека” фотохромных соединений, способных модулировать активность ГАМК-рецепторов, достаточно обширна и открывает большие возможности для анализа ГАМК-зависимых процессов торможения и возбуждения в нейронных сетях и моделях нейрональных патологий.
РЕЦЕПТОРЫ ГЛИЦИНА
Глициновые рецепторы (ГлиР), как и ионотропные ГАМКР формируют анион-избирательные ионные каналы и обеспечивают быстрое торможение в нервной системе млекопитающих. ГлиР экспрессируются преимущественно в спинном мозге и стволе мозга, а также во многих других областях нервной системы, включая сетчатку [103], гиппокамп [104–106], зубчатую фасцию [107], кору мозжечка [108], слуховое и вестибулярное ядра [109] и другие части головного мозга [104, 110, 111].
Из мозга млекопитающих выделено и клонировано четыре подтипа α-субъединиц ГлиР (α1, α2, α3, α4), которые на 90% гомологичны между собой [112, 113] и β-субъединицу, которая имеет 47% гомологии с α1 [114]. Аналогичный набор субъединиц характерен для нервной системы зебра рыбки Danio rerio [115–117]. Субъединицы α1, α2 и α3 могут формировать функциональные гомомерные ГлиР, а комбинации с β-субъединицей они формируют гетеромерные рецепторы. Однако β-субъединица не обладает способностью формировать функциональные гомомерные рецепторы [118, 119]. Субъединица β является наиболее распространенной по сравнению с другими субъединицами. Ее важным свойством является наличие в цитоплазматическом домене участка связывания с джеферином – арматурным белком, играющим ключевую роль в формировании синаптических кластеров [120–122]. Другими словами, эта субъединица обеспечивает синаптическую локализацию ГлиР.
Свойства гомомерных и гетеромерных рецепторов проявляют функциональные и фармакологические различия: проводимость одиночных каналов [119], действие блокаторов [123, 124], синаптическая и экстрасинаптическая экспрессия [125]. Cубъединичный состав ГлиР меняется в процессе онтогенеза. В период эмбриогенеза и на ранних стадиях постнатального развития наиболее распространенной является α2-субъединица, а в ЦНС взрослых млекопитающих преобладает α1-субъединица [110, 126].
Фотохромные модуляторы рецепторов глицина
Недавно создано два первых фотохромных модулятора активности ГлиР [49, 50]. Оба соединения созданы на базе азобензола и диазепама (табл. 3).
Таблица 3.
Фотохромные модуляторы рецепторов глицина
| Фотохром | Структурная формула | Год | Действие | Ссылка |
|---|---|---|---|---|
| Azo-NZ1 | 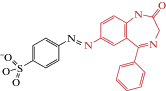 |
2018 | Trans-блокатор каналов ГлиР α2
экспрессирующихся в CHO клетках
и синапрических ГлиР в срезах неонатального мозга |
[46] |
| Glight | 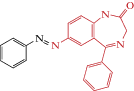 |
2020 | Trans-блокатор каналов α1β2γ2-ГАМКА and ρ2 ГАМКC рецепторов receptors экспрессирующихся в CHO клетках и синапрических ГлиР в срезах гиппокампа |
[47] |
Первое соединение – это описанный выше фотохром Azo-NZ1. Поскольку Azo-NZ1 является светоуправляемым блокатором хлор-избирательных каналов рецепторов ГАМК, то необходимо было выяснить, действует ли фотохром на другие типы анион-избирательных каналов, формируемых разными субъединицами ГлиР. В линиях культивируемых клеток, экспрессирующих рецепторы известного субъединичного состава, показано, что фотохром Azo-NZ1 оказывал слабый эффект на глицин-активируемые токи в клетках, экспрессирующих гомомерные α-ГлиР и гетеромерные ГлиР, формируемые α1/β-субъединицами. С другой стороны, Azo-NZ1 вызывал сильное угнетение амплитуды глицин-активируемых токов в клетках, экспрессирующих гомомерные α2-ГлиР и гетеромерные ГлиР, формируемые α2/β-субъединицами. С помощью целенаправленного мутагенеза трансмембранного домена, формирующего анион-избирательную пору, был определен сайт взаимодействия Azo-NZ1 с ГлиР. В дополнение к анализу на ГАМКАР, было показано, что в ГлиР аминокислота в положении 2' поры ионного канала имеет решающее значение для блокирующего действия Azo-NZ1 [49].
Результаты, полученные при гетерологической экспрессии ГлиР известного субъединичного состава, предполагают, что Azo-NZ1 может быть эффективным светоуправляемым модулятором активности глицинергических синапсов на ранних фазах постнатального развития, взаимодействуя с “неонатальными” рецепторами, формируемыми альфа2-субъединицами.
Эту гипотеза была проверена на мотонейронах гипоглоссального ядра срезов ствола мозга мышей, имеющих мощные глицинергические синаптические входы [127, 128]. Известно, что экспрессия подтипов ГлиР регулируется в процессе развития: при рождении и в первые постнатальные дни у грызунов преобладают альфа2-субъединицы ГлиР, но в течение двух недель постнатальной жизни экспрессия альфа1-субъединицы резко увеличивается и на взрослых этапах становится преобладающей [110, 129, 130]. Сравнительный анализ вызванных постсинаптических глицинергических токов был проведен на мотонейронах гипоглоссального ядра срезов мозга мышей на разных стадиях постнатального развития. Было показано, что Azo-NZ1 в транс-конфигурации блокирует вызванные постсинаптические токи, опосредованные ГлиР, сформированными “неонатальными” альфа2-субъединицами, и мало влияет на токи, опосредованные рецепторами, сформированными “взрослыми” альфа1-субъединицами. Облучение ультрафиолетом, переводящее фотохром в цис-конфигурацию, устраняет действие Azo-NZ1 на “неонатальные” альфа2-ГлиР в срезах мозга. Эти результаты показывают, что Azo-NZ1 является светоуправляемым модулятором глицинергичесих синапсов неонатального мозга.
Второй фотохромный модулятор ГлиР, названный Glyght (табл. 3), синтезирован на основе 7-амино-нитразепама и 2-нитропиридина. Как и другие азобензольные производные бензодиазепина, Glyght при облучении УФ переходит в цис-конфигурацию, а при облучении синим или видимым светом – в транс-конфигурацию [50]. На мотонейронах гипоглоссального ядра срезов мозга неонатальных мышей показано, что в транс-конфигурации Glyght является “инертным”, т.е. не оказывает влияния на вызванные глицинергические постсинаптические токи. Освещение УФ (цис-Glyght) приводило к снижению амплитуды токов. Анализ in vivo показал, что Glyght эффективно влияет на поведение зебра рыбок Dario rerio [50].
Таким образом, фотохромные соединения Azo-NZ1 и Glyght являются модуляторами ГлиР, и их использование является перспективным для контроля тормозных процессов в нервной системе млекопитающих.
ЗАКЛЮЧЕНИЕ
В целом, представленные данные показывают, что фотофармакология является чрезвычайно перспективным направлением, открывающим уникальные возможности для дистанционной стимуляции нейронов. При этом, как правило, не требуются генетические манипуляции для создания высокоизбирательных светоуправляемых фармакологических препаратов, воздействующих на определенные участки мозга.
Одним из важных ограничений широкого использования азобензолов так же, как и других фотопереключателей, является необходимость освещения короткими длинами волн ультрафиолетового диапазона, которые могут вызывать отрицательное воздействие на функции биологических молекул. Однако в последние годы разрабатываются азобензольные переключатели в красном диапазоне световых волн [131].
Использование света в качестве регулятора активности биологических молекул открывает возможности для точного пространственного и временного контроля активностью клеток, органов и целых организмов. Эти особенности являются важными для физиологического анализа функций нервной системы и, возможно, в будущем – обеспечения мощных и избирательных контролируемых светом терапевтических воздействий.
Список литературы
Магазаник Л.Г. (1968) Механизм десенситизации постсинаптической мембраны мышечных волокон. Биофизика. 13(1): 199–202. [Magazanik L.G. (1968) On the mechanism of desensitization of the muscle fiber postsynaptic membrane. Biofizika. 13(1): 199–202 (In Russ)].
Magazanik L.G., Nasledov G.A. (1970) Desensitization to acetylcholine of frog tonic muscle fibres. Nature. 226(5243): 370–371.
Magazanik L.G., Vyskocit F. (1975) The effect of temperature on desensitization kinetics at the post-synaptic membrane of the frog muscle fibre. J. Physiol. 249(2): 285–300.
Magazanik L.G., Snetkov V.A., Giniatullin R.A., Khazipov R.N. (1990) Changes in the time course of miniature endplate currents induced by bath-applied acetylcholine. Neurosci. Lett. 113(3): 281–285.
Giniatullin R.A., Magazanik L.G. (1998) Desensitization of the post-synaptic membrane of neuromuscular synapses induced by spontaneous quantum secretion of mediator. Neurosci. Behav. Physiol. 28(4): 438–442.
Magazanik L.G. (1976) Functional properties of postjunctional membrane. Annu. Rev. Pharmacol. Toxicol. 16(1): 161–175.
Magazanik L.G. (2000) Blockade of ion channels as an approach to studying AMPA receptor subtypes. Neurosci. Behav. Physiol. 30(1): 27–35.
Тихонов Д.Б., Магазаник Л.Г. (2008) Происхождение и молекулярная эволюция ионотропных рецепторов глутaматa. Рос. физиол. журн. им. И.М. Сеченова. 94(9): 989–1004. [Tikhonov D.B., Magazanik L.G. (2008) Origin and molecular evolution of ionotropic glutamate receptors. Russ. J. Physiol. 94(9): 989–1004 (In Russ)].
Калеменев С.В., Зубарева О.Е., Лукомская Н.Я., Магазаник Л.Г. (2012) Нейропротекторное действие неконкурентных блокаторов NMDA-рецепторов ИЭМ-1957 и мемантина на модели фокальной ишемии мозга. Докл. Акад. наук. 443 (6): 750–750. [Kalemenev S.V., Zubareva O.E., Lukomskaya N.Y., Magazanik L.G. (2012) Neuroprotective effect of noncompetitive NMDA receptor antagonists IEM-1957 and memantine in experimental focal cerebral ischemia. Dokl. Biol. Sci. 443(1): 78–80 (In Russ)].
Ватаев С.И., Оганесян Г.А., Лукомская Н.Я., Магазаник Л.Г. (2013) Влияние блокаторов каналов ионотропных глутаматных рецепторов на эффекты депривации сна у крыс. Рос. физиол. журн. им И.М. Сеченова. 99(5): 575–585. [Vataev S.I., Oganesian G.A., Lukomskaia N., Magazanik L.G. (2013) The action of ionotropic glutamate receptor channel blockers on effects of sleep deprivation in rats. Russ. J. Physiol. 99(5): 575–585 (In Russ)].
Malkin S.L., Kim K.K., Tikhonov D.B., Magazanik L.G., Zaitsev A.V. (2015) Statistical models suggest presence of two distinct subpopulations of miniature EPSCs in fast-spiking interneurons of rat prefrontal cortex. Neuroscience. 301: 508–519. https://doi.org/:10.1016/j.neuroscience.2015.06.034
Чижов А.В., Амахин Д.В., Зайцев А.В., Магазаник Л.Г. (2018) AMPAR-опосредованные интериктальные разряды в нейронах энторинальной коры: эксперимент и модель. Докл. Акад. наук. 479(1): 103–106 [Chizhov A.V., Amakhin D.V., Zaizev A.V., Magazanik L.G. (2018) AMPAR-mediated interictal discharges in neurons of entorhinal cortex: experiment and model. Dokl. Biol. Sci. 479(1): 47–50 (In Russ)]. https://doi.org/:10.1134/S0012496618020011
Bregestovski P., Maleeva G., Gorostiza P. (2018) Light-induced regulation of ligand-gated channel activity. Br. J. Pharmacol. 175(11): 1892–1902. https://doi.org/:10.1111/bph.14022
Lin W.C., Tsai M.C., Rajappa R., Kramer R.H. (2018) Design of a highly bistable photoswitchable tethered ligand for rapid and sustained manipulation of neurotransmission. J. Am. Chem. Soc. 140(24): 7445–7448. https://doi.org/:10.1021/jacs.8b03942
Deisseroth K. (2011) Optogenetics. Nat. Methods. 8(1): 26–29. https://doi.org/:10.1038/nmeth.f.324
Kim C.K., Adhikari A., Deisseroth K. (2017) Integration of optogenetics with complementary methodologies in systems neuroscience. Nat. Rev. Neurosci. 18(4): 222–235. https://doi.org/:10.1038/nrn.2017.15
Gorostiza P., Isacoff E.Y. (2008) Optical switches for remote and noninvasive control of cell signaling. Science. 322(5900): 395–399. https://doi.org/:10.1126/science.1166022
Bregestovski P., Waseem T., Mukhtarov M. (2009) Genetically encoded optical sensors for monitoring of intracellular chloride and chloride-selective channel activity. Front. Mol. Neurosci. 2(15). https://doi.org/:10.3389/neuro.02.015.2009
Suzuki J., Kanemaru K., Iino M. (2016) Genetically encoded fluorescent indicators for organellar calcium imaging. Biophys. J. 111(6): 1119–1131. https://doi.org/:10.1016/j.bpj.2016.04.054
Imamura H., Nhat K.P.H., Togawa H., Saito K., Iino R., Kato-Yamada Y., Nagai T., Noji H. (2009) Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators. Proc. Natl. Acad. Sci. U S A. 106(37): 15651–15656. https://doi.org/:10.1073/pnas.0904764106
Berg J., Hung Y.P., Yellen G. (2009) A genetically encoded fluorescent reporter of ATP: ADP ratio. Nat. Methods. 6(2): 161–166. https://doi.org/:10.1038/nmeth.1288
Schumacher C.H., Körschen H.G., Nicol C., Gasser C., Seifert R. Schwärzel M., Möglich A. (2016) A fluorometric activity assay for light-regulated cyclic-nucleotide-monophosphate actuators. Methods. Mol. Biol. 1408: 93–105. https://doi.org/:10.1007/978-1-4939-3512-3_7
Wojtovich A.P., Foster T.H. (2014) Optogenetic control of ROS production. Redox. Biol. 2: 368–376. https://doi.org/:10.1016/j.redox.2014.01.019
Bilan D.S., Pase L., Joosen L., Gorokhovatsky A.Y., Ermakova Y.G., Gadella T., Grabher C., Schultz C., Lukyanov S., Belousov V.V. (2013) HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chem. Biol. 8(3): 535–542. https://doi.org/:10.1021/cb300625g
Covington H.E., Lobo M.K., Maze I., Vialou V., Hyman J.M., Zaman S., LaPlant Q., Mouzon E., Ghose S., Tamminga C.A., Neve R.L., Deisseroth K., Nestler E.J. (2010) Antidepressant effect of optogenetic stimulation of the medial prefrontal cortex. J. Neurosci. 30(48): 16082–16090. https://doi.org/:10.1523/JNEUROSCI.1731-10.2010
Haubensak W., Kunwar P.S., Cai H., Ciocchi S., Wall N.R., Ponnusamy R., Biag J., Dong H., Deisseroth K., Callaway E.M., Fanselow M.S., Lüthi A., Anderson D.J. (2010) Genetic dissection of an amygdala microcircuit that gates conditioned fear. Nature. 468(7321): 270–276. https://doi.org/:10.1038/nature09553
Velema A., Szymanski W., Feringa B.L. (2014) Photopharmacology: beyond proof of principle. J. American. Chem. Soc. 136(6): 2178–2191. https://doi.org/:10.1021/ja413063e
Mitscherlich E. (1834) Uber das stickstoffbenzid. Ann. der Physik. 108(15): 225–227.
Hartley G.S. (1937) The cis-form of azobenzene. Nature. 140(3537): 281–281.
Merino E., Ribagorda M. (2012) Control over molecular motion using the cis–trans photoisomerization of the azo group. Beilstein. J. Org. Chem. 8(1): 1071–1090. https://doi.org/:10.3762/bjoc.8.119
Koshima H., Ojima N., Uchimoto H. (2009) Mechanical motion of azobenzene crystals upon photoirradiation. J. Am. Chem. Soc. 131(20): 6890–6891. https://doi.org/:10.1021/ja8098596
Irie M. (2000) Diarylethenes for memories and switches. Chem. Rev. 100(5): 1685–1716. https://doi.org/:10.1021/cr980069d
Lubbe A.S., Szymanski W., Feringa B.L. (2017) Recent developments in reversible photoregulation of oligonucleotide structure and function. Chem. Soc. Rev. 46(4): 1052–1079. https://doi.org/:10.1039/c6cs00461j
Klajn R. (2014) Spiropyran-based dynamic materials. Chem. Soc. Rev. 43(1): 148–184. https://doi.org/:10.1039/c3cs60181a.
Lin W.C., Kramer R.H. (2018) Light-Switchable Ion Channels and Receptors for Optogenetic Interrogation of Neuronal Signaling. Bioconjug. Chem. 29(4): 861–869. https://doi.org/:10.1021/acs.bioconjchem.7b00803
Fortin D.L., Dunn T.W., Fedorchak A., Allen D., Montpetit R., Banghart M.R., Trauner D., Adelman J.P., Kramer R.H. (2011) Optogenetic photochemical control of designer K+ channels in mammalian neurons. J. Neurophysiol. 106(1): 488–496. https://doi.org/:10.1152/jn.00251.2011
Leippe P., Winter N., Sumser M.P., Trauner D. (2018) Optical control of a delayed rectifier and a two-pore potassium channel with a photoswitchable bupivacaine. ACS Chem. Neurosci. 9(12): 2886–2891. https://doi.org/:10.1021/acschemneuro.8b00279
Trads J.B., Hüll K., Matsuura B.S., Laprell L., Fehrentz T., Görldt N., Kozek K.A., Weaver C.D., Klöcker N., Barber D.M., Trauner D. (2019) Sign inversion in photopharmacology: Incorporation of cyclic azobenzenes in photoswitchable potassium channel blockers and openers. Angew. Chem. Int. Ed. Engl. 58(43): 15421–15428. https://doi.org/:10.1002/anie.201905790
Volgraf M., Gorostiza P., Numano R., Kramer R.H., Isacoff E.Y., Trauner D. (2006) Allosteric control of an ionotropic glutamate receptor with an optical switch. Nat. Chem. Biol. 2(1): 47–52. https://doi.org/:10.1038/nchembio756
Gorostiza P., Volgraf M., Numano R., Szobota S., Trauner D., Isacoff E.Y. (2007) Mechanisms of photoswitch conjugation and light activation of an ionotropic glutamate receptor. Proc. Natl. Acad. Sci. 104(26): 10865–10870. https://doi.org/:10.1073/pnas.0701274104
Laprell L., Repak E., Franckevicius V., Hartrampf F., Terhag J., Hollmann M., Sumser M., Rebola N., DiGregorio D.A., Trauner D. (2015) Optical control of NMDA receptors with a diffusible photoswitch. Nat. Commun. 6(1): 1–11. https://doi.org/:10.1038/ncomms9076
Donthamsetti P.C., Winter N., Schönberger M., Levitz J., Stanley C., Javitch J.A., Isacoff E.Y., Trauner D. (2017) Optical control of dopamine receptors using a photoswitchable tethered inverse agonist. J. Am. Chem. Soc. 139(51): 18522–18535. https://doi.org/:10.1021/jacs.7b07659
Lemoine D., Habermacher C., Martz A., Méry P.F., Bouquier N., Diverchy F., Taly A., Rassendren F., Specht A., Grutter T. (2013) Optical control of an ion channel gate. Proc. Natl. Acad. Sci. U S A. 110(51): 20813–20818. https://doi.org/:10.1073/pnas.1318715110
Tochitsky I., Banghart M.R., Mourot A., Yao J.Z., Gaub B., Kramer R.H., Trauner D. (2012) Optochemical control of genetically engineered neuronal nicotinic acetylcholine receptors. Nat. Chem. 4(2): 105–111. https://doi.org/:10.1038/nchem.1234
Stein M., Middendorp S.J., Carta V., Pejo E., Raines D.E., Forman S.A., Sigel E., Trauner D. (2012) Azo-propofols: photochromic potentiators of GABAA receptors. Angew. Chem. Int. Ed. Engl. 51(42): 10500–10504. https://doi.org/:10.1002/anie.201205475
Yue L., Pawlowski M., Dellal S.S., Xie A., Feng F., Otis T.S., Bruzik K.S., Qian H., Pepperberg D.R. (2012) Robust photoregulation of GABA A receptors by allosteric modulation with a propofol analogue. Nat. Commun. 3(1): 1–12. https://doi.org/:10.1038/ncomms2094
Maleeva G., Wutz D., Rustler K., Nin-Hill A., Rovira C., Petukhova E., Bautista-Barrufet A., Gomila-Juaneda A., Scholze P., Peiretti F., Alfonso-Prieto M., König B., Gorostiza P., Bregestovski P. (2019) A photoswitchable GABA receptor channel blocker. Br. J. Pharmacol. 176(15): 2661–267. https://doi.org/:10.1111/bph.14689
Rustler K., Maleeva G., Gomila A.M., Gorostiza P., Bregestovski P., König B. (2020) Optical Control of GABAA Receptors with a Fulgimide-Based Potentiator. Chemistry. 26(56): 12722–12727. https://doi.org/:10.1002/chem.202000710
Maleeva G., Nin-Hill A., Rustler K., Petukhova E., Ponomareva D., Mukhametova E., Gomila-Juaneda A., Wutz D., Alfonso-Prieto M., König B., Gorostiza P., Bregestovski P. (2021) Subunit-specific photocontrol of glycine receptors by azobenzene-nitrazepam photoswitcher. eNeuro. 8(1). https://doi.org/:10.1523/ENEURO.0294-20.2020
Gomila A.M., Rustler K., Maleeva G., Nin-Hill A., Wutz D., Bautista-Barrufet A., Rovira X., Bosch M., Mukhametova E., Petukhiva E., Ponomareva D., Mukhamedyarov M., Peiretti F., Alfonso-Prieto M., Rovira C., König B., Bregestovski P., Gorostiza P. (2020) Photocontrol of endogenous glycine receptors in vivo. Cell. Chem. Biol. 27(11): 1425–1433. https://doi.org/:10.1016/j.chembiol.2020.08.005
Thompson A.J., Lester H.A., Lummis S.C. (2010) The structural basis of function in Cys-loop receptors. Q Rev. Biophy.s 43(4): 449–499. https://doi.org/:10.1017/S0033583510000168
Ortells M.O. Lunt G.G. (1995) Evolutionary history of the ligand-gated ion-channel superfamily of receptors. Trends. Neurosci. 18(3): 121–127. https://doi.org/:10.1016/0166-2236(95)93887-4
Karlin A., Akabas M.H. (1995) Toward a structural basis for the function of nicotinic acetylcholine receptors and their cousins. Neuron. 15(6): 1231–1244.
Вульфиус Е.А. (2006) α7-Подтип нейрональных никотиновых рецепторов ацетилхолина: структура, свойства, распространение, функции. Биол. Мембр. 23(2): 111–118 [Vulfius C.A. (2006) α7-subtype of neuronal nicotinic acetylcholine receptors: structure, properties, distribution, functions. Biol. Membr. 23(2): 111–118 (In Russ)].
Малеева Г.В., Брежестовский П.Д. (2014) Молекулярная физиология рецепторов глицина в нервной системе позвоночных. Рос. физиол. журн. им И.М. Сеченова 100(3): 274–300 [Maleeva G.V., Bregestovski P.D. (2014) Molecular physiology of glycine receptors in nervous system of vertebrates. Russ. J. Physiol. 100(3): 274–300 (In Russ)].
Millar N.S., Gotti C. (2009) Diversity of vertebrate nicotinic acetylcholine receptors. Neuropharmacology 56(1): 237–246. https://doi.org/:10.1016/j.neuropharm.2008.07.041
Karlin A. (2002) Emerging structure of the nicotinic acetylcholine receptors. Nat. Rev. Neurosci. 3(2): 102–114. https://doi.org/:10.1038/nrn731
Changeux J.P. (2012) The nicotinic acetylcholine receptor: the founding father of the pentameric ligand-gated ion channel superfamily. J. Biol. Chem. 287(48): 40207–40215. https://doi.org/:10.1074/jbc.R112.407668
Miledi R. (1960) Junctional and extrajunctional acetylcholine receptors in skeletal muscle fibres. J. Physiol. 151(1): 24–30.
Mishina M., Takai T., Imoto K., Noda M., Takahashi T., Numa S., Methfessel C., Sakmann B. (1986) Molecular distinction between fetal and adult forms of muscle acetylcholine receptor. Nature. 321(6068): 406–411.
Hall Z.W., Sanes J.R. (1993) Synaptic structure and development: the neuromuscular junction. Cell. 72: 99–121.
McGehee D.S., Role L.W. (1995) Physiological diversity of nicotinic acetylcholine receptors expressed by vertebrate neurons. Annu. Rev. Physiol. 57(1): 521–546.
Kalamida D., Poulas K., Avramopoulou V., Fostieri E., Lagoumintzis G., Lazaridis K., Sideri A., Zouridakis M., Tzartos S.J. (2007) Muscle and neuronal nicotinic acetylcholine receptors. Structure, function and pathogenicity. FEBS J. 274(15): 3799–3845. https://doi.org/:10.1111/j.1742-4658.2007.05935.x
Gotti C., Zoli M., Clementi F. (2006) Brain nicotinic acetylcholine receptors: native subtypes and their relevance. Trends. Pharmacol. Sci. 27(9): 482–491. https://doi.org/:10.1016/j.tips.2006.07.004
Hogg R.C., Raggenbass M., Bertrand D. (2003) Nicotinic acetylcholine receptors: from structure to brain function. Rev. Physiol. Biochem. Pharmacol. 147: 1–46. https://doi.org/:10.1007/s10254-003-0005-1
Benowitz N.L. (2009) Pharmacology of nicotine: addiction, smoking-induced disease, and therapeutics. Annu. Rev. Pharmacol. Toxicol. 49: 57–71. https://doi.org/:10.1146/annurev.pharmtox.48.113006.094742
Dani J.A., De Biasi M. (2013) Mesolimbic dopamine and habenulo-interpeduncular pathways in nicotine withdrawal. Cold. Spring. Harb. Perspect. Med. 3(6): a012138. https://doi.org/:10.1101/cshperspect.a012138
Posadas I., López-Hernández B., Ceña V. (2013) Nicotinic receptors in neurodegeneration. Curr. Neuropharmacol. 11(3): 298–314. https://doi.org/:10.2174/1570159X11311030005
Deal W.J., Erlanger B.F., Nachmansohn D. (1969) Photoregulation of biological activity by photochromic reagents, III. Photoregulation of bioelectricity by acetylcholine receptor inhibitors. Proc. Natl. Acad. Sci. U S A. 64(4): 1230–1234. https://doi.org/:10.1073/pnas.64.4.1230
Conti-Tronconi B.M., Hunkapiller M.W., Lindstrom J.M., Raftery M.A. (1982) Subunit structure of the acetylcholine receptor from Electrophorus electricus. Proc. Natl. Acad. Sci. U S A. 79(21): 6489–6493.
Bartels E., Wassermann N.H., Erlanger B.F. (1971) Photochromic activators of the acetylcholine receptor. Proc. Natl. Acad. Sci. U S A. 68(8): 1820–1823.
Damijonaitis A., Broichhagen J., Urushima T., Hüll K., Nagpal J., Laprell L., Schönberger M., Woodmansee D.H., Rafiq A., Sumser M.P., Kummer W., Gottschalk A., Kummer W. (2015) AzoCholine enables optical control of alpha 7 nicotinic acetylcholine receptors in neural networks. ACS Chem. Neurosci. 6(5): 701–707. https://doi.org/:10.1021/acschemneuro.5b00030
Karlin A. (1969) Chemical modification of the active site of the acetylcholine receptor. J. Gen. Physiol. 54(1): 245–264.
Bregestovski P.D., Iljin V.I., Jurchenko O.P., Veprintsev B.N., Vulfius C.A. (1977) Acetylcholine receptor conformational transition on excitation masks disulphide bonds against reduction. Nature. 270(5632): 71–73.
Sheridan R.E., Lester H.A. (1982) Functional stoichiometry at the nicotinic receptor. The photon cross section for phase 1 corresponds to two bis-Q molecules per channel. J. Gen. Physiol. 80(4): 499–515.
Lester H.A., Krouse M.E., Nass M.M., Wassermann N.H., Erlanger B.F. (1980) A covalently bound photoisomerisable agonist. Comparison with reversibly bound agonists at Electrophorus electroplaques. J. Gen. Physiol. 75(2): 207–232.
Lester H.A., Krouse M.E., Nass M.M., Wassermann N.H., Erlanger B.F. (1979) Light-activated drug confirms a mechanism of ion channel blockade. Nature. 280(5722): 509–510.
Krouse M.E., Lester H.A., Wassermann N.H., Erlanger B.F. (1985) Rates and equilibria for a photoisomerizable antagonist at the acetylcholine receptor of Electrophorus electroplaques. J. Gen. Physiol. 86(2): 235–256.
Chabala L.D., Gurney A.M., Lester H.A. (1986) Dose-response of acetylcholine receptor channels opened by a flash-activated agonist in voltage-clamped rat myoballs. J. Physiol. 371(1): 407–433.
Celie P.H., van Rossum-Fikkert S.E., van Dijk W.J., Brejc K., Smit A.B., Sixma T.K. (2004) Nicotine and carbamylcholine binding to nicotinic acetylcholine receptors as studied in AChBP crystal structures. Neuron. 41(6): 907–914. https://doi.org/:10.1016/s0896-6273(04)00115-1
Sieghart W. (1995) Structure and pharmacology of g-aminobutyric acid A receptor subtypes. Pharmacol. Rev. 47: 181–234.
Knoflach F., Hernandez M.C., Bertrand D. (2016) GABAA receptor-mediated neurotransmission: Not so simple after all. Biochem. Pharmacol. 115: 10–17. https://doi.org/:10.1016/j.bcp.2016.03.014
Sieghart W., Sperk G. (2002) Subunit composition, distribution and function of GABAA receptor subtypes. Curr. Top. Med. Chem. 2(8): 795–816. https://doi.org/:10.2174/1568026023393507
Somogyi P., Tamas G., Lujan R., Buhl E.H. (1998) Salient features of synaptic organisation in the cerebral cortex. Brain. Res. Brain. Res. Rev. 26(2–3): 113–135.
Salzman C. (1998) Addiction to benzodiazepines. Psy. Quart. 69: 251–261.
Calcaterra N.E., Barrow J.C. (2014) Classics in chemical neuroscience: diazepam (valium). ACS Chem. Neurosci. 5(4): 253–260. https://doi.org/:10.1021/cn5000056
Chang-Sheng S.C., Olcese R., Olsen R.W. (2003) A single M1 residue in the β2 subunit alters channel gating of GABAA receptor in anesthetic modulation and direct activation. J. Biol. Chem. 278(44): 42821–42828. https://doi.org/:10.1074/jbc.M306978200
Bali M., Akabas M.H. (2004) Defining the propofol binding site location on the GABAA receptor. Mol. Pharmacol. 65(1): 68–76. https://doi.org/:10.1124/mol.65.1.68
Wisden W., Korpi E.R., Bahn S. (1996) The cerebellum: a model system for studying GABAA receptor diversity. Neuropharmacology. 35(9–10): 1139–1160.
Mäkelä J., Iivanainen M., Pieninkeroinen I.P., Waltimo O., Lahdensuu M. (1993) Seizures associated with propofol anesthesia. Epilepsia. 34(5): 832–835.
Yamakura T., Sakimura K., Shimoji K., Mishina M. (1995) Effects of propofol on various AMPA-, kainate-and NMDA-selective glutamate receptor channels expressed in Xenopus oocytes. Neurosci. Lett. 188(3): 187–190.
Vasileiou I., Xanthos T., Koudouna E., Perrea D., Klonaris C., Katsargyris A., Papadimitriou L. (2009) Propofol: a review of its non-anaesthetic effects. Eur. J. Pharmacol. 605(1–3): 1–8. https://doi.org/:10.1016/j.ejphar.2009.01.007
Wu Q., Zhao Y., Chen X., Zhu M., Miao C. (2018) Propofol attenuates BV2 microglia inflammation via NMDA receptor inhibition. Can. J. Physiol. Pharmacol. 96(3): 241–248. https://doi.org/:10.1139/cjpp-2017-0243
Walder B., Tramèr M.R., Seeck M. (2002) Seizure-like phenomena and propofol: a systematic review. Neurology. 58(9): 1327–1332. https://doi.org/:10.1212/wnl.58.9.1327
Lin W.C., Davenport C.M., Mourot A., Vytla D., Smith C.M., Medeiros K.A., Chambers J.J., Kramer R.H. (2014) Engineering a light-regulated GABAA receptor for optical control of neural inhibition. ACS Chem. Biol. 9(7): 1414–1419. https://doi.org/:10.1021/cb500167u
Lin W.C., Tsai M.C., Davenport C.M., Smith C.M., Veit J., Wilson N.M., Adesnik H., Kramer R.H. (2015) A comprehensive optogenetic pharmacology toolkit for in vivo control of GABAA receptors and synaptic inhibition. Neuron. 88(5): 879–891. https://doi.org/:10.1016/j.neuron.2015.10.026
Huckvale R., Mortensen M., Pryde D., Smart T.G., Baker J.R. (2016) Azogabazine; a photochromic antagonist of the GABA A receptor. Org. Biomol. Chem. 14(28): 6676–6678. https://doi.org/:10.1039/c6ob01101b
Chambon J.P., Feltz P., Heaulme M., Restle S., Schlichter R., Biziere K., Wermuth C.G. (1985) An arylaminopyridazine derivative of gamma-aminobutyric acid (GABA) is a selective and competitive antagonist at the GABAA receptor site. Proc. Natl. Acad. Sci. U S A. 82(6): 1832–1836.
Lin W.C., Tsai M.C., Rajappa R., Kramer R.H. (2018) Design of a highly bistable photoswitchable tethered ligand for rapid and sustained manipulation of neurotransmission. J. Am. Chem. Soc. 140(24): 7445–7448. https://doi.org/:10.1021/jacs.8b03942
Gastaut H., Naquet R., Poire R., Tassinari C.A. (1965) Treatment of status epilepticus with diazepam (Valium). Epilepsia. 6(2): 167–182.
Tan K.R., Rudolph U., Lüscher C. (2011) Hooked on benzodiazepines: GABAA receptor subtypes and addiction. Trends. Neurosci. 34(4): 188–197. https://doi.org/:10.1016/j.tins.2011.01.004
Rogawski M.A., Heller A.H. (2019) Diazepam buccal film for the treatment of acute seizures. Epilepsy Behav. 101(Pt B): 106537. https://doi.org/:10.1016/j.yebeh.2019.106537
Vitanova. L, Haverkamp S., Wässle H. (2014) Immunocytochemical localization of glycine and glycine receptors in the retina of the frog Rana ridibunda. Cell Tissue. Res. 317(3): 227–235. https://doi.org/:10.1007/s00441-004-0914-6
Danglot L., Rostaing P., Triller A., Bessis A. (2004) Morphologically identified glycinergic synapses in the hippocampus. Mol. Cell Neurosci. 27(4): 394–403. https://doi.org/:10.1016/j.mcn.2004.05.007
Brackmann M., Zhao C., Schmieden V., Braunewell K.H. (2004) Cellular and subcellular localization of the inhibitory glycine receptor in hippocampal neurons. Biochem. Biophys. Res. Commun. 324(3): 1137–1142. https://doi.org/:10.1016/j.bbrc.2004.09.172
Xu T.-L., Gong N. (2010) Glycine and glycine receptor signaling in hippocampal neurons: diversity, function and regulation. Prog. Neurobiol. 91(4): 349–361. https://doi.org/:10.1016/j.pneurobio.2010.04.008
Chattipakorn S.C., McMahon L.L. (2003) Strychnine-sensitive glycine receptors depress hyperexcitability in rat dentate gyrus. J. Neurophysiol. 89(3): 1339–1342. https://doi.org/:10.1152/jn.00908.2002
Leite J.F., Cascio M. (2001) Structure of ligand-gated ion channels: critical assessment of biochemical data supports novel topology. Mol. Cell. Neurosci. 17(5): 777–792. https://doi.org/:10.1006/mcne.2001.0984
Friauf E., Hammerschmidt B., Kirsch J. (1997) Development of adult-type inhibitory glycine receptors in the central auditory system of rats. J. Comp. Neurol. 385(1): 117–134.
Malosio M., Marqueze B., Pouey A., Kuhse J., Betz H. (1991) Widespread expression of glycine receptor subunit mRNAs in the adult and developing rat brain. EMBO J. 10(9): 2401–2409.
Baer K., Waldvogel H.J., Faull R.L.M., Rees M.I. (2009) Localization of glycine receptors in the human forebrain, brainstem, and cervical spinal cord: an immunohistochemical review. Front. Mol. Neurosci. 4(2): 25. https://doi.org/:10.3389/neuro.02.025.2009
Grenningloh G., Rienitz A., Schmitt B., Methfessel C., Zensen M., Beyreuther K., Gundelfinger E.D., Betz H. (1988) Molecular cloning of the antagonist-binding subunit of the glycine receptor. J. Recept. Res. 8(1–4): 183–193.
Becker C.M., Hoch W., Betz H. (1988) Glycine receptor heterogeneity in rat spinal cord during postnatal development. EMBO J. 7(12): 3717–3726.
Grenningloh G., Schmieden V., Schofield P.R., Seeburg P.H., Siddique T., Mohandas T.K., Becker C.M., Betz H. (1990) Alpha subunit variants of the human glycine receptor: primary structures, functional expression and chromosomal localization of the corresponding genes. EMBO J. 9(3): 771–776.
David-Watine B., Goblet C., De Saint Jan D., Fucile S., Devignot V., Bregestovski P., Korn H. (1999) Cloning, expression and electrophysiological characterization of glycine receptor alpha subunit from zebrafish. Neuroscience. 90(1): 303–317.
Imboden M., De Saint Jan D., Leulier F., Korn H., Goblet C., Bregestovski P. (2001) Isolation and characterization of an alpha 2-type zebrafish glycine receptor subunit. Neuroscience. 103(3): 799–810. https://doi.org/:10.1016/s0306-4522(00)00575-3
Devignot V., Prado de Carvalho L., Bregestovski P., Goblet C. (2003) A novel glycine receptor αZ1 subunit variant in the zebrafish brain. Neuroscience. 122(2): 449–457. https://doi.org/:10.1016/s0306-4522(03)00171-4
Grenningloh G., Pribilla I., Prior P., Multhaup G., Beyreuther K., Taleb O., Betz H. (1990) Cloning and expression of the 58 kd beta subunit of the inhibitory glycine receptor. Neuron. 4(6): 963–970.
Bormann J., Rundström N., Betz H., Langosch D. (1994) Residues within transmembrane segment M2 determine chloride conductance of glycine receptor homo- and hetero-oligomers. EMBO J. 12(10): 3729–3737.
Meyer G., Kirsch J., Betz H., Langosch D. (1995) Identification of a Gephyrin Binding Motif on the Glycine Receptor p Subunit. Neuron. 15(3): 563–572.
Kirsch J., Betz H. (1995) The Postsynaptic Protein Gephyrin Localization Is Regulated of the Glycine Receptor-Associated by the Cytoskeleton. J. Neurosci. 715(6): 4148–4156.
Kneussel M., Betz H. (2000) Clustering of inhibitory neurotransmitter receptors at developing postsynaptic sites: the membrane activation model. Trends. Neurosci. 23(9): 429–435. https://doi.org/:10.1016/s0166-2236(00)01627-1
Pribilla I., Takagi T., Langosch D., Bormann J., Betz H., Pribilla I. (1992) The atypical M2 segment of the subunit confers picrotoxinin resistance to inhibitory glycine receptor channels. EMBO J. 11(12): 4305-4311.
Zhorov B.S., Bregestovski P.D. (2000) Chloride channels of glycine and GABA receptors with blockers: Monte Carlo minimization and structure-activity relationships. Biophys. J. 78(4): 1786–1803. https://doi.org/:10.1016/S0006-3495(00)76729-4
Kirsch J., Meyer G., Betz H. (1996) Synaptic Targeting of Ionotropic Neurotransmitter Receptors. Mol. Cell. Neurosci. 8(2–3): 93-98.
Singer J.H., Berger A.J. (2000) Development of inhibitory synaptic transmission to motoneurons. Brain. Res. Bull. 53(5): 553–560. https://doi.org/:10.1016/s0361-9230(00)00389-0
Singer J.H., Talley E.M., Bayliss D.A., Berger A.J. (1998) Development of glycinergic synaptic transmission to rat brain stem motoneurons. J. Neurophysiol. 80(5): 2608–2620.
Mukhtarov M., Ragozzino D., Bregestovski P. (2005) Dual Ca2+ modulation of glycinergic synaptic currents in rodent hypoglossal motoneurones. J. Physiol. 569(3): 817–831. https://doi.org/:10.1113/jphysiol.2005.094862
Akagi H., Miledi R. (1988) Heterogeneity of glycine receptors and their messenger RNAs in rat brain and spinal cord. Science. 242(4876): 270–273.
Becker C.M., Hoch W., Betz H. (1988) Glycine receptor heterogeneity in rat spinal cord during postnatal development. EMBO J. 7(12): 3717–3726.
Samanta S., Beharry A.A., Sadovski O., McCormick T.M., Babalhavaeji A., Tropepe V., Woolley G.A. (2013) Photoswitching azo compounds in vivo with red light. J. Am. Chem. Soc. 135(26): 9777–9784. https://doi.org/:10.1021/ja402220t
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова