Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 4-5, стр. 641-646
Ингибитор гистондеацитилаз усиливает долговременную синаптическую потенциацию в нейронах виноградной улитки
Д. Е. Колотова 1, А. Ю. Малышев 1, П. М. Балабан 1, *
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pmbalaban@gmail.com
Поступила в редакцию 17.01.2021
После доработки 09.02.2021
Принята к публикации 09.02.2021
Аннотация
В последнее время в литературе накапливается все больше данных о важной роли эпигенетических перестроек при формировании долговременной синаптической пластичности – основному клеточному механизму обучения и памяти. В данной работе мы изучили влияние ингибирования гистондеацетилаз, одного из видов эпигенетических модификаций, на формирование долговременной потенциации синаптических ответов в премоторных (командных) нейронах оборонительного поведения виноградной улитки. Потенциация синаптических входов премоторных нейронов лежит в основе аверзивной памяти этого животного. Мы показали, что применение ингибитора гистондеацетилаз бутирата натрия увеличивает амплитуду долговременной потенциации, вызванной пятикратной тетанизацией сенсорного нерва, совмещенной с аппликацией серотонина. Мы также обнаружили, что аппликация бутирата сама по себе вызывает увеличение амплитуды ВПСП через 4 ч после применения блокатора. Однако данное увеличение не может лежать в основе обнаруженного эффекта облегчения долговременной потенциации, который наблюдался на всем протяжении эксперимента. Таким образом, в нашей работе продемонстрирована роль модификации гистонов в механизмах синаптической пластичности.
ВВЕДЕНИЕ
Ацетилирование гистонов играет важную роль в эпигенетической регуляции синаптической пластичности и памяти у беспозвоночных и позвоночных животных [1, 2]. На ацетилирование гистонов оказывают влияние две группы ферментов – гистонацетилтрансферазы и гистондеацетилазы. В литературе последних лет накопилось много данных о важной роли баланса гистонацетилтрансфераз и гистондеацетилаз, изменения которого могут как нарушать, так и улучшать синаптическую пластичность, память и процессы обучения у взрослых животных [3]. Для изучения роли ацетилирования гистонов в регуляции синаптической пластичности эффективно применение ингибиторов гистондеацетилаз [4, 5], приводящих к усилению ацетилирования гистонов. В ряде работ, посвященных влиянию различных ингибиторов гистондеацетилаз на формирование долговременной синаптической пластичности показано, что ингибитор гистондеацетилаз класса I бутират натрия влияет на долговременные изменения эффективности синаптической передачи на клеточных и поведенческих моделях [6–10]. Было показано, что ингибирование деацетилирования гистонов может приводить к усилению формирования долговременных синаптических изменений и улучшению памяти у беспозвоночных животных [7, 8, 11]. Также получены данные о том, что аппликация бутирата натрия приводит к усилению долговременной потенциации на срезах гиппокампа крыс [6]. Однако влияние ингибирования гистондеацетилаз на формирование долговременной потенциации у виноградной улитки – важного модельного объекта в нейробиологических исследованиях, ранее не было изучено в электрофизиологических экспериментах. В данной работе с помощью ингибитора гистондеацетилаз бутирата натрия исследовалось влияние ацетилирования гистонов на формирование долговременной потенциации у виноградной улитки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты были проведены на улитках Helix lucorum taurica L. массой 20–30 г. За 1–2 нед. до эксперимента улиток помещали во влажную среду, где они находились в активном состоянии. Протокол экспериментов утвержден Этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН. Электрофизиологические эксперименты проводили на изолированной ЦНС улиток. Препарирование и идентификацию нейронов осуществляли по стандартной методике [12]. Перед началом препарирования производили инъекцию холодного изотонического раствора MgCl2 для обездвиживания и обезболивания животного. Изолированную ЦНС помещали в физиологический раствор Рингера (мМ): 100 NaCl, 4 KCl, 7 CaCl2, 5 MgCl2, 10 Trizma, pH 7.6.
Внутриклеточную регистрацию активности премоторных (командных) интернейронов париетальных ганглиев (Pa3 и Pa2) проводили при помощи острых стеклянных микроэлектродов, заполненных ацетатом калия (2 M), сопротивлением 20–30 МОм. Регистрировали возбуждающие постсинаптические потенциалы (ВПСП), вызванные электрической стимуляцией интестинального нерва, не содержащего отростков регистрируемых нейронов. В каждом эксперименте амплитуду стимула подбирали таким образом, чтобы стимуляция вызывала не потенциалы действия, а ВПСП амплитудой 5–15 мВ.
В начале записи проводили 5 тестовых стимуляций с интервалом между стимулами 10 мин, затем осуществляли тетанизацию интестинального нерва (пачка стимулов частотой 10 Гц, длительность пачки 10 с, 10-кратное увеличение амплитуды тестового стимула). Всего тетанизацию осуществляли 5 раз с интервалом 5 мин. Перед каждой тетанизацией в экспериментальную ванночку добавляли серотонин (10−5 M), который отмывали через 2 мин после тетанизации. После пятой тетанизации продолжали тестирующую стимуляцию интестинального нерва с исходной амплитудой стимула каждые 10 мин в течение нескольких часов.
Первые 50 мин записи перфузионная система находилась в замкнутом режиме вплоть до момента первой тетанизации. В двух сериях экспериментов с ингибитором гистондеацетилаз в этот временной период в экспериментальной ванночке находился бутират натрия в концентрации 60 мкМ. После первой тетанизации (и первой аппликации серотонина) производился интенсивный “отмыв” препарата, который полностью удалял бутират из ванночки. После последней тетанизации система перфузии переводилась в разомкнутое состояние (отмыв), при этом скорость протока составляла 0.2 мл/мин при объеме ванночки 3 мл.
Достоверность изменений амплитуды синаптических потенциалов оценивали по статистическому критерию Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ритмическая тестирующая стимуляция интестинального нерва с частотой 1 стимул в 10 мин приводила в течение нескольких часов к постепенному уменьшению амплитуд ВПСП в командных нейронах – феномен, хорошо описанный для данного препарата [12] и вызванный, скорее всего, гомосинаптической депрессией (привыканием) (рис. 1, заполненные треугольники). Для статистического анализа изменений амплитуд ответов мы выделили два временных окна в записи: 120–170 мин после первой тетанизации (это временное окно далее в тексте называется “2 ч после тетанизации”) и 210–260 мин после тетанизации (этот период в тексте будет обозначаться как “4 ч после тетанизации”). Пятикратная тетанизирующая стимуляция, совмещенная с аппликацией серотонина, вызывала выраженный рост амплитуд ВПСП (рис. 1, заполненные кружки). Так, через 2 ч после тетанизации усредненная амплитуда ВПСП составляла 101.8 ± 8.8% от исходной (n = 12), в то время как в контрольных экспериментах эффект ослабления ответа приводил к тому, что в той же временной точке амплитуда ВПСП составляла в среднем 48.1 ± 4.1%, n = 21 (p < 0.001). Через 4 ч после тетанизации амплитуда ВПСП тетанизированных входов также превышала средние амплитуды ответов в контрольной группе (71.7 ± 11.8%, n = 12 и 38.3 ± 4.1%, n = 21, p < 0.05). Ингибирование гистондеацетилаз путем добавления бутирата в экспериментальную ванночку за 1 ч до тетанизации приводило к достоверному увеличению амплитуды синаптической потенциации, вызванной сочетанным применением тетанизации нерва и аппликации серотонина (рис. 1, пустые кружки). Через 2 ч после тетанизации средняя амплитуда ВПСП в группе с бутиратом составляла 220.8 ± 59.4% (n = 14) и была достоверно выше средних амплитуд ВПСП в группе тетанизации без бутирата (101.8 ± 8.8%, n = 12, p < 0.01). Через 4 ч после тетанизации амплитуда ответов в группе с бутиратом была также выше, чем в группе тетанизации без бутирата натрия (151 ± 38.7, n = 14 и 71.7 ± 11.8%, n = 12, p < 0.05), что говорит о долговременности эффекта.
Рис. 1.
Влияние бутирата натрия на формирование долговременной потенциации амплитуды комплексного ВПСП в премоторных (командных) гигантских нейронах париетальных ганглиев виноградной улитки, вызванной тетанизацией синаптического входа. Амплитуда ВПСП при первой тестовой стимуляции была принята за единицу. Серыми прямоугольниками обозначено время, когда бутират натрия присутствовал в экспериментальной ванночке и эпохи усреднения ВПСП, использованные для статистического анализа, и обозначаемые в тексте как “2 ч после тетанизации” и “4 ч после тетанизации”. На графике представлены средние значения ± SEM.
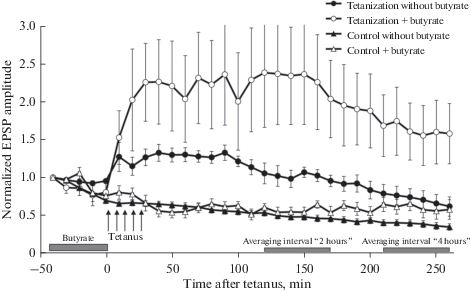
Для выяснения возможного влияния бутирата натрия на амплитуду ВПСП в командных нейронах была поставлена специальная контрольная серия экспериментов, в которых бутират также присутствовал в экспериментальной ванночке первые 50 мин записи, после которых препарат интенсивно отмывался и система перфузии переводилась в открытый режим, как и в остальных сериях экспериментов, но тетанизации при этом не проводилось. Выяснилось, что само по себе добавление бутирата не вызывало изменения амплитуды ВПСП во временном окне “2 ч после тетанизации”. Средняя амплитуда ответов в этот временной период составляла 48.1 ± 4.1%, n = 21 в контроле и 56.8 ± 6.1, n =1 1, для группы “контроль с бутиратом”. Однако через 4 ч в группе “контроль с бутиратом” начинался небольшой, но достоверный рост амплитуды ВПСП. Так, в группе “контроль без бутирата” средняя амплитуда ВПСП в эпоху анализа “4 ч после тетанизации” составляла 38.3 ± 4.1%, n = 21, в то время как в группе “контроль с бутиратом” усредненная амплитуда синаптических ответов была достоверно выше и равнялась 60.4 ± 9.5%, n = 14, p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Прежде всего необходимо отметить, что исследованные в настоящей работе синаптические входы и идентифицированные нейроны прямо относятся к сети оборонительного поведения виноградной улитки. Роль гигантских FMRFamid-содержащих нейронов париетальных ганглиев хорошо описана [13], поэтому изменение эффективности синаптических входов к данным нейронам имеет прямое функциональное значение для регуляции оборонительного поведения животного.
На поведенческом уровне на этом животном проделана большая работа по выяснению возможности влияния двух различных ингибиторов гистондеацетилаз (бутирата натрия и трихостатина А) на оборонительное поведение и показаны достоверные эффекты увеличения величины оборонительных реакций улитки не только во время реконсолидации обстановочной памяти, но и восстановление памяти при ее нарушении двумя разными способами [2]. Существенным является тот факт, что введение ингибиторов гистондеацетилаз в этой работе без тестирования (реактивации) памяти не приводило к выраженным поведенческим эффектам при тестировании в течение нескольких дней, что предполагает регулирующее влияние ингибиторов гистондеацетилаз именно на молекулярную систему формирования и поддержания памяти. В настоящей работе эффекты ингибитора гистондеацетилаз без потенциации наблюдались только через несколько часов и были сравнительно слабо выраженными.
Полученные данные можно интерпретировать как нейросетевое объяснение поведенческих результатов на этих животных. С точки зрения возможной роли эпигенетических процессов в регуляции пластичности и памяти, можно сказать, что не только интибиторы гистондеацетилаз, но и другие регулирующие факторы координированно влияют на уровень экспрессии генов. По-видимому, влияние этих факторов без сильных внешних стимулов (потенциация, подкрепление при обучении и т.д.) заторможено специальными системами “молекулярных тормозов” и только в условиях сильных внешних воздействий эпигенетическими регуляторами открывается “окно возможностей” для долговременных изменений [3]. Существенно отметить, что деацетилирование гистонов приводит к изменениям плотности упаковки хроматина, которые большей частью обратимы, и по сути только открывают возможность (“окно”) для долговременных изменений экспрессии генов, которые в основном осуществляются путем метилирования ДНК [3, 14]. Полученные в настоящей работе данные позволяют считать, что обратимые посттрансляционные модификации гистонов служат основой для пластических изменений в функциональных сетях нейронов. В то же время именно метилирование ДНК и метил-зависимые способы регуляции трехмерной организации хроматина могут служить стабильной молекулярной основой для долговременного хранения пластических изменений и памяти [3, 14].
Список литературы
Campbell R.R., Wood M.A. (2019) How the epigenome integrates information and reshapes the synapse. Nat. Rev. Neurosci. 20: 133–147.
Zuzina A.B., Vinarskaya A.K., Balaban P.M. (2020) Histone deacetylase inhibitors rescue the impaired memory in terrestrial snails. J. Comp. Physiol. A Neuroethol. Sensory, Neural, Behav Physiol. 206: 639–649. https://doi.org/10.1007/s00359-020-01422-w
Borodinova A.A., Balaban P.M. (2020) Epigenetic Regulation as a Basis for Long-Term Changes in the Nervous System: In Search of Specificity Mechanisms. Biochemistry (Mosc.). 85: 994–1010.
Penney J., Tsai L.H. (2014) Histone deacetylases in memory and cognition. Sci. Signal 7: re12.
Peixoto L., Abel T. (2013) The role of histone acetylation in memory formation and cognitive impairments. Neuropsychopharmacology. 38: 62–76.
Levenson J.M., O’Riordan K.J., Brown K.D., Trinh M.A., Molfese D.L., Sweatt J.D. (2004) Regulation of histone acetylation during memory formation in the hippocampus. J. Biol. Chem. 279: 40545–40559. https://doi.org/10.1074/jbc.M402229200
Federman N., Fustiñana M.S., Romano A. (2012) Reconsolidation involves histone acetylation depending on the strength of the memory. Neuroscience. 219: 145–156. https://doi.org/10.1016/j.neuroscience.2012.05.057
Federman N., Fustiñana M.S., Romano A. (2009) Histone acetylation is recruited in consolidation as a molecular feature of stronger memories. Learn Mem. 16: 600–606. https://doi.org/10.1101/lm.1537009
Lattal K.M., Barrett R.M., Wood M.A. (2007) Systemic or Intrahippocampal Delivery of Histone Deacetylase Inhibitors Facilitates Fear Extinction. Behav. Neurosci. 121: 1125–1131. https://doi.org/10.1037/0735-7044.121.5.1125
Stefanko D.P., Barrett R.M., Ly A.R., Reolon G.K., Wood M.A. (2009) Modulation of long-term memory for object recognition via HDAC inhibition. Proc. Natl. Acad. Sci. USA. 106: 9447–9452. https://doi.org/10.1073/pnas.0903964106
Chen S., Cai D., Pearce K., Sun P.Y.W., Roberts A.C., Glanzman D.L. (2014) Reinstatement of long-term memory following erasure of its behavioral and synaptic expression in Aplysia. Elife. 3: 1–21. https://doi.org/10.7554/eLife.03896
Malyshev A.Y., Balaban P.M. (2002) Identification of mechanoafferent neurons in terrestrial snail: Response properties and synaptic connections. J. Neurophysiol. 87: 2364–2371. https://doi.org/10.1152/jn.00185.2001
Balaban P.M. (2002) Cellular mechanisms of behavioral plasticity in terrestrial snail. Neurosci. Biobehav. Rev. 26: 597–630.
Miller C.A., Sweatt J.D. (2007) Covalent Modification of DNA Regulates Memory Formation. Neuron. 53: 857–869. https://doi.org/10.1016/j.neuron.2007.02.022
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


