Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 8, стр. 973-995
Влияние острого плавательного стресса на поведенческие и нейрохимические эффекты производного пиразоло[C]пиридина ГИЖ-72 и диазепама у мышей BALB/c и C57BL/6
Н. В. Кудряшов 1, 2, *, П. Л. Наплёкова 1, А. В. Волкова 1, К. А. Касабов 1, В. Б. Наркевич 1, В. С. Кудрин 1, Т. С. Калинина 1, Т. А. Воронина 1
1 НИИ фармакологии им. В.В. Закусова
Москва, Россия
2 Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский университет)
Москва, Россия
* E-mail: kunvi@mail.ru
Поступила в редакцию 20.02.2021
После доработки 23.03.2021
Принята к публикации 28.04.2021
Аннотация
Изучено влияние острого плавательного стресса (ОПС) на поведенческие и нейрохимические эффекты производного пиразоло[C]пиридина ГИЖ-72 (20 мг/кг, в/б) и диазепама (1 мг/кг, в/б). Установлено, что через 1 ч после ОПС происходило усиление тревожных реакций в тесте “открытое поле” у мышей линии BALB/c и в тесте “закапывание шариков” у мышей линии С57BL/6. Через 24 ч наблюдалось ослабление тревожных реакций мышей BALB/c и С57BL/6 в тесте “открытое поле” и С57BL/6 в тесте “закапывание шариков”. Через 1 ч после ОПС происходило повышение уровня серотонина и снижение норадреналина в гипоталамусе мышей BALB/c и С57BL/6, а в префронтальной коре – повышение норадреналина, 3,4-диоксифенилуксусной кислоты и соотношения 3,4-диоксифенилуксусная кислота/дофамин у мышей линии BALB/c. Эти изменения коррелировали с усилением тревожных реакций, а их ослабление под действием ГИЖ-72, диазепама или через 24 ч после ОПС совпадало с ослаблением тревожных реакций мышей. Диазепам и ГИЖ-72 ослабляли тревожные реакции мышей BALB/c и C57BL/6 в тестах “открытое поле” и “закапывание шариков” при отсутствии стресса. Через 1 ч после ОПС эффекты ГИЖ-72 сохранялись в тестах “открытое поле” и “закапывание шариков” у мышей BALB/c и С57BL/6, в то время как эффекты диазепама сохранились у С57BL/6 и усиливались у BALB/c в тесте “открытое поле”. Через 24 ч эффекты ГИЖ-72 в тесте “открытое поле” усиливались у мышей BALB/c, но ослаблялись и сопровождались тенденцией к седативному эффекту у С57BL/6. Эффекты диазепама в “открытом поле” усиливались только у С57BL/6 и отсутствовали у BALB/c. Эффекты ГИЖ-72 и диазепама в тесте “закапывание шариков” через 24 ч после ОПС сохранялись у BALB/c, но не C57BL/6.
Различные виды острых стрессовых воздействий, таких как хэндлинг, электрошок, принудительное плавание, воздействие углекислого газа и других, могут приводить к уменьшению плотности и аффинности ГАМКА-рецепторов [1, 2]. Эти изменения обусловлены десенситизацией последних [3, 4], снижением синтеза и экзоцитоза ГАМК [2], нарушением биосинтеза эндогенных нейроактивных стероидов [5]. В ряде экспериментальных работ было обнаружено, что процедура “принудительное плавание” изменяет противосудорожный и анксиолитический эффекты бензодиазепинов, повышает судорожный порог у грызунов при применении антагонистов ГАМКА-рецепторов [6–8]. Известно, что процедура “принудительное плавание” приводит к повышению уровней прогестерона и прегнановых нейроактивных стероидов (аллопрегнанолона и аллотетрагидродезоксикортикостерона) в тканях головного мозга и плазме крыс в течение часа после стрессовой экспозиции [5, 9, 10]. Кроме того, острый плавательный стресс (ОПС) продолжительностью не более 10 мин приводит к увеличению плотности митохондриального транслокационного белка 18 кДа (TSPO) через 24 ч после данной процедуры, который, как полагают, играет важную роль в регуляции биосинтеза эндогенных нейроактивных стероидов [11].
Известно, что фенотип эмоционально-стрессовой реакции играет важную роль в реализации анксиолитического эффекта производных бензодиазепина. В частности, у мышей линии C57BL/6, характеризующейся активной реакцией на стресс, бензодиазепины в малых дозах оказывают седативный эффект. В то же время у мышей линии BALB/c, характеризующейся фризинг-реакцией на стресс, наблюдают активирующее действие бензодиазепинов. При увеличении дозы седативный эффект развивается вне зависимости от линии мышей [12, 13].
В настоящее время накоплено большое количество данных о том, что различные виды острого стресса сопровождаются изменениями в моноаминергических системах головного мозга грызунов [14–16]. В то же время поведенческие и нейрохимические эффекты анксиолитических средств различной химической структуры в условиях ОПС остаются слабо изученными, что делает актуальным изучение свойств этих средств в условиях данной модели на мышах с различными фенотипами эмоциональной реакции на стресс.
ГИЖ-72 (4,6-диметил-2-(4-хлорфенил)-2,3-дигидро-1Н-пиразоло[4,3-C]пиридин-3-он, хлоралгидрат) – синтезированное в ФГБНУ НИИ фармакологии им. В.В. Закусова производное пиразоло[C]пиридина, обладающее анксиолитическим и антидепрессивным эффектами, а также низкой токсичностью. Анксиолитический эффект ГИЖ-72 не только сохраняется, но и усиливается в условиях непредсказуемого хронического умеренного стресса и зависит от функциональной активности 5α-редуктазы – одного из ключевых ферментов биосинтеза эндогенных нейростероидов [17].
Целью настоящего исследования являлось изучение влияния ОПС на поведенческие и нейрохимические эффекты производного пиразоло[C]пиридина ГИЖ-72 и диазепама у мышей с различными фенотипами эмоциональной реакции на стресс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Опыты были проведены на 189 самцах мышей инбредной линии BALB/c и 189 самцах инбредной линии С57BL/6 массой 20–25 г (Питомник “Столбовая” ФГБУН НЦБМТ ФМБА России). Животных содержали в стандартных условиях вивария при естественной суточной смене освещенности день/ночь, свободном доступе к воде и пище. Эксперименты проводились в соответствии с Директивой Совета Европейского сообщества 2010/63/EEC и решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 81 “Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств”.
Вещества
В настоящей работе были использованы: 4,6-диметил-2-(4-хлорфенил)-2,3-дигидро-1Н-пиразоло[4,3-C]пиридин-3-она хлоралгидрат (ГИЖ-72, 20 мг/кг) (Ф-ГБНУ НИИ фармакологии им. В.В. Закусова), диазепам (1 мг/кг; Sigma Aldrich). В качестве контроля использовали эквивалентный объем (0.1 мл на 10 г массы тела животного) 0.9%-ного раствора натрия хлорида c добавлением Tween-80 (Sigma Aldrich). Все вещества вводили в/б за 30 мин до поведенческих процедур.
Схема эксперимента
Мыши инбредных линий BALB/c и C57BL/6 были разделены на две большие группы каждая: животные первой были подвергнуты процедуре “принудительное плавание”, второй – не были подвержены стрессовому воздействию. Животные каждой из этих групп были разделены на 6 подгрупп (по 8–9 животных в каждой), которым через 30 мин (3 группы) или 23.5 ч (3 группы) после “принудительного плавания” вводили следующие вещества: (1) 0.9%-ный изотонический раствор NaCl (контроль); (2) ГИЖ-72; (3) диазепам. Через 30 мин после введения веществ оценивали ориентировочно-исследовательскую активность и компульсивно-подобное поведение в тестах “открытое поле” и “закапывание шариков” соответственно. После окончания поведенческих тестов мышей декапитировали, выделяли структуры головного мозга и проводили оценку содержания моноаминов и их метаболитов.
Процедура “принудительное плавание”
Для моделирования острого стресса мышей на 10 мин помещали в пластиковые цилиндры (высотой 30 см, диаметром 10 см), которые на 20 см заполняли водой при температуре 22°C, затем бережно высушивали и возвращали в боксы [18].
Тест “открытое поле”
Для оценки тревожных реакций использовали установку “открытое поле” квадратной формы со сторонами 40 см и стенками высотой 22 см. Площадка установки была разделена на 25 одинаковых квадратов, в 9 центральных располагались 16 отверстий диаметром 2 см. Освещенность площадки составляла 300 лк, перед помещением на площадку мыши находились в темноте в течение 30 мин – в помещении с освещением 5 лк. В ходе теста регистрировали следующие параметры: периферическую горизонтальную двигательную активность у стенок установки, центральную горизонтальную двигательную активность, вертикальную активность и число обследованных отверстий в полу установки в течение 2 мин. При суммировании перечисленных параметров определяли коэффициент ориентировочно-исследовательской реакции (КОИР), по сумме горизонтальной периферической и центральной двигательной активности определяли общую двигательную активность, индекс тревожности определяли по соотношению центральной активности к сумме центральной и периферической активности, умноженному на 100%. Увеличение индекса тревожности являлось коррелятом ослабления тревожных реакций [19].
Тест “закапывание шариков”
В качестве экспериментальной установки использовали индивидуальные поликарбонатные боксы для грызунов (31.5 × 23 × 15.7 см), которые на 5 см заполняли плотно утрамбованными опилками. Предварительно животных помещали в индивидуальные боксы с подстилкой на 30 мин с целью ознакомления. После предварительной посадки опилки вновь утрамбовывали и помещали на них 9 стеклянных шариков диаметром 1.5 см. Мышей помещали в индивидуальные боксы с шариками на 30 мин, по истечению которых подсчитывали количество зарытых шариков (зарытыми считались шарики, погруженные в подстилку на 2/3 объема). В экспериментальной комнате поддерживали минимальный уровень шума и освещение в 100 лк [20].
Определение содержания моноаминов и их метаболитов в ткани мозга
Мышей декапитировали и извлекали на холоде (4°C) следующие структуры мозга: префронтальную кору, гиппокамп, полосатое тело и гипоталамус. Образцы ткани мозга хранились в жидком азоте в течение 2–3 недель до анализа. Структуры мозга гомогенизировали в 0.1 моль/л растворе HClO4 с добавлением в качестве внутреннего стандарта 0.5 нмоль/л дигидроксибензиламина и центрифугировали при 10 000 g в течение 10 мин при температуре 4°C (центрифуга Eppendorf, Германия). Надосадочную жидкость отбирали и определяли в ней содержание моноаминов и их метаболитов методом высокоэффективной жидкостной хроматографии (ионпарная хроматография) с электрохимической детекцией. Норадреналин (НА), дофамин (ДА) и его метаболиты – 3,4-диоксифенилуксусную кислоту (ДОФУК), гомованилиновую кислоту (ГВК) и 3-метокситирамин (3-МТ), серотонин (5-НТ) и его метаболит 5-оксииндолуксусную кислоту (5-ОИУК) разделяли на обращенно-фазной колонке (С18, 4 мкм, 150 × 4.6 мм, Phenomenex, Германия). Подвижная фаза содержала 0.1 моль/л цитратно-фосфатного буфера (рН 2.9), 1.85 ммоль/л 1-октансульфоновой кислоты, 0.27 ммоль/л этилендиаминтетраацетата натрия и 8% ацетонитрила. Скорость элюции подвижной фазы составляла 1.0 мл/мин при давлении 200 атм. Измерение проводили с помощью электрохимического детектора (BAS LC-4B, США) на стеклоугольном электроде (+0.85 V) против электрода сравнения Ag/AgCl [21].
Статистический анализ
Обработку полученных данных проводили с помощью программного обеспечения GraphPad Prizm 8.0 (GraphPad Software Inc., США). Проверка результатов на нормальность распределения осуществляли по критерию Шапиро–Уилка, после чего данные были представлены в виде средних значений по группе с указанием стандартной ошибки среднего. Отличия между группами определяли по методу трехфакторного дисперсионного анализа с последующим post-hoc анализом по критерию Ньюмана–Кейлса. В качестве факторов были выделены: стресс, линия мышей и вводимые вещества. Данные, представленные в процентах, обрабатывали в соответствии с критерием Фишера. Результаты считали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Тест “открытое поле”
Было установлено, что при отсутствии стресса двигательная и исследовательская активности были выше у мышей линии C57BL/6 по сравнению с мышами линии BALB/c (рис. 1), что согласуется с ранее полученными данными о межлинейных различиях в тесте “открытое поле” [13]. Введение ГИЖ-72 (20 мг/кг, в/б) приводило к увеличению индекса тревожности в 1.5 раза у мышей BALB/c (p < 0.05) и 1.3 раза у животных C57BL/6 по сравнению с контролем, что соответствует анксиолитическому эффекту и согласуется с ранее полученными результатами [17]. Диазепам (1 мг/кг, в/б) у мышей линии BALB/c увеличивал периферическую горизонтальную активность в 1.7 раза (p < 0.01), центральную – в 3.3 раза (р < 0.05), индекс тревожности – в 1.8 раза (p < 0.05) по сравнению с контролем, что также соответствует анксиолитическому эффекту. Однако у мышей линии С57BL/6 введение диазепама приводило к уменьшению активности в центральной части установки в 9 раз (р < 0.05), индекса тревожности в 6.6 раза (p < 0.01), вертикальной активности в 1.6 раза (p < 0.01), КОИР в 1.7 раза (p < 0.01) и тенденции к уменьшению периферической активности, что в совокупности с уменьшением общей двигательной активности в 1.4 раза (p < 0.05) свидетельствует о седативном эффекте диазепама и согласуется с особенностью эффектов бензодиазепинов у мышей линии С57BL/6 [13, 22].
Рис. 1.
Влияние острого плавательного стресса (ОПС) на эффекты ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) в тесте “открытое поле” у мышей BALB/c и С57BL/6. (a) – центральная активность; (b) – индекс тревожности; (c) – вертикальная активность; (d) – общая двигательная активность. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p <0.01 – по сравнению с контролем соответствующей линии после стресса; ^, ^^ – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях; х, хх – р < 0.05, p < 0.01 – по сравнению с тем же веществом без стресса.
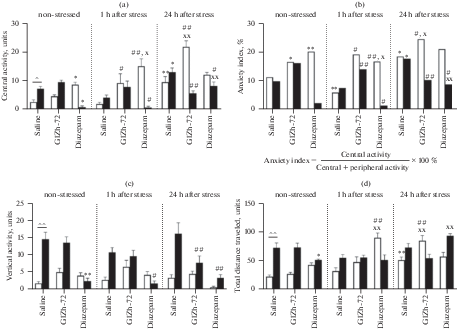
Через 1 ч после ОПС у мышей линии BALB/c регистрировали уменьшение индекса тревожности в 1.9 раза (р < 0.01) и тенденцию к уменьшению центральной активности по сравнению с контролем, что соответствует повышению уровня тревожности. У мышей линии C57BL/6 не было выявлено значимых изменений в аналогичных условиях, но была отмечена тенденция к уменьшению периферической, центральной и общей двигательной активности, а также индекса тревожности. ГИЖ-72 через 1 ч после ОПС повышал активность в центральной части установки в 4.8 раза (р < 0.05), а индекс тревожности в 3.3 раза (р < 0.01) у мышей BALB/c по сравнению с группой животных, подвергнутых стрессу. У мышей С57BL/6 введение ГИЖ-72 в тех же условиях приводило к увеличению индекса тревожности в 1.9 раза (р < 0.01). Диазепам не только сохранял, но и усиливал анксиолитический эффект у мышей BALB/c через 1 ч после ОПС. В частности, увеличение периферической активности было выше в 2.2 раза (p < 0.01), центральной в 1.7 раза (р < 0.05), КОИР и общей двигательной активности в 2.8 раза (р < 0.01) по сравнению с введением диазепама без предварительной процедуры острого стресса. У мышей С57BL/6 эффекты диазепама не зависели от ОПС.
Через 24 ч после ОПС поведенческий паттерн мышей BALB/c и С57BL/6 отличался. Так, у BALB/c регистрировали усиление: периферической активности в 2.1 раза (p < 0.05), центральной в 3.7 раза (p < 0.01), индекса тревожности в 1.6 раза (p < 0.05), общей двигательной активности в 2.3 раза (p < 0.05), КОИР в 2.1 раза (p < 0.05) по сравнению с контролем. В то же время у С57BL/6 отмечали увеличение центральной активности и индекса тревожности в 1.8 раза (p < 0.05). У BALB/c введение ГИЖ-72 через 24 ч после ОПС приводило к увеличению всех видов активности кроме вертикальной: периферической в 1.6 раза (p < 0.01), центральной в 2.3 (p < 0.01), индекса тревожности в 1.3 (p < 0.05), общей двигательной в 1.7 (p < 0.01), КОИР в 1.7 раза (p < 0.05). В противоположность этому введение ГИЖ-72 мышам С57BL/6 через 24 ч после ОПС, приводило к уменьшению центральной активности в 1.7 раза (p < 0.01), индекса тревожности в 1.7 (p < 0.05), вертикальной активности в 2.1 (p < 0.01), КОИР в 1.4 раза (p < 0.05) и тенденции к уменьшению общей двигательной активности по сравнению со стрессированным контролем. Эффекты диазепама, вводимого через 24 ч после стресса, характеризовались только тенденцией к увеличению центральной активности и индекса тревожности у BALB/c и увеличением периферической активности в 1.4 раза (p < 0.05), уменьшением центральной активности в 1.6 (p < 0.05), индекса тревожности в 2 (p < 0.05), вертикальной в 4.7 раза (p < 0.01) у С57BL/6.
Таким образом, эффекты ГИЖ-72 в тесте “открытое поле” через 24 ч после ОПС по своему паттерну напоминали эффекты диазепама при отсутствии стрессовых воздействий у мышей BALB/c и C57BL/6.
Тест “закапывание шариков”
Мыши контрольной группы С57BL/6 закапывали в 1.2 раз меньше шариков по сравнению с BALB/c (p < 0.05) (рис. 2). ГИЖ-72 ослаблял компульсивно-подобное поведение мышей BALB/c и С57BL/6 в 1.9 (p < 0.01) и 1.6 (p < 0.01) раз соответственно. Аналогичным образом действовал и диазепам, уменьшая количество зарытых шариков в 2.1 и 1.5 раза (p < 0.01) у мышей BALB/c и С57BL/6 соответственно.
Рис. 2.
Влияние острого плавательного стресса на эффекты ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) в тесте “закапывание шариков” у мышей BALB/c и С57BL/6. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; ^, ^^ – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях; х, хх – р < 0.05, p < 0.01 – по сравнению с тем же веществом без стресса.

Через 1 ч после ОПС было отмечено усиление компульсивно-подобного поведения мышей C57BL/6 в 1.3 раза (p < 0.05) по сравнению с животными контрольной группы. ГИЖ-72 и диазепам, вводимые через 1 ч после ОПС, сохраняли свои эффекты у мышей BALB/c и C57BL/6.
Через 24 ч после ОПС регистрировали ослабление компульсивно-подобного поведения у мышей C57BL/6, но не BALB/c, в 2.9 раза (p < 0.01) по сравнению с контролем. Эффекты ГИЖ-72 и диазепама, вводимых через 24 ч после стресса, сохранились у мышей BALB/c. В то же время эффект диазепама усиливался у мышей C57BL/6 в 3 раза (p < 0.01) по сравнению с аналогичным эффектом при отсутствии стресса.
Таким образом, компульсивно-подобное поведение мышей линии C57BL/6, но не BALB/c, зависело от времени, прошедшего после ОПС. Анти-компульсивные эффекты диазепама и ГИЖ-72 сохранялись через 1 ч после ОПС у мышей обеих линий, а через 24 ч – только у мышей линии BALB/c.
Нейрохимические изменения
Наиболее значимые изменения в содержании моноаминов и их метаболитов в префронтальной коре, полосатом теле, гипоталамусе и гиппокампе представлены на рис. 3–8.
Рис. 3.
Влияние ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) на содержание ДА и НА в различных структурах головного мозга мышей BALB/c и С57BL/6 через 1 ч после острого плавательного стресса. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; х, хх – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях.
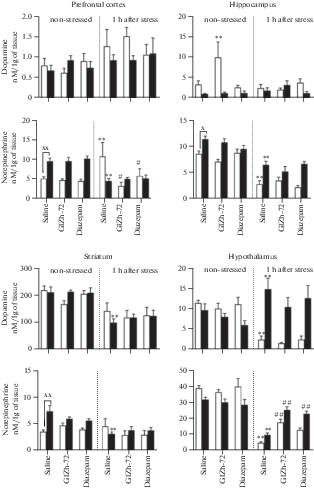
При отсутствии стресса у мышей линии С57BL/6 наблюдались различия в содержании моноаминов по сравнению с мышами BALB/c. В префронтальной коре уровни НА и ГВК у мышей С57BL/6 превосходили таковые у мышей BALB/c в 1.8 (p < 0.01) и 1.7 (р < 0.01) раз соответственно (рис. 3 и 7). В гиппокампе мышей С57BL/6 наблюдались более высокие концентрации НА (в 1.3 раза, р < 0.01), 5-ОИУК (в 2.2 раза, р < 0.05), 5-НТ (в 2.1 раза, p < 0.01), (рис. 5) и соотношения ГВК/ДА в 5.8 раз (p < 0.01). В полосатом теле мышей С57BL/6 отмечены более высокие уровни НА (в 2.1 раза, p < 0.01), ДОФУК (в 1.9 раз, p < 0.01) и соотношения ДОФУК/ДА (в 2.7 раз, p < 0.01) (рис. 4), содержание 5-НТ, напротив, было меньше (в 1.9 раз, p < 0.01), чем у мышей BALB/c. В гипоталамусе обнаружен более низкий уровень ДОФУК (в 1.4 раза, p < 0.01) у мышей С57BL/6, чем у линии BALB/c.
Рис. 4.
Влияние ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) на содержание ДОФУК и соотношения ДОФ-УК/ДА в различных структурах головного мозга мышей BALB/c и С57BL/6 через 1 ч после острого плавательного стресса. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; х, хх – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях.
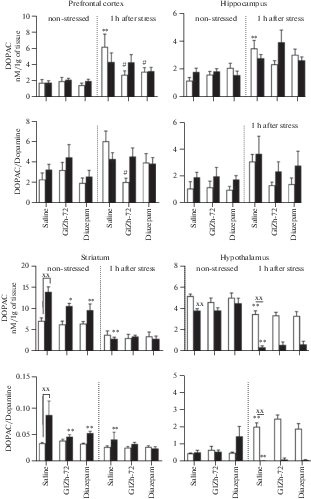
Рис. 5.
Влияние ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) на содержание 5-НТ и 5-ОИУК в различных структурах головного мозга мышей BALB/c и С57BL/6 через 1 ч после острого плавательного стресса. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; х, хх – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях.
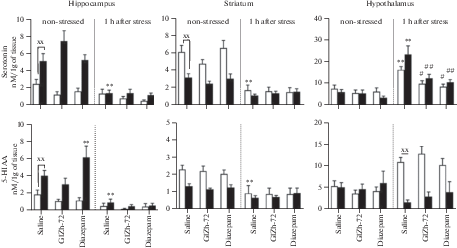
Влияние ГИЖ-72 и диазепама на содержание и оборот моноаминов в отсутствие стресса было более выражено у мышей линии С57BL/6. Так, в гиппокампе диазепам приводил к увеличению 5-ОИУК (в 1.5 раза, p < 0.01), а ГИЖ-72 к увеличению 5-НТ (в 1.5 раза, p < 0.05). В полосатом теле наблюдалось снижение ДОФУК под действием ГИЖ-72 (в 1.3 раза, p < 0.05) и диазепама (в 1.4 раза, p < 0.01); снижение соотношения ДОФУК/ДА после введения ГИЖ-72 в 2 раза (p < 0.01) и диазепама – в 1.6 раз (p < 0.01). У мышей BALB/c ГИЖ-72 увеличивал ДА (в 2.9 раз, p < 0.01) и соотношение 5-ОИУК/5-НТ (в 3.1 раз, p < 0.01) в гиппокампе.
Через 1 ч после ОПС наблюдались значимые изменения в содержании моноаминов во всех структурах мозга обеих линий мышей по сравнению с контролем, не подвергавшимся стрессу. В префронтальной коре мышей BALB/c наблюдалось увеличение НА (в 2.1 раза, p < 0.05) (рис. 3), ДОФУК (в 3.4 раза, p < 0.01) и соотношения ДОФУК/ДА (в 2.6 раз, p < 0.05) (рис. 4), в то время как у мышей С57BL/6 обнаружено снижение НА (в 2.1 раза, p < 0.05), ГВК (в 5.5 раз, p < 0.01) и соотношения ГВК/ДА (в 10.4 раз, p < 0.01). В гиппокампе мышей BALB/c выявлено снижение НА (в 3 раза, p < 0.01), увеличение ДОФУК (в 2.9 раз, p < 0.01) и 3-МТ (в 8.9 раз, p < 0.01). У мышей С57BL/6 в гиппокампе наблюдалось снижение НА (в 1.7 раз, p < 0.01), 5-ОИУК (в 4.3 раза, p < 0.01), 5-НТ (в 3.5 раз, p < 0.01) и соотношения ГВК/ДА (в 2.6 раз, p < 0.01). В полосатом теле мышей BALB/c обнаружено снижение 5-НТ (в 3.6 раз, p < 0.01) и 5-ОИУК (в 2.6 раз, p < 0.01) (рис. 5). У мышей С57BL/6 в данной структуре было выявлено снижение НА (в 2.3 раза, p < 0.01), ДОФУК (в 4.7 раз, p < 0.01), ДА (в 2.1 раз, p < 0.01), соотношения ДОФУК/ДА (в 2 раза, p < 0.01). В гипоталамусе мышей BALB/c регистрировали снижение НА (в 8 раз, p < 0.01), ДОФУК (в 1.5 раз, p < 0.01), ДА (в 4.7 раз, p < 0.01), увеличение 3-МТ (в 3.1 раз, p < 0.01), 5-НТ (в 2.1 раз, p < 0.01) и соотношения ДОФУК/ДА (в 4 раза, p < 0.01). У мышей С57BL/6 в гипоталамусе было обнаружено снижение НА (в 3.2 раза, p < 0.01), ДОФУК (в 10.1 раз, p < 0.01), соотношения ДОФУК/ДА (в 26.5 раз, p < 0.05), также выявлено увеличение ДА (в 1.5 раз, p < 0.01), 3-МТ (в 3.3 раза, p < 0.01) и 5-НТ (в 3.8 раз, p < 0.01).
Влияние ГИЖ-72 и диазепама через 1 ч после ОПС на содержание и оборот моноаминов было наиболее выражено в префронтальной коре и гипоталамусе по сравнению с контрольными группами, подвергнутыми стрессу. Так, в префронтальной коре мышей BALB/c после введения ГИЖ-72 было обнаружено снижение НА (в 3.2 раза, p < 0.01), ДОФУК (в 2.2 раза, p < 0.01) и соотношения ДОФУК/ДА (в 2.9 раз, p < 0.05). Диазепам также уменьшал НА (в 1.8 раз, p < 0.05), ДОФУК (в 2.2 раза, p < 0.01) и 3-МТ (в 1.8 раз, p < 0.05). В гипоталамусе мышей BALB/c ГИЖ-72 повышал НА (в 3.6 раз, p < 0.01) и уменьшал 5-НТ (в 1.6 раз, p < 0.05), диазепам уменьшал 5-НТ (в 1.9 раз, p < 0.05). У мышей С57BL/6 в гипоталамусе оба препарата повышали НА (ГИЖ-72 – в 2.6 раз, диазепам – в 2.4 раза, p < 0.01) (рис. 6), и снижали 5-НТ (ГИЖ-72 – в 1.9 раз, диазепам – в 2.2 раза, p < 0.01).
Рис. 6.
Влияние ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) на содержание ДА и НА в различных структурах головного мозга мышей BALB/c и С57BL/6 через 24 ч после острого плавательного стресса. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; х, хх – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях.
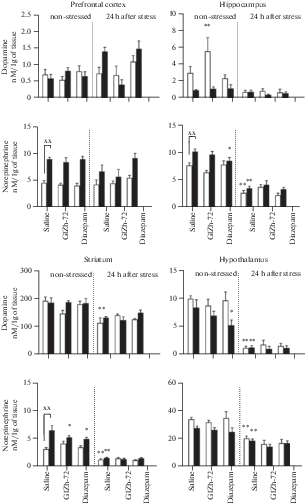
Рис. 7.
Влияние ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) на содержание ГВК, ДОФУК и соотношения ДОФУК/ДА в различных структурах головного мозга мышей BALB/c и С57BL/6 через 24 ч после острого плавательного стресса. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; х, хх – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях.
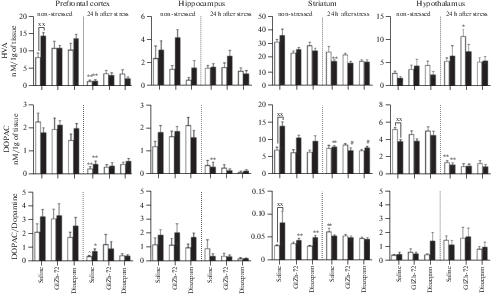
Через 24 ч после ОПС наблюдались значимые изменения в содержании моноаминов во всех структурах мозга обеих линий мышей по сравнению с контролем, не подвергавшимся стрессу. У мышей BALB/c во фронтальной коре наблюдалось снижение ДОФУК (в 9.1 раз, p < 0.01), ГВК (в 5.7 раз, p < 0.01) и соотношения ДОФ-УК/ДА (в 5.8 раз, p < 0.05) (рис. 7). У мышей линии С57BL/6 также выявлено снижение ДОФУК (в 4 раза, p < 0.05), ГВК (в 9 раз, p < 0.01), соотношений ДОФУ-К/ДА и ГВК/ДА (в 4.4 и 5.2 раза соответственно, p < 0.05), а также увеличение 5-ОИУК (в 5.6 раз, p < 0.05) (рис. 8). В гиппокампе изменения были наиболее выражены у мышей линии С57BL/6: снижение НА (в 2.9 раз, p < 0.01), ДОФУК (в 5.7 раз, p < 0.01), 5-ОИУК (в 10.1 раз, p < 0.01), 5-НТ (в 13 раз, p < 0.01) и увеличение 3-МТ (в 14.1 раз, p < 0.01). У мышей BALB/c наблюдалось только снижение НА (в 2.9 раз, p < 0.01) в гиппокампе. В полосатом теле мышей BALB/c регистрировали снижение НА (в 2.5 раза, p < 0.05), ДА (в 1.7 раз, p < 0.01), увеличение 5-ОИУК (в 1.7 раз, p < 0.01) и соотношения ДОФУК/ДА (в 2 раза, p < 0.01). У мышей С57BL/6 в полосатом теле обнаружено снижение НА (в 4 раза, p < 0.01), ДОФУК (в 1.8 раз, p < 0.01) и ГВК (в 2 раза, p < 0.01). В гипоталамусе у обеих линий наблюдались похожие изменения: снижение НА (BALB/c – в 1.7 раз, С57BL/6 – в 1.5 раз, p < 0.05), ДОФУК (BALB/c – в 3.7 раз, С57BL/6 – в 3.5 раз, p < 0.01) и ДА (BALB/c – в 8.7 раз, С57BL/6 – в 6.4 раза, p < 0.01).
Рис. 8.
Влияние ГИЖ-72 (20 мг/кг) и диазепама (1 мг/кг) на содержание 5-НТ и 5-ОИУК в различных структурах головного мозга мышей BALB/c и С57BL/6 через 24 ч после острого плавательного стресса. Белый цвет – мыши линии BALB/c; черный цвет – мыши линии С57BL/6. *, ** – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии без стресса; #, ## – р < 0.05, p < 0.01 – по сравнению с контролем соответствующей линии после стресса; х, хх – р < 0.05, p < 0.01 – по сравнению с BALB/c в аналогичных условиях.
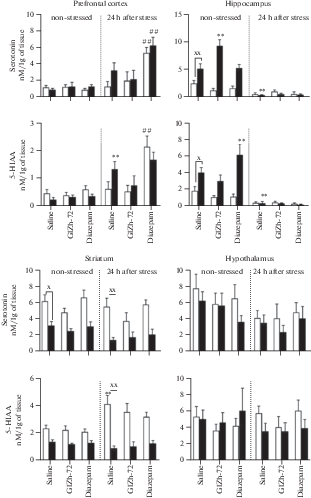
Влияние ГИЖ-72 и диазепама через 24 ч после ОПС на содержание и оборот моноаминов было наиболее выражено в префронтальной коре и гипоталамусе по сравнению с контрольными группами, подвергнутыми стрессу. ГИЖ-72 снижал уровень ДА до контрольных значений в префронтальной коре у мышей С57BL/6 (в 3.2 раза, p < 0.05) и повышал ГВК в гипоталамусе у мышей BALB/c (в 2.9 раз, p < 0.05). Диазепам повышал 5-НТ у обеих линий (BALB/c – в 4.1 раз, С57BL/6 – в 1.9 раз, p < 0.01) и 5-ОИУК у мышей BALB/c (в 3.4 раза, p < 0.01) в префронтальной коре.
Таким образом, наиболее значимыми нейрохимическими эффектами ОПС были: (1) повышение уровня 5-НТ и снижение НА в гипоталамусе мышей обеих линий; (2) повышение уровней НА, ДОФУК и соотношения ДОФУК/ДА в префронтальной коре мышей линии BALB/c. Перечисленные эффекты ослаблялись после введения изучаемых веществ или через 24 ч после ОПС. Уменьшение соотношения ДОФУК/ДА с одновременной тенденцией к уменьшению уровней 5-НТ и 5-ОИУК в полосатом теле мышей С57BL/6, в отличие от предыдущих эффектов, сохранялись через 24 ч после ОПС.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В тесте “открытое поле” через 1 ч после ОПС наблюдали повышение тревожности у мышей BALB/c и тенденцию к подобным изменениям у C57BL/6, через 24 ч – противоположный эффект, который выражался в увеличении всех регистрируемых параметров, кроме вертикальной активности, у мышей BALB/c и избирательным увеличением центральной активности у С57BL/6. Этот эффект можно охарактеризовать как “парадоксальный анксиолитический”, поскольку наряду с увеличением КОИР и общей двигательной активности мышей BALB/c наблюдали повышение индекса тревожности (процентного соотношения горизонтальной активности в центральной части установки и суммарной горизонтальной активности) у мышей обеих линий, что расценивают как коррелят анксиолитического эффекта [19]. Подобная динамика поведенческих реакций может быть обусловлена адаптивными изменениями в системе эндогенных нейроактивных стероидов. Известно, что ОПС приводит к изменению плотности митохондриального TSPO, играющего важную роль в биосинтезе эндогенных ГАМКА-модулирующих нейроактивных стероидов [11]. В частности, через 30–60 мин после ОПС плотность TSPO в головном мозге грызунов уменьшается, а через 24 ч – увеличивается в 2 раза [23]. Кроме того, введение РК11195, избирательного блокатора TSPO, приводит к уменьшению ОИР мышей BALB/c и C57BL/6 в тесте “открытое поле” [19], что согласуется с эффектами, наблюдаемыми через 1 ч после ОПС. С другой стороны, в тесте “закапывание шариков” аналогичная динамика была выявлена только у С57BL/6. Однако эти эффекты могут быть обусловлены иными механизмами, поскольку РК11195 не оказывает значимого влияния на поведение мышей в данном тесте [17].
Эффекты ГИЖ-72 в тесте “открытое поле” зависели от времени, прошедшего после стрессовой экспозиции, диазепам демонстрировал подобную зависимость в тесте “закапывание шариков”. По-видимому, анксиолитический эффект ГИЖ-72 опосредован активностью в отношении биосинтеза ГАМКА-модулирующих нейроактивных стероидов, что косвенно подтверждается двумя фактами. Во-первых, ранее было показано, что анксиолитический эффект ГИЖ-72 дозозависимо устраняется финастеридом [17], это может свидетельствовать о способности ГИЖ-72 модулировать активность 5α-редуктазы – одного из ключевых ферментов биосинтеза аллопрегнанолона – позитивного аллостерического модулятора ГАМКА-рецепторов. Во-вторых, эффекты ГИЖ-72 в тесте “открытое поле” через 24 ч после ОПС по своему поведенческому паттерну сходны с эффектами диазепама при отсутствии стрессового воздействия. Такие результаты можно было бы объяснить усилением биосинтеза ГАМКА-модулирующих нейроактивных стероидов под действием ГИЖ-72 на фоне увеличения плотности TSPO, которую наблюдают в эти временные рамки [23]. Аллопрегнанолон и диазепам способны замещать прегнанолон на оперантной модели лекарственной дифференцировки у крыс [24], что подтверждает схожесть эффектов этих веществ.
При изучении нейрохимических эффектов ОПС, а также влияния ГИЖ-72 и диазепама на вызванные стрессом изменения было установлено, что наибольшее их количество затрагивало ДА- и НА-системы всех изучаемых структур головного мозга мышей. В то же время значимые стресс-индуцированные изменения в 5-НТ-системе наблюдали, главным образом, в гипоталамусе и гиппокампе.
Повышение уровня ДОФУК через 1 ч после ОПС и увеличение оборота ДОФУК/ДА в префронтальной коре может быть следствием активации дофаминергических нейронов кортикостероном. Глюкокортикоидные рецепторы в избытке экспрессируются на дофаминергических нейронах вентральной области покрышки, формирующих восходящие мезокортикальные проекции, а их стимуляция необходима для поведенческой адаптации в условиях стресса – переключения между активной и пассивной стратегией поведения в тесте “принудительное плавание” [25]. В частности, было установлено, что стимуляция D1-рецепторов возбуждающих нейронов медиальной префронтальной коры на фоне острого стресса приводит к нейропластическим изменениям, которые опосредуют снижение чувствительности к повторным стрессовым воздействиям [26, 27]. По-видимому, уменьшение повышенного на фоне стресса уровня ДОФУК в префронтальной коре после введения диазепама и ГИЖ-72 – следствие угнетающего влияния изучаемых веществ на активность гипоталамо-гипофизарно-надпочечниковой системы [28]. Через 24 ч после стресса уровни ДОФУК, ГВК и обороты ДОФУК/ДА и ГВК/ДА в префронтальной коре были снижены, что может свидетельствовать об уменьшении активности дофаминергической системы после устранения стрессового фактора [29], это совпадало во времени с ослаблением тревожных реакций мышей в тесте “открытое поле”.
Уровень ДОФУК у контрольной группы мышей C57BL/6 при отсутствии стресса в гипоталамусе был ниже, чем у BALB/c, что, по-видимому, обусловлено особенностью ДА-системы мышей C57BL/6 – более высокими уровнями тирозингидроксилазы [30]. Уменьшение уровня ДА в гипоталамусе мышей BALB/c через 1 ч после ОПС согласуется с подобными изменениями у BALB/c при предъявлении хищника – повышением оборота ДОФУК/ДА [31]. Повышение концентрации ДА в гипоталамусе мышей C57BL/6 также согласуется с подобными изменениями после электрошока, психологического стресса и условно-рефлекторного страха [15]. В целом, изменения концентрации ДА и его оборота в гипоталамусе после острого стресса, по-видимому, являются следствием изменения секреции АКТГ, тиреотропного гормона, пролактина и соматотропного гормона [32].
Увеличение соотношения ДОФУК/ДА в гиппокампе мышей обеих линий через 1 ч после ОПС согласуется с результатами, полученными на модели иммобилизационного стресса – увеличением уровня ДОФУК [33, 34]. Подобные изменения характеризуют увеличение внутриклеточного метаболизма ДА и увеличение активности ДА-ергической системы. В свою очередь, это может указывать на регуляторную роль ДА в процессах нейропластичности: известно, что ДА стимулирует пролиферацию нейрональных клеток-предшественников и способствует выживаемости вновь образованных клеток гиппокампа [35]. Это предположение может быть подкреплено несколькими фактами. Во-первых, острый стресс способен оказывать стимулирующее влияние на процессы нейрогенеза в гиппокампе грызунов [36]. Во-вторых, хронический стресс приводит к уменьшению соотношения ДОФУК/ДА в гиппокампе грызунов [37], что сопровождается угнетением гиппокампального нейрогенеза [38, 39], в то время как антидепрессанты, известные своей способностью увеличивать количество митозов в субгранулярной зоне зубчатой извилины гиппокампа [40, 41], восстанавливают соотношение ДОФУК/ДА до контрольных значений в условиях хронического стресса [42]. Во-вторых, подобные изменения также наблюдают после воздействия нейротоксинов, в частности, 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП). Так, однократное введение МФТП приводило к увеличению соотношения ДОФУК/ДА в гиппокампе мышей С57BL/6 [43], а через несколько недель после МФТП-индуцированного повреждения регистрировали увеличение бромдезоксиуридин-положительных клеток в черной субстанции и гиппокампе мышей [44, 45].
В полосатом теле было обнаружено более высокое содержание ДОФУК и оборота ДОФУК/ДА у контрольной группы мышей C57BL/6 по сравнению с BALB/c, что может быть связано не только с ферментом тирозингидроксилаза, но и межлинейными различиями в уровнях стероидных гормонов. В частности, у C57BL/6 отмечают более высокие уровни андростендиола в плазме крови и тканях мозга [46], который участвует в синтезе тестостерона [47]. Известно, что хроническое, но не однократное введение тестостерона крысам приводит к увеличению уровней Д-ОФУК и ГВК, а также оборотов ДА по этим метаболитам [48], что согласуется с полученными результатами.
ОПС приводил к уменьшению оборота ДОФУК/ДА в полосатом теле у C57BL/6 через 1 ч после стрессовой экспозиции, в то время как у BALB/c была отмечена лишь тенденция к подобным изменениям. Согласно данным литературы, после теста “принудительное плавание” происходит увеличение уровня ДА в полосатом теле мышей BALB/c [14]. Расхождение полученных результатов с данными литературы можно объяснить различными временными интервалами между ОПС и декапитацией мышей. В представленном исследовании выделение изучаемых структур головного мозга проводили через 1 ч после ОПС, а в работе Miura и соавт. [14] через 40 мин после этой процедуры. По-видимому, уменьшение оборота ДОФУК/ДА в полосатом теле отражает истощение ДА в нигростриарной системе из-за интенсивной двигательной активности во время процедуры “принудительное плавание”, что подтверждается тенденцией к уменьшению общей двигательной активности мышей C57BL/6 в тесте “открытое поле” через 1 ч после ОПС. Через 24 ч данный показатель восстанавливался до контрольных значений у C57BL/6 и повышался у BALB/c, что совпадало с увеличением общей двигательной активности мышей BALB/c в тесте “открытое поле”.
С другой стороны, изменения активности ДА-ергической системы полосатого тела может отражать активность кортико-стриато-таламо-кортикальных нейронных сетей, дисфункция которых может лежать в основе патогенеза обсессивно-компульсивного расстройства [49, 50]. Установлено, что повышение оборотов ДОФУК/ДА, 3-МТ/ДА и ГВК/ДА в полосатом теле мышей с мутацией в дофаминовом транспортере (ДАТ) сопровождалось увеличением двигательной активности и уменьшением компульсивно-подобного поведения в тесте “закапывание шариков” по сравнению с интактными животными [51]. Таким образом, более высокий уровень ДОФУК и оборота ДОФУК/ДА в полосатом теле C57BL/6 может отчасти обусловливать межлинейные различия в тесте “закапывание шариков”.
Диазепам и ГИЖ-72 снижали уровни ДОФУК и оборот ДОФУК/ДА в полосатом теле C57BL/6 при отсутствии стресса, а через 24 ч после стресса данный эффект не только сохранялся, но и усиливался, совпадая по вектору действия с эффектами самого стресса и ослаблением тревожных реакций мышей в тесте “открытое поле”, что, по-видимому, может быть одним из нейрохимических маркеров анксиолитического эффекта изучаемых веществ.
Другим важным нейрохимическим показателем компульсивно-подобного поведения мышей в тесте “закапывание шариков” может являться уровень и оборот 5-НТ в полосатом теле. В работе Saadat и соавт. [52] было показано, что резкое повышение уровня 5-НТ, равно как и длительное снижение с одновременным уменьшением концентрации ДА, в полосатом теле мышей приводит к подавлению компульсивно-подобного поведения в тесте “закапывание шариков”. В нашей работе ОПС приводил к изменению компульсивно-подобного поведения только у мышей C57BL/6: через 1 ч после стрессовой экспозиции регистрировали повышение количества закопанных шариков, а через 24 ч – уменьшение. Это можно объяснить специфическими нейрохимическими изменениями в ДА- и 5-НТ-ергических системах полосатого тела. В частности, у мышей С57BL/6 отмечали снижение ДОФУ-К, ДА, оборота ДОФУК/ДА, а также уровней 5-НТ и 5-ОИУК в полосатом теле, в то время как у BALB/c регистрировали только снижение 5-НТ и 5-ОИУК через 1 ч после ОПС. Через 24 ч после ОПС тенденция к подобным изменениям сохранялась только у мышей С57BL/6, что может объяснять уменьшение компульсивно-подобного поведения и потенцирование эффекта диазепама.
Как правило, ОПС [53] и электрошок [16] приводят к повышению уровня 5-НТ в гиппокампе мышей, однако в нашей работе был получен противоположный результат – снижение уровней 5-НТ и 5-ОИУК. Как и при рассмотрении других нейрохимических изменений, в данном случае важно учитывать временной интервал от ОПС до извлечения изучаемых структур. Fujino и соавт. [53] было показано, что уровень 5-НТ в гиппокампе мышей резко повышается во время процедуры “принудительное плавание”, после чего постепенно возвращается к базальным значениям. Полученные в представленной работе результаты могут быть обусловлены истощением запасов нейромедиатора, о чем свидетельствует одновременное уменьшение концентрации 5-НТ и его основного метаболита – 5-ОИУК. Эти изменения сохранялись через 24 ч после ОПС.
Увеличение уровня 5-НТ в гипоталамусе через 1 ч после ОПС может свидетельствовать об активации гипоталамо-гипофизарно-надпочечниковой системы. В частности, 5-НТ может активировать гипоталамо-гипофизарно-надпочечниковую систему через стимуляцию 5-НТ2С-рецепторов паравентрикулярного ядра гипоталамуса [54]. Подобные нейрохимические изменения у мышей наблюдают как после ОПС [14], так и при электрошоке [16]. ГИЖ-72 и диазепам уменьшали концентрацию 5-НТ в гипоталамусе до базальных значений, что, по-видимому, связано с угнетающим действием изучаемых веществ на гипоталамо-гипофизарно-надпочечниковую систему [28]. Повышение уровня 5-НТ в гипоталамусе не наблюдалось через 24 ч после ОПС, что сопровождалось ослаблением тревожных реакций мышей в тесте “открытое поле”.
В случае с НА-ергической системой наблюдались определенные сходства с вектором изменений, происходящих в ДА-ергической: (1) увеличение уровня НА в префронтальной коре через 1 ч после ОПС только у BALB/с, которое полностью устранялось ГИЖ-72 и диазепамом – аналогичные тенденции были отмечены и в случае уровня ДОФУК; (2) уменьшение концентрации НА в полосатом теле через 1 ч после ОПС только у C57BL/6 и усиление этой тенденции через 24 ч после острого стресса – аналогично уровню ДОФУК.
Известно, что взаимодействие НА- и ДА-ергической систем в префронтальной коре имеет свои характерные особенности. Так, в этой структуре головного мозга плотность ДАТ низкая, поэтому функцию обратного захвата ДА выполняет норадреналиновые транспортеры (НАТ), а сродство ДА к НАТ превышает таковое к ДАТ [55–57]. Кроме того, ДА- и НА-ергическая системы префронтальной коры объединяют общие внутриклеточные сигнальные пути, сопряженные с дофаминовыми и адренорецепторами, а также совместное высвобождение ДА и НА в ответ на различные стимулы [58]. Несмотря на то, что кортикальные области имеют более плотные НА-ергические проекции из голубого пятна, чем полосатое тело, это может компенсироваться высокой плотностью адренорецепторов в последнем [59]. Связь между ДА- и НА-ергической системами полосатого тела прослеживается в локализации адренорецепторов на ДА-терминалях [60, 61], а также цАМФ-зависимыми внутриклеточными путями, сопряженными одновременно с ДА- и адренорецепторами [62]. Большое совпадение в экспрессии ДА- и адренорецепторов, а также сопряженных с ними внутриклеточных сигнальных путей, могут опосредовать сходные физиологические функции этих систем в префронтальной коре и полосатом теле. Снижение уровня НА в гиппокампе мышей (за счет усиления метаболизма НА) также наблюдают при предъявлении хищника [63] и после иммобилизационного стресса [64]. По-видимому, уменьшение данного параметра отражает динамику изменения концентрации и функцию гиппокампального НА во время острого стресса. Непосредственно во время острого стресса регистрируют увеличение НА в гиппокампе с одновременным повышением внеклеточной концентрации глюкозы [65, 66]. НА модулирует метаболизм глюкозы за счет стимуляции β- и α2-адренорецепторов [67, 68]: усиливает гликогенолиз астроцитов, нейрональный гликолиз и повышает плотность транспортеров глюкозы на поверхности нейронов и астроцитов [66]. Как полагают, это необходимо для обеспечения энергетических потребностей формирования памяти, связанной со стрессом [66]. Важно отметить, что этот эффект является быстрым и реализуется, главным образом, во время фаз приобретения и консолидации памяти [66], что, по-видимому, и объясняет уменьшение его концентрации в гиппокампе, когда нейрохимические измерения проводили после, а не непосредственно во время стрессовой экспозиции.
В нашей работе, как и в других, посвященных изучению нейрохимических эффектов различных видов острого стресса, таких как электрошок [16, 69], иммобилизация [64] и ОПС [14], регистрировали снижение концентрации НА в гипоталамусе через 1 ч после ОПС, в то время как ГИЖ-72 и диазепам оказывали противоположное влияние. По-видимому, это объясняется увеличением высвобождения НА в гипоталамусе во время острого стресса [70] с последующим усилением метаболизма, что, по-видимому, и опосредует его конечное уменьшение. НА, в свою очередь, в условиях острого стресса стимулирует секрецию кортикотропин-рилизинг-гормона, который опосредует эндокринные эффекты стресса [70]. ГИЖ-72 и диазепам препятствовали снижению НА в гипоталамусе, что, по-видимому, отражает снижение вызванного стрессом высвобождения НА и его метаболизма и является одним из нейрохимических маркеров анксиолитического эффекта [71].
Таким образом, можно выделить четыре важных нейрохимических изменения, наблюдаемых через 1 ч после ОПС, которые коррелировали с усилением тревожных реакций, а их изменение после введения изучаемых веществ или через 24 ч после стресса совпадало с анксиолитическим эффектом. Два эффекта были общими для мышей BALB/c и C57BL/6 – это (1) повышение уровня 5-НТ и (2) снижение НА в гипоталамусе. Два других – были характерны только для мышей BALB/c: (3) повышение уровня НА, (4) ДОФУК и увеличение оборота ДОФУК/ДА в префронтальной коре. Еще один эффект был характерен только для мышей С57BL/6 – снижение оборота ДОФУК/ДА с одновременной тенденцией к уменьшению уровней 5-НТ и 5-ОИУК в полосатом теле. Данный эффект, в отличие от предыдущих, сохранялся через 24 ч после ОПС. По-видимому, он является нейрохимическим маркером ослабления компульсивно-подобного поведения.
ЗАКЛЮЧЕНИЕ
Особенности поведенческих и нейрохимических эффектов ОПС зависели от времени, прошедшего с момента стрессовой экспозиции. Через 1 ч после ОПС отмечали усиление тревожных реакций мышей BALB/c и тенденцию к подобным изменениям у С57BL/6 в тесте “открытое поле”. В противоположность этому усиление компульсивно-подобного поведения в тесте “закапывание шариков” через 1 ч после ОПС наблюдали только у мышей C57BL/6. Через 24 ч после ОПС отмечали ослабление тревожных реакций мышей обеих линий в тесте “открытое поле” и у С57BL/6 в тесте “закапывание шариков”. Изменения в содержании и обороте моноаминов через 1 ч после ОПС включали: повышение уровня 5-НТ и снижение НА в гипоталамусе у мышей обеих линий и повышение уровня НА, ДОФУК, соотношения ДОФУК/ДА в префронтальной коре у BALB/c. Эти изменения коррелировали с тревожными реакциями, а их ослабление под действием ГИЖ-72, диазепама или через 24 ч после стресса совпадало с ослаблением тревожных реакций мышей в тесте “открытое поле”. В то же время снижение ДОФУК и оборота ДОФУК/ДА с тенденцией к уменьшению уровней 5-НТ и 5-ОИУК в полосатом теле мышей С57BL/6, которые сохранялись через 24 ч после стресса, могут быть нейрохимическим коррелятом ослабления компульсивно-подобного поведения.
Диазепам и ГИЖ-72 ослабляли тревожные реакции мышей линий BALB/c и C57BL/6, при этом у мышей C57BL/6 в тесте “открытое поле” диазепам вызывал выраженный седативный эффект. Перечисленные эффекты изучаемых соединений сопровождались одним общим нейрохимическим эффектом – снижением ДОФУК и соотношения ДОФУК/ДА в полосатом теле мышей C57BL/6. Этот нейрохимический эффект не только сохранялся, но и усиливался через 24 ч после ОПС. Через 1 ч после ОПС эффекты ГИЖ-72 сохранялись в тестах “открытое поле” и “закапывание шариков” у мышей BALB/c и С57BL/6, в то время как эффекты диазепама усиливались у мышей BALB/c и сохранялись у С57BL/6 в тесте “открытое поле”. Через 24 ч после стресса эффекты ГИЖ-72 в тесте “открытое поле” сохранялись у мышей BALB/c, но ослаблялись и сопровождались тенденцией к седативному эффекту у С57BL/6. Эффекты диазепама в “открытом поле”, напротив, усиливались только у С57BL/6 и отсутствовали у BALB/c. Эффекты ГИЖ-72 и диазепама в тесте “закапывание шариков” через 24 ч после стресса сохранялись у BALB/c, но не C57BL/6.
Список литературы
Biggio G, Concas A, Serra M, Salis M, Corda MG, Nurchi V, Crisponi C, Gessa GL (1984) Stress and beta-carbolines decrease the density of low affinity GABA binding sites; an effect reversed by diazepam. Brain Res 305: 13–18. https://doi.org/10.1016/0006-8993(84)91114-4
File SE (1993) The interplay of learning and anxiety in the elevated plus-maze. Behav Brain Res 58: 199–202. https://doi.org/10.1016/0166-4328(93)90103-w
McDonald BJ, Amato A, Connolly CN, Benke D, Moss SJ, Smart TG (1998) Adjacent phosphorylation sites on GABAA receptor beta subunits determine regulation by cAMP-dependent protein kinase. Nat Neurosci 1: 23–28. https://doi.org/10.1038/223
Nusser Z (1999) A new approach to estimate the number, density and variability of receptors at central synapses. Eur J Neurosci 11: 745–752. https://doi.org/10.1046/j.1460-9568.1999.00535.x
Purdy RH, Morrow AL, Moore PH, Jr., Paul SM (1991) Stress-induced elevations of gamma-aminobutyric acid type A receptor-active steroids in the rat brain. Proc Natl Acad Sci U S A 88: 4553–4557. https://doi.org/10.1073/pnas.88.10.4553
Park CH, Hitri A, Lukacs LG, Deutsch SI (1993) Swim stress selectively alters the specific binding of a benzodiazepine antagonist in mice. Pharmacol Biochem Behav 45: 299–304. https://doi.org/10.1016/0091-3057(93)90242-l
Deutsch SI, Rosse RB, Huntzinger JA, Novitzki MR, Mastropaolo J (1990) Profound stress-induced alterations in flurazepam’s antiseizure efficacy can be attenuated. Brain Res 520: 272–276. https://doi.org/10.1016/0006-8993(90)91715-s
Briones-Aranda A, Rocha L, Picazo O (2005) Alterations in GABAergic function following forced swimming stress. Pharmacol Biochem Behav 80: 463–470. https://doi.org/10.1016/j.pbb.2005.01.002
Vallee M, Rivera JD, Koob GF, Purdy RH, Fitzgerald RL (2000) Quantification of neurosteroids in rat plasma and brain following swim stress and allopregnanolone administration using negative chemical ionization gas chromatography/mass spectrometry. Anal Biochem 287: 153–166. https://doi.org/10.1006/abio.2000.4841
Reddy DS, Rogawski MA (2002) Stress-induced deoxycorticosterone-derived neurosteroids modulate GABA(A) receptor function and seizure susceptibility. J Neurosci 22: 3795–3805. https://doi.org/20026274
Batarseh A, Papadopoulos V (2010) Regulation of translocator protein 18 kDa (TSPO) expression in health and disease states. Mol Cell Endocrinol 327: 1–12. https://doi.org/10.1016/j.mce.2010.06.013
Середенин СБ (2003) Фармакологическая регуляция эмоционально-стрессовых реакций. Вестник Рос акад мед наук 35–37. [Seredenin SB (2003) Pharmacological regulation of emotional stress reactions. Vestn Ross Akad Med Nauk 35–37(In Russ)].
Seredenin SB, Nadorova AV, Kolik LG, Yarkova MA (2013) Effects of phenazepam on the behavior of C57BL/6 and BALB/c mice in the open field test after naloxone pretreatment. Bull Exp Biol Med 155: 346–349. https://doi.org/10.1007/s10517-013-2150-0
Miura H, Naoi M, Nakahara D, Ohta T, Nagatsu T (1993) Changes in monoamine levels in mouse brain elicited by forced-swimming stress, and the protective effect of a new monoamine oxidase inhibitor, RS-8359. J Neural Transm Gen Sect 94: 175–187. https://doi.org/10.1007/BF01277023
Sasaki K, Suzuki K, Ueno M, Takako K, Yoshizaki F (1998) Increase in monoamine levels caused by emotional stress in mice brain regions is attenuated by Saiko-ka-ryukotsu-borei-to. Methods Find Exp Clin Pharmacol 20: 27–30. https://doi.org/10.1358/mf.1998.20.1.485628
Shanks N, Zalcman S, Zacharko RM, Anisman H (1991) Alterations of central norepinephrine, dopamine and serotonin in several strains of mice following acute stressor exposure. Pharmacol Biochem Behav 38: 69–75. https://doi.org/10.1016/0091-3057(91)90591-o
Кудряшов НВ, Калинина ТС, Касабов КА, Шимширт АА, Волкова АВ, Жмуренко ЛА, Воронина ТА (2018) Роль метаболизма нейростероидов в антикомпульсивном эффекте производного пиразоло[c]пиридина – ГИЖ-72. Экспер и клин фармакол 81: 7–11. [Kudryashov NV, Kalinina TS, Kasabov KA, Shimshirt AA, Volkova AV, Zhmurenko LA, Voronina TA (2018) The role of neurosteroids metabolism in anticompulsive effect of pyrazole[c]pyridine derivative GIZH-72. Eksper i Klin Farmakol 81: 7–11(In Russ)].
Porsolt RD, Bertin A, Jalfre M (1977) Behavioral despair in mice: a primary screening test for antidepressants. Arch Int Pharmacodyn Ther 229: 327–336.
Калинина ТС, Шимширт АА, Кудряшов НВ, Воронина ТА, Середенин СБ (2014) Нейростероидогенез и ориентировочно-исследовательское поведение грызунов. Экспер и клин фармакол 77: 3–7. [Kalinina TS, Shimshirt AA, Kudryashov NV, Voronina TA, Seredenin SB (2014) Neurosteroidogenesis and exploratory responses in rodents. Eksper i Klin Farmakol 77: 3–7(In Russ)]. https://doi.org/10.30906/0869-2092-2014-77-2-3-7
Witkin JM (2008) Animal models of obsessive-compulsive disorder. Curr Protoc Neurosci Chapter 9:Unit 9 30. https://doi.org/10.1002/0471142301.ns0930s45
Anderzhanova EA, Bachli H, Buneeva OA, Narkevich VB, Medvedev AE, Thoeringer CK, Wotjak CT, Kudrin VS (2013) Strain differences in profiles of dopaminergic neurotransmission in the prefrontal cortex of the BALB/C vs. C57Bl/6 mice: consequences of stress and afobazole. Eur J Pharmacol 708: 95–104. https://doi.org/10.1016/j.ejphar.2013.03.015
Garrett KM, Niekrasz I, Haque D, Parker KM, Seale TW (1998) Genotypic differences between C57BL/6 and A inbred mice in anxiolytic and sedative actions of diazepam. Behav Genet 28: 125–136. https://doi.org/10.1023/a:1021424108213
Avital A, Richter-Levin G, Leschiner S, Spanier I, Veenman L, Weizman A, Gavish M (2001) Acute and repeated swim stress effects on peripheral benzodiazepine receptors in the rat hippocampus, adrenal, and kidney. Neuropsychopharmacology 25: 669–678. https://doi.org/10.1016/S0893-133X(01)00286-X
Vanover KE (1997) Discriminative stimulus effects of the endogenous neuroactive steroid pregnanolone. Eur J Pharmacol 327: 97–101. https://doi.org/10.1016/s0014-2999(97)89647-1
de Kloet ER, Molendijk ML (2016) Coping with the Forced Swim Stressor: Towards Understanding an Adaptive Mechanism. Neural Plast 2016: 6503162. https://doi.org/10.1155/2016/6503162
Shinohara R, Taniguchi M, Ehrlich AT, Yokogawa K, Deguchi Y, Cherasse Y, Lazarus M, Urade Y, Ogawa A, Kitaoka S, Sawa A, Narumiya S, Furuyashiki T (2018) Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry 23: 1717–1730. https://doi.org/10.1038/mp.2017.177
Anderson EM, Gomez D, Caccamise A, McPhail D, Hearing M (2019) Chronic unpredictable stress promotes cell-specific plasticity in prefrontal cortex D1 and D2 pyramidal neurons. Neurobiol Stress 10: 100152. https://doi.org/10.1016/j.ynstr.2019.100152
Mikkelsen JD, Soderman A, Kiss A, Mirza N (2005) Effects of benzodiazepines receptor agonists on the hypothalamic-pituitary-adrenocortical axis. Eur J Pharmacol 519: 223–230. https://doi.org/10.1016/j.ejphar.2005.06.049
Belujon P, Grace AA (2015) Regulation of dopamine system responsivity and its adaptive and pathological response to stress. Proc Biol Sci 282 https://doi.org/10.1098/rspb.2014.2516
Ginovart N, Marcel D, Bezin L, Gagne C, Pujol JF, Weissmann D (1996) Tyrosine hydroxylase expression within Balb/C and C57black/6 mouse locus coeruleus. II. Quantitative study of the enzyme level. Brain Res 719: 45–55. https://doi.org/10.1016/0006-8993(96)00075-3
Belzung C, El Hage W, Moindrot N, Griebel G (2001) Behavioral and neurochemical changes following predatory stress in mice. Neuropharmacology 41: 400–408. https://doi.org/10.1016/s0028-3908(01)00072-7
Konstandi M, Johnson E, Lang MA, Malamas M, Marselos M (2000) Noradrenaline, dopamine, serotonin: different effects of psychological stress on brain biogenic amines in mice and rats. Pharmacol Res 41: 341–346. https://doi.org/10.1006/phrs.1999.0597
Nadaoka I, Yasue M, Sami M, Kitagawa Y (2012) Oral administration of Cimicifuga racemosa extract affects immobilization stress-induced changes in murine cerebral monoamine metabolism. Biomed Res 33: 133–137. https://doi.org/10.2220/biomedres.33.133
Rowland NE, Dunn AJ (1995) Effect of dexfenfluramine on metabolic and neurochemical measures in restraint-stressed ob/ob mice. Physiol Behav 58: 749–754. https://doi.org/10.1016/0031-9384(95)00105-r
Takamura N, Nakagawa S, Masuda T, Boku S, Kato A, Song N, An Y, Kitaichi Y, Inoue T, Koyama T, Kusumi I (2014) The effect of dopamine on adult hippocampal neurogenesis. Prog Neuropsychopharmacol Biol Psychiatry 50: 116–124. https://doi.org/10.1016/j.pnpbp.2013.12.011
Kirby ED, Muroy SE, Sun WG, Covarrubias D, Leong MJ, Barchas LA, Kaufer D (2013) Acute stress enhances adult rat hippocampal neurogenesis and activation of newborn neurons via secreted astrocytic FGF2. Elife 2:e00362. https://doi.org/10.7554/eLife.00362
Gemmel M, Rayen I, Lotus T, van Donkelaar E, Steinbusch HW, De Lacalle S, Kokras N, Dalla C, Pawluski JL (2016) Developmental fluoxetine and prenatal stress effects on serotonin, dopamine, and synaptophysin density in the PFC and hippocampus of offspring at weaning. Dev Psychobiol 58: 315–327. https://doi.org/10.1002/dev.21372
de Andrade JS, Cespedes IC, Abrao RO, Dos Santos TB, Diniz L, Britto LR, Spadari-Bratfisch RC, Ortolani D, Melo-Thomas L, da Silva RC, Viana MB (2013) Chronic unpredictable mild stress alters an anxiety-related defensive response, Fos immunoreactivity and hippocampal adult neurogenesis. Behav Brain Res 250: 81–90. https://doi.org/10.1016/j.bbr.2013.04.031
Mineur YS, Belzung C, Crusio WE (2007) Functional implications of decreases in neurogenesis following chronic mild stress in mice. Neuroscience 150: 251–259. https://doi.org/10.1016/j.neuroscience.2007.09.045
Alenina N, Klempin F (2015) The role of serotonin in adult hippocampal neurogenesis. Behav Brain Res 277: 49–57. https://doi.org/10.1016/j.bbr.2014.07.038
Anacker C, Zunszain PA, Cattaneo A, Carvalho LA, Garabedian MJ, Thuret S, Price J, Pariante CM (2011) Antidepressants increase human hippocampal neurogenesis by activating the glucocorticoid receptor. Mol Psychiatry 16: 738–750. https://doi.org/10.1038/mp.2011.26
Kudryashov NV, Kalinina TS, Shimshirt AA, Volkova AV, Narkevich VB, Naplekova PL, Kasabov KA, Kudrin VS, Voronina TA, Fisenko VP (2020) The Behavioral and Neurochemical Aspects of the Interaction between Antidepressants and Unpredictable Chronic Mild Stress. Acta Naturae 12: 63–72. https://doi.org/10.32607/actanaturae.10942
Kapitza IG, Kalinina TS, Nerobkova LN, Voronina TA, Klodt PM, Narkevich VB, Kudrin VS (2008) Relationship between the severity of hypokinesia induced by neurotoxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine and neurochemical changes in brain structures of C57Bl/6 mice. Bull Exp Biol Med 146: 52–55. https://doi.org/10.1007/s10517-008-0204-5
Zhao M, Momma S, Delfani K, Carlen M, Cassidy RM, Johansson CB, Brismar H, Shupliakov O, Frisen J, Janson AM (2003) Evidence for neurogenesis in the adult mammalian substantia nigra. Proc Natl Acad Sci U S A 100: 7925–7930. https://doi.org/10.1073/pnas.1131955100
Shan X, Chi L, Bishop M, Luo C, Lien L, Zhang Z, Liu R (2006) Enhanced de novo neurogenesis and dopaminergic neurogenesis in the substantia nigra of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced Parkinson’s disease-like mice. Stem Cells 24: 1280–1287. https://doi.org/10.1634/stemcells.2005-0487
Tagawa N, Sugimoto Y, Yamada J, Kobayashi Y (2006) Strain differences of neurosteroid levels in mouse brain. Steroids 71: 776–784. https://doi.org/10.1016/j.steroids.2006.05.008
Miller WL, Auchus RJ (2019) The “backdoor pathway” of androgen synthesis in human male sexual development. PLoS Biol 17: e3000198. https://doi.org/10.1371/journal.pbio.3000198
Sanchez MG, Bourque M, Morissette M, Di Paolo T (2010) Steroids-dopamine interactions in the pathophysiology and treatment of CNS disorders. CNS Neurosci Ther 16:e43-71. https://doi.org/10.1111/j.1755-5949.2010.00163.x
Schneier FR, Martinez D, Abi-Dargham A, Zea-Ponce Y, Simpson HB, Liebowitz MR, Laruelle M (2008) Striatal dopamine D(2) receptor availability in OCD with and without comorbid social anxiety disorder: preliminary findings. Depress Anxiety 25: 1–7. https://doi.org/10.1002/da.20268
Zhang H, Wang B, Li K, Wang X, Li X, Zhu J, Zhao Q, Yang Y, Lv L, Zhang M, Zhang H (2019) Altered Functional Connectivity Between the Cerebellum and the Cortico-Striato-Thalamo-Cortical Circuit in Obsessive-Compulsive Disorder. Front Psychiatry 10: 522. https://doi.org/10.3389/fpsyt.2019.00522
DiCarlo GE, Aguilar JI, Matthies HJ, Harrison FE, Bundschuh KE, West A, Hashemi P, Herborg F, Rickhag M, Chen H, Gether U, Wallace MT, Galli A (2019) Autism-linked dopamine transporter mutation alters striatal dopamine neurotransmission and dopamine-dependent behaviors. J Clin Invest 129: 3407–3419. https://doi.org/10.1172/JCI127411
Saadat KS, Elliott JM, Colado MI, Green AR (2006) The acute and long-term neurotoxic effects of MDMA on marble burying behaviour in mice. J Psychopharmacol 20: 264–271. https://doi.org/10.1177/0269881106058022
Fujino K, Yoshitake T, Inoue O, Ibii N, Kehr J, Ishida J, Nohta H, Yamaguchi M (2002) Increased serotonin release in mice frontal cortex and hippocampus induced by acute physiological stressors. Neurosci Lett 320: 91–95. https://doi.org/10.1016/s0304-3940(02)00029-0
Heisler LK, Pronchuk N, Nonogaki K, Zhou L, Raber J, Tung L, Yeo GS, O’Rahilly S, Colmers WF, Elmquist JK, Tecott LH (2007) Serotonin activates the hypothalamic-pituitary-adrenal axis via serotonin 2C receptor stimulation. J Neurosci 27: 6956–6964. https://doi.org/10.1523/JNEUROSCI.2584-06.2007
Sesack SR, Hawrylak VA, Matus C, Guido MA, Levey AI (1998) Dopamine axon varicosities in the prelimbic division of the rat prefrontal cortex exhibit sparse immunoreactivity for the dopamine transporter. J Neurosci 18: 2697–2708.
Giros B, Wang YM, Suter S, McLeskey SB, Pifl C, Caron MG (1994) Delineation of discrete domains for substrate, cocaine, and tricyclic antidepressant interactions using chimeric dopamine-norepinephrine transporters. J Biol Chem 269: 15985–15988.
Gu H, Wall SC, Rudnick G (1994) Stable expression of biogenic amine transporters reveals differences in inhibitor sensitivity, kinetics, and ion dependence. J Biol Chem 269: 7124–7130.
Xing B, Li YC, Gao WJ (2016) Norepinephrine versus dopamine and their interaction in modulating synaptic function in the prefrontal cortex. Brain Res 1641: 217–233. https://doi.org/10.1016/j.brainres.2016.01.005
Ranjbar-Slamloo Y, Fazlali Z (2019) Dopamine and Noradrenaline in the Brain; Overlapping or Dissociate Functions? Front Mol Neurosci 12: 334. https://doi.org/10.3389/fnmol.2019.00334
Paschalis A, Churchill L, Marina N, Kasymov V, Gourine A, Ackland G (2009) beta1-Adrenoceptor distribution in the rat brain: an immunohistochemical study. Neurosci Lett 458: 84–88. https://doi.org/10.1016/j.neulet.2009.04.023
Hara M, Fukui R, Hieda E, Kuroiwa M, Bateup HS, Kano T, Greengard P, Nishi A (2010) Role of adrenoceptors in the regulation of dopamine/DARPP-32 signaling in neostriatal neurons. J Neurochem 113: 1046–1059. https://doi.org/10.1111/j.1471-4159.2010.06668.x
Nomura S, Bouhadana M, Morel C, Faure P, Cauli B, Lambolez B, Hepp R (2014) Noradrenalin and dopamine receptors both control cAMP-PKA signaling throughout the cerebral cortex. Front Cell Neurosci 8: 247. https://doi.org/10.3389/fncel.2014.00247
Hayley S, Borowski T, Merali Z, Anisman H (2001) Central monoamine activity in genetically distinct strains of mice following a psychogenic stressor: effects of predator exposure. Brain Res 892: 293–300. https://doi.org/10.1016/s0006-8993(00)03262-5
Кондаурова ЕМ, Антонов ЮВ, Баженова ЕЮ, Базовкина ДВ, Науменко ВС (2020) Эффекты острого стресса у мышей, различающихся чувствительностью 5-HT1A-рецепторов к хронической активации с помощью 8-OH-DPAT. Рос физиол журн им ИМ Сеченова 106(9): 1069–1084. [Kondaurova EM, Antonov YV, Bazhenova EY, Bazovkina DV, Naumenko VS (2020) Acute Stress Effects on Mice Differeding by Sensivity of 5-HT1A-Receptor to Chronic Activation with 8-OH-DPAT. Russ J Physiol 106(9): 1069–1084 (In Russ)]. https://doi.org/10.31857/S0869813920090010
Tajima T, Endo H, Suzuki Y, Ikari H, Gotoh M, Iguchi A (1996) Immobilization stress-induced increase of hippocampal acetylcholine and of plasma epinephrine, norepinephrine and glucose in rats. Brain Res 720: 155–158. https://doi.org/10.1016/0006-8993(96)00046-7
Osborne DM, Pearson-Leary J, McNay EC (2015) The neuroenergetics of stress hormones in the hippocampus and implications for memory. Front Neurosci 9: 164. https://doi.org/10.3389/fnins.2015.00164
Subbarao KV, Hertz L (1990) Effect of adrenergic agonists on glycogenolysis in primary cultures of astrocytes. Brain Res 536: 220–226. https://doi.org/10.1016/0006-8993(90)90028-a
Gibbs ME, Hutchinson DS, Summers RJ (2008) Role of beta-adrenoceptors in memory consolidation: beta3-adrenoceptors act on glucose uptake and beta2-adrenoceptors on glycogenolysis. Neuropsychopharmacology 33: 2384–2397. https://doi.org/10.1038/sj.npp.1301629
Irwin J, Ahluwalia P, Anisman H (1986) Sensitization of norepinephrine activity following acute and chronic footshock. Brain Res 379: 98–103. https://doi.org/10.1016/0006-8993(86)90260-x
Pacak K, Palkovits M, Kopin IJ, Goldstein DS (1995) Stress-induced norepinephrine release in the hypothalamic paraventricular nucleus and pituitary-adrenocortical and sympathoadrenal activity: in vivo microdialysis studies. Front Neuroendocrinol 16: 89–150. https://doi.org/10.1006/frne.1995.1004
Tanaka M, Yoshida M, Emoto H, Ishii H (2000) Noradrenaline systems in the hypothalamus, amygdala and locus coeruleus are involved in the provocation of anxiety: basic studies. Eur J Pharmacol 405: 397–406. https://doi.org/10.1016/s0014-2999(00)00569-0
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


