Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 9, стр. 1138-1149
Влияние нефрэктомии на реактивность артерий спонтанно гипертензивных крыс
В. Н. Ярцев *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: yartsev@infran.ru
Поступила в редакцию 22.02.2021
После доработки 21.06.2021
Принята к публикации 05.07.2021
Аннотация
В опытах на сегментах передней брыжеечной (ПБА) и внутренней сонной артерии (ВСА) крыс линии SHR изучалось влияние хронической болезни почек на констрикторные и дилататорные свойства этих артерий в изометрическом режиме. В качестве модели хронической болезни почек использовали нефрэктомию, которую осуществляли посредством удаления 5/6 почечной ткани крыс в возрасте 3 месяца. После пресокращения сосудов фенилэфрином их дилатацию вызывали ацетилхолином или нитропруссидом натрия в отсутствие и на фоне действия блокаторов калиевых каналов (тетраэтиламмония или глибенкламида) либо ингибитора гуанилатциклазы – метиленового синего. Было обнаружено значительное повышение артериального давления у нефрэктомированных животных по сравнению с контрольными. Констрикторная реакция ПБА нефрэктомированных крыс на фенилэфрин несколько снижалась относительно реакции контрольных и достоверно уменьшалась на фоне действия метиленового синего относительно исходного значения. У ВСА нефрэктомированных крыс эта реакция была значительно меньше, чем у ВСА контрольных как при отсутствии, так и на фоне действия блокаторов и ингибитора. Влияния нефрэктомии на дилататорную реакцию обеих артерий, вызванную ацетилхолином или нитропруссидом натрия, обнаружено не было, однако констрикторная фаза реакции ВСА на ацетилхолин на фоне действия глибенкламида достоверно снижалась у нефрэктомированных, но не у контрольных крыс. Делается заключение, что хроническая болезнь почек может ослаблять эндотелий-зависимые и эндотелий-независимые констрикторные реакции в большей степени у ВСА, чем у ВБА спонтанно гипертензивных крыс, при участии АТФ-чувствительных К+-каналов у ВСА и гуанилатциклазы у ВБА.
Хроническая болезнь почек (ХБП) в последнее время привлекает большое внимание в связи с ее широкой распространенностью и высокой смертностью, в десятки раз превышающей смертность в общей популяции [1]. Причем основной причиной смерти при ХБП являются события, связанные с нарушением работы сердечно-сосудистой системы [2–4]. Известно, что при ХБП риск смерти от сердечно-сосудистых осложнений увеличивается вследствие ускоренного развития атеросклероза, повышенной жесткости артерий и нарушения функции эндотелия. В частности, было показано, что уремические токсины, выделяющиеся в кровь при ХБП, изменяют фенотип сосудистых гладкомышечных клеток, приводя к экспрессии коллагена и последующему ремоделированию внеклеточного матрикса сосудистой стенки [5]. Причем механизм образования отложений гидроксиапатита на внутренней поверхности и внутри сосудистой стенки при ее кальцификации аналогичен механизму, имеющему место в костной ткани [6]. В опытах на крысах с использованием нефрэктомии как модели ХБП было продемонстрировано, что отмеченное многими исследователями нарушение функции эндотелия у пациентов с ХБП [7–9], в частности, связано с усилением окислительного стресса и воспаления, приводившим к уменьшению продукции оксида азота (NO) [10], а также эндотелиального гиперполяризующего фактора [11, 12].
Другим широко распространенным и опасным заболеванием, связанным с нарушением функционирования сердечно-сосудистой системы, считается гипертоническая болезнь, сопровождающаяся артериальной гипертензией, которая, согласно проведенным оценкам, поражает 16–37% населения [13] и в 2010 г. была причиной смерти в 18% случаев, а наряду с повышенным потреблением соли является во всем мире главным фактором риска смерти и потери работоспособности [14]. В исследованиях на изолированных кровеносных сосудах спонтанно гипертензивных крыс, а также людей, страдающих гипертензией, было показано, что при повышенном артериальном давлении наблюдаются структурные и функциональные изменения артерий, такие, как ремоделирование сосудистой стенки, сопровождающееся ее утолщением и повышением жесткости [15], увеличение экспрессии и чувствительности IP3-рецепторов [16], а также значительное уменьшение эндотелий-зависимой дилатации [17–19].
Было отмечено, что гипертензия и ХБП являются взаимосвязанными заболеваниями [20], однако вопрос о влиянии ХБП на сократительную активность кровеносных сосудов при наличии гипертонической болезни иной этиологии остается практически не изученным. Нам удалось обнаружить только одну работу по выяснению действия нефрэктомии на реактивность артерий спонтанно гипертензивных крыс [21].
Исходя из имеющихся данных о том, что нефрэктомия, являющаяся общепризнанной моделью ХБП [22–24], может приводить к повышению изначально нормального артериального давления, предположительно, за счет обнаруженного снижения дилататорной [10, 11, 22–25] и увеличения констрикторной [22, 24, 26] способности кровеносных сосудов, в качестве рабочей гипотезы для нашего исследования выступало предположение о том, что ХБП может вызывать аналогичные изменения и при наличии гипертонической болезни иной этиологии. Учитывая все сказанное выше, мы провели данное исследование, целью которого являлось изучение влияния нефрэктомии на реактивность артерий спонтанно гипертензивных крыс и выяснение возможных механизмов этого влияния.
В качестве объектов исследования были взяты: передняя брыжеечная артерия (ПБА), часто используемая при изучении влияния нефрэктомии на реактивность кровеносных сосудов [25, 27, 28], и внутренняя сонная артерия (ВСА), которая, будучи парной, обеспечивает большую часть мозгового кровотока у человека и крысы [29], а, как известно, нарушение этого кровотока является частой причиной инсультов при гипертонии разной этиологии [30].
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из ЦКП Биоколлекция Института физиологии им. И.П. Павлова РАН, поддержанной Программой по сохранению и развитию биоресурсных коллекций России.
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по биоэтике Института физиологии им. И.П. Павлова РАН. Опыты проводили на самцах крыс линии SHR через 3 месяца после нефрэктомии (n = 9, артериальное давление (АД) 238 ± 2 мм рт. ст.) и ложнооперированных контрольных (n = 11, АД 190 ± 2 мм рт. ст., р < 0.001) животных массой 250–350 г. АД измеряли на хвосте манжеточным методом с помощью электроманометра фирмы ELEMA (Швеция). ХБП моделировали путем резекции 5/6 массы почечной ткани у крыс в возрасте 3 месяца по описанной ранее методике [25], в результате использования которой через 4 месяца после операции содержание мочевины в сыворотке крови крыс увеличивалось в среднем с 4.9 ± 0.6 до 20.1 ± 2.6 ммоль/л (р < 0.001) [25]. Контролем служили ложнооперированные крысы, которые подвергались аналогичному оперативному вмешательству, но без удаления почечной ткани. Эвтаназию животных осуществляли посредством эфирного наркоза.
После эвтаназии отпрепаровывали левую ВСА, а затем ПБА. От каждой из этих артерий отрезали кольцевой участок длиной 2 мм, который надевали на две вольфрамовые иголочки (диаметром 70 мкм каждая), одна из которых была соединена со штоком погружателя микроэлектродов, а вторая – с механотроном 6МХ1С, сигнал от которого, отражающий изменение натяжения в стенке сегмента, усиливался и поступал на АЦП S-Recorder-L (ADSlab, Россия), а далее на персональный компьютер для обработки в программе S-Recorder (ADSlab, Россия). Иголочки с кольцевым участком помещали в проточную термостатируемую (37°C) ванночку объемом 10 мл, заполненную бикарбонатным раствором Кребса следующего состава (в мМ): NaCl – 115, KCl – 4.7, CaCl2 – 2.6, MgSO4⋅7H2O – 1.2, NaHCO3 – 25, KH2PO4 – 1.2, глюкоза – 10. рН раствора доводили до значения 7.4 и контролировали в течение всего эксперимента, поддерживая это значение путем пропускания через раствор соответствующего количества СО2 или комнатного воздуха. После погружения препарата в раствор, иголочки миографа ступенчато разводили до значения натяжения, при котором наблюдался максимальный ответ сосудистого сегмента на стимуляцию электрическим полем (30 В, 3 мс) с частотой 10 Гц в течение 3 с. Электростимуляция осуществлялась с помощью двух платиновых электродов, расположенных на расстоянии 2 мм от сосудистого сегмента. После адаптации препарата, продолжавшейся 30 мин, начинали регистрацию натяжения стенки сосуда. Для оценки дилататорной способности сосуда использовали ацетилхолин хлорид (Sigma-Aldrich, США) 10–5 М или нитропруссид натрия (ICN Biomedicals, США) 10–6 М на фоне пресокращения фенилэфрином (Sigma-Aldrich, США) 10–5 М. Дилатацию выражали в процентном отношении к констрикции, вызванной фенилэфрином. С целью оценки участия Ca2+-активируемых K+-каналов большой проводимости, АТФ-чувствительных K+-каналов и растворимой гуанилатциклазы в сосудистых реакциях в ванночку вводили соответствующие блокаторы: тетраэтиламмоний хлорид (Вектон, Россия) 10–3 М, глибенкламид (Sigma-Aldrich, США) 10–5 М или ингибитор растворимой гуанилатциклазы – метиленовый синий (Вектон, Россия) 10–5 М. Через 15 мин после введения блокатора или ингибитора в ванночку вводили фенилэфрин с последующим добавлением ацетилхолина и нитропруссида натрия. Глибенкламид растворяли в диметилсульфоксиде (Вектон, Россия), широко применяемом для этой цели в экспериментах на изолированных сосудах [31]. Концентрация диметилсульфоксида в ванночке с сосудистым сегментом не превышала 0.1%. Маточные растворы остальных используемых веществ готовили на основе дистиллированной воды.
При статистической обработке результатов использовали программы IBM SPSS Statistics v. 26 и Statistica v. 12. Оценку нормальности распределения выборок проводили с помощью программы IBM SPSS Statistics v. 26, используя критерии Пирсона и Колмогорова–Смирнова. Вследствие нормальности распределения полученные данные представляли в виде среднего значения ± стандартная ошибка среднего. Достоверность отличий реакций сосудов нефрэктомированных и контрольных крыс в отсутствие и на фоне действия блокаторов K+-каналов и ингибитора гуанилатциклазы определяли, применяя двухфакторный дисперсионный анализ с поправкой Бонферрони при последующем post-hoc анализе. Для сравнения двух выборок использовали t-критерий Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
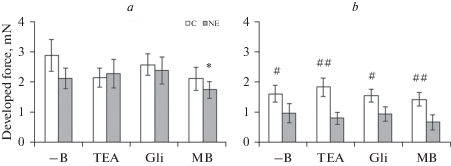
В экспериментах на ПБА контрольных и нефрэктомированных крыс введение фенилэфрина вызывало сократительную реакцию, которая в среднем составляла 2.9 ± 0.5 и 2.1 ± 0.3 мН (р > 0.05) соответственно. Какого-либо действия блокаторов K+-каналов на эту реакцию у крыс обеих групп обнаружено не было, в то время как ингибитор гуанилатциклазы статистически достоверно снижал величину сокращения ПБА нефрэктомированных животных (рис. 1a). Величина сократительной реакции ВСА контрольных и нефрэктомированных крыс была существенно меньше, чем у ПБА и составляла в среднем 1.6 ± 0.3 и 1.0 ± 0.3 мН соответственно. Под действием блокаторов K+-каналов и ингибитора гуанилатциклазы на эту артерию у крыс обеих групп не происходило изменения величины данной реакции относительно исходных значений. Нефрэктомия привела к достоверному и значительному снижению сократительного ответа ВСА на фенилэфрин как в отсутствие, так и при наличии блокаторов и ингибитора (рис. 1b).
Рис. 1.
Сократительная реакция на фенилэфрин (10–5 М) сегмента верхней брыжеечной (a) и внутренней сонной (b) артерии контрольных (C) и нефрэктомированных (NE) крыс при отсутствии блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего. * р < 0.05 при сравнении с –В соответствующей группы; # р < 0.05 и ## р < 0.005 при сравнении с NE.
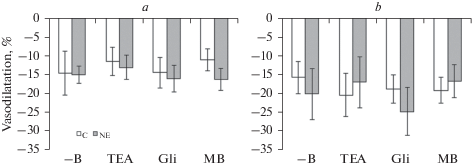
Артерии, пресокращенные фенилэфрином, в подавляющем большинстве случаев реагировали на введение ацетилхолина двухфазной реакцией, дилататорная фаза которой у контрольных и нефрэктомированных крыс для ПБА составляла 14.7 ± 5.8 и 15.0 ± 2.3%, а для ВСА 16.1 ± 4.2 и 20.5 ± 6.8% соответственно. В результате действия блокаторов K+-каналов и ингибитора гуанилатциклазы не происходило изменения дилататорной фазы реакции обоих сосудов контрольных и нефрэктомированных крыс относительно исходных значений (рис. 2a, b). Влияния нефрэктомии на эту фазу реакции не было обнаружено ни при отсутствии, ни на фоне действия блокаторов и ингибитора.
Рис. 2.
Дилататорная фаза реакции на ацетилхолин (10–5 М) пресокращенного фенилэфрином (10–5 М) сегмента верхней брыжеечной (a) и внутренней сонной (b) артерии контрольных (C) и нефрэктомированных (NE) крыс при отсутствии блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего.
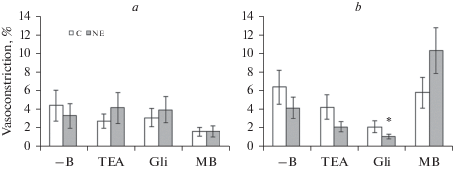
Констрикторная фаза реакции на ацетилхолин ПБА контрольных и нефрэктомированных крыс составляла 4.4 ± 1.6 и 3.4 ± 1.3% соответственно и не изменялась на фоне действия блокаторов и ингибитора (рис. 3a). Вызванная ацетилхолином сократительная реакция ВСА контрольных и нефрэктомированных крыс в условиях отсутствия блокаторов K+-каналов и ингибитора гуанилатциклазы была равна 6.5 ± 1.8 и 4.3 ± 1.1% соответственно и достоверно снижалась только на фоне действия глибенкламида и только у нефрэктомированных крыс (рис. 3b).
Рис. 3.
Сократительная фаза реакции на ацетилхолин (10–5 М) пресокращенного фенилэфрином (10–5 М) сегмента верхней брыжеечной (a) и внутренней сонной (b) артерии контрольных (C) и нефрэктомированных (NE) крыс при отсутствии блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего. *р < 0.05 при сравнении с –В соответствующей группы.
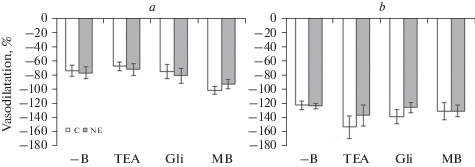
Дилататорная реакция контрольных и нефрэктомированных крыс, вызванная нитропруссидом натрия, в условиях отсутствия блокаторов K+-каналов и ингибитора гуанилатциклазы была примерно одинаковой, составляя у ПБА 74.7 ± 7.7 и 77.3 ± 7.9%, а у ВСА 121.1 ± 6.2 и 122.1 ± 3.6% соответственно, и достоверно не изменялась на фоне их действия у обеих артерий (рис. 4).
Рис. 4.
Дилататорная реакция на нитропруссид натрия (10–6 М) пресокращенного фенилэфрином (10–5 М) сегмента верхней брыжеечной (a) и внутренней сонной (b) артерии контрольных (C) и нефрэктомированных (NE) крыс при отсутствии блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Данные представлены в виде среднего значения ± стандартная ошибка среднего.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В нашей работе было показано, что нефрэктомия вызывает значительное повышение артериального давления у спонтанно гипертензивных крыс. Повышение артериального давления было отмечено ранее после нефрэктомии в опытах на нормотензивных крысах линии Wistar [32] и Sprague-Dawley [28], а также при ХБП у человека [33]. Однако отмеченное нами повышение давления не было связано с увеличением сократительной способности артерий, имевшим место, например, у спонтанно гипертензивных крыс по сравнению с нормотензивными [15]. В нашей работе было показано, что нефрэктомия, напротив, уменьшает сократительную реакцию, в частности, на фенилэфрин, что проявлялось в небольшой степени у ПБА и в значительной у ВСА. Изменение реактивности кровеносных сосудов при ХБП у человека и после нефрэктомии у животных было отмечено многими исследователями [8, 10, 23, 27]. Следует заметить, что это изменение может быть разным у разных сосудов, а также у одних и тех же сосудов животных разных генетических линий. Например, в опытах на хвостовой артерии и аорте крысы [22] нефрэктомия приводила к возрастанию величины сократительного ответа на фенилэфрин на аорте и к снижению на хвостовой артерии. В нашей предыдущей работе на крысах линии WKY [26] нефрэктомия вызывала увеличение реакции на фенилэфрин у ПБА и не изменяла ее у ВСА. Причиной отличия новых результатов от полученных нами ранее, может являться как отличие генетических линий животных, так и значительное возрастание АД после нефрэктомии в этой серии опытов (с 190 ± 2 до 238 ± 2 мм рт. ст.) в отличие от предыдущей (с 127.1 ± 1.8 до 127.2 ± 2.2 мм рт. ст.). Отсутствие большего сокращения ПБА на фенилэфрин в концентрации 10–5 М при высоком АД (у крыс SHR по сравнению с WKY) было отмечено в работах других авторов [34, 35]. Полученные нами результаты согласуются с данными о снижении сократительной реакции на фенилэфрин после нефрэктомии, полученными на хвостовой артерии [22, 36] и на аорте крысы [32]. Причем в опытах на аорте крысы была отмечена отрицательная корреляция между величиной максимальной реакции на фенилэфрин и артериальным давлением [32].
В нашей работе на спонтанно гипертензивных крысах величина дилататорной реакции артерий на ацетилхолин была значительно меньше величины, полученной нами ранее на крысах линии WKY [26]. Такое снижение эндотелий-зависимой дилатации при гипертонии было отмечено многими авторами, в частности, на общей сонной [37] и брыжеечной артерии крысы [17, 38–40] вплоть до полного исчезновения этой реакции [38, 40]. Нами не было отмечено какого-либо действия нефрэктомии на эндотелий-зависимую дилатацию, вызванную ацетилхолином, ни на ПБА, ни на ВСА спонтанно гипертензивных крыс. Аналогичные результаты были получены ранее на хвостовой артерии [22] и на ПБА крыс линии Sprague-Dawley другими авторами [28], а также нами на ПБА крыс линии WKY [26]. Следует заметить, что в единственной обнаруженной нами работе по выяснению действия нефрэктомии на реактивность артерий спонтанно гипертензивных крыс [21] также не наблюдалось изменения дилататорной реакции на ацетилхолин. Однако на крысах других линий в ряде работ было показано снижение эндотелий-зависимой дилатации после нефрэктомии. В частности, такое снижение было отмечено на аорте [10, 23, 25] и общей сонной артерии крысы [11]. В исследовании, проведенном на ПБА крыс линии Wistar [25], нефрэктомия, в отличие от нашего исследования, приводила к уменьшению расслабления этой артерии, вызванного ацетилхолином, что может объясняться генетическими различиями животных. Как было показано в опытах на брыжеечной артерии мыши [28], эти различия могут являться причиной различного влияния нефрэктомии на эндотелий-зависимую дилатацию кровеносных сосудов.
С целью оценки участия Ca2+-активируемых K+-каналов большой проводимости, АТФ-чувствительных K+-каналов и растворимой гуанилатциклазы в сосудодвигательных реакциях ПБА и ВСА мы использовали соответствующие блокаторы – тетраэтиламмоний и глибенкламид, а также и ингибитор растворимой гуанилатциклазы – метиленовый синий. В нашей работе было показано отсутствие влияния этих веществ на вызванную ацетилхолином дилатацию ПБА и ВСА контрольных и нефрэктомированных крыс, что согласуется с данными, полученными на ПБА крыс линии SHR при использовании тетраэтиламмония [17, 39], глибенкламида [38, 40] и метиленового синего [38, 39]. Причиной такого отсутствия действия блокаторов K+-каналов и ингибитора гуанилатциклазы могло являться компенсирование блокады одного сигнального пути активацией другого. В частности, на ПБА было показано, что ибериотоксин (блокатор Ca2+-активируемых K+-каналов большой проводимости – ВKCa), сам по себе не оказывающий влияния на вызванную ацетилхолином дилатацию, в сочетании с апамином (блокатор SKCa) и TRAM-34 (блокатор IKCa) начинал действовать [38].
В подавляющем большинстве случаев в наших опытах отмечалась не только дилататорная, но и констрикторная реакция ПБА и ВСА на ацетилхолин. Вызванное ацетилхолином сокращение кровеносных сосудов крыс линии SHR было продемонстрировано, в частности, на общей сонной артерии [18]. В опытах на разных кровеносных сосудах других линий крыс было показано, что вызванная ацетилхолином эндотелий-зависимая вазоконстрикция обусловлена стимуляцией мускариновых рецепторов эндотелия [41, 42], связана с синтезом простагландинов [41–44] и опосредована ваниллоидными рецепторами TRPV4 эндотелия [43]. Сократительная реакция в наших опытах на ПБА контрольных и нефрэктомированных крыс под действием блокаторов K+-каналов и ингибитора гуанилатциклазы не изменялась, в то время как на ВСА было обнаружено значительное угнетение этой реакции у нефрэктомированных крыс под действием глибенкламида, что может свидетельствовать об участии АТФ-чувствительных K+-каналов в эндотелий-зависимой констрикции этих сосудов после нефрэктомии.
Влияния нефрэктомии на эндотелий-независимую дилатацию, вызванную нитропруссидом натрия, нами не было обнаружено ни на ПБА, ни на ВСА. В большинстве исследований на крысах других линий влияния нефрэктомии на вызодилатацию, вызванную нитропруссидом натрия, также не наблюдалось. В частности, оно не отмечалось на брыжеечной [28], сонной артерии [11, 12], использовавшихся в наших опытах. Не было также обнаружено изменения этой реакции общей сонной [45, 46] и брыжеечной артерии [39, 47] крыс линии SHR по сравнению с крысами WKY. В наших экспериментах блокаторы K+-каналов и ингибитор гуанилатциклазы не оказывали действия на эндотелий-независимую дилатацию ПБА и ВСА. Отсутствие уменьшения этой реакции на фоне действия глибенкламида и тетраэтиламмония было показано и другими авторами [31].
Обнаруженные нами различия действия нефрэктомии на сократительные свойства ПБА и ВСА могут быть связаны, в частности, с тем, что у этих артерий, различающихся строением стенки (в которой у ПБА в отличие от ВСА преобладают гладкомышечные клетки), различаются сигнальные пути, участвующие в эндотелий-зависимой и эндотелий-независимой констрикции. Например, было показано, что в условиях блокады эпителиальных Na+-каналов усиление потока в брыжеечной артерии вызывает эндотелий-зависимую констрикцию, а в сонной артерии увеличивается эндотелий-зависимая дилатация [48]. Различие сигнальных путей кровеносных сосудов, различающихся строением стенки, было обнаружено также для аорты и хвостовой артерии крысы после нефрэктомии [22].
Итак, в нашем исследовании впервые было изучено влияние нефрэктомии на констрикторные реакции артерий спонтанно гипертензивных крыс и показано, что нефрэктомия вызывает повышение артериального давления у этих животных, которое не было обусловлено предполагавшимся увеличением сократительной способности артерий. Обнаружено существенное уменьшение констрикторных реакций артерий, в значительно большей степени выраженное у ВСА, чем у ВБА. Можно предположить, что существенное снижение сократительной способности ВСА после нефрэктомии у спонтанно гипертензивных крыс в условиях чрезвычайно высокого АД (238 ± 2 мм рт. ст.), вызванного нефрэктомией, может приводить к опасному возрастанию АД в расположенных дистальнее ВСА сосудах головного мозга, способствуя возникновению в нем инсульта. Кроме того, нами было обнаружено, что уменьшение сократительной реакции изученных артерий связано с изменением активности АТФ-чувствительных K+-каналов у ВСА и гуанилатциклазы у ВБА. Полученные данные позволяют предположить, что хроническая болезнь почек при наличии гипертонической болезни иной этиологии может приводить к снижению сократительной способности артерий, способствуя, в частности, возникновению инсульта. Описанные нами изменения сократимости, а также сигнальных механизмов вазоконстрикции, отличающиеся у брыжеечной и сонной артерии, могут учитываться при лечении ХБП.
Список литературы
Liyanage T, Ninomiya T, Jha V, Neal B, Patrice HM, Okpechi I, Zhao MH, Lv J., Garg AX, Knight J, Rodgers A, Gallagher M, Kotwal S, Cass A, Perkovic V (2015) Worldwide access to treatment for end-stage kidney disease: a systematic review. Lancet 385(9981): 1975–1982. https://doi.org/10.1016/s0140-6736(14)61601-9
Tanaka K, Watanabe T, Takeuchi A, Ohashi Y, Nitta K, Akizawa T, Matsuo S, Imai E, Makino H, Hishida A (2017) Cardiovascular events and death in Japanese patients with chronic kidney disease. Kidney Int 91(1): 227–234. https://doi.org/10.1016/j.kint.2016.09.015
Vallianou NG, Mitesh S, Gkogkou A, Geladari E (2019) Chronic Kidney Disease and Cardiovascular Disease: Is there Any Relationship? Curr Cardiol Rev 15(1): 55–63. https://doi.org/10.2174/1573403x14666180711124825
Fujii H, Kono K, Nishi S (2019) Characteristics of coronary artery disease in chronic kidney disease. Clin Exp Nephrol 23(6): 725–732. https://doi.org/10.1007/s10157-019-01718-5
Bai Y, Zhang J, Xu J, Cui L, Zhang H, Zhang S (2015) Alteration of type I collagen in the radial artery of patients with end-stage renal disease. Am J Med Sci 349(4): 292–297. https://doi.org/10.1097/maj.0000000000000408
Kuranov G, Nikolaev A, Frank-Kamenetskaya O, Gulyaev N, Volina O (2019) Physicochemical characterization of human cardiovascular deposits. J Biol Inorg Chem 24(7): 1047–1055. https://doi.org/10.1007/s00775-019-01714-w
Malyszko J (2010) Mechanism of endothelial dysfunction in chronic kidney disease. Clin Chim Acta 411(19–20): 1412–1420. https://doi.org/10.1016/j.cca.2010.06.019
Kopel T, Kaufman JS, Hamburg N, Sampalis JS, Vita JA, Dember LM (2017) Endothelium-Dependent and -Independent Vascular Function in Advanced Chronic Kidney Disease. Clin J Am Soc Nephrol 12(10): 1588–1594. https://doi.org/10.2215/cjn.12811216
Keskin GS, Helvacı Ö, Yayla Ç, Paşaoğlu Ö, Keskin Ç, Arınsoy T, Derici Ü (2019) Relationship between plasma YKL-40 levels and endothelial dysfunction in chronic kidney disease. Turk J Med Sci 49(1): 139–146. https://doi.org/10.3906/sag-1804-169
Li T, Gua C, Wu B, Chen Y (2018) Increased circulating trimethylamine N-oxide contributes to endothelial dysfunction in a rat model of chronic kidney disease. Biochem Biophys Res Commun 495(2): 2071–2077. https://doi.org/10.1016/j.bbrc.2017.12.069
Köhler R, Eichler I, Schönfelder H, Grgic I, Heinau P, Si H, Hoyer J (2005) Impaired EDHF-mediated vasodilation and function of endothelial Ca-activated K channels in uremic rats. Kidney Int 67(6): 2280-2287. https://doi.org/10.1111/j.1523-1755.2005.00331.x
Moroe H, Honda H (2006) Comparison of endothelial function in the carotid artery between normal and short-term hypercholesterolemic rabbits. Comp Biochem Physiol C Toxicol Pharmacol 144(2): 197–203. https://doi.org/10.1016/j.cbpc.2006.08.011
Poulter NR, Prabhakaran D, Caulfield M (2015) Hypertension. Lancet 386(9995): 801–812. https://doi.org/10.1016/s0140-6736(14)61468-9
Campbell NR, Lackland DT, Lisheng L, Niebylski ML, Nilsson PM, Zhang XH (2015) Using the Global Burden of Disease study to assist development of nation-specific fact sheets to promote prevention and control of hypertension and reduction in dietary salt: a resource from the World Hypertension League. J Clin Hypertens (Greenwich) 17(3): 165–167. https://doi.org/10.1111/jch.12479
Brown IAM, Diederich L, Good ME, DeLalio LJ, Murphy SA, Cortese-Krott MM, Hall JL, Le TH, Isakson BE (2018) Vascular Smooth Muscle Remodeling in Conductive and Resistance Arteries in Hypertension. Arterioscler Thromb Vasc Biol 38(9): 1969–1985. https://doi.org/10.1161/atvbaha.118.311229
Lin Q, Zhao G, Fang X, Peng X, Tang H, Wang H, Jing R, Liu J, Lederer WJ, Chen J, Ouyang K (2016) IP(3) receptors regulate vascular smooth muscle contractility and hypertension. JCI Insight 1(17): e89402. https://doi.org/10.1172/jci.insight.89402
Sipola M, Finckenberg P, Vapaatalo H, Pihlanto-Leppälä A, Korhonen H, Korpela R, Nurminen ML (2002) Alpha-lactorphin and beta-lactorphin improve arterial function in spontaneously hypertensive rats. Life Sci 71(11): 1245–1253. https://doi.org/10.1016/s0024-3205(02)01793-9
Denniss SG, Ford RJ, Smith CS, Jeffery AJ, Rush JW (2016) Chronic in vivo or acute in vitro resveratrol attenuates endothelium-dependent cyclooxygenase-mediated contractile signaling in hypertensive rat carotid artery. J Appl Physiol (1985) 120(10): 1141–1150. https://doi.org/10.1152/japplphysiol.00675.2015
Lan C, Chen X, Zhang Y, Wang W, Wang WE, Liu Y, Cai Y, Ren H, Zheng S, Zhou L, Zeng C. (2018) Curcumin prevents strokes in stroke-prone spontaneously hypertensive rats by improving vascular endothelial function. BMC Cardiovasc Disord 18(1): 43. https://doi.org/10.1186/s12872-018-0768-6
Ku E, Lee BJ, Wei J, Weir MR (2019) Hypertension in CKD: Core Curriculum 2019. Am J Kidney Dis 74(1): 120–131. https://doi.org/10.1053/j.ajkd.2018.12.044
Thuraisingham RC, Raine AE (1999) Maintenance of normal agonist-induced endothelium-dependent relaxation in uraemic and hypertensive resistance vessels. Nephrol Dial Transplant 14(1): 70–75. https://doi.org/10.1093/ndt/14.1.70
Spradley FT, White JJ, Paulson WD, Pollock DM, Pollock JS (2013) Differential regulation of nitric oxide synthase function in aorta and tail artery from 5/6 nephrectomized rats. Physiol Rep 1(6): e00145. https://doi.org/10.1002/phy2.145
Zanetti M, Gortan Cappellari G, Barbetta D, Semolic A, Barazzoni R (2017) Omega 3 Polyunsaturated Fatty Acids Improve Endothelial Dysfunction in Chronic Renal Failure: Role of eNOS Activation and of Oxidative Stress. Nutrients 9(8). https://doi.org/10.3390/nu9080895
Li T, Gua C, Wu B, Chen Y (2018) Increased circulating trimethylamine N-oxide contributes to endothelial dysfunction in a rat model of chronic kidney disease. Biochem Biophys Res Commun 495(2): 2071–2077. https://doi.org/10.1016/j.bbrc.2017.12.069
Иванова ГТ, Лобов ГИ, Береснева ОН, Парастаева ММ (2019) Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов. Нефрология 23(4): 88–95. [Ivanova GТ, Lobov GI, Beresneva ОN, Parastaeva ММ (2019) Changes in the reactivity of vessels of rats with an experimental decrease in the mass of functioning nephrons. Nephrology 23(4): 88–95. (In Russ)]. https://doi.org/10.24884/1561-6274-2019-23-4-88-95
Ярцев ВН, Иванова ГТ, Лобов ГИ (2020) Влияние нефрэктомии на реактивность артерий крыс линии Wistar-Kyoto. Рос физиол журн им ИМ Сеченова 106(12): 1553–1563. [Yartsev VN, Ivanova G., Lobov GI (2020) Effect of Nephrectomy on the Reactivity of Arteries from the Wistar-Kyoto Rats. Russ J Physiol 106(12): 1553–1563. (In Russ)]. https://doi.org/10.31857/S0869813920120092
Hamzaoui M, Djerada Z, Brunel V, Mulder P, Richard V, Bellien J, Guerrot D (2020) 5/6 nephrectomy induces different renal, cardiac and vascular consequences in 129/Sv and C57BL/6JRj mice. Sci Rep 10(1): 1524. https://doi.org/10.1038/s41598-020-58393-w
Nguy L, Nilsson H, Lundgren J, Johansson ME, Teerlink T, Scheffer PG, Guron G (2012) Vascular function in rats with adenine-induced chronic renal failure. Am J Physiol Regul Integr Comp Physiol 302(12): R1426–R1435. https://doi.org/10.1152/ajpregu.00696.2011
Roloff EV, Tomiak-Baquero AM, Kasparov S, Paton JF (2016) Parasympathetic innervation of vertebrobasilar arteries: is this a potential clinical target? J Physiol 594(22): 6463–6485. https://doi.org/10.1113/jp272450
Cipolla MJ, Liebeskind DS, Chan SL (2018) The importance of comorbidities in ischemic stroke: Impact of hypertension on the cerebral circulation. J Cereb Blood Flow Metab 38(12): 2129–2149. https://doi.org/10.1177/0271678x18800589
Ohashi M, Faraci F, Heistad D (2005) Peroxynitrite hyperpolarizes smooth muscle and relaxes internal carotid artery in rabbit via ATP-sensitive K+ channels. Am J Physiol Heart Circ Physiol 289(5): H2244–H2250. https://doi.org/10.1152/ajpheart.00254.2005
Ulu N, Mulder GM, Vavrinec P, Landheer S, Duman-Dalkilic B, Gurdal H, Goris M, Duin M, van Dokkum RP, Buikema H, van Goor H, Henning RH (2013) Epidermal growth factor receptor inhibitor PKI-166 governs cardiovascular protection without beneficial effects on the kidney in hypertensive 5/6 nephrectomized rats. J Pharmacol Exp Ther 345(3): 393–403. https://doi.org/10.1124/jpet.113.203497
Cruz-Domínguez MP, Villalobos-Molina R, Miliar-García A, Montes-Cortés DH, Reséndiz-Ramírez AC, Asbun-Bojalil J, Cervantes-Cruz J, Castillo-Hernández MC, Castillo-Henkel C (2008) Evidence of alpha1-adrenoceptor functional changes in omental arteries of patients with end-stage renal disease. Auton Autacoid Pharmacol 28(1): 19–27. https://doi.org/10.1111/j.1474-8673.2007.00413.x
Albarwani S, Al-Siyabi S, Al-Husseini I, Al-Ismail A, Al-Lawati I, Al-Bahrani I, Tanira MO (2015) Lisinopril alters contribution of nitric oxide and K(Ca) channels to vasodilatation in small mesenteric arteries of spontaneously hypertensive rats. Physiol Res 64(1): 39–49. https://doi.org/10.33549/physiolres.932780
Carvalho-Galvão A, Ogunlade B, Xu J, Silva-Alves CRA, Mendes-Júnior LG, Guimarães DD, Cruz JC, Queiroz TM, Balarini CM, Braga VA, Filipeanu CM, Lazartigues E, de França-Silva MDS (2018) Central administration of TRV027 improves baroreflex sensitivity and vascular reactivity in spontaneously hypertensive rats. Clin Sci (Lond) 132(14): 1513–1527. https://doi.org/10.1042/cs20180222
Brymora A, Flisiński M, Grześk G, Szadujkis-Szadurski L, Odrowaz-Sypniewska G, Manitius J (2007) Inflammation, malnutrition and vascular contraction in experimental chronic kidney disease. J Nephrol 20(4): 423–429.
Lan C, Chen X, Zhang Y, Wang W, Wang WE, Liu Y, Cai Y, Ren H, Zheng S, Zhou L, Zeng C (2018) Curcumin prevents strokes in stroke-prone spontaneously hypertensive rats by improving vascular endothelial function. BMC Cardiovasc Disord 18(1): 43. https://doi.org/10.1186/s12872-018-0768-6
Fujii K, Tominaga M, Ohmori S, Kobayashi K, Koga T, Takata Y, Fujishima M (1992) Decreased endothelium-dependent hyperpolarization to acetylcholine in smooth muscle of the mesenteric artery of spontaneously hypertensive rats. Circ Res 70(4): 660–669. https://doi.org/10.1161/01.res.70.4.660
Young RH, Ding YA, Lee YM, Yen M (1995) Cilazapril reverses endothelium-dependent vasodilator response to acetylcholine in mesenteric artery from spontaneously hypertensive rats. Am J Hypertens 8(9): 928–933. https://doi.org/10.1016/0895-7061(95)00158-l
Sunano S, Watanabe H, Tanaka S, Sekiguchi F, Shimamura K (1999) Endothelium-derived relaxing, contracting and hyperpolarizing factors of mesenteric arteries of hypertensive and normotensive rats. Br J Pharmacol 126(3): 709–716. https://doi.org/10.1038/sj.bjp.0702355
Baretella O, Xu A, Vanhoutte PM (2014) Acidosis prevents and alkalosis augments endothelium-dependent contractions in mouse arteries. Pflugers Arch 466(2): 295–305. https://doi.org/10.1007/s00424-013-1323-z
Giang M, Papamatheakis DG, Nguyen D, Paez R, Blum Johnston C, Kim J, Brunnell A, Blood Q, Goyal R, Longo LD, Wilson SM (2016) Muscarinic Receptor Activation Affects Pulmonary Artery Contractility in Sheep: The Impact of Maturation and Chronic Hypoxia on Endothelium-Dependent and Endothelium-Independent Function. High Alt Med Biol 17(2): 122–132. https://doi.org/10.1089/ham.2015.0116
Zhang P, Sun C, Li H, Tang C, Kan H, Yang Z, Mao A, Ma X (2018) TRPV4 (Transient Receptor Potential Vanilloid 4) Mediates Endothelium-Dependent Contractions in the Aortas of Hypertensive Mice. Hypertension 71(1): 134–142. https://doi.org/10.1161/hypertensionaha.117.09767
Лобов ГИ, Соколова ИБ (2020) Роль NO и H2S в регуляции тонуса церебральных сосудов при хронической болезни почек. Рос физиол журн им ИМ Сеченова 106(8): 1002–1015. [Lobov GI, Sokolova IB (2020) Role of NO and H2S in the regulation of the tone of cerebral vessels in chronic kidney disease. Russ J Physiol 106(8): 1002–1015. (In Russ)]. https://doi.org/10.31857/S0869813920080063
Chen Hi HI, Chiang IP, Jen C. (1996) Exercise Training Increases Acetylcholine-Stimulated Endothelium-Derived Nitric Oxide Release in Spontaneously Hypertensive Rats. J Biomed Sci 3(6): 454–460. https://doi.org/10.1007/bf02258049
Denniss SG, Ford RJ, Smith CS, Jeffery AJ, Rush JW (2016) Chronic in vivo or acute in vitro resveratrol attenuates endothelium-dependent cyclooxygenase-mediated contractile signaling in hypertensive rat carotid artery. J Appl Physiol (1985) 120(10): 1141–1150. https://doi.org/10.1152/japplphysiol.00675.2015
Qiu F, Liu X, Zhang Y, Wu Y, Xiao D, Shi L (2018) Aerobic exercise enhanced endothelium-dependent vasorelaxation in mesenteric arteries in spontaneously hypertensive rats: the role of melatonin. Hypertens Res 41(9): 718–729. https://doi.org/10.1038/s41440-018-0066-9
Ashley Z, Mugloo S, McDonald FJ, Fronius M (2018) Epithelial Na+ channel differentially contributes to shear stress-mediated vascular responsiveness in carotid and mesenteric arteries from mice. Am J Physiol Heart Circ Physiol 314(5): H1022–H1032. https://doi.org/10.1152/ajpheart.00506.2017
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


