Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 1, стр. 98-108
Влияние аллостерического модулятора М5 холинорецепторов VU 0238429 на нервно-мышечную передачу в диафрагмальной мышце мыши
И. В. Ковязина 1, 2, *, А. А. Хамидуллина 2, Н. С. Фёдоров 3, А. И. Маломуж 1, **
1 Казанский институт биохимии и биофизики ФИЦ Казанский научный центр РАН
Казань, Россия
2 Казанский Государственный медицинский университет
Казань, Россия
3 Казанский Федеральный университет
Казань, Россия
* E-mail: irina.kovyazina@list.ru
** E-mail: artur57@gmail.com
Поступила в редакцию 15.10.2021
После доработки 10.11.2021
Принята к публикации 13.11.2021
- EDN: QRZVLV
- DOI: 10.31857/S0869813922010083
Аннотация
Исследовали влияние соединения VU 0238429, аллостерического модулятора мускариновых холинорецепторов М5 подтипа, на амплитудно-временные параметры спонтанных и вызванных потенциалов концевой пластинки, а также на силу мышечных сокращений при низко- и высокочастотном раздражении двигательного нерва. Показано, что холинорецепторы М5 подтипа могут регулировать квантовый выброс ацетилхолина из двигательных нервных окончаний в диафрагме мыши: увеличивать уровень секреции медиатора при низкочастотной стимуляции нерва и снижать его при стимуляции с частотой 70 Гц. Фармакологическая потенциация М5 холинорецепторов оказывает угнетающее действие на силу мышечных сокращений, вызванных как прямой, так и непрямой стимуляцией, что необходимо учитывать при разработке лекарственных препаратов на основе модуляторов этих рецепторов.
Мускариновые холинорецепторы М1–M5 подтипов широко представлены в центральной и периферической нервной системе, где они контролируют ряд важных физиологических процессов [1]. Несмотря на то, что рецепторы М5 подтипа составляют всего 2% от общей популяции мускариновых холинорецепторов в головном мозге [2], они экспрессируются в отдельных областях, представляющих терапевтический интерес. Агонисты и антагонисты М5 холинорецепторов рассматриваются как потенциальные фармакологические агенты для лечения целого ряда расстройств, включая шизофрению, болезнь Альцгеймера, наркозависимость и болезнь Паркинсона [1, 3]. Данные, полученные на мышах, нокаутированных по гену, кодирующему мускариновые рецепторы М5 подтипа, свидетельствуют о том, что именно эти рецепторы отвечают за вызванное ацетилхолином расширение сосудов головного мозга, и, следовательно, их лиганды могут быть использованы в качестве терапевтического средства при лечении цереброваскулярных заболеваний или острого ишемического инсульта [2, 4].
Ранее, с помощью методов иммуногистохимии, было показано, что М5 рецепторы присутствуют в области нервно-мышечного контакта скелетных мышц позвоночных [5, 6], однако их физиологическая роль в периферических синапсах остается до конца не выясненной. По данным Wright и соавт. [5] М5 рецепторы локализуются на мышечных волокнах и/или шванновских клетках и контролируют рост мышц, а также размер моторных синапсов.
Недостаток информации о физиологической роли М5 рецепторов во многом обусловлен тем, что до недавнего времени отсутствовали селективные фармакологические агенты, с помощью которых можно было бы исследовать функции этих рецепторов. Сравнительно недавно скрининговые и медицинские исследования позволили идентифицировать первые М5 селективные аллостерические лиганды, в частности соединение VU 0238429, проявляющее высокоизбирательное потенцирующее действие на этот подтип холинорецепторов [7]. Данное соединение более чем в 30 раз избирательнее по отношению к M5 рецепторам по сравнению с М1 и М3 подтипами и неэффективно в отношении М2 и М4 подтипов мускариновых рецепторов [7].
В настоящей работе мы исследовали влияние селективного аллостерического модулятора мускаринового ацетилхолинового рецептора M5 подтипа – соединения VU 0238429 на амплитудно-временные характеристики одноквантовых (миниатюрных) и многоквантовых потенциалов концевой пластинки (ПКП), а также на силу мышечных сокращений при разных режимах стимуляции двигательного нерва. Показано, что холинорецепторы М5 подтипа могут регулировать процесс квантового выделения ацетилхолина из моторных нервных окончаний. Кроме того, фармакологическая потенциация этих рецепторов снижает силу мышечных сокращений, что необходимо учитывать при поиске лекарственных препаратов, мишенью которых являются мускариновые холинорецепторы М5 подтипа.
Препарат и растворы
Исследования были проведены на изолированных нервно-мышечных препаратах диафрагмы лабораторных мышей линии BALB/c массой 22–25 г. Животные содержались при комнатной температуре (20–24°C) в хорошо вентилируемом помещении с 12-часовым циклом свет/темнота и неограниченном доступе к пище и воде.
Экспериментальные процедуры выполняли в соответствии с инструкциями по использованию лабораторных животных Казанского медицинского университета в соответствии с руководством NIH по уходу и использованию лабораторных животных. Протокол эксперимента соответствовал требованиям Директивы Совета европейских сообществ 86/609/EEC.
Животных подвергали глубокому наркозу, а затем быстро декапитировали и выделяли диафрагмальную мышцу в реберном кольце вместе с диафрагмальными нервами, длина культи которых составляла не менее 0.5 см. Далее препарат разделяли на две полудиафрагмы с подходящими к ним нервами.
Изолированную мышцу с фрагментом нерва помещали в экспериментальную камеру, через которую протекал предварительно аэрированный раствор Рингера–Кребса следующего состава (в мМ): 137 NaCl, 5 KCl, 1 MgCl2, 2 CaCl2, 1 Na2HPO4, 15 NaHCO3, 11 глюкоза; pH раствора составлял 7.3–7.4, температуру в ванночке поддерживали на уровне 22.0 ± 0.1°C.
Соединение VU 0238429 (Tocris, Великобритания) растворяли в растворе DMSO, а затем в буферном растворе до концентрации 1 мкМ, и подавали в экспериментальную камеру путем перфузии (финальная концентрация DMSO 0.01%).
Регистрация потенциалов концевой пластинки
Потенциалы концевой пластинки (ПКП) регистрировали внутриклеточно с использованием стандартной микроэлектродной техники. При регистрации ПКП мышечные сокращения блокировали µ-конотоксином GIIIB (3 мкМ, Peptide Institute Inc., Япония).
Регистрацию синаптических сигналов осуществляли с помощью комплекса, включающего микроэлектродный усилитель TEV-200A (Dagan Corporation, США) с полосой пропускания от 0.03 до 10 кГц, изолированный импульсный стимулятор 2100 (AM Systems, США), высокоскоростной аналогово-цифровой цифровой преобразователь (Digidata 1322A, Axon Instrument Inc., США) с частотой дискретизации 10 мкс и программное обеспечение AxoClamp (Axon Instrument Inc.). Двигательный нерв стимулировали прямоугольными импульсами супрамаксимальной величины и длительностью 100 мкс с частотой 0.5–70 Гц.
ПКП регистрировали в контроле и через 20 мин после добавления соединения VU 0238429 в омывающий раствор. Зарегистрированные сигналы анализировали с использованием программного обеспечения Clampfit (Axon Instrument Inc.) в автономном режиме. Оценивали амплитуду, время нарастания и постоянную времени спада (10–90% амплитуды) ПКП. Квантовый состав ПКП оценивали двумя способами: 1) как соотношение средних значений амплитуд вызванных и спонтанных (“одноквантовых”) ответов; 2) как соотношение площадей вызванных и “одноквантовых” ответов. При анализе параметров ПКП, зарегистрированных в режиме высокочастотных пачек (10 с с частотами 10, 50 и 70 Гц), параметры сигналов выражали в процентах по отношению к первому сигналу, а затем усредняли (n = 20–30 пачек).
Тензометрия
Фрагмент полудиафрагмы (шириной около 1 см) помещали в экспериментальную ванночку тензометрической установки SIH Muscle Tester (WPI, США), оснащенной усилителем SI-BAM21-LC (WPI) и контроллером температуры SI-TCM2 (WPI). “Реберный” край фрагмента полудиафрагмы фиксировали крючком, который был соединен с датчиком силы (SI-KG2B, WPI), “сухожильный” край фиксировали крючком, закрепленным на плече микроманипулятора со встроенным микрометром. При помощи микрометра препарат растягивался на 10–15% от длины и в течение 15–20 мин перед началом эксперимента промывался раствором Рингера–Кребса в условиях редкой стимуляции для достижения устойчивого состояния.
Мышцу стимулировали прямоугольными стимулами супрамаксимальной амплитуды длительностью 100 мкс. Протокол стимуляции во всех экспериментах (сокращения при прямом и непрямом раздражении) был идентичный: 20 с с частотой 0.5 Гц, 10 с с частотами 10, 50 и 70 Гц. Время периода между стимуляциями составляло 20 с.
Ответы при непрямом раздражении вызывались стимуляцией диафрагмального нерва через “всасывающий” электрод. При прямом раздражении сокращения диафрагмы вызывали стимуляцией через два серебряных проволочных электрода, находящихся в экспериментальной ванночке в непосредственной близости от препарата. При этом в растворе присутствовал блокатор никотиновых холинорецепторов d-тубокурарин (2 мкМ, Sigma, США). Сигналы от датчика силы получали и анализировали в цифровом виде с использованием (ЦАП-АЦП) системы LabTrax 8/16 (WPI) и программного обеспечения MDAC Software (WPI). Сила сокращений (максимальная амплитуда одиночных и тетанических изометрических сокращений) измерялась в граммах. Регистрация сокращений осуществлялась в контроле и через 20 мин после добавления соединения VU 0238429 в омывающий раствор.
Статистика
Экспериментальные результаты представлены в виде среднего значения и стандартной ошибки среднего (SEM). Для статистической обработки результатов экспериментов использовали двухсторонний критерий Стьюдента (для параметрических данных) либо непараметрический критерий Манна–Уитни.
Для описания относительного изменения квантового состава ПКП в ходе стимуляции нерва с частотой 10 Гц использовали модель, описанную в работе [8]. Для частот стимуляции выше 10 Гц эту модель модифицировали путем добавления “медленной” экспоненциальной компоненты:
В этой формуле m(t) соответствует квантовому составу ПКП в момент времени t, A – квантовый состав в начале стимуляции (отн. ед.), B – постоянная времени истощения готового к освобождению пула везикул (с), С – средняя амплитуда плато (отн. ед.), D – полупериод восполнения везикулярного пула (с), Е – крутизна динамики восстановления везикулярного пула (с), а F – постоянная времени “медленной” фазы снижения квантового состава (при 50 и 70 Гц, с).
Для сравнения относительного изменения амплитуд ПКП при высокочастотной стимуляции нерва в контроле и в присутствии VU 0238429 использовался F-тест. Статистический анализ осуществлялся с помощью программного обеспечения OriginLab 2021b. Различия между группами считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние аллостерического модулятора М5 холинорецепторов VU 0238429 на амплитудно-временные параметры ПКП при низко- и высокочастотной стимуляции двигательного нерва
Потенциация М5 холинорецепторов не оказывала влияния на амплитуду миниатюрных ПКП (МПКП) и их частоту (рис. 1а), а также временные параметры (время роста и постоянная времени спада, на рисунке не представлены).
Рис. 1.
Влияние модулятора мускариновых холинорецепторов М5 подтипа VU 0238429 (1 мкМ) на амплитудно-временные параметры миниатюрных (МПКП; MEPP) и вызванных (ПКП; EPP) потенциалов концевой пластинки. Панель (a) – амплитуда (amplitude) и частота (frequency) миниатюрных потенциалов концевой пластинки в контроле и после аппликации VU 0238429. Панель (b) – квантовый состав (EPP quantal content), время нарастания (10–90% EPP rise time) и постоянная времени спада (decay time) вызванных потенциалов концевой пластинки при низкочастотной стимуляции нерва (0.5 Гц) в контроле и после аппликации VU 0238429. На панелях a и b данные представлены по отдельным клеткам в контроле и после аппликации VU 0238429: кружки – значения по отдельным опытам, горизонтальная линия – среднее значение ± стандартная ошибка (прямоугольник) и стандартное отклонение (вертикальный отрезок) для всей серии экспериментов (n1= 22, n2= 29).*p < 0.05 по сравнению с контролем (тест Стьюдента для независимых выборок). Панель (c) – относительные изменения амплитуды ПКП при стимуляции нерва с частотой 10, 50 и 70 Гц в течение 10 с: черные кружки – контроль, серые кружки – VU 0238429. За 100% принята амплитуда 1-го ПКП в пачке. n = 15. Панели (d), (e) – репрезентативные записи вызванных потенциалов концевой пластинки, зарегистрированных в ходе стимуляции с частотой 70 Гц в типичном эксперименте в контроле (control) и в присутствии VU 0238429: сплошная линия – 1-й ПКП в пачке импульсов, пунктирная линия – ПКП после 1 с стимуляции, линия точками – ПКП после 10 с стимуляции с частотой 70 Гц. На врезках представлены МПКП из тех же экспериментов, зарегистрированные до начала стимуляции.

В присутствии соединения VU 0238429 (1 мкМ) при редкой частоте стимуляции нерва (0.5 Гц) квантовый состав ПКП был в среднем на 17% выше, чем в контроле (34.2 ± 2.3 по сравнению с 28.1 ± 1.2, n1= 22, n2= 29, тест Стьюдента для независимых выборок, p < 0.05, рис. 1b). При оценке квантового состава соотношением площадей многоквантовых и одноквантовых (миниатюрных) ПКП значения этой величины составили 34.2 ± 1.9 в контроле и 41.6 ± 2.9 в присутствии соединения VU 0238429, то есть относительное изменение квантового состава составило 22%. Длительность переднего фронта многоквантовых ПКП (10–90%) также достоверно увеличивалась: с 0.75 ± 0.18 мс в контроле до 0.87 ± 0.16 мс (n1= 22, n2= 29, тест Стьюдента для независимых выборок, p < 0.05, рис. 1b). При этом длительности заднего фронта ПКП (τ времени спада ПКП) в контроле и в присутствии соединения VU 0238429 достоверно не различались (2.81 ± 0.13 и 3.09 ± 0.08 мс, соответственно, n1= 22, n2= 29, тест Стьюдента для независимых выборок, p > 0.05, рис. 1b).
Значения мембранного потенциала мышечного волокна, при которых регистрировали ПКП и МПКП в контроле и в присутствии соединения VU 0238429 также достоверно не различались (–60.4 ± 2.1 мВ для VU 0238429 по сравнению с –60.0 ± 1.2 мВ в контроле, n1= 22, n2= 29, тест Стьюдента для независимых выборок, p > 0.05).
При высокочастотном раздражении нерва (10–70 Гц) развивалась синаптическая депрессия, то есть последовательное снижение квантового состава ПКП в ходе пачки импульсов, наиболее выраженное при стимуляции нерва с частотой более 10 Гц (рис. 1c–e). Так, при стимуляции нерва с частотой 70 Гц квантовый состав ПКП в первые 200 мс быстро снижался (на 40% в контроле и на 50% в присутствии VU 0238429) и продолжал снижаться в последующие 10 с соответственно до 38.2 ± 3.6% и 27.8 ± 4.5% (n = 15) от исходных значений в контроле и в присутствии VU 0238429. Аппроксимация относительного изменения квантового состава ПКП при высокочастотной стимуляции нерва моделью, состоящей из экспоненциального спада и возрастающей логистической функции (см. Методы исследования), показала достоверные различия в динамике этого параметра в контроле и при потенциации М5 рецепторов (F-тест, p < 0.05, n = 15, табл. 1).
Таблица 1.
Параметры модели, описывающей изменение квантового состава ПКП при высокочастотной стимуляции нерва
| A (отн. ед) |
B (с) |
C (отн. ед) |
D (с) |
E (с) |
F (с) |
|
|---|---|---|---|---|---|---|
| 10 Гц контроль |
0.88 ± 0.04 | 1.67 ± 0.27 | 0.75 ± 0.01 | 1.14 ± 0.44 | 1.34 ± 0.09 | – |
| VU 0238429 | 0.87 ± 0.03 | 1.48 ± 0.16 | 0.72 ± 0.01 | 0.96 ± 0.27 | 1.16 ± 0.07 | – |
| 50 Гц контроль |
0.89 ± 0.08 | 0.28 ± 0.05 | 0.73 ± 0.01 | 0.15 ± 0.15 | 0.29 ± 0.02 | 39.13 ± 1.03 |
| VU 0238429 | 1.05 ± 0.01 | 0.43 ± 0.02 | 0.64 ±0.01 | 0.49 ± 0.03 | 0.24 ± 0.01 | 31.69 ± 0.80 |
| 70 Гц контроль |
1.02 ± 0.03 | 0.38 ± 0.02 | 0.57 ± 0.01 | 0.42 ± 0.02 | 0.17 ± 0.01 | 25.56 ± 0.73 |
| VU 0238429 | 1.05 ± 0.01 | 0.22 ± 0.01 | 0.53 ± 0.02 | 0.31 ± 0.01 | 0.12 ± 0.01 | 13.58 ± 0.13 |
Влияние аллостерического модулятора М5 холинорецепторов VU 0238429 на силу мышечных сокращений при прямой и непрямой стимуляции
Сила сокращений фрагмента полудиафрагмы мыши при стимуляции двигательного нерва составляла по максимальной амплитуде: 0.72 ± 0.09 г при 0.5 Гц; 0.87 ± 0.11 г при 10 Гц; 4.81 ± 0.52 г при 50 Гц и 5.15 ± 0.63 г при 70 Гц (n = 7). Добавление в перфузионный раствор соединения VU 0238429 в концентрации 1 мкМ приводило к снижению силы сокращений на всех исследуемых частотах стимуляции (рис. 2a). Так, регистрируемый параметр снижался на 24.5 ± 4.7% при 0.5 Гц; на 23.3 ± 3.6% при 10 Гц; 23.6 ± 4.6% при 50 Гц и 24.0 ± 5.7% при 70 Гц (p < 0.05; n = 7 для всех случаев).
Рис. 2.
Угнетающее влияние модулятора мускариновых холинорецепторов М5 подтипа VU 0238429 (1 мкМ) на силу сокращения полудиафрагмы мыши при непрямой (панель (a), Indirect stimulation) и прямой (панель (b), Direct stimulation) стимуляции с частотами 0.5, 10, 50 и 70 Гц. В верхних частях панелей – нативные записи сокращений в отдельно взятых экспериментах в контроле (черный) и через 20 мин после аппликации VU 0238429 (серый). В нижних частях панелей представлены относительные изменения силы сокращений после аппликации VU 0238429 по отношению к контролю (%): кружки – значения по отдельным опытам, горизонтальная линия – среднее значение ± стандартная ошибка (прямоугольник) и стандартное отклонение (вертикальный отрезок) для всей серии экспериментов (n = 7). * p < 0.05 по сравнению с контролем (парный тест Стьюдента для абсолютных значений в г в контроле и в присутствии VU 0238429).
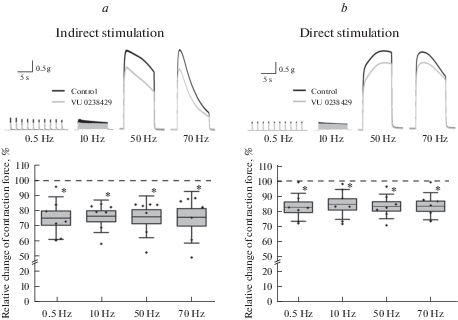
Для того, чтобы установить, обусловлен ли выявленный нами угнетающий эффект VU 0238429 изменениями в холинергической трансмиссии в мионевральном синапсе, были проведены эксперименты с прямой стимуляцией мышцы в условиях блокады никотиновых холинорецепторов. Контрольные значения силы сокращений в данной серии экспериментов составляли по максимальной амплитуде 0.58 ± 0.07 г при 0.5 Гц; 0.58 ± 0.07 г при 10 Гц; 4.41 ± 0.79 г при 50 Гц и 4.46 ± 0.76 г при 70 Гц (n = 7).
В присутствие VU 0238429 сила сокращений при прямой стимуляции также снижалась (рис. 2b). Это угнетающее действие аллостерического модулятора так же как и в случае непрямой стимуляции проявлялось на всех исследуемых частотах и составляло соответственно: 17.2 ± 3.1% при 0.5 Гц; 15.3 ± 3.7% при 10 Гц; 16.6 ± 3.1% при 50 Гц и 16.5 ± 3.4% при 70 Гц (p < 0.05; n = 7 для всех случаев). Выраженность угнетающего эффекта соединения VU 0238429 при прямой и непрямой стимуляции нервно-мышечного препарата достоверно не отличалась для всех частот (критерий Манна–Уитни, p > 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Пять подтипов мускариновых рецепторов млекопитающих, M1–M5, составляют две функционально разные группы: рецепторы с нечетными номерами (M1, M3, M5) активируют предпочтительно G-белки Gq/G11-типа; четные подтипы (M2, M4) активируют Gi/Go белки. Большинство клеток экспрессируют два или более подтипа мускариновых рецепторов, которые вызывают разнообразные физиологические ответы в зависимости от локализации и идентичности подтипов [1, 9]. Так, в нервно-мышечных контактах позвоночных были обнаружены мускариновые рецепторы всех известных на данный момент пяти подтипов [5, 6]. И если для холинорецепторов М1, М2 и М3 подтипов было показано их участие в регуляции квантовой и неквантовой секреции [5, 6, 10–13], то роль рецепторов М5 подтипа в нервно-мышечных контактах до сих пор не ясна. Отчасти этот недостаток информации был обусловлен отсутствием селективных лигандов для данного подтипа холинорецепторов.
Сравнительно недавно были синтезированы селективные в отношении М5 рецепторов аллостерические модуляторы, позволяющие лучше изучить функции этих рецепторов в центральной и периферической нервной системах и, возможно, разработать лекарственные препараты на основе агонистов и антагонистов М5 рецепторов. Последнее особенно важно, если учесть, что недостаточная или, наоборот, избыточная активация М5 рецепторов может быть основным звеном патогенеза целого ряда заболеваний – болезни Альцгеймера, Паркинсона, наркозависимости, депрессии и шизофрении [1, 3]. Поскольку помимо головного мозга М5 рецепторы располагаются и в скелетной мускулатуре [5, 14], необходимо учитывать возможные последствия приема таких препаратов на опорно-двигательную систему при проведении терапии нейродегенеративных заболеваний.
В данной работе изучили эффекты положительного аллостерического модулятора М5 холинорецепторов – соединения VU 0238429 – на амплитудно-временные параметры ПКП и силу сокращений диафрагмальной мышцы мыши.
Результаты исследования свидетельствуют о том, что повышенная активация холинорецепторов М5 подтипа приводит к повышению квантового выброса ацетилхолина из двигательных нервных окончаний и увеличению длительности переднего фронта (10–90% время роста) ПКП. Изменение времени роста ПКП может быть следствием десинхронизации освобождения синаптических везикул в отдельных активных зонах [15]. Стимуляция с частотой 70 Гц приводила к несколько более выраженной депрессии амплитуд последовательных ПКП в пачке, что может быть связано с повышенным расходом медиатора и уменьшением количества везикул, готовых к освобождению. Ранее было показано, что М5 рецепторы в моторных синапсах мыши локализуются на мышечных волокнах либо в шванновских клетках и регулируют размер волокон и концевых пластинок [5]. О наличии мускариновых рецепторов, в частности М1 и М3 подтипов, на сарколемме сообщалось и ранее [16, 17]. Наблюдаемые нами эффекты соединения VU 0238429 на процесс нейросекреции предполагают либо наличие некоторого количества М5 рецепторов на нервном окончании, либо ретроградный эффект от их активации на мышечной либо шванновской клетках.
Наши результаты тензометрии косвенно подтверждают наличие холинорецепторов М5 подтипа на сарколемме. Так, сила сокращений снижалась в присутствии аллостерического модулятора VU 0238429 в одинаковой степени при прямой и непрямой стимуляции диафрагмы. Судя по всему, основной причиной снижения амплитуды сокращений при непрямой стимуляции является тот же фактор, что и при прямой стимуляции, то есть происходят изменения в сократимости мышечных волокон, а не в работе синаптического аппарата. Если более выраженная депрессия амплитуд ПКП при высокочастотной стимуляции нерва и отражается на снижении силы сокращений, то этот вклад не столь существенен.
Эффект активации М5 рецепторов на сократительную способность мышц, по всей видимости, связан с влиянием на электромеханическое сопряжение, а не на работу сократительного аппарата мышечных волокон. На данный момент внутриклеточные механизмы, связанные с активацией М5 холинорецепторов, наиболее полно изучены в нейронах. Показано, что активация M5 рецепторов запускает целый ряд клеточных реакций, таких как инактивирование аденилатциклазы, деградация фосфоинозитидов, изменение уровня циклического АМФ и модуляция работы калиевых каналов [18–20]. В нейронах гиппокампа была продемонстрирована способность мускариновых рецепторов всех подтипов модулировать работу натриевых каналов и снижать амплитуду натриевых токов. В частности, для М5 рецепторов эта регуляция осуществляется через активацию протеинкиназы С [21]. Кроме того, было показано, что в культуре клеток фибробластов мыши (NIH 3T3) активация всех экспрессированных там мускариновых рецепторов может угнетать функционирование кальциевых каналов L типа также путем активации протеинкиназы С [22]. Вопрос колокализации М5 рецепторов с натриевыми и/или кальциевыми каналами в скелетных мышцах и возможность их функциональной регуляции до сих пор остается открытым.
Использованное в данном исследовании соединение VU 0238429 является положительным аллостерическим модулятором ацетилхолиновых рецепторов, то есть оно избирательно увеличивает вероятность связывания эндогенного ацетилхолина с рецепторами М5 подтипа. Обнаруженные эффекты фармакологического соединения свидетельствуют о том, что в изолированном диафрагмальном препарате мыши даже при низкочастотной активности присутствует ацетилхолин в концентрации, достаточной для активации рецепторов, в том числе, на скелетной мышце.
Доказательства выделения ацетилхолина в изолированном нервно-мышечном препарате в отсутствие стимуляции нерва были получены еще в 60-е годы прошлого столетия, причем, как оказалось, определенная часть медиатора выделяется непосредственно из скелетной мышцы [23, 24]. Впоследствии было установлено, что выделяемый из мышцы ацетилхолин синтезируется холин- и карнитин-ацетилтрансферазами [25, 26] и концентрации этого медиатора может быть достаточно для активации мускариновых холинорецепторов. В отсутствие стимуляции нерва была продемонстрирована эндогенная активация мускариновых холинорецепторов М1 подтипа, которая сказывается на уровне неквантового выделения ацетилхолина из нервного окончания [10]. В этой же работе было показано, что для реализации физиологического эффекта активации этих мускариновых рецепторов (которые имеют схожие с М5 механизмы трансдукции сигнала) достаточно концентрации миметика всего в несколько нМ. Согласно данным различных авторов, в области синаптического контакта ацетилхолин детектируется в концентрации в несколько десятков нМ, создаваемой в результате неквантового выделения медиатора. С помощью этого процесса выделяется основная масса ацетилхолина именно в отсутствие нервной импульсации (см. обзоры [27, 28]). Следовательно, есть все основания полагать, что даже в покое может иметь место активация мускариновых холинорецепторов как в синапсе, так и за его пределами ацетилхолином, который выделяется как из нервного окончания, так и непосредственно из мышцы, и это способно отражаться на сократимости скелетной мускулатуры.
Таким образом, холинорецепторы М5 подтипа могут модулировать процесс нейросекреции ацетилхолина в моторных синапсах скелетных мышц. Кроме того, их активация приводит к снижению сократительной активности мышечных волокон, что необходимо учитывать при разработке потенциальных лекарственных препаратов, мишенью которых являются М5 рецепторы.
Список литературы
Wess J, Eglen RM, Gautam D (2007) Muscarinic acetylcholine receptors: mutant mice provide new insights for drug development. Nat Rev Drug Discov 6: 721–733. https://doi.org/10.1038/nrd2379
Yamada M, Basile AS, Fedorova I, Zhang W, Duttaroy A, Cui Y, Lamping KG, Faraci FM, Deng CX, Wess J (2003) Novel insights into M5 muscarinic acetylcholine receptor function by the use of gene targeting technology. Life Sci 74: 345–353. https://doi.org/10.1016/j.lfs.2003.09.022
Langmead CJ, Watson J, Reavill C (2008) Muscarinic acetylcholine receptors as CNS drug targets. Pharmacol Ther 117: 232–243. https://doi.org/10.1016/j.pharmthera.2007.09.009
Araya R, Noguchi T, Yuhki M, Kitamura N, Higuchi M, Saido TC, Seki K, Itohara S, Kawano M, Tanemura K, Takashima A, Yamada K, Kondoh Y, Kanno I, Wess J, Yamada M (2006) Loss of M5 muscarinic acetylcholine receptors leads to cerebrovascular and neuronal abnormalities and cognitive deficits in mice. Neurobiol Dis 24: 334–344. https://doi.org/10.1016/j.nbd.2006.07.010
Wright MC, Potluri S, Wang X, Dentcheva E, Gautam D, Tessler A, Wess J, Rich MM, Son YJ (2009) Distinct muscarinic acetylcholine receptor subtypes contribute to stability and growth, but not compensatory plasticity, of neuromuscular synapses. J Neurosci 29:14942–14955. https://doi.org/10.1523/jneurosci.2276-09.2009
Tsentsevitsky AN, Kovyazina IV, Nurullin LF, Nikolsky EE (2017) Muscarinic cholinoreceptors (M1-, M2-, M3- and M4-type) modulate the acetylcholine secretion in the frog neuromuscular junction. Neurosci Lett 649: 62–69. https://doi.org/10.1016/j.neulet.2017.04.015
Bridges TM, Marlo JE, Niswender CM, Jones CK, Jadhav SB, Gentry PR, Plumley HC, Weaver CD, Conn PJ, Lindsley CW (2009) Discovery of the first highly M5-preferring muscarinic acetylcholine receptor ligand, an M5 positive allosteric modulator derived from a series of 5-trifluoromethoxy N-benzyl isatins. J Med Chem 52: 3445–3448. https://doi.org/10.1021/jm900286j
Ruiz R, Cano R, Casañas JJ, Gaffield MA, Betz WJ, Tabares L (2011) Active zones and the readily releasable pool of synaptic vesicles at the neuromuscular junction of the mouse. J Neurosci 31: 2000–2008. https://doi.org/10.1523/JNEUROSCI.4663-10.2011
Nathanson NM (2008) Synthesis, trafficking, and localization of muscarinic acetylcholine receptors. Pharmacol Ther 119: 33–43. https://doi.org/10.1016/j.pharmthera.2008.04.006
Malomouzh AI, Mukhtarov MR, Nikolsky EE, Vyskočil F (2007) Muscarinic M1 acetylcholine receptors regulate the non-quantal release of acetylcholine in the rat neuromuscular junction via NO-dependent mechanism. J Neurochem 102: 2110–2117. https://doi.org/10.1111/j.1471-4159.2007.04696.x
Tsentsevitsky AN, Zakyrjanova GF, Petrov AM, Kovyazina IV (2020) Breakdown of phospholipids and the elevated nitric oxide are involved in M3 muscarinic regulation of acetylcholine secretion in the frog motor synapse. Biochem Biophys Res Commun 524: 589–594. https://doi.org/10.1016/j.bbrc.2020.01.112
Garcia N, Santafé MM, Salon I, Lanuza MA, Tomàs J (2005) Expression of muscarinic acetylcholine receptors (M1-, M2-, M3- and M4-type) in the neuromuscular junction of the newborn and adult rat. Histol Histopathol 20: 733–743. https://doi.org/10.14670/HH-20.733
Oliveira L, Timóteo MA, Correia-de-Sá P (2009) Negative crosstalk between M1 and M2 muscarinic autoreceptors involves endogenous adenosine activating A1 receptors at the rat motor endplate. Neurosci Lett 459: 127–131. https://doi.org/10.1016/j.neulet.2009.05.001
Levey AI (1993) Immunological localization of m1-m5 muscarinic acetylcholine receptors in peripheral tissues and brain. Life Sci 52: 441–448. https://doi.org/10.1016/0024-3205(93)90300-r
Bukharaeva EA, Kim KK, Nikol’skii EE, Vyskochil F (2000) Synchronization of evoked secretion of quanta of mediator as a mechanism facilitating the action of sympathomimetics. Neurosci Behav Physiol 30: 139–146. https://doi.org/10.1007/BF02463151
Malomouzh AI, Arkhipova SS, Nikolsky EE, Vyskočil F (2011) Immunocytochemical demonstration of M(1) muscarinic acetylcholine receptors at the presynaptic and postsynaptic membranes of rat diaphragm endplates. Physiol Res 60: 185–188. https://doi.org/10.33549/physiolres.932131
Newman Z, Malik P, Wu TY, Ochoa C, Watsa N, Lindgren C (2007) Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci 25: 1619–1630. https://doi.org/10.1111/j.1460-9568.2007.05422.x
Felder CC, Ma AL, Briley EM, Axelrod J (1993) Muscarinic acetylcholine receptor subtypes associated with release of Alzheimer amyloid precursor derivatives activate multiple signal transduction pathways. Ann NY Acad Sci 695: 15–18. https://doi.org/10.1111/j.1749-6632.1993.tb23020.x
Guo J, Schofield GG (2003) Activation of muscarinic m5 receptors inhibits recombinant KCNQ2/KCNQ3 K+ channels expressed in HEK293T cells. Eur J Pharmacol 462: 25–32. https://doi.org/10.1016/s0014-2999(03)01323-2
Cumbay MG, Watts VJ (2005) Galphaq potentiation of adenylate cyclase type 9 activity through a Ca2+/calmodulin-dependent pathway. Biochem Pharmacol 69: 1247–1256. https://doi.org/10.1016/j.bcp.2005.02.001
Cantrell AR, Ma JY, Scheuer T, Catterall WA (1996) Muscarinic modulation of sodium current by activation of protein kinase C in rat hippocampal neurons. Neuron 16: 1019–1026. https://doi.org/10.1016/s0896-6273(00)80125-7
Pemberton KE, Jones SV (1997) Inhibition of the L-type calcium channel by the five muscarinic receptors (m1-m5) expressed in NIH 3T3 cells. Pflugers Arch 433: 505–514. https://doi.org/10.1007/s004240050306
Mitchell JF, Silver A (1963) The spontaneous release of acetylcholine from the denervated hemidiaphragm of the rat. J Physiol 165: 117–129. https://doi.org/10.1113/jphysiol.1963.sp007046
Krnjevic K, Straughan DW (1964) The release of acetylcholine from the denervated rat diaphragm. J Physiol 170: 371–378. https://doi.org/10.1113/jphysiol.1964.sp007337
Molenaar PC, Polak RL (1980) Acetylcholine synthesizing enzymes in frog skeletal muscle. J Neurochem 35: 1021–1025. https://doi.org/10.1111/j.1471-4159.1980.tb07855.x
Tucek S (1982) The synthesis of acetylcholine in skeletal muscles of the rat. J Physiol 322: 53–69. https://doi.org/10.1113/jphysiol.1982.sp014022
Krivoi II (2002) Mechanisms of the non-neurotransmitter actions of acetylcholine in the neuromuscular apparatus. Neurosci Behav Physiol 32: 149–156. https://doi.org/10.1023/a:1013975324963
Vyskocil F, Malomouzh AI, Nikolsky EE (2009) Non-quantal acetylcholine release at the neuromuscular junction. Physiol Res 58: 763–784. https://doi.org/10.33549/physiolres.931865
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


