Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 1, стр. 59-84
Клеточная терапия как способ коррекции нарушений нейрогенеза во взрослом мозге в модели болезни Альцгеймера
А. В. Чаплыгина 1, Д. Ю. Жданова 1, В. И. Ковалев 1, Р. А. Полтавцева 2, *, Н. И. Медвинская 1, Н. В. Бобкова 1
1 Институт биофизики клетки Российской академии наук
Пущино, Россия
2 Национальный медицинский исследовательский центр акушерства, гинекологии
и перинатологии имени академика В.И. Кулакова Министерства Здравоохранения РФ
Москва, Россия
* E-mail: rimpol@mail.ru
Поступила в редакцию 20.09.2021
После доработки 18.10.2021
Принята к публикации 19.10.2021
- EDN: HVUPMO
- DOI: 10.31857/S0869813922010046
Аннотация
В основу настоящей работы положена гипотеза о нарушении нейрогенеза в мозге при болезни Альцгеймера (БА), приводящем к некомпенсированной гибели нейронов и ухудшению памяти. Предполагается, что лечение может быть осуществлено путем активации эндогенного нейрогенеза при помощи клеточной терапии. В нашем исследовании для внутримозговой трансплантации использовали мезенхимальные стволовые клетки (МСК), выделенные из Вартонова студня пупочного канатика человека, имеющие ряд существенных преимуществ по сравнению с МСК, выделенными из других тканей. Эксперименты выполнены на трансгенных (Tg) 8–9-месячных самках мышей линии 5XFAD – модели наследственной формы БА. Для оценки эффектов трансплантации МСК во фронтальную кору головного мозга анализировались состояние пространственной памяти в сопоставлении с морфофункциональными характеристиками ниш взрослого нейрогенеза – субгранулярной зоны зубчатой фасции гиппокампа (SGZ) и субвентрикулярной зоны боковых желудочков головного мозга (SVZ), височной зоны неокортекса и СА1/СА3 полей гиппокампа – структур, ответственных за обучение и память. Анализировали иммунопозитивность к BrdU и к маркерам нейрональной дифференцировки: нестину, даблкортину, 3-бета-тубулину, NeuN, МАР2 и GFAP. Tg мыши характеризовались нарушением соотношения интенсивности пролиферативной активности в SGZ/SVZ и снижением нейрональной плотности в коре головного мозга и гиппокампе. Позитивный эффект МСК на память мышей проявился через два месяца после трансплантации. На этом же сроке МСК были обнаружены только в мозге Tg животных. Под влиянием МСК у Tg и nTg мышей возрастала плотность BrdU+ позитивных клеток в нишах взрослого нейрогенеза, однако только в гиппокампе Tg мышей отмечалось снижение числа амилоидных бляшек, повышение плотности нейронов и иммунопозитивности к синаптофизину, а также снижение числа клеток с апоптозом. Позитивное действие МСК у Tg животных проявилось в гиппокампе – структуре, отдаленной от места трансплантации клеток во фронтальной коре, что свидетельствует о паракринном действии МСК, валидности химерной модели и перспективах клинического использования МСК для лечения БА.
Несмотря на то, что в мировой литературе накоплен значительный экспериментальный материал по изучению морфологических, биохимических и физиологических характеристик болезни Альцгеймера (БА), в настоящее время не существует однозначной концепции молекулярных основ патогенеза данного заболевания и адекватных подходов к его лечению и профилактике [1]. По прогнозам ВОЗ, если не будет найдено эффективное лечение, то к 2050 г. число заболевших деменциями, где основную долю составляют больные БА, приблизится к 131 млн человек [2].
Нейрофармакология, включающая развитие генной и клеточной терапии, становится на ближайшие 20 лет одним из приоритетов государственной политики РФ, согласно Национальной технологической инициативе [3]. Число публикаций по этой теме за последние 5 лет возросло более чем в 30 раз [PubMed].
Растворимые олигомеры амилоидного β-пептида (AβOs) и внутриклеточные фибриллы Тау-белка вызывают окислительный стресс в нейронах и способствуют повреждению синапсов на ранних этапах развития БА, что впоследствии ведет к нейродегенерации и потере памяти [4, 5]. По единодушному признанию ученых и клиницистов причиной развития нейродегенеративных заболеваний является некомпенсируемая гибель нейронов [6], поэтому предполагается, что клеточная терапия для стимуляции эндогенного нейрогенеза может быть эффективным подходом. Кроме того, большинство патологий имеет комплексную этиологию, поэтому использование мезенхимальных стволовых клеток (МСК), способных оказывать воздействие на разные аспекты этих заболеваний, весьма целесообразно и может рассматриваться как потенциальное терапевтическое средство для многих нейропатологий – от нарушений белого вещества у недоношенных младенцев до нейродегенеративных заболеваний у пожилых людей [7–9].
Однако до настоящего времени отсутствует ясное понимание молекулярно-клеточных механизмов, участвующих в терапевтических эффектах МСК, что является серьезным препятствием их внедрения в клиническую практику [10]. Известно, что МСК способны оказывать разнообразные эффекты, поскольку обладают как противовоспалительными свойствами, так и способностью выделять трофические факторы. МСК, как полагают, проявляют свои регенеративные способности путем адаптации их секретома к патологическим условиям в мозге, пораженном нейродегенеративным процессом, способствуя эндогенному восстановлению повреждений посредством аутокринной и паракринной сигнализации [7, 11]. МСК способны направляться в пораженные области, что подразумевает их потенциальное использование в качестве средств для введения терапевтических агентов. Кроме того, использование МСК имеет незначительный риск активации иммунной системы реципиента из-за низкой экспрессии рецепторов основного комплекса гистосовместимости (MHC) класса I, отсутствия рецепторов MHC класса II и отсутствия костимулирующих белков (например, CD40, CD80 и CD86) на плазматической мембране [12, 13]. МСК могут быть получены из широкого спектра тканей, включая костный мозг, жировую ткань, пульпу зуба, Вартонов студень пупочного канатика, пуповинную кровь [14, 15]. На сегодняшний день МСК, выделенные из постнатального костного мозга (BM-MSC), представляют собой наиболее широко изученную популяцию МСК, полученных от взрослого человека, с учетом их возможного использования в различных терапевтических приложениях и являются “золотым стандартом” в МСК-трансплантологии. Однако МСК, полученные из костного мозга, имеют ряд ограничений, главным образом, связанных с их проблематичным выделением, культивированием и использованием. В последние годы МСК, выделенные из Вартонова студня пупочного канатика (WJ-MSC), стали альтернативным источником BM-MSC, благодаря их легкой изоляции, а также иммуно- и морфофункциональным характеристикам. Будучи фенотипически схожими с МСК, получаемыми из тканей взрослого человека, WJ-MSC демонстрируют иной профиль экспрессии генов, связанных с адгезией клеток, пролиферацией и функционированием иммунной системы. Трансплантация подтверждает их иммуномодулирующее действие на Т-клетки, аналогичное BM-MSC. Кроме того, WJ-MSC сверхэкспрессируют гены, участвующие в нейротрофической поддержке, и их секретом индуцирует созревание нейронов клеток нейробластомы SH-SY5Y в большей степени, чем BM-MSC. Существенным преимуществом по сравнению с BM-MSC и МСК из других тканей является отсутствие у WJ-MSC риска злокачественного перерождения, что делает их привлекательным кандидатом для клеточной терапии при нейродегенеративных и иммуноопосредованных расстройствах центральной нервной системы [16, 17]. В спектр активности МСК входят и выделяемые ими экзосомы, которые показывают стабильность в циркуляции, хорошую биосовместимость, низкую токсичность и иммуногенность [18], поддерживают динамическую иммуномодулирующую активность и являются переносчиками липидов, белков, факторов роста, цитокинов, хемокинов и нуклеиновых кислот секретома родительских МСК [19] и способны при интраназальном введении улучшать память у животных с моделью БА [20], в связи с этим, именно WJ-MSC были использованы для мозговой трансплантации в нашем исследовании.
Подавляющее большинство работ по изучению эффектов и механизмов действия МСК проведено на клеточных культурах ткани мозга эмбрионов, зародышей и новорожденных мышей с генетическими нейропатологиями, или hiPSC пациентов с нейродегенеративными заболеваниями [21–24]. Несмотря на всю привлекательность данного подхода, очевидно, что культура не воспроизводит всех условий развития нейродегенеративного процесса в стареющем мозге, а, следовательно, спектр действия кокультивируемых МСК может быть существенно изменен, затрудняя трансляцию полученных данных на мозг человека. Поэтому большой интерес вызывают исследования на химерных моделях in vivo, которые приближают исследование к реальным условиям клинического использования этих клеток. Действительно, имеются сообщения о различных благоприятных эффектах после трансплантации МСК человека в модели нейродегенеративных заболеваний, таких как БА, болезнь Паркинсона, боковой амиотрофический склероз или острый инсульт мозга у грызунов [25–29]. Их действие проявилось в выделении нейротрофических факторов и защите клеток от апоптоза, в усилении нейрогенеза, в модуляции воспаления или аномальном клиренсе агрегатов бета-амилоидного белка [15]. Однако исследования МСК в условиях моделирования разных нейропатологий in vivo часто ограничиваются изучением эффективности разных способов введения этих клеток, включая системное, внутримозговое или интраназальное, используя короткие сроки после трансплантации, или исследованием состояния ткани мозга только в месте введения МСК без анализа состояния самих трансплантированных клеток [25], что, по-видимому, обусловлено широко распространенным представлением о весьма ограниченном времени жизни как клеток после трансплантации, так и выделяемых ими факторов [30]. Это противоречит поведенческим наблюдениям. Ранее мы показали, что позитивные эффекты на память животных с индуцированной нейродегенерацией альцгеймеровского типа развиваются в отдаленные сроки после трансплантации [31, 32]. Лишь отдельные исследования посвящены изучению состояния МСК человека и ткани мозга животных с моделями нейродегенеративных заболеваний, в частности, БА, проведенные в длительных хронических опытах [26].
В основу нашей работы была положена гипотеза, что нарушение нейрогенеза во взрослом организме в основных мозговых нишах является одним из ключевых событий в ухудшении процессов обучения и памяти при БА, а, следовательно, и лечение данной патологии может быть осуществлено за счет активации собственного эндогенного нейрогенеза. Использование МСК для модуляции эндогенного нейрогенеза у взрослых может оказать значительное влияние на будущие стратегии лечения БА [9, 33]. Однако несмотря на большой интерес к этой проблеме [25, 26, 29], ряд вопросов остаются не до конца выясненными, в частности, соотношение интенсивности пролиферативной активности в нишах нейрогенеза на модели БА и влияние длительной трансплантации МСК на этот процесс. Поэтому в нашем комплексном исследовании в длительных хронических экспериментах с использованием широко распространенной модели БА на Tg мышах 5XFAD проведено детальное изучение молекулярно-клеточных эффектов трансплантации МСК, выделенных из Вартонова студня пупочного канатика человека, с акцентом на изучение зон взрослого нейрогенеза (SVZ и SGZ), неокортекса и полей гиппокампа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Были отобраны 8–9-месячные трансгенные самки линии 5XFAD (n = 34) и нетрансгенные nTg контрольные животные (n = 34). Генотипирование мышей 5XFAD проводили с помощью ПЦР анализа ДНК, экстрагируемой из биопсии уха, с использованием праймеров 5'-AGGACTGACCACTCGACCAG-3' и 5'-CGGGGGTCTAGTTCTGCAT-3'. Мышей содержали по 6 особей в клетке в условиях естественной освещенности, со свободным доступом к воде и пище.
Выделение, культивирование и мозговая трансплантация МСК
Первичную культуру мезенхимальных стромальных клеток выделяли из Вартонова студня пупочного канатика, полученного после операции кесарево сечения от здоровых обследованных рожениц. Забор материала осуществляли с письменного информированного согласия доноров. Дальнейшее выделение и культивирование мезенхимальных стромальных клеток проводили в соответствии с протоколом, описанным нами ранее [20]. Кратко: МСК культивировали в питательной среде, содержащей DMEM:F12 (1 : 1,Gibco, США), 10% эмбриональной телячьей сыворотки (HyClone, США), 2 мM L-глутамина (ПанЭко, РФ), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Gibco, США), в культуральных флаконах (75 см2, Corning, США) при 37°С в атмосфере 5% СО2. Смену среды проводили каждые 3-и сутки на 50–100%, пассировали при достижении конфлюэнтности 80%.
Для исследований использовали культуру МСК 3-го пассажа.
Анализ экспрессии поверхностных маркеров мультипотентных мезенхимальных стромальных клеток – CD90, CD105, CD73, CD13, CD44 и маркеров гемапоэтических клеток CD14, CD34, CD45, проводили с помощью проточной цитометрии, измерения проводили на приборе FACSCalibur (BD, США). Для анализа способности исследуемых клеток к разнонаправленной дифференцировке и доказательства их мультипотентности проводили направленную дифференцировку в остеогенном, хондрогенном и адипогенном направлениях.
Трансплантацию суспензии МСК проводили в стерильных условиях под нембуталовым наркозом (40 мг/кг, в/б) с применением 0.5%-ного раствора новокаина для местного обезболивания при скальпировании. Введение клеток животным проводили через трепанационное отверстие в черепе в паренхиму фронтальной коры по стереотаксическим координатам АР +2, L 3; H 2.5 [34] в количестве 50 000 клеток в 5 мкл с помощью микрошприца Гамильтона. Установлено, что при интрапаренхимальной трансплантации МСК в кору происходит минимальная травматизация мозга реципиента [35]. Контрольным Tg и nTg мышам вводили физиологический раствор по тем же координатам и в том же объеме.
Поведенческие эксперименты
Обучение пространственному навыку в водном лабиринте Морриса с последующим тестированием пространственной памяти проводили через 1 и 2 месяца после трансплантации. Круглый бассейн диаметром 80 см, заполненный водой (23°C) на глубину 30 см, условно подразделяли на четыре равных сектора, один из которых, таргетный сектор, содержал скрытую спасательную платформу (диаметром 5 см), погруженную от поверхности на глубину 0.5 см. Для исключения визуального обнаружения платформы воду в бассейне забеляли раствором сухого молока. Обучение животных пространственному навыку осуществляли на протяжении 5-ти дней, по два сеанса утром и вечером. Через сутки после окончания обучения проводили тестирование уровня пространственной памяти в течение 1 мин при отсутствии спасательной платформы. Состояние памяти оценивали по способности животного узнавать сектор бассейна, в котором при обучении располагалась спасательная платформа. Для этого анализировали число заходов в каждый сектор бассейна, выраженное в процентах, и время пребывания мышей в каждом секторе.
BrdU введение
Животные получали внутрибрюшинные инъекции 5'-бром-2'-дезоксиуридина (BrdU, Sigma) (в\б; 50 мг\кг веса в 0.7%-ном растворе NaCl) в 4-х временных точках (2, 3, 4 и 12 недель после трансплантации МСК; n = 3 мыши на каждую временную точку из каждой группы nTg + физиологический раствор (n = 12), Tg + физиологический раствор (n = 12), nTg + YB-1(n = 12), Tg + YB-1(n = 12)). Инъекцию BrdU осуществляли накануне забоя животных для каждой временной точки. В отдельной серии по анализу выживаемости пролиферирующих клеток и их дифференцировке исследовали эти показатели через 2 мес. после введения BrdU.
Иммуногистохимия
Подсчет числа иммунопозитивных клеточных ядер для определения темпа клеточного деления проводили на срезах мозга Tg и nTg стареющих самок. Мыши анестезировались диэтиловым эфиром, после чего подвергались интракардиальной перфузии физиологическим раствором (0.9%-ным раствором NaCl) с последующим введением 4%-ного параформальдегида на 0.01 M фосфатном буфере (pH 7.4). Далее животные декапитировались, мозг вынимался и подвергался постфиксации в 4%-ном свежеприготовленном растворе параформальдегида на 0.01 M фосфатном буфере (pH 7.4) в течение 2-х суток. Далее в течение 12-ти ч мозг промывали в чистом фосфатном буфере (рН 7.4), а затем в течение последующих 12-ти ч в проточной воде. Затем выдерживали 3 дня в 30%-ном растворе сахарозы, повторно отмывали проточной водой в течение последующих 12-ти ч. На замораживающем столике микротома (МЗП-01, Техном, РФ) с использованием среды Tissue-Tek (Sakura, Нидерланды) готовили срезы толщиной 30 мкм.
Для избежания перекрестных сшивок антигенных молекул, ухудшающих иммунохимическое окрашивание, применялся метод демаскирования антигена в цитратном буфере – Heat Induced Epitope Retrival [36], для чего срезы предварительно трижды отмывались в растворе TBS + Triton X100, а затем на 20 мин помещались в горячий (90–95°С) раствор цитратного буфера (10 мМ цитрата натрия, 0.5% Tween 20, pH 6.0) с последующим 10-минутным охлаждением в дистиллированной воде.
Для оценки иммуноположительных к BrdU ядер срезы инкубировались с антителами к BrdU (Abcam, Великобритания, ab1893; 1 : 1000) с последующей окраской вторичными меченными 633 Alexa антителами (Thermofisher, США, A-21100; 1 : 200). Подсчет иммуноположительных ядер проводился в 10-ти полях зрения субэпендимальной зоны боковых желудочков (SVZ), субгранулярной зоны (SGZ) зубчатой фасции гиппокампа у каждого животного. Анализу подвергался каждый 6-й срез мозга. Использовали флуоресцентный микроскоп Leica DM IL (объектив 20×, что обеспечивало видимую площадь – 0.1 мм2). Оценивали среднюю плотность иммунопозитивных ядер в пересчете на 1 мм2.
Анализ характера дифференцировки BrdU+ клеток проводили через 2 месяца после его введения в тех же структурах мозга. Для определения характера нейрогенеза на срезах мозга осуществляли двойное иммуномечение с использованием антител к BrdU (Abcam, Великобритания, ab1893; 1 : 1000) и одному из маркеров нейрональной зрелости и глии, включая нестин (Abcam, Великобритания, США, ab ab6142; 1 : 100), даблкортин (Thermofisher, США, 481200; 1 : 100), 3 бета-тубулин (Abcam, Великобритания, ab18207; 1 : 1000) и NeuN (Abcam, Великобритания, ab104225; 1 : 1000), а также на маркер астроглии GFAP (Abcam, Великобритания, ab7260; 1 : 1000). Затем готовили вторичные антитела, меченные флуорофором 488 ((Abcam, Великобритания, ab150077; 1 : 1000) и (Abcam, Великобритания, ab150113; 1 : 1000)). Подсчет клеток с колокализацией иммунопозитивности к BrdU и одному из исследуемых маркеров нейрональной дифференцировки проводили в 10-ти полях зрения SVZ и SGZ у каждого животного. Использовали флуоресцентный микроскоп (объектив 20×), дающий видимую площадь в 0.1 мм2. Оценивали среднюю плотность иммунопозитивных ядер в пересчете на 1 мм2.
Другим методом оценки состояния нейрогенеза в мозге под влиянием трансплантации МСК у 4-х групп экспериментальных животных явилось определение пролиферативной активности в нишах взрослого нейрогенеза: SGZ и SVZ боковых желудочков c использованием антисыворотки к гистону H3 (HH3 – пролиферативный митотический маркер), фосфорилированному по Ser10 (Thermofisher, США, PA5-17869; 1 : 200), и вторичных антител, меченных флуорофором 594 (Abcam, Великобритания, ab150080; 1 : 400). Фосфорилированный гистон Н3 (Ser10) является надежным и специфичным маркером М фазы клеточного цикла, поскольку его содержание коррелирует с переходом клетки в G2/M фазу клеточного цикла и является необходимым условием конденсации хроматина во время митоза. Подсчет флуоресцирующих клеток проводили не менее, чем в 10-ти полях зрения в указанных структурах мозга на стороне трансплантации МСК у каждого животного, используя флуоресцентный микроскоп Leica DM IL (объектив 20×, видимая площадь – 0.1 мм2).
Для оценки состояния синаптического аппарата в неокортексе, СА1 и СА3 полях гиппокампа у 4-х групп животных проводили с использованием кроличьих моноклональных первичных антител к синаптофизину (Gene Tex, США, GTX61475; 1 : 200) и вторичных флуоресцентных козьих антител к иммуноглобулинам кролика (Cell Signaling Technology, США, 4412; 1 : 400). Срезы мозга анализировали на сканирующем конфокальном люминесцентном микроскопе Leica с объективом 63×. Площадь иммунопозитивности к синаптофизину оценивали количественно с помощью компьютерной программы ImageJ.
Для определения % клеток с апоптозом анализировали морфологическое состояние ядер и хроматина с использованием ДНК специфичного красителя DAPI, который широко применяется для идентификации апоптозных клеток по морфологическим признакам, таким как наличие апоптосом, ядерному пикнозу, фрагментации хроматина и измененной форме их ядер [37–39]. Фиксированные срезы инкубировали в растворе DAPI (Thermofisher, США, D1306; 1 : 1 000 000 относительно стокового раствора) и с использованием флуоресцентной микроскопии (длина волны 350 нм) осуществляли подсчет % апоптозных ядер в 10-ти полях зрения (объектив 60×, 0.125 мм2) неокортекса и СА1/СА3 полей гиппокампа у каждого контрольного животного Tg и nTg групп и мышей с трансплантацией МСК. Анализировали каждый 6-й срез этих структур.
Для определения нейрональной и астроцитарной плотности в неокортексе и полях гиппокампа проводили иммунопозитивное мечение с использованием первичных антител на нейрональный маркер MAP2 (Thermofisher, США, PA1-10005; 1 : 1000) или на маркер астроцитов GFAP (Abcam, Великобритания, ab7260; 1 : 500) соответственно. В качестве вторичных антител использовали аnti-сhicken Alexa Fluor® 647 (Abcam, Великобритания, ab150171; 1 : 300) или anti-rabbit Alexa Fluor® 488 (Abcam, Великобритания, ab 150077; 1 : 1000) для определения нейронов и астроцитов соответственно. Подсчет клеток проводили в 10-ти полях зрения в неокортексе и полях гиппокампа у каждого животного контрольных и экспериментальных групп. Использовали конфокальный люминесцентный микроскоп Leica DM IL (объектив 20×, площадь 0.1 мм2).
Анализ влияния трансплантации МСК на интенсивность амилоидного бляшкообразования осуществляли в мозге трансгенных 5XFAD мышей в неокортексе и гиппокампе. Для обнаружения бляшек использовали флуоресцентное окрашивание с тиофлавином S и определяли плотность амилоидных бляшек не менее, чем в 10 полях зрения для каждого животного и каждой структуры, используя флуоресцентный микроскоп Leica DM IL (объектив 20×, видимая площадь – 0.1 мм2).
Анализ клеточной плотности проводился минимум в 10-ти полях зрения с помощью программного обеспечения Leica Application Suite (Advanced Fluorescence LAS-AF) на микрофотографиях срезов головного мозга каждого экспериментального животного, полученных при использовании флуоресцентного микроскопа Leica DM IL с объективами 10×, 20× или 40×. Расчет клеточной плотности производился по формуле d = n/S, где n – число клеток в анализируемом поле, S – площадь этого поля, в мм2, и рассчитываемого с использованием масштабной линейки. Результаты представлены как среднее значение клеточной плотности в данной структуре и ошибкой среднего, рассчитанной в статистической программе SigmaPlot 12.5. Задача существенно упрощалась, если все поля данной структуры у всех животных анализировались с использованием одного объектива и одного усиления, показателем чего служили одинаковые значения на масштабной линейке.
Статистический анализ
Данные представлены как среднее значение параметра и стандартная ошибка этого значения. Для статистического анализа стереологических данных был использован двухсторонний t-критерий Стьюдента или факторный анализ One Way ANOVA с последующим Post-Hoc анализом для обработки поведенческих данных. Значения, которые являются статистически значимыми (p < 0.05), обозначены звездочкой (*) или горизонтальными линиями, указывающими, какие два значения достоверно различаются.
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтической комиссии ИБК РАН. Все процедуры, выполненные в исследованиях с участием людей, соответствуют этическим стандартам Национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участников было получено информированное добровольное согласие.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для трансплантации были получены и охарактеризованы мезенхимальные стволовые клетки, был проведен их цитометрический анализ, который показал, что полученные клетки были иммунопозитивны к маркерам CD73, CD90, CD105, данные маркеры [40] рекомендованы Международным обществом клеточной терапии для идентификации мультипотентных мезенхимальных стромальных клеток (ММСК), также клетки были иммунопозитивны к CD44, иммунопозитивность к маркерам гемопоэтических клеток CD14, CD34, CD45 отсутствовала.
Полученные для трансплантации клетки показали свою способность к направленной дифференцировке в остеогенном, адипогенном и хондрогенном направлениях, что подтвердило их принадлежность к мезенхимальным стволовым клеткам, обладающим мультипотентностью.
Для комплексной оценки эффектов трансплантации анализировались поведение и важнейшие характеристики морфофункционального состояния как ниш нейрогенеза, так неокортекса и гиппокампа – структур, ответственных за обучение и память.
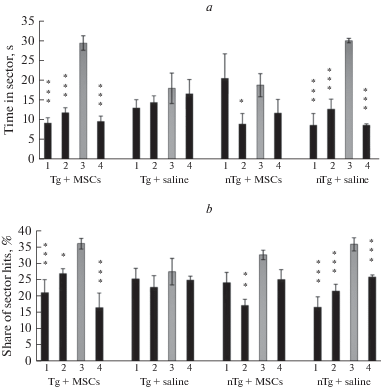
Тестирование пространственной памяти у 4-х групп экспериментальных животных в лабиринте Морриса после 5-дневного обучения показало, что через месяц после трансплантации МСК позитивный эффект – узнавание сектора, в котором при обучении находилась спасательная платформа, был слабо выражен как у группы Tg + МСК, так и nTg + МСК мышей линии 5XFAD. При тестировании памяти через 2 мес. после трансплантации все Tg мыши демонстрировали хорошую пространственную память и идентифицировали сектор обучения как по времени, так и по числу заходов в него. В результате факторного анализа были получены следующие значения факторов для выделения секторов бассейна по времени: для группы Tg + МСК F3,20 = 45.04, p < 0.001; для Tg + физ. р-р F3,20 = 0.569, p < 0.643; для nTg + МСК F3,16 = 1.84, p < 0.193 и для группы nTg + физ. р-р F3,16 = 51.78, p < < 0.00001. Факторы выделения секторов бассейна по количеству заходов в сектор обучения имели следующие значения: для группы Tg + МСК F3,20 = 5.3, p < 0.001; для Tg + физ. р-р F3,20 = 0.32, p < 0.81; для nTg + МСК F3,16 = 11.14, p < 0.003 и для группы nTg + физ. р-р F3,16 = 29.11, p < 0.000001. Данные Post-hoc анализа представлены на рис. 1a, b. Контрольные nTg мыши, подвергнутые аналогичной трансплантации, даже несколько ухудшили свои показатели памяти. Результаты свидетельствуют о позитивном эффекте МСК в отдаленные сроки после их трансплантации у Tg мышей.
Рис. 1.
Состояние пространственной памяти у Тg 5ХFAD мышей через два месяца после мозговой трансплантации МСК человека. а – время пребывания в секторах водного лабиринта Морриса, b – число заходов в % в сектора лабиринта Морриса. 1, 2, 3 и 4 – сектора лабиринта Морриса, где 3 – таргетный сектор, в котором при обучении располагалась спасательная платформа. *** – р < 0.001, ** – р < 0.01, * – р < 0.05 (относительно таргетного 3-го сектора).
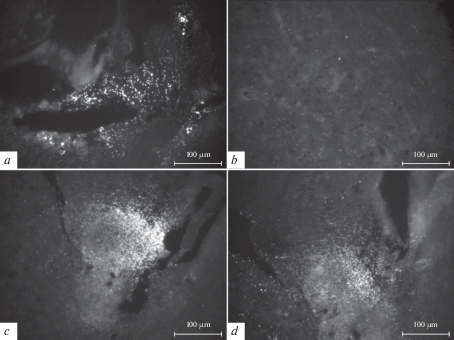
В связи с полученными поведенческими результатами представляло интерес исследовать, как долго выживают трансплантированные МСК в мозге Tg мышей. Установлено, что МСК, прижизненно меченные Hoechst 33258, определялись в месте введения через 7 и 60 дней после их трансплантации (рис. 2c, d), при этом часть клеток могла мигрировать в стриатум и SVZ боковых желудочков – нишу взрослого нейрогенеза. Важно отметить, что большая часть введенных МСК не выявила иммунопозитивности к маркерам нейронов или астроцитов NeuN, MAP2 или GFAP соответственно даже на поздних сроках трансплантации. В мозге nTg мышей введенные МСК не были обнаружены через 60 дней после их введения.
Рис. 2.
Локализация трансплантированных МСК, прижизненно меченных Hoechst 33258, во фронтальной коре мозга nTg (a, b) и Tg (c, d) мышей на 7-й (a, c) и 60-й (b, d) дни после введения соответственно. Шкала – 100 мкм.
Для определения влияния трансплантации МСК на нейрогенез в мозге 5XFAD стареющих самок мышей, в начале необходимо было оценить роль экспрессии 5 мутантных генов, присутствующих у этой трансгенной линии, на плотность нейральных прогениторных клеток (НПК) в нейрогенных областях, т. е. SVZ и SGZ. Для этой цели трансгенным и контрольным нетрансгенным мышам вводили аналог тимидина 5'-бром-2'-дезоксиуридин (BrdU) на 4-х возрастных точках, начиная с 9 мес. и заканчивая в 12 мес., что позволило проанализировать динамику изменения пролиферативной активности в мозге этих старых мышей. Контрольным группам нетрансгенных мышей вводили BrdU в том же режиме. BrdU, как известно, включается в ДНК делящихся клеток. Использование специфических антител к BrdU позволяет идентифицировать клеточные ядра, ДНК которых включили BrdU в течение суток.
На каждой временной точке мы количественно определили плотность иммунореактивных к BrdU клеток в срезах мозга этих мышей. Анализ срезов показал, что не были выявлены изменения в динамике плотности иммунореактивных клеток в период с 9-го по 12-й месяцы у Tg и nTg контрольных мышей ни в одной из нейрогенных ниш (рис. 3). Однако у nTg мышей пролиферация клеток BrdU+ в SGZ на всех временных точках показала явную тенденцию к повышению по сравнению с SVZ. У Tg животных, напротив, выраженность пролиферативной активности на всех временных точках не различалась между двумя нишами взрослого нейрогенеза. При этом сравнительный анализ показал, что у Tg животных на всех временных точках выраженность пролиферативной активности в SGZ проявила тенденцию к снижению, а плотность BrdU+ клеток в SVZ имела тенденцию к повышению по сравнению с nTg контрольными животными. Эти результаты свидетельствуют о том, что мутации и генерация бета-амилоида по-разному влияют на пролиферацию нейральных прогениторных клеток в нишах взрослого нейрогенеза и нарушают баланс этой активности, снижая ее в SGZ.
Рис. 3.
Динамика пролиферативной активности клеток в мозге Tg и nTg мышей в SGZ гиппокампа и SVZ боковых желудочков мозга в возрастной период с 9-го по 12-й месяцы. По оси абсцисс – плотность иммунопозитивных к BrdU клеток на площади 0.1 мм2 среза мозга. По оси ординат – время (недели) введения BrdU и определения BrdU+ иммунореактивных клеток.

Чтобы проверить, проявляется ли изменение интенсивности пролиферации клеток в нишах нейрогенеза у Tg мышей с изменением количества нейральных прогениторных клеток, срезы мозга были одновременно обработаны антителами против BrdU и антителами против одного из маркеров дифференцировки нейронов. Характер нейрогенеза оценивали с использованием маркеров нейрональной зрелости – нестина, дoблкортина, 3-бета-тубулина и NeuN, а также маркера покоящихся нейральных стволовых клеток в нишах нейрогенеза и астроглии GFAP. Анализ характера дальнейшей дифференцировки пролиферирующих клеток в нишах нейрогенеза, проведенный через 2 месяца после введения BrdU, показал, что у Tg и nTg мышей количественно в обеих нишах превалируют GFAP позитивные клетки, которые с большой вероятностью являются астроцитами, плотность остальных типов нейральных прогениторов была менее 2/мм2. При сопоставлении Tg и nTg мышей мы не наблюдали достоверных различий в уровнях иммунопозитивных клеток к нестину, 3-бета-тубулину и NeuN (рис. 4). Количество иммунопозитивных клеток к даблкортину было минимально и не различалось у Tg и nTg контрольных животных. Для того, чтобы оценить выживаемость пролиферирующих клеток в нишах нейрогенеза, BrdU позитивные клетки которых одновременно имели иммунопозитивность к различным маркерам нейрональной дифференцировки, мы сравнили суммарный % клеток с двойной иммунопозитивностью, выживших в обеих нишах, а затем отдельно в каждой из зон. Количественный анализ показал, что у нетрасгенных животных таких клеток оказалось в обеих нишах 50%, а у Tg мышей 41.1%. При этом у нетрансгенных мышей определялось 45.5 и 58.3% в SGZ и SVZ соответственно, в то время как у Tg мышей выживаемость клеток с маркерами нейрональной дифференцировки в SGZ составила 45.6%, но на треть снизилась в SVZ и составила 37.1%. Полученные данные свидетельствуют о тенденции к снижению клеток с сигналами нейрональной дифференцировки у Tg стареющих самок, главным образом в SVZ.
Рис. 4.
Характеристика глио- и нейрогенеза в SGZ и SVZ у контрольных Tg и nTg групп мышей. Количественное распределение плотности клеток с двойной иммунопозитивностью к BrdU и маркерам нейрональной зрелости и глии. GFAP – глиальный фибриллярный кислый белок, маркер астроглиальных клеток; Nestin – белок промежуточных филаментов нейральных стволовых и прогениторных клеток; 3b-tub – ассоциирован с микротрубочками, маркер дифференцирующихся нейронов; NeuN – маркерный белок ядер зрелых нейронов.

С целью понимания, с чем было связано снижение плотности клеток с сигналами нейрональной дифференцировки в ядрах нейрогенеза у трансгенных мышей, мы проанализировали пролиферативную активность, используя другой метод определения пролиферативной активности – антисыворотку к гистону H3 (HH3 – пролиферативный митотический маркер), фосфорилированному по Ser10 (1 : 200), и вторичных антител, меченных флуорофором 594 (1 : 400) в нишах взрослого нейрогенеза, наряду с анализом нейрональной плотности в коре головного мозга и гиппокампе. Было подтверждено, что Tg животные характеризовались повышенной пролиферативной активностью в SVZ мозга, но достоверно (р < 0.01) сниженной плотностью нейронов в неокортексе и гиппокампе по сравнению с nTg мышами (рис. 5a–с). В совокупности эти результаты свидетельствуют о том, что пролиферация нейрональных прогениторных клеток изменены в нишах нейрогенеза у Tg мышей, что и проявляется в тенденции к снижению их выживаемости в мозге в условиях развития нейродегенерации альцгеймеровского типа.
Рис. 5.
Трансплантация МСК усиливает пролиферацию в SVZ у Tg и nTg мышей (a), репрезентативные изображения иммунопозитивности к пролиферативному маркеру – гистону H3 (HH3 – пролиферативный митотический маркер), фосфорилированному по Ser10. 1 – nTg + физ. р-р, 2 – nTg + МСК, 3 – Tg + + физ. р-р, 4 – Tg + МСК; трансплантация МСК увеличивает нейрональную (верхняя диаграмма) плотность в неокортексе (b) и гиппокампе (поле CA1) (с) только у Tg мышей, репрезентативные фотографии коры головного мозга (d) и гиппокампа (поле CA1) (e) у разных групп экспериментальных животных: 1 – Tg + МСК; 2 – Tg + физ. р-р; 3 – nTg + МСК; 4 – nTg + физ. р-р после гистоиммунохимической окраски на нейроны (MAP2 – красный) и астроциты (GFAP – зеленый). Достоверность отличия от данных контрольных Tg и nTg животных, получавших физиологический раствор * – p < 0.05; ** – p < 0.01; *** – p < 0.001. Данные представлены как среднее значение ± стандартная ошибка. Для всех микрофотографий а (1–4) шкала – 25 мкм. Для всех микрофотографий d, e (1–4) шкала – 140 мкм.

Трансплантация МСК оказала разнообразные эффекты на морфофункциональное состояние как ниш нейрогенеза, так и мозговых структур, ответственных за обучение и память – неокортекс и гиппокамп. Вне зависимости от трансгенности животных наблюдалось усиление пролиферативной активности (BrdU+ позитивные клетки), а также росло число BrdU+-DCX+ клеток в нишах нейрогенеза. На рис. 5a представлены результаты подсчета клеток с двойной иммунопозитивностью в SVZ у Tg и nTg мышей через 2 мес. после трансплантации МСК, а также увеличение нейрональной плотности, отмеченное в неокортексе и гиппокампе только у Tg + МСК мышей, что происходило на фоне снижения плотности астроцитов в неокортексе (р < 0.05) при ее неизменности в гиппокампе (рис. 5b, с). Репрезентативные фотографии срезов мозга разных групп экспериментальных животных с гистоиммунохимической окраской нейронов (красный цвет) и астроцитов (зеленый цвет) представлены на рис. 5d, e.
Позитивный эффект трансплантации МСК у Tg мышей был отмечен при анализе плотности амилоидных бляшек, проявившийся в достоверном снижении плотности бляшек в гиппокампе (рис. 6a), что полностью ассоциировалось с позитивным влиянием МСК на память Tg животных.
Рис. 6.
Под влиянием трансплантации МСК уменьшается плотность амилоидных бляшек в гиппокампе (поля CA1, СА3) (a), репрезентативные микрофотографии бляшек с использованием тиофлавина S: 1 – Tg + физ. р-р, 2 – Tg + МСК. Трансплантация МСК снижает (b) число апоптозных клеток в гиппокампе (поле CA1) у Tg мышей линии 5XFAD, репрезентативные изображения окраски срезов гиппокампа (поле CA1) красителем DAPI, стрелочками показаны апоптотические клетки, 1 – nTg + физ. р-р, 2 – nTg + МСК, 3 – Tg + физ. р-р, 4 – Tg + МСК. Достоверность отличия данных по двухстороннему t-критерию Стьюдента между указанными группами мышей, соединенных горизонтальными линиями : * – р < 0.05; ** – р < 0.01. Данные представлены как среднее значение ± стандартная ошибка. Для микрофотографий а (1–2) шкала – 50 мкм. Для микрофотографий b (1–2) шкала – 100 мкм.
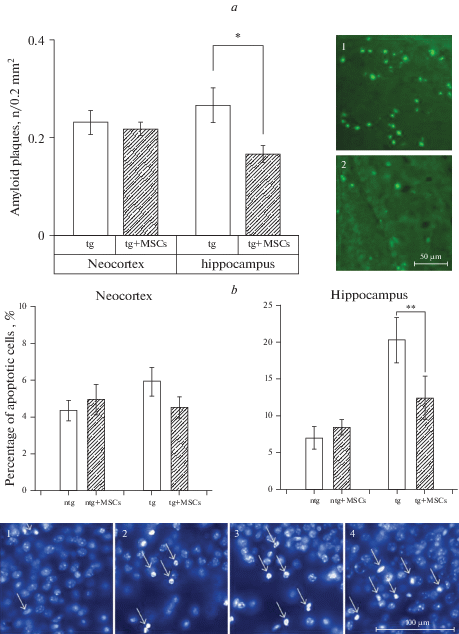
Клетки, в которых ДНК или другие компоненты необратимо повреждены, в нормальных условиях подвергаются запрограммированной гибели, называемой апоптозом. Эти клетки претерпевают последовательные структурные и молекулярные изменения во время процесса апоптоза, характеризующегося образованием пузырей плазматической мембраны, уплотнением хроматина, фрагментацией ДНК, сжатием клеток и коллапсом клетки на небольшие неповрежденные фрагменты, называемые апоптотическими тельцами. DAPI, ДНК-специфический краситель, который проявляет синюю флуоресценцию, плохо проходит через интактную клеточную мембрану, но апоптоз увеличивает проницаемость клеточной мембраны и окраску ядерного конденсированного и фрагментированного хроматина, что выражается в сильной голубой флуоресценции этих образований. Клетки с фрагментированными и конденсированными ядрами считались апоптотическими [41, 42]. Контрольные Tg животные характеризовались достоверным увеличением процента апоптозных клеток в гиппокампе (р < 0.01), но не в неокортексе. Введение МСК вызывало снижение выраженности апоптоза в гиппокампе. Выраженность апоптоза была незначительной в мозге nTg мышей, и введение МСК не оказывало на них достоверного влияния (рис. 6b).
Количественный иммуногистохимический анализ синаптофизина, представленный на рис. 7, выявил снижение синаптической плотности у Tg мышей по сравнению с nTg животными в височной коре (р < 0.001) и полях СА1 и СА3 (р < 0.001) гиппокампа.
Рис. 7.
Влияние трансплантации МСК человека на синаптическую плотность в височной коре (a), полях СА1 (b) и СА3 (c) гиппокампа у трансгенных мышей 5ХFAD. По оси ординат площадь иммунофлуоресценции синаптофизина на срезах мозга разных групп животных, указанных на оси абсцисс. Репрезентативные изображения иммунофлуоресцентного мечения на синаптофизин: 1 – nTg + физ. р-р, 2 – nTg + МСК, 3 – Tg + физ. р-р, 4 – Tg + МСК. Достоверность отличия данных по двухстороннему t-критерию Стьюдента: *** – р < 0.001 (относительно группы nTg мышей), xxx – р < 0.001 (относительно группы Tg мышей). Для микрофотографий а–с (1–4) шкала – 25 мкм.
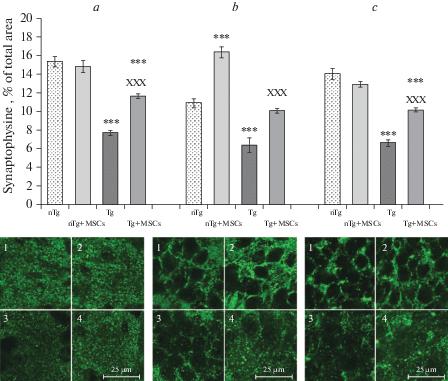
У Tg животных с трансплантацией МСК отмечено повышение синаптической плотности по сравнению с контрольными Tg + физ. р-р. мышами в коре головного мозга (р < 0.001) и в полях гиппокампа (р < 0.001). У nTg мышей введение МСК не повлияло на уровень синаптофизина в височной коре относительно контрольной nTg + физ. р-р. группы, но увеличило синаптическую плотность в поле СА1 (р < 0.001). Таким образом, развитие нейродегенерации альцгеймеровского типа на модели наследственной формы БА у 5XFAD мышей происходит на фоне снижения синаптической плотности в височной коре и полях СА1 и СА3 гиппокампа, а введение этим животным МСК из Вартонова студня пуповины существенно улучшает синаптическую пластичность в этих структурах.
В целом, полученные результаты свидетельствуют, что у трансгенной линии 5XFAD мышей основные нарушения морфофункционального состояния нейронов были выявлены в гиппокампе, при этом позитивный эффект трансплантации МСК также ярко проявился в этой структуре, что коррелировало с улучшением пространственной памяти у Tg мышей после введения МСК.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Используемые в исследовании трансгенные мыши линии 5XFAD (TG6799) широко применяются в качестве модели наследственной формы БА и характеризуются ранним выраженным амилоидогенезом в головном мозге, поскольку в своем геноме несут шведскую (K670N/M671L), флоридскую (I716V) и лондонскую (V717I) мутации белка предшественника бета-амилоида АРР человека APP(695), а также M146L и L286V мутации в гене пресенилина 1. Экспрессия обоих трансгенов находится под Thy1 промотером. Уже к четырем месяцам у животных наблюдается накопление высоких уровней бета-амилоида, а также синаптическая дегенерация, потеря нейронов и дефицит в пространственном обучении [43], а к шести месяцам амилоидные бляшки и глиоз обнаруживаются в коре головного мозга и гиппокампе [44]. В целом данная модель БА отражает вклад в развитие этого заболевания АРР и пресенилинов, играющих важную роль в регуляции взрослого нейрогенеза [45, 46].
Особенностью данного исследования явилось использование химерной модели, позволившей анализировать состояние МСК человека, трансплантированных в мозг Tg 5XFAD мышей, пораженный нейродегенеративным процессом альцгеймеровского типа. Использование стареющих самок приближает исследование к реальным условиям клинического применения этих клеток. Факт большей подверженности женщин риску заболеть БА признается большинством исследователей [47–49], однако экспериментальных работ на моделях БА у стареющих самок сравнительно мало [50].
Полученные результаты не только подтвердили существующие данные литературы о наличии характерных для трансгенных животных таких изменений, как нарушение пространственной памяти, наличие амилоидных бляшек в мозге, снижение нейрональной плотности в неокортексе и гиппокампе, уменьшение синаптогенеза [51], но и выявили ряд интересных особенностей. Снижение нейрональной плотности, что было характерно для всех групп Tg животных, безусловно, связано с токсическим влиянием бета-амилоида, который, как показано другими авторами, увеличивает число реактивных астроцитов вблизи амилоидных бляшек [52]. Такие астроциты окружают бляшки, изолируя их от контактов со здоровой тканью [53], возможно, поэтому токсическое действие сформированных бляшек менее выражено, чем у растворимых олигомерных форм этого белка. Тем не менее, реактивные астроциты участвуют в секреции воспалительных цитокинов, включая IL-1, IL-6 и TNF-alpha, тем самым способствуя нейровоспалению [54], и, по-видимому, гибели нейронов. Следует отметить и тот факт, что агрегаты Aβ через активацию синтеза хемотаксических молекул в окружающих моноцитах способствуют привлечению астроцитов к амилоидным бляшкам [55]. Отсутствие различий в астроцитарной плотности в гиппокампе у всех групп животных вне зависимости от трансгенности, по-видимому, связано с постоянством их числа даже при БА, что отличает гиппокамп от коры головного мозга [56].
Большая подверженность гибели нейронов гиппокампа у Tg мышей хорошо соответствует как существующему представлению об ускоренном старении при БА, так и зеркальной гипотезе о более раннем старении структур мозга, которые в эмбриогенезе развиваются позже [57]. Гиппокамп и является такой структурой. Ранее в нашей работе мы также показали, что нейроны в гиппокампе старых трансгенных мышей характеризуются более выраженными морфологическими нарушениями, чем клетки возрастного контроля нетрансгенных животных. Это свидетельствует об ускоренном старении клеток гиппокампа в условиях развития БА [58]. Известно, что часть клеток при старении переходит в сенесцентные клетки, которые экспрессируют провоспалительные цитокины, факторы роста и протеазы (цитокины IL-6 и IL-8, MMP-1, MMP-3, фибронектин и ламинин B), что в совокупности составляет секреторный фенотип, связанный со старением (SASP). Такой “коктейль” может негативно влиять на микроокружение и в конечном итоге приводить к активации апоптоза в нейронах и их гибели [59], что мы и видели в гиппокампе, но не в неокортексе трансгенных мышей.
Наблюдаемое нами снижение нейрональной плотности в мозге трансгенных животных может быть и следствием ухудшения нейрогенеза, что было описано в мозге трансгенных животных с другими моделями БА [60–62]. Некоторыми авторами высказывается предположение, что нарушение нейрогенеза является ранним критическим событием в БА, которое может лежать в основе нарушений памяти, по крайней мере частично, и усугублять уязвимость нейронов в формировании гиппокампа [63]. Кроме того, нарушение нейрогенеза может являться результатом как внутренней патологии нейрональных клеток-предшественников, так и нарушением самих нейрогенных ниш, о чем, к сожалению, не позволяют судить наши результаты, и требуется дополнительное исследование этого вопроса. Интересно отметить, что снижение пролиферативной активности в нишах взрослого нейрогенеза авторы наблюдали только у трансгенных мышей старше 9 мес., что ставит под сомнение участие в этом процессе бета-амилоида, генерация которого начинается в более ранние сроки.
Для оценки нейрогенеза мы использовали целый ряд маркеров нейрональной дифференцировки. Известно, что во взрослом организме нестин в основном синтезируется в клетках-предшественниках нейронов SGZ. При дифференцировке нестин замещается тканеспецифичными белками промежуточных филаментов. Клетки-предшественники нейронов начинают экспрессировать даблкортин при активном делении, а их дочерние нейрональные клетки продолжают экспрессировать даблкортин в течение 2-х–3-х нед., когда клетки созревают в нейроны. Понижение уровня даблкортина начинается через 2 недели и происходит в то же время, когда эти клетки начинают экспрессировать NeuN. 3-бета-тубулин образует микротрубочки и встречается почти исключительно в нейронах. Он является отличительным ранним маркером дифференцированных нервных клеток. Иммунореактивность к NeuN становится очевидной по мере снижения экспрессии даблкортина.
Использование подсчета BrdU+ клеток позволило нам выявить нарушение баланса выраженности пролиферативной активности между двумя нишами взрослого нейрогенеза, характерного для нетрансгенных животных. В исследованиях редко уделяют внимание этому факту, поскольку в основном изучают SGZ, отвечающую за нейрогенез в гиппокампе не только у животных, но и у человека [64]. Анализ судьбы пролиферирующих клеток с использованием различных перечисленных выше маркеров нейрональной зрелости показал, что подавляющее большинство клеток в обеих нишах были иммунопозитивны к астроглиальному маркеру GFAP. Учитывая, что иммунопозитивность к этому маркеру имеют и нейральные стволовые клетки, непосредственно расположенные в нишах нейрогенеза, полученные данные могут быть расценены как отсутствие нейрональной дифференцировки в мозге Tg животных. Суммарная оценка числа клеток в зонах нейрогенеза свидетельствует, что у животных используемой нами трансгенной линии в большей степени страдает нейрогенез в SVZ, где пролиферирующие клетки либо не вступают в дифференцировку, либо погибают на ее ранних стадиях.
Результаты иммуноцитохимического окрашивания клеток, выделенных из Вартонова студня пупочного канатика и использованных нами для мозговой трансплантации, свидетельствуют об их принадлежности к МСК и отсутствии в препарате гемопоэтических стволовых клеток, о чем свидетельствует наличие специфических маркеров МСК на их поверхности, таких как CD 90, CD 105, CD 73, CD 44, CD 13, отсутствие CD14, CD34, CD45 [40], а также их дифференцировка в остеогенном, адипогенном и хондрогенном направлениях подтверждает их мультипотентность.
Далее нас интересовала судьба трансплантированных во фронтальную кору МСК. Присутствие МСК, прижизненно меченных Hoechst 33258, в месте введения у трансгенных животных нами было установлено как через 7, так и через 60 дней после трансплантации, в то время как у nTg мышей в отдаленные сроки мы не обнаружили меченых МСК. Выживание МСК в мозге модельных животных без использования иммуносупрессии отмечали и другие авторы [65]. По-видимому, это свидетельствует как о возможном снижении иммунной защиты у Tg животных [66], что ранее нами было обнаружено у бульбэктомированных животных – другой модели спорадической формы БА [67], так и о способности МСК вызывать иммуносупрессию и иммуномодуляцию [68], позволяющую им выживать даже при ксеногенной трансплантации. Другой особенностью большей части введенных МСК человека явилась слабая способность к дифференцировке, проявившаяся в отсутствие иммунопозитивности к маркерам нейронов и астроцитов, что, по-видимому, позволяло им длительное время выделять ростовые и трофические факторы, оказывая паракринное воздействие на морфофункциональное состояние клеток мозга Tg мышей и их функционирование [65].
В данной работе было установлено, что максимальный позитивный эффект МСК на память Tg мышей также проявился через 2 мес. после их трансплантации, что ассоциировалось с присутствием в их мозге МСК. Ранее полученные нами данные также показали высокую эффективность трансплантации МСК в отношении памяти мышей с другой моделью БА [31]. Причины нарушения памяти в группе nTg + МСК мышей до настоящего времени неясны. По-видимому, МСК в здоровом и в мозге, пораженном патологическим процессом, оказывают разные эффекты, на что указывалось в литературе [69].
Количественный анализ амилоидных бляшек у Tg мышей с трансплантацией человеческих МСК выявил достоверное снижение плотности бляшек в гиппокампе, что полностью ассоциировалось с позитивным влиянием МСК на память Tg животных. Очевидно, что эффект был обусловлен очисткой мозговых структур, ответственных за память, от токсического действия бета-амилоида за счет системного действия многочисленных биологически активных соединений, таких как противовоспалительные цитокины, трофические и ростовые факторы, выделяемые МСК и нормализующие деятельность клеток неокортекса и гиппокампа [70]. Снижение числа бляшек, возможно, связано с тем, что выделяемая МСК молекула внутриклеточной адгезии-1 (sICAM-1), которая через сигнальный путь sICAM-1/LFA-1 (антиген-1, связанный с функцией лимфоцитов (LFA-1)) индуцирует экспрессию непрелизина в микроглии, что способствует утилизации бета-амилоида и уменьшает число бляшек [27]. Другой возможностью снижения бляшек под влиянием МСК является активация аутофагии [28].
В наших исследованиях было показано, что трансплантация МСК вызывает активацию пролиферации в нишах взрослого нейрогенеза, главным образом, в SVZ. Снижение потери нейронов в гиппокампе и усиление нейрогенеза в разных животных моделях поражений мозга под влиянием МСК наблюдали и другие авторы [71]. Эффект авторы связали с активацией BDNF-TrkB сигнального пути, вызывавшего активацию внутриклеточных Akt и/или Erk, что приводило к фосфорилированию CREB, ответственного за транскрипцию BDNF.
Недавно было высказано предположение, что сигнальный путь Wnt модулирует нейрогенез в моделях БА, связанных с амилоидом-β, где в качестве лечения использовали МСК. В обработанных Aβ нейрональных клетках-предшественниках (NPC) при кокультивировании с МСК значительно увеличивалась экспрессию Ki-67, GFAP, SOX2, нестина, а также β-катенина и Ngn1, что доказывает усиление сигнального пути Wnt [29].
Нейрогенез в субгранулярной зоне зубчатой извилины гиппокампа может действовать как эндогенный механизм восстановления памяти при БА. Известна тесная связь Wnt сигнального пути с регуляцией и контролем внутриклеточной активности Ca2+ и Ca2+-зависимых механизмов. β-катенин является центральным звеном канонического пути Wnt/β-катенина и связан с регуляцией нейрогенеза в зубчатой фасции гиппокампа и в SVZ, а также модулирует синаптическую передачу и пластичность [72].
Однако полученные нами результаты не позволяют прямо ассоциировать улучшение памяти у трансгенных старых мышей с моделью БА, наблюдаемую при трансплантации МСК, исключительно с активацией нейрогенеза, поскольку активация была отмечена и в мозге нетрансгенных животных с аналогичным введением МСК, но память улучшалась только у трансгенных мышей. Конечно, основной причиной могло быть отсутствие МСК в мозге контрольных мышей во время обучения и тестирования памяти спустя 2 мес. после трансплантации. Причиной наблюдаемого поведенческого эффекта МСК у трансгенных мышей могла быть и повышенная плотность нейронов, главным образом, в гиппокампе.
Полученные результаты свидетельствуют о наличии у МСК нейропротективных свойств. Ряд авторов связывают их со способностью МСК выделять различные провоспалительные цитокины в ответ на повреждение (IL-1β, IL-6, IL-8, IL-10, TNFα, IFNβ). Установлено, что одну из центральных ролей в эффектах МСК играет IL-6 и активация сигнального пути IL-6/STAT3. Так, введение нативных, но не МСК с генетической конструкцией, подавляющей экспрессию IL-6, сопровождалось улучшением моторного поведения у крыс, которым в неонатальный период вызывали инфаркт мозга, что указывает на наличие у IL-6 репарационного действия. Путем воздействия на ряд других сигнальных путей – простагландин E2 (PGE2), белок TNF-индуцибельного гена 6 (TSG-6), рецептор прогестерона (PR) и глюкокортикоидный рецептор (GR) МСК переводят активированную микроглию в М2 фенотип, что сопровождается торможением выделения провоспалительных цитокинов и способствует восстановлению ткани и нейрорегенерации [73]. В исследованиях in vitro при совместном культивировании корковых нейронов и МСК было установлено, что на поверхности нейронов снижается экспрессия GluR1 субъединицы AMPAR, что повышает их устойчивость к эксайтотоксичности глутамата и препятствует повышению уровня внутриклеточного Са2+, что не оказывает влияния на их выживаемость и даже снижает число нейронов с апоптическими ядрами [74]. Возможно, это происходит за счет увеличения экспрессии антиапоптотического гена Bcl-2 и снижения экспрессии проапоптотического гена Bax. В нашей работе ярко проявилась противоапооптотическая активность МСК в гиппокампе трансгенных старых мышей. Выраженная нейропротективная активность МСК может осуществляться и через секрецию как ростового фактора фибробластов (FGF)-II [75], так и BDNF [76]. Выделяемый МСК TNF путем активации поверхностных клеточных TNF рецепторов 1-го и 2-го типов запускает сигнальный путь, в конечном итоге приводящий к транскрипции генов, повышающих выживаемость клеток [74].
Нейропротективное действие МСК на нейрон может быть опосредовано и через их действие на астроциты. Факторы, выделяемые МСК, способны активировать сигнальный путь p38, что приводит к уменьшению синтеза белка AQP4 на отростках астроцитов, а также к повышению активности плазминогена-1 астроцитов, что способствует превращению про-нейтрофинов (pro-BDNF и pro-NGF) в их активные формы. МСК снижают синтез нейрокана в активированных астроцитах, а также регулируют VEGF-A-зависимую активность eNOS астроцитов. Реализация этих молекулярно-клеточных механизмов также приводит к снижению апоптотической гибели астроцитов и сохранению целостности и стабилизации гематоэнцефалического барьера [77], к усилению роста нейритов и восстановлению нейронных связей. Другие исследования на животных моделях продемонстрировали, что МСК человека оказывают нейропротективное действие посредством сложных комплексных механизмов, таких как модуляция нейровоспаления, усиление нейрогенеза и модуляция убиквитинирования белков [78, 79].
Известно, что МСК синтезируют и выделяют в окружающую среду факторы роста, цитокины и хемокины [80], экзосомы [81]. Выделенные МСК вещества способны модулировать локальную иммунную систему, усиливать процесс образования новых сосудов, стимулировать миграцию, пролиферацию, дифференцировку клеток и формирование внеклеточного матрикса. Важно отметить, что все эти факторы присутствуют в условиях химерной модели in vivo, и лишь частично могут быть воспроизведены при кокультивировании МСК с трансгенной культурой in vitro, что повышает ценность полученных нами результатов. Важно отметить, что все трансгенные животные, использованные в работе, находились на развернутой стадии нейродегенеративного процесса альцгеймеровского типа, поэтому позитивные эффекты внутримозговой трансплантации МСК можно рассматривать как лечебные, что особенно важно в условиях отсутствия эффективной терапии этого заболевания на этапе его развернутой фазы.
В настоящее время МСК не применяют для лечения пациентов с болезнью БА, в связи с этим сложно оценить эффективность данной терапии, но все больше данных свидетельствует о том, что данный метод окажется многообещающим способом лечения БА и других нейродегенеративных заболеваний, о чем свидетельствуют полученные нами результаты.
Список литературы
Caselli RJ, Beach TG, Knopman DS, Graff-Radford NR (2017) Alzheimer Disease: Scientific Breakthroughs and Translational Challenges. Mayo Clin Proc 92(6): 978–994. https://doi.org/10.1016/j.mayocp.2017.02.011
Tiwari S, Atluri V, Kaushik A, Yndart A, Nair M (2019) Alzheimer’s disease: pathogenesis, diagnostics, and therapeutics. Int J Nanomedicine 19(14): 5541–5554. https://doi.org/10.2147/IJN.S200490
Loera-Valencia R, Piras A, Ismail MAM, Manchanda S, Eyjolfsdottir H, Saido TC. Johansson J, Eriksdotter M, Winblad B, Nilsson P (2018) Targeting Alzheimer’s disease with gene and cell therapies. J Int Med 284(1): 2–36. https://doi.org/10.1111/joim.12759
Sadigh-Eteghad S, Sabermarouf B, Majdi A, Taleb M, Farhoudi M, Mahmoudi Jl (2015) Amyloid-beta: a crucial factor in Alzheimer’s disease. Med Princ Pract 24(1): 1–10. https://doi.org/10.1159/000369101
Lane CA, Hardy J, Schott JM (2018) Alzheimer’s disease. Eur J Neurol 25(1): 59–70. https://doi.org/10.1111/ene.13439
Winner B, Kohl Z, Gage FH (2011) Neurodegenerative disease and adult neurogenesis. Eur J Neurosci. 33(6): 1139–1151. https://doi.org/10.1111/j.1460-9568.2011.07613.x
Liang X, Ding Y, Zhang Y, Tse HF, Lian Q (2014) Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplant 23(9): 1045–1059. https://doi.org/10.3727/096368913x667709
Josine EG Vaes, Marit A Vink, Caroline GM de Theije, Freek E Hoebeek, Manon JNL Benders, Cora H A Nijboer (2019) The Potential of Stem Cell Therapy to Repair White Matter Injury in Preterm Infants: Lessons Learned From Experimental Models. Front Physiol 10: 540. https://doi.org/10.3389/fphys.2019.00540
Noureddini M, Bagheri-Mohammadi S (2021) Adult Hippocampal Neurogenesis and Alzheimer’s Disease: Novel Application of Mesenchymal Stem Cells and their Role in Hippocampal Neurogenesis. Int J Mol Cell Med 10(1): 1–10. https://doi.org/10.22088/IJMCM.BUMS.10.1.1
Vitek MP, Araujo JA, Fossel M, Greenberg BD, Howel GR, Sukoff Rizzo SJ, Seyfried NT, Tenner AJ, Territo PR, Windisch M, Bain LJ, Ross AR, Carrillo MC, Lamb BT, Edelmayer RM (2021) Translational animal models for Alzheimer’s disease: An Alzheimer’s Association Business Consortium Think Tank. Alzheimers Dement (N Y) 6(1): e12114. https://doi.org/10.1002/trc2.12114
Paton MCB, McDonald CA, Allison BJ, Fahey MC, Jenkin G, Miller SL (2017) Perinatal brain injury as a consequence of preterm birth and intrauterine inflammation: designing targeted stem cell therapies. Front Neurosci 11: 200. https://doi.org/10.3389/fnins.2017.00200
De Miguel MP, Fuentes-Julian S, Blazquez-Martinez A, Pascual CY, Aller MA, Arias J, Arnalich-Montiel F (2012) Immunosuppressive properties of mesenchymal stem cells: advances and applications. Curr Mol Med 12(5): 574–591. https://doi.org/10.2174/156652412800619950
Jacobs SA, Roobrouck VD, Verfaillie CM, Van Gool SW (2013) Immunological characteristics of human mesenchymal stem cells and multipotent adult progenitor cells. Immunol Cell Biol 91(1): 32–39. https://doi.org/10.1038/icb.2012.64
Kobolak J, Dinnyes A, Memic A, Khademhosseini A, Mobasheri A (2016) Mesenchymal stem cells: identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods 99: 62–68. https://doi.org/10.1016/j.ymeth.2015.09.016
Volkman R, Offen D (2017) Concise review: mesenchymal stem cells in neurodegenerative diseases. Stem Cells 35: 1867–1880. https://doi.org/10.1002/stem.2651
Frausin S, Viventi S, Verga Falzacappa L, Quattromani MJ, Leanza G, Tommasini A, Valencic E (2015) Wharton’s jelly derived mesenchymal stromal cells: Biological properties, induction of neuronal phenotype and current applications in neurodegeneration research. Acta Histochem 117(4–5): 329–338. https://doi.org/10.1016/j.acthis.2015.02.005
Donders R, Bogie JFJ, Ravanidis S, Gervois P, Vanheusden M, Marée R, Schrynemackers M, Smeets HJM, Pinxteren J, Gijbels K, Walbers S, Mays RW, Deans R, Van Den Bosch L, Stinissen P, Lambrichts I, Gyselaers W, Hellings N (2018) Human Wharton’s Jelly-Derived Stem Cells Display a Distinct Immunomodulatory and Proregenerative Transcriptional Signature Compared to Bone Marrow-Derived Stem Cells. Stem Cells 27(2): 65–84. https://doi.org/10.1089/scd.2017.0029
Shi J, Zhao YC, Niu ZF, Fan HJ, Hou SK, Guo XQ, Sang L, Lv Q (2021) Mesenchymal stem cell-derived small extracellular vesicles in the treatment of human diseases: progress and prospect. World J Stem Cells 13(1): 49–63. https://doi.org/10.4252/wjsc.v13.i1.49
Wang X, Thomsen P (2021) Mesenchymal stem cell-derived small extracellular vesicles and bone regeneration. Basic Clin Pharmacol Toxicol 128: 18–36. https://doi.org/10.1111/bcpt.13478
Zhdanova DY, Poltavtseva RA, Svirshchevskaya EV, Bobkova NV (2021) Effect of Intranasal Administration of Multipotent Mesenchymal Stromal Cell Exosomes on Memory of Mice in Alzheimer’s Disease Model. Bull Exp Biol Med 170(4): 575–582. https://doi.org/10.1007/s10517-021-05109-3
Venugopal CKS, Rai KS, Pinnelli VB, Kutty BM, Dhanushkodi A (2018) Neuroprotection by Human Dental Pulp Mesenchymal Stem Cells: From Billions to Nano. Curr Gene Ther 18(5): 307–323. https://doi.org/10.2174/1566523218666180913152615
Mead B, Logan A, Berry M, Leadbeater W, Scheven BA (2014) Paracrine-mediated neuroprotection and neuritogenesis of axotomised retinal ganglion cells by human dental pulp stem cells: comparison with human bone marrow and adipose-derived mesenchymal stem cells. PLoS One 9(10): e109305. https://doi.org/10.1371/journal.pone.0109305
Labrador-Velandia S, Alonso-Alonso ML, Di Lauro S, García-Gutierrez MT, Srivastava GK, Pastor JC, Fernandez-Bueno I (2019) Mesenchymal stem cells provide paracrine neuroprotective resources that delay degeneration of co-cultured organotypic neuroretinal cultures. Exp Eye Res 185: 107671. https://doi.org/10.1016/j.exer.2019.05.011
Peng C, Li Y, Lu L, Zhu J, Li H, Hu J (2019) Efficient One-Step Induction of Human Umbilical Cord-Derived Mesenchymal Stem Cells (UC-MSCs) Produces MSC-Derived Neurospheres (MSC-NS) with Unique Transcriptional Profile and Enhanced Neurogenic and Angiogenic Secretomes. Stem Cells Int 2019: 9208173. https://doi.org/10.1155/2019/9208173
Lee HJ, Lee JK, Lee H, Shin J-W, Carter J E, Sakamoto Toshiro, Kyung Jin H, Bae J-s (2010) The therapeutic potential of human umbilical cord blood-derived mesenchymal stem cells in Alzheimer’s disease. Neurosci Lett 481(1): 30–35. https://doi.org/10.1016/j.neulet.2010.06.045
Park H-J, Shin JY, Lee BR, Kim HO, Lee PH (2012) Mesenchymal stem cells augment neurogenesis in the subventricular zone and enhance differentiation of neural precursor cells into dopaminergic neurons in the Substantia Nigra of a Parkinsonian model. Cell Transplant 21: 1629–1640. https://doi.org/10.3727/096368912X640556
Kim J-Y, Kim DH, Kim JH, Kim J-Y, Lee D, Jeon HB, Kwon S-J, Kim SM, Yoo YJ, Lee EH, Choi SJ, Seo SW, Lee JI, Na DL, Yang YS, Oh W, Chang JW (2012) Soluble intracellular adhesion molecule-1 secreted by human umbilical cord blood-derived mesenchymal stem cell reduces amyloid-β plaques. Cell Death Differ 19: 680–691. https://doi.org/10.1038/cdd.2011.140
Shin JY, Park HJ, Kim HN, Oh SH, Bae J-S, Ha H-J, Lee PH (2014) Mesenchymal stem cells enhance autophagy and increase β-amyloid clearance in Alzheimer disease models. Autophagy 10: 32–44. https://doi.org/10.4161/auto.26508
Oh SH, Kim HN, Park H-J, Shin JY, Lee PH (2015) Mesenchymal stem cells increase hippocampal neurogenesis and neuronal differentiation by enhancing the Wnt signaling pathway in an Alzheimer’s disease model. Cell Transpl 24: 1097–1109. https://doi.org/10.3727/096368914X679237
Калинина ЮА, Гилерович ЕГ, Коржевский ДЭ (2019) Астроциты и их участие в механизмах терапевтического действия мультипотентных мезенхимальных стромальных клеток при ишемическом повреждении головного мозга. Гены и клетки 14(1): 33–40. [Kalinina YA, Gilerovich EG, Korzhevskij DE (2019) Astrocytes and their participation in the mechanisms of therapeutic action of multipotent mesenchymal stromal cells in ischemic brain damage. Genes and Cells 14 (1): 33–40. (In Russ)]. https://doi.org/10.23868/201903004
Bobkova NV, Poltavtseva RA, Samokhin AN, Sukhikh GT (2013) Therapeutic effect of mesenchymal multipotent stromal cells on memory in animals with Alzheimer-type neurodegeneration. Bull Exp Biol Med 156(1): 119–121. https://doi.org/10.1007/s10517-013-2293-z
Poltavtseva RA, Samokhin AN, Bobkova NV, Alexandrova MA, Sukhikh GT (2020) Effect of Transplantation of Neural Stem and Progenitor Cells on Memory in Animals with Alzheimer’s Type Neurodegeneration. Bull Exp Biol Med 168(4): 589–596. https://doi.org/10.1007/s10517-020-04758-0
Арсентьева ЕВ, Полякова ДИ (2021) Современный взгляд на использование клеточных технологий для стимуляции репаративного нейрогенеза. Научное обозрение. Мед науки (2): 16–24. [Arsent’yeva YEV, Polyakova DI (2021) A modern view of the use of cell technologies to stimulate reparative neurogenesis. Scientific Review. Med Sci (2): 16–24. (In Russ)].
Franklin KBJ, Paxinos G (2008) The mouse brain in stereotaxic coordinates. Amsterdam. Elsevier.
Nemecek S, Subrtova D (1995) Cerebrospinal fluid dissemination of fetal neural isografts in brain of adult rats. Sb Ved Pr Lek Fak Karlovy Univer Hradci Kralove 38(1): 5–9.
Werner M, Von Wasielewski R, Komminoth P (1996) Antigen retrival, signal amplification and intensification in immunohistochemistry. Histochem Cell Biol 105(4): 253–260. https://doi.org/10.1007/BF01463928
Zhu M, Li W, Guo J, Lu Y, Dong X, Lin B, Chen Y, Zhang X, Li M (2016) Alpha fetoprotein antagonises benzyl isothiocyanate inhibition of the malignant behaviors of hepatocellular carcinoma cells. Oncotarget 7(46): 75749–75762. https://doi.org/10.18632/oncotarget.12407
Wang W, Zhu M, Xu Z, Li W, Dong X, Chen Y, Lin B, Li M (2019) Ropivacaine promotes apoptosis of hepatocellular carcinoma cells through damaging mitochondria and activating caspase-3 activity. Biol Res 52(1): 36. https://doi.org/10.1186/s40659-019-0242-7
Yi S, Liu G, Wu Y, Liang Q, Li L (2020) Baicalein suppresses the growth of the human thyroid cancer cells by inducing mitotic catastrophe, apoptosis and autophagy via NF-kB signalling pathway. J BUON 25(1): 389–394.
Du WJ, Chi Y, Yang ZX, Li ZJ, Cui JJ, Song BQ, Li X, Yang SG, Han ZB, Han ZC (2016) Heterogeneity of proangiogenic features in mesenchymal stem cells derived from bone marrow, adipose tissue, umbilical cord, and placenta. Stem Cell Res & Therapy 7(1): 1–1. https://doi.org/10.1186/s13287-016-0418-9
Borner C (2003) The Bcl2 protein family: Sensors and checkpoints for life-or-death decisions. Mol Immunol 39: 615–647. https://doi.org/10.1016/s0161-5890(02)00252-3
Lewandowska U, Szewczyk K, Owczarek K, Hrabec Z, Podsędek A, Koziołkiewicz M, Hrabec E (2013) Flavanols from Evening Primrose (Oenothera paradoxa) Defatted Seeds Inhibit Prostate Cells Invasiveness and Cause Changes in Bcl-2/Bax mRNA Ratio. J Agricult and Food Chem 61(12): 2987–2998. https://doi.org/10.1021/jf304269x
Oakley H, Cole SL, Logan S, Maus E, Shao P, Craft J, Vassar R (2006) Intraneuronal β-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: potential factors in amyloid plaque formation. J Neurosci 26 (40): 10129–10140. https://doi.org/10.1523/JNEUROSCI.1202-06.2006
Bobkova NV, Lyabin DN, Medvinskaya NI, Samokhin AN, Nekrasov PV, Nesterova IV, Ovchinnikov LP (2015) The Y-box binding protein 1 suppresses Alzheimer’s disease progression in two animal models. PLoS One 10 (9): e0138867. https://doi.org/10.1371/journal.pone.0138867
Lazarov O, Marr RA (2010) Neurogenesis and Alzheimer’s disease: at the crossroads. Exp Neurol 223(2): 267–281. https://doi.org/10.1016/j.expneurol.2009.08.009
Bonds JA, Kuttner-Hirshler Y, Bartolotti N, Tobin MK, Pizzi M, Marr R, Lazarov O (2015) Presenilin-1 dependent neurogenesis regulates hippocampal learning and memory. PLoS One 10(6): e0131266. https://doi.org/10.1371/journal.pone.0131266
Baum LW (2005) Sex, hormones, and Alzheimer’s disease. J Gerontol Ser A: Biol Sci and Med Sci 60(6): 736–743. https://doi.org/10.1093/gerona/60.6.736
Webber KM, Casadesus G, Perry G, Atwood CS, Bowen R, Smith MA (2005) Gender differences in Alzheimer disease: the role of luteinizing hormone in disease pathogenesis. Alzheimer Disease & Associated Disorders 19(2): 95–99. https://doi.org/10.1097/01.wad.0000165512.90864.3f
Mielke MM, Vemuri P, Rocca WA (2014) Clinical epidemiology of Alzheimer’s disease: assessing sex and gender differences. Clin Epidemiol 6: 37–48. https://doi.org/10.2147/CLEP.S37929
Rodriguez JJ, Jones VC, Tabuchi M, Allan SM, Knight EM, LaFerla FM, Oddo S, Verkhratsky A (2008) Impaired adult neurogenesis in the dentate gyrus of a triple transgenic mouse model of Alzheimer’s disease. PloS One 13;3(8): e2935. https://doi.org/10.1371/journal.pone.0002935
Hall AM, Roberson ED (2012) Mouse models of Alzheimer’s disease. Brain Res Bull 88(1): 3–12. https://doi.org/10.1016/j.brainresbull.2011.11.017
Vehmas AK, Kawas CH, Stewart WF, Troncoso JC (2003) Immune reactive cells in senile plaques and cognitive decline in Alzheimer’s disease. Neurobiol Aging 24(2): 321–331. https://doi.org/10.1016/S0197-4580(02)00090-8
Itagaki S, McGeer PL, Akiyama H, Zhu S, Selkoe D (1989) Relationship of microglia and astrocytes to amyloid deposits of Alzheimer disease. J Neuroimmunol 24(3): 173–182. https://doi.org/10.1016/0165-5728(89)90115-X
Hartlage-Rübsamen M, Zeitschel U, Apelt J, Gärtner U, Franke H, Stahl T, Günther A, Schliebs R, Penkowa M, Bigl V, Roßner S (2003) Astrocytic expression of the Alzheimer’s disease β-secretase (BACE1) is stimulus-dependent. Glia 41(2): 169–179. https://doi.org/10.1002/glia.10178
Koistinaho M, Lin S, Wu XI, Esterman M, Koger D, Hanson J, Higgs R, Liu F, Malkani S, Bales KR, Paul SM (2004) Apolipoprotein E promotes astrocyte colocalization and degradation of deposited amyloid-β peptides. Nature Med 10(7): 719–726. https://doi.org/10.1038/nm1058
von Bartheld CS, Bahney J, Herculano-Houzel S (2016) The search for true numbers of neurons and glial cells in the human brain: a review of 150 years of cell counting. J Compar Neurol 524(18): 3865–3895. https://doi.org/10.1002/cne.24040
Douaud G, Groves AR, Tamnes CK, Westlye LT, Duff EP, Engvig A, Walhovd KB, James A, Gass A, Monsch AU, Matthews PM (2014) A common brain network links development, aging, and vulnerability to disease. Proc Natl Acad Sci USA 111(49): 17648–17653. https://doi.org/10.1073/pnas.1410378111
Evgen'ev M, Bobkova N, Krasnov G, Garbuz D, Funikov S, Kudryavtseva A, Kulikov A, Samokhin A, Maltsev A, Nesterova I (2019) The Effect of Human HSP70 Administration on a Mouse Model of Alzheimer’s Disease Strongly Depends on Transgenicity and Age. J Alzheimers Dis 67(4): 1391–1404. https://doi.org/10.3233/JAD-180987
Coppé JP, Desprez PY, Krtolica A, Campisi J (2010) The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu Rev Pathol: Mechanisms of Disease 5: 99–118. https://doi.org/10.1146/annurev-pathol-121808-102144
Li D, Tang J, Xu H, Fan X, Bai Y, Yang L (2008) Decreased hippocampal cell proliferation correlates with increased expression of BMP4 in the APPswe/PS1ΔE9 mouse model of Alzheimer’s disease. Hippocampus 18(7): 692–698. https://doi.org/10.1002/hipo.20428
Donovan MH, Yazdani U, Norris RD, Games D, German DC, Eisch AJ (2006) Decreased adult hippocampal neurogenesis in the PDAPP mouse model of Alzheimer’s disease. J Compar Neurol 495(1): 70–83. https://doi.org/10.1002/cne.20840
Taniuchi N, Niidome T, Goto Y, Akaike A, Kihara T, Sugimoto H (2007) Decreased proliferation of hippocampal progenitor cells in APPswe/PS1dE9 transgenic mice. Neuroreport 18(17): 1801–1805. https://doi.org/10.1097/WNR.0b013e3282f1c9e9
Demars M, Hu YS, Gadadhar A, Lazarov O (2010) Impaired neurogenesis is an early event in the etiology of familial Alzheimer’s disease in transgenic mice. J Neurosci Res 88(10): 2103–2117. https://doi.org/10.1002/jnr.22387
Boldrini M, Fulmore CA, Tartt AN, Simeon LR, Pavlova I, Poposka V, Rosoklija GB, Stankov A, Arango V, Dwork AJ, Hen R (2018) Human hippocampal neurogenesis persists throughout aging. Cell Stem Cell 22(4): 589–599. https://doi.org/10.1016/j.stem.2018.03.015
Zhang R, Cai Y, Xiao R, Zhong H, Li X, Guo L, Xu H, Fan X (2019) Human amniotic epithelial cell transplantation promotes neurogenesis and ameliorates social deficits in BTBR mice. Stem Cell Res & Therapy 10(1): 1–3. https://doi.org/10.1186/s13287-019-1267-0
Shi Q, Chowdhury S, Ma R, Le KX, Hong S, Caldarone BJ, Stevens B, Lemere CA (2017) Complement C3 deficiency protects against neurodegeneration in aged plaque-rich APP/PS1 mice. Sci Translat Med 9(392). https://doi.org/10.1126/scitranslmed.aaf6295
Novoselova EG, Bobkova NV, Sinotova OA, Ogai VB, Glushkova OV, Medvinskaya NI, Samokhin AN (2003) The immune state of bulbectomized mice. Dokl Biol Sci 393: 505–507. https://doi.org/10.1023/b:dobs.0000010308.59629.c0
Vercelli A, Mereuta OM, Garbossa D, Muraca G, Mareschi K, Rustichelli D, Ferrero I, Mazzini L, Madon E, Fagioli F (2008) Human mesenchymal stem cell transplantation extends survival, improves motor performance and decreases neuroinflammation in mouse model of amyotrophic lateral sclerosis. Neurobiol Disease 31(3): 395–405. https://doi.org/10.1016/j.nbd.2008.05.016
Björklund A, Lindvall O (2000) Cell replacement therapies for central nervous system disorders. Nature Neurosci 3(6): 537–544. https://doi.org/10.1038/75705
Aithal AP, Bairy LK, Seetharam RN (2021) Safety and therapeutic potential of human bone marrow-derived mesenchymal stromal cells in regenerative medicine. Stem Cell Investig 8: 10. https://doi.org/10.21037/sci-2020-036
Ko HR, Ahn SY, Chang YS, Hwang I, Yun T, Sung DK, Sung SI, Park WS, Ahn JY (2018) Human UCB-MSCs treatment upon intraventricular hemorrhage contributes to attenuate hippocampal neuron loss and circuit damage through BDNF-CREB signaling. Stem Cell Res & Therapy 9(1): 1–5. https://doi.org/10.1186/s13287-018-1052-5
Varela-Nallar L, Inestrosa NC (2013) Wnt signaling in the regulation of adult hippocampal neurogenesis. Front Cell Neurosci 7: 100. https://doi.org/10.3389/fncel.2013.00100
Xu C, Fu F, Li X, Zhang S (2017) Mesenchymal stem cells maintain the microenvironment of central nervous system by regulating the polarization of macrophages/microglia after traumatic brain injury. Int J Neurosci 127(12): 1124–1135. https://doi.org/10.1080/00207454.2017.1325884
Papazian I, Kyrargyri V, Evangelidou M, Voulgari-Kokota A, Probert L (2018) Mesenchymal stem cell protection of neurons against glutamate excitotoxicity involves reduction of NMDA-triggered calcium responses and surface GluR1, and is partly mediated by TNF. Int J Mol Sci 19(3): 651. https://doi.org/10.3390/ijms1903065
Reuss B, Halbach OV (2003) Fibroblast growth factors and their receptors in the central nervous system. Cell Tissue Res 313(2): 139–157. https://doi.org/10.1007/s00441-003-0756-7
Isele NB, Lee HS, Landshamer S, Straube A, Padovan CS, Plesnila N, Culmsee C (2007) Bone marrow stromal cells mediate protection through stimulation of PI3-K/Akt and MAPK signaling in neurons. Neurochem Int 50(1): 243–250. https://doi.org/10.1016/j.neuint.2006.08.007
Park HJ, Shin JY, Kim HN, Oh SH, Song SK, Lee PH (2015) Mesenchymal stem cells stabilize the blood–brain barrier through regulation of astrocytes. Stem Cell Res & Therapy 6(1): 1–2. https://doi.org/10.1186/s13287-015-0180-4
Park HJ, Lee PH, Bang OY, Lee G, Ahn YH (2008) Mesenchymal stem cells therapy exerts neuroprotection in a progressive animal model of Parkinson’s disease. J Neurochem 107(1): 141–151. https://doi.org/10.1111/j.1471-4159.2008.05589.x
Park HJ, Bang G, Lee BR, Kim HO, Lee PH (2011) Neuroprotective effect of human mesenchymal stem cells in an animal model of double toxin induced multiple system atrophy parkinsonism. Cell Transplant 20: 827–835. https://doi.org/10.3727/096368910X540630
Poltavtsev AM, Poltavtseva RA, Yushina MN, Volgina NE, Svirshchevskaya EV (2017) Cytokine Production in Mixed Cultures of Mesenchymal Stromal Cells from Wharton’s Jelly and Peripheral Blood Lymphocytes. Bull Exp Biol Med 163(1): 169–175. https://doi.org/10.1007/s10517-017-3759-1
Полтавцева РА, Бобкова НВ, Жданова ДЮ, Свирщевская ЕВ, Сухих ГТ (2021) Нейродегенерация альцгеймеровского типа. Возможная коррекция ухудшения памяти при внутривенном введении препарата экзосом. Биол мембр 38(5): 374–387. [Poltavtseva RA, Bobkova NV, Zhdanova DYU, Svirshchevskaya EV, Sukhikh GT (2021) Alzheimer’s type neurodegeneration. possible correction of memory impairment with intravenous injection of exosomes. Biol Membr 38(5): 374–387. (In Russ)]. https://doi.org/10.31857/S0233475521050066
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


