Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 1, стр. 85-97
Участие 5-НТ1 И 5-НТ5А рецепторов в модуляции синаптической передачи и внутренних свойств мембраны спинальных мотонейронов лягушки (Rana ridibunda)
Н. И. Калинина 1, *, Н. П. Веселкин 1, 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: nkalinina54@mail.ru
Поступила в редакцию 31.10.2021
После доработки 15.11.2021
Принята к публикации 15.11.2021
- EDN: WODUGV
- DOI: 10.31857/S0869813922010071
Аннотация
Эндогенный моноамин серотонин (5-НТ) участвует в модуляции моторного выхода у позвоночных животных, взаимодействуя с различными типами 5-НТ рецепторов. Ранее 5-НТ5А рецепторы были обнаружены в поясничных мотонейронах крысы с помощью иммуногистохимических методов, где предполагается их постсинаптическая локализация. Однако сведений о наличии 5-HT5A рецепторов в поясничном отделе спинного мозга низших позвоночных (в том числе амфибий) мы не обнаружили. В настоящей работе с использованием фармакологического подхода, вне- и внутриклеточной регистрации потенциалов острым электродом исследовано возможное участие 5-НТ5А рецепторов (наряду с 5-НТ1 рецепторами) в модуляции моторного выхода спинальных мотонейронов лягушки Rana ridibunda. Результаты внеклеточного отведения (при аппликации 5-СТ, агониста 5-НТ1 и 5-НТ5А рецепторов и SB-699551 селективного антагониста 5-НТ5А рецептора) указывают на пространственно-временную модуляцию активности нейронов вентрального рога. Изменение амплитуды полевого антидромного потенциала, пиковой амплитуды вызванного корешкового потенциала и внутриклеточного дорсально-корешкового постсинаптического потенциала, а также изменение частоты внеклеточных спайков и латентности первого внутриклеточного ПД при аппликации 5-СТ были время-зависимыми: в первые минуты наблюдалась потенциация, которая позже сменялась угнетением. Суммарно полученные результаты свидетельствуют об участии 5-НТ5А рецепторов наряду с 5-НТ1 рецепторами в модуляции моторного выхода спинальных мотонейронов лягушки.
ВВЕДЕНИЕ
Эндогенный моноамин серотонин (5-НТ) участвует в модуляции моторного выхода, взаимодействуя с различными типами 5-НТ рецепторов [1–6]. Серотонинергические нейроны, локализованные в ядрах шва и ретикулярной формации, дают проекции почти ко всем областям головного и спинного мозга. У млекопитающих нисходящие серотонинергические волокна образуют синапсы на соматодендритной мембране поясничных мотонейронов [7, 3 ].
В настоящее время различают 7 семейств серотониновых рецепторов 5-НТ1–7, которые объединяют 16 подтипов. За исключением 5-НТ3 рецепторов, которые представляют собой лиганд-управляемые ионные каналы, все остальные типы 5-НТ рецепторов являются метаботропными, связанными с G-белками [8–10].
Экспрессия различных подтипов 5-НТ рецепторов исследовалась разными методиками, включая in situ гибридизацию, фармакологию, иммуногистохимию. В мотонейронах млекопитающих обнаружены 5-НТ1А,В/D, 5-НТ2А,В,С [3] и 5-НТ5А рецепторы [11–13], для остальных подтипов 5-НТ рецепторов данных нет.
Ранее мы показали, что в поясничных мотонейронах лягушки серотонин уменьшает частоту глицинергических миниатюрных тормозных постсинаптических потенциалов (мТПСП), не оказывая заметного влияния на частоту ГАМКергических мТПСП [14]. Этот эффект реализуется посредством активации пресинаптических 5-НТ1B/D рецепторов и приводит к частичному облегчению моторного выхода [15]. Кроме того, мы получили данные, свидетельствующие о наличии 5-НТ1А и 5-НТ2В,С рецепторов на постсинаптической мембране поясничных мотонейронов лягушки, и предположили возможную совместную модуляцию аккомодационных свойств мотонейрона этими двумя типами серотониновых рецепторов [16].
5-НТ5А рецепторы относятся к малоисследованной группе серотониновых рецепторов [9]. Недостаточное понимание роли этого рецептора частично объяснялось отсутствием доступных селективных лигандов 5-НТ5A рецептора [17, 18]. Рецептор 5-HT5A остается только условно классифицированным в семействе рецепторов 5-HT (база данных IUPHAR) [10]. Хотя селективного агониста до сих пор нет, разработка его селективного антагониста (SB-699551) [19] позволила детальнее исследовать функциональную роль этого “орфанного” рецептора [20]. Этот малоизученный подтип принадлежит семейству рецепторов, связанных с G-белком, которые отрицательно влияют на аденилатциклазу [21–23]. Его активация приводит к мобилизации внутриклеточного Ca2+ [24] и стимуляции внутренне выпрямляющих калиевых каналов [20, 25].
Рецепторы 5-HT5A в основном локализуются в коре головного мозга, гиппокампе и мозжечке [26], а также в миндалине, хвостатом ядре, мозжечке, гипоталамусе, черной субстанции, таламусе и спинном мозге [11, 27–30]. 5-НТ5А рецепторы были обнаружены иммуногистохимически в поясничных мотонейронах дорсолатерального ядра и в мотонейронах Lamina IX спинного мозга крысы [11, 31]. Наблюдения, полученные с помощью электронного микроскопа, предполагают постсинаптическую локализацию 5-НТ5А рецепторов [11].
Умеренная экспрессия 5-HT5A рецепторов во всех группах мотонейронов Lamina IX и в колонке промежуточных дилатеральных клеток (по сравнению с дорсальным рогом и дорсолатеральным ядром L6) предполагает, что 5-HT5A рецепторы также участвуют в контроле моторных и вегетативных функций [11]. Учитывая это, мы предположили, что 5-НТ5А рецепторы могут играть роль в модуляции моторного выхода у амфибий.
В недавних экспериментах на крысах было показано, что при активации 5-HT5A рецепторов уменьшаются болевые ощущения в спинном мозге, а 5-HT и агонист серотонина 5-CT уменьшают нейропатическую боль посредством активации рецепторов 5-HT5A и 5-HT1A,B/D. Эти рецепторы могут быть важной частью нисходящей системы подавления боли у млекопитающих [32–34]. Данных о наличии 5-HT5A рецепторов в поясничном отделе спинного мозга низших позвоночных (в том числе амфибий) мы не обнаружили. Поэтому в данной работе мы поставили цель проверить наличие 5-НТ5A рецепторов и в случае присутствия исследовать их роль (наряду с ролью 5-НТ1 рецепторов) в модуляции моторного выхода (синаптической передачи и собственных свойств мембраны) спинальных мотонейронов лягушки Rana ridibunda. Для этого мы провели электрофизиологическую регистрацию внеклеточных и внутриклеточных потециалов мотонейронов в присутствии селективных антагонистов и агонистов 5HT1,5А рецепторов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Приготовление среза спинного мозга
Опыты проводили на препарате поясничного сегмента изолированного спинного мозга лягушки Rana ridibunda. Эксперименты выполнялись в соответствии с требованиями Комитета по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, разработанными на основе международных рекомендаций European Communities Council Directive 1986 (86/609/EEC). Под эфирным наркозом производили дорсальную ламинэктомию. После снятия оболочки выделяли IX и X сегменты спинного мозга вместе с корешками в виде фронтальных срезов толщиной 2–3 мм (такая толщина позволяет регистрировать в середине среза структурно неповрежденные клетки). Один из них фиксировали в экспериментальной камере ростральной поверхностью вверх. Приготовление препарата, устройство камеры, схема эксперимента подробно описаны ранее [14].
Для перфузии использовали раствор следующего состава (мМ): 100 NaCl, 2 KCl, 0.5 MgCl2, 5.5 глюкоза, 1.5 CaCl2, 9 NaHCO3, 2 Трис, рН 7.4–7.6, аэрируемый газовой смесью (98% О2 и 2% СО2) и имеющий температуру 16–18°С. Скорость протока составляла 6 мл/мин, объем ванны 0.5 мл.
Внеклеточная и внутриклеточная регистрация потенциалов
Потенциалы регистрировали с помощью микроэлектродного дифференциального усилителя, разработанного в нашей лаборатории (вед. инж. Б.Т. Рябов), оцифровывали c частотой 10–20 кГц с помощью АЦП NI USB-6211 (National Instruments, США) и записывали на компьютере, используя программу WinWCP (Strathclyde Electrophysiology Software, Великобритания).
Потенциалы отводили от мотонейронов IX или X сегментов как внеклеточно (вблизи ядра поясничных мотонейронов), так и внутриклеточно с помощью острых стеклянных микроэлектродов с диаметром кончика 1–1.5 мкм, заполненных 3М раствором KCl, имевших сопротивление 10–20 МОм. Глубина погружения микроэлектрода, двигавшегося строго вертикально вдоль колонки мотонейронов, составляла от 300 до 1200 мкм от ростральной поверхности среза в зоне неповрежденных клеток. Известно, что поясничный спинальный мотонейрон является самой крупной клеткой спинного мозга, имеющей разветвленное дендритное дерево. Дендриты поясничных мотонейронов лягушки могут распространяться в ростро-каудальном направлении спинного мозга на расстояние до 2 мм [35]. Учитывая особенности структуры мотонейронов, неповрежденные клетки можно наколоть примерно в середине среза, т.е. на указанной выше глубине. Клетки, расположенные в зоне повреждения структуры дендритов (до 300 мкм от ростральной поверхности мозга), имеют отличные от здоровых клеток параметры, что показано нами ранее [36]. Поясничные мотонейроны идентифицировали по наличию антидромного потенциала действия, возникающего при стимуляции IX или X вентрального корешка. В анализ включали мотонейроны с мембранным потенциалом покоя не менее –60 мВ и амплитудой антидромного потенциала действия не менее 70 мВ.
Фармакология
Агонист 5-HT1A,B/D и 5-НТ5А рецепторов (5-СТ, 5–10 мкМ), антагонист 5-НТ1,2 рецепторов (метисергид, MS, 10 мкМ) и селективный антагонист 5-НТ5А рецепторов (SB 699551, 10 мкМ) добавляли в перфузирующий раствор. Все реактивы были приобретены в Sigma-Aldrich или Tocris Bioscience.
Статистическая обработка
Анализ первичных электрофизиологических данных производился с использованием программы Clampfit 10.5 (Molecular Devices, CША). Для статистического анализа и графического представления результатов использовали программу Sigma Plot 12.5. Нормальность распределения данных оценивалась по критерию Шапиро–Уилка. Статистическая значимость оценивалась с использованием парного критерия Стьюдента и однофакторного дисперсионного анализа ANOVA с последующими апостериорными сравнениями средних значений по тесту Тьюки. Все значения приведены как среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Влияние аппликации агониста 5-НТ5А и антагониста 5-НТ1,2 рецепторов на антидромный полевой потенциал (внеклеточная регистрация)
Аппликация 5-СТ, агониста 5-HT1A,B/D и 5-НТ5А рецепторов достоверно вызывала потенциацию амплитуды антидромного полевого потенциала, регистрируемого внеклеточно вблизи поясничных мотонейронов с 2.3 ± 0.3 мВ до 3.4 ± 0.3 мВ (n = 6). Потенциация исчезала при отмывке в нормальном растворе (рис. 1а, слева сверху).
Рис. 1.
Действие агониста и антагонистов 5-НТ1A,B/D, 5А рецепторов на амплитуду полевого антидромного потенциала. (а) – 5-СТ потенцирует (слева вверху), а смесь 5-СТ и SB 699551 вызывает меньшую потенциацию (слева внизу), однофакторный дисперсионный анализ (F1,10 = 6.2), (b) – потенциация амплитуды антидромного полевого потенциала при совместной аппликации 5-СТ и метисергида, однофакторный дисперсионный анализ (F2,12 = 4.5).
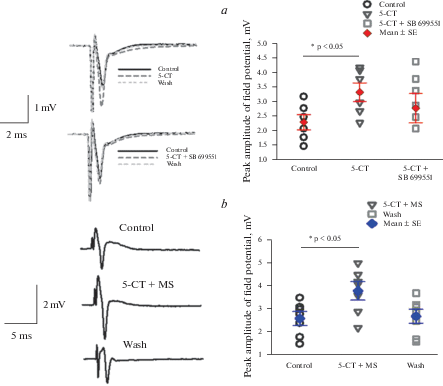
Чтобы выявить, эффект активации конкретных подтипов 5-HT рецепторов, мы использовали совместное применение 5-СТ с селективным антагонистом 5-НТ5А рецепторов – SB 699551 и селективным антагонистом 5-НТ1А,В/D рецепторов – метисергидом. Потенциация ответа была меньше (2.8 ± 0.5 мВ, n = 6) при совместной аппликации 5-СТ и селективного антагониста 5-НТ5А рецепторов SB 699551 (10 мкМ), то есть активация только 5-НТ1А,В/D рецепторов была недостаточна для полной потенциации, вызванной аппликацией 5-СТ (рис. 1а). В то же время при блокировании 5-НТ1А,В/D рецепторов метисергидом (при преимущественной активации 5-НТ5А рецепторов) увеличение амплитуды полевого потенциала сохранялось, составив 3.8 ± 0.4 мВ против 2.6 ± 0.3 мВ в контроле, n = 6 (рис. 1b).
Этот результат свидетельствует об участии в потенциации антидромного полевого потенциала как 5-НТ1А,В/D, так и 5-НТ5А рецепторов в разной степени, причем эффект 5-НТ5А рецепторов преобладает.
2. Модуляция полевого антидромного потенциала по величине и по времени
Действие агониста 5-СТ и антагонистов 5НТ1А,В/D и 5-НТ5А рецепторов на полевой антидромный потенциал отличалось как по величине, так и по времени развития эффекта (рис. 2а). При активации 5-НТ5А рецепторов потенциация происходила раньше по времени (через 5–7 мин) и была больше по величине (порядка 47%), в то время как активация 5НТ1А,В/D рецепторов вызывала меньшую потенциацию (порядка 22%), развивающуюся медленнее (20–25 мин). При совместной активации 5-НТ5А и 5-НТ1А,В/D рецепторов потенциация была такая же, как при активации 5-НТ5А рецепторов (составляя по величине порядка 46%), но максимальный эффект развивался позже по времени (через 10–12 мин).
Рис. 2.
Модуляция полевого антидромного потенциала по величине и по времени в зависимости от типа активируемых рецепторов (а) и модуляция по амплитуде и частоте внеклеточных ПД (b). (b) – увеличение числа внеклеточных антидромных ПД и амплитуды ПД при совместной аппликации агониста (5-СТ) и антагониста 5-НТ1,2 рецепторов метисергида (активация 5-НТ5А рецепторов). Наложение 10 пробегов. На развертке 30 мс (нижние записи) хорошо видна потенциация антидромного полевого потенциала через 5 мин, а через 20 мин – восстановление к исходному уровню, хотя количество ПД при этом продолжает нарастать.
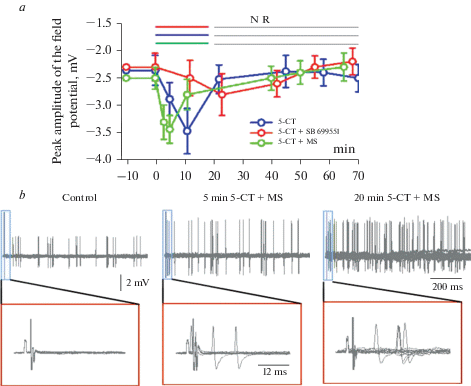
3. Эффект совместной аппликации 5-СТ и метисергида на частоту вызванных внеклеточных антидромных ПД
При совместной аппликации 5-СТ и метисергида, т.е. активации 5-НТ5А рецепторов, наблюдалось увеличение амплитуды ПД примерно вдвое, количество внеклеточных ПД, возникающих в ответ на антидромную стимуляцию вентрального корешка, возросло в 4 раза (рис. 2b). Время-зависимый эффект активации серотониновых рецепторов на изменение амплитуды полевого антидромного потенциала сохранялся: вначале наблюдали потенцирующий эффект, который позже сменялся угнетающим (рис. 2b). Однако частота генерации ПД продолжала увеличиваться в течение всего эксперимента. Возможным механизмом этого явления может быть активация других нейронов в локальных сетях спинного мозга, однако это предположение требует дополнительной экспериментальной проверки.
4. Действие 5-СТ и MS на вызванные корешковые потенциалы
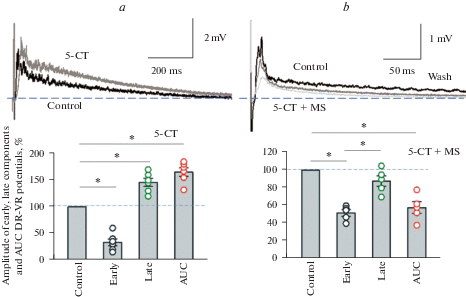
При активации 5-НТ1A,B/D, 5А рецепторов с помощью агониста 5-СТ (5–10 мкМ) наблюдалось уменьшение амплитуды ранних моно- и дисинаптических компонентов (с латентностью 2–12 мс) до 33 ± 7% от начального уровня и увеличение на 46 ± 8% (n = 6) амплитуды поздних компонентов (с латентностью 12–200 мс) корешковых потенциалов, регистрируемых от вентрального корешка при стимуляции дорсального корешка (ДК-ВК потенциалов). Соответственно изменялась площадь под кривой ДК-ВК потенциалов (увеличение на 66 ± 8%, n = 6) (рис. 3a). Активации 5-НТ5А рецепторов путем аппликации неселективного агониста 5-СТ в условиях блокады 5-НТ1A,B/D рецепторов с помощью метисергида вызывала уменьшение амплитуды ранних компонентов в два раза (до 52 ± 5% от начального уровня, n = 5), т.е. в меньшей степени, чем при аппликации одного агониста (5-СТ). Кроме того, исчезал эффект потенциации поздних компонентов ДК-ВК ответа. Амплитуда поздних компонентов и площадь под кривой также уменьшались (до 88 ± 6% и до 58 ± 7% соответственно) (рис. 3b). Эти результаты указывают на участие в модуляции вызванной синаптической активности как 5-НТ1A,B/D, так и 5-НТ5А рецепторов.
5. Действие 5-СТ и метисергида на вызванные внутриклеточные потенциалы
При внутриклеточной регистрации многокомпонентного ПСП, вызванного стимуляцией дорсального корешка (ДК ПСП), аппликация 5-СТ вызывала время-зависимый эффект: в первые 3–5 мин наблюдалась кратковременная потенциация пиковой амплитуды ДК ПСП на 53 ± 4.4%, а затем, через 10–15 мин, – уменьшение амплитуды ДК ПСП до 76 ± 4% (n = 5, t-test, p < 0.001) от исходного ответа (рис. 4а, b). При блокировании 5-НТ1A,B/D рецепторов метисергидом время-зависимый эффект не наблюдался, ответ уменьшался, и через 14 мин составлял примерно 20% от исходного в контроле (рис. 4c, d, e). Эти наблюдения указывают на ингибирующую роль 5-НТ5А рецепторов на пиковую амплитуду внутриклеточного ДК ПСП.
Рис. 4.
Время-зависимый эффект 5-СТ на вызванный внутриклеточный ДК ВПСП. (а) – активация 5‑НТ1 и 5-НТ5А рецепторов вызывает первоначальную потенциацию (3 мин аппликации) и последующее угнетение ответа (14 мин аппликации). На вставке показано то же самое при меньшей развертке; (b) – соответствующая столбчатая диаграмма; (c, d, e) – потенциация пропадает при блокировании 5‑НТ1А,В/D рецепторов с помощью метисергида (MS): контроль, 7 мин, 14 мин соответственно аппликации смеси 5-СТ + MS. Наблюдается угнетение всего ДК ВПСП (парный t-тест Стьюдента, p < 0.05). (f) – увеличение количества ПД при аппликации 5-СТ и уменьшение при отмывке ниже исходного уровня; (g) – уменьшение латентности первого ПД при стимуляции ДК через 4 мин и увеличение ее через 10 мин аппликации; (h, i) – соответствующие диаграммы (время-зависимый эффект), для (h): t-тест, p = 0.04; для (i): однофакторный дисперсионный анализ p < 0.001 (тест Тьюки), F2,15 = 34.

6. Действие 5-СТ на частоту и латентность ПД, вызванных стимуляцией ДК
Поскольку 5-СТ вызывает потенциацию антидромного полевого потенциала (рис. 1а, слева), отражающего синхронный разряд мотонейронов, то можно ожидать увеличение числа внутриклеточных ПД, возникающих в каждом отдельном мотонейроне при стимуляции ДК. Этот эффект продемонстрирован на рис. 4f. Аппликация 5-СТ через 5–6 мин увеличивала среднее число ПД от 55 ± 4 до 75 ± 5 (n = 5, t-test, p = 0.04), при отмывке число ПД снижалось до 23 ± 4, что ниже исходного в контроле (рис. 4f, h). На рис. 4g проиллюстрировано укорочение латентности первого ПД с 42 ± 3 мс в контроле до 26 ± 3 мс через 4 мин аппликации 5-СТ (начальный эффект) и последующее увеличение через 10–12 мин аппликации 5-СТ до 62 ± 4 мс (n = 6).
7. Действие 5-СТ и метисергида на мембранный потенциал покоя, кинетические параметры, быструю и среднюю фазы следовой гиперполяризации антидромного ПД
Чтобы выявить эффект 5-СТ на пассивные свойства мембраны мотонейронов, агонист добавляли в перфузирующий раствор в условиях блока спайковой активности с помощью блокатора натриевых каналов ТТХ (1 мкМ). Аппликация 5-СТ вызывала небольшую деполяризацию мембраны в большинстве случаев на 1.5–2.0 мВ (n = 4, парный t-тест, p < 0.05, рис. 5а, сверху), деполяризация исчезала при совместной аппликации 5-СТ и антагониста 5-НТ1,2 рецепторов метисергида (рис. 5а, внизу).
Рис. 5.
Действие 5-СТ и смеси 5-СТ + MS на МПП в условиях блока спайковой активности с помощью ТТХ – (а). Действие 5-СТ на кинетические параметры и следовую гиперполяризацию антидромного ПД – (b).
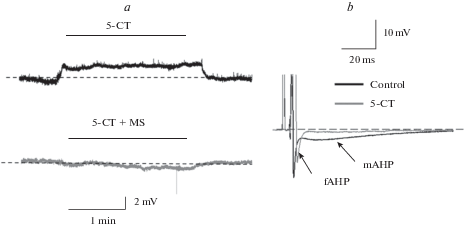
В отсутствие ТТХ аппликация 5-СТ уменьшала амплитуду антидромного ПД (на 18.0 ± 0.5%, n = 5) и увеличивала его полуширину более чем в два раза, также снижались амплитуды быстрой (fAHP) и средней (mAHP) фаз следовой гиперполяризации: в среднем на 36.0 ± 0.2% и на 83.0 ± 0.3%, n = 5 соответственно (рис. 5b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В наших экспериментах при внеклеточной регистрации как совместная, так и раздельная активация 5-НТ1А,В/D и 5-НТ5А рецепторов в первые несколько минут вызывали потенциацию амплитуды негативной волны полевого антидромного потенциала, отражающего синхронный разряд нейронов, но в различной степени. Следовательно, как 5-НТ1А,В/D, так и 5-НТ5А рецепторы вызывают потенциацию антидромного полевого потенциала. При активации 5-НТ5А рецепторов потенциация происходила быстрее по времени и была больше по величине, в то время как активация 5-НТ1А,В/D рецепторов вызывала меньшую потенциацию, развивающуюся медленнее. При совместной активации 5-НТ5А и 5-НТ1А,В/D рецепторов потенциация усиливалась по величине и развивалась быстрее. Эти наблюдения указывают на пространственно-временную модуляцию активности нейронов вентрального рога (как мотонейронов, так, по-видимому, и интернейронов).
Изменение амплитуды полевого антидромного потенциала, пиковой амплитуды вызванных корешкового потенциала и внутриклеточного ДК ПСП, а также изменение частоты внеклеточных спайков и латентности первого внутриклеточного ПД при аппликации 5-СТ были время-зависимыми: в первые 3–5 мин наблюдалась потенциация этих параметров, что свидетельствовало о возбуждающем эффекте, в последующие 10–15 мин потенциация сменялась угнетением. Аналогичный время-зависимый эффект при аппликации агониста 5-НТ1А,7 рецепторов 8-ОН-DPAT мы наблюдали в наших предыдущих исследованиях [36] при регистрации антидромного полевого потенциала: в первые 3–5 мин – увеличение амплитуды полевого потенциала, а затем снижение ее через 15 мин. 8-ОН-DPAT оказывал время-зависимое действие также на частоту и время возникновения антидромного ПД: первоначально увеличивал возбудимость мотонейронов, а затем уменьшал ее. Наблюдаемую нами потенциацию можно объяснить тем, что 5-HT5A рецепторы могут постсинаптически подавлять тормозные интернейроны [11, 37]. Таким образом, активация рецепторов 5-HT5A5-НТ1А,7 в тормозных и возбуждающих интернейронах может производить противоположный эффект [32].
В предыдущей работе [16] мы показали, что агонист 5-НТ1А,7 рецепторов 8-ОН-DPAT не вызывал деполяризацию мембраны и не изменял входное сопротивление. Учитывая это, мы предполагаем, что 5-СТ вызывает деполяризацию, активируя либо 5-НТ1В/D, либо 5-НТ5А рецепторы. Мы не зарегистрировали изменение МП при блокировании 5-НТ1А,В/D рецепторов метисергидом (рис. 5а, внизу), возможно, потому, что понимание индивидуальной роли 5-НТ5А рецепторов и рецепторов 5-НТ1 типа усложнено, из-за того, что рецепторы 5-НТ5А и 5-НТ1A связываются с множественными системами вторичных мессенджеров, которые могут перекрестно взаимодействовать друг с другом [30, 38].
В статье Goodfellow с соавт. [20] показано, что удаление гена, ответственного за экспрессию 5-HT5A рецептора у нокаутных мышей, приводит к неожиданно большому увеличению ингибирующих токов 5-HT1A рецептора. Авторы предполагают, что присутствие тесно связанных рецепторов 5-HT1A и 5-HT5A в одних и тех же нейронных клетках может служить биологической защитой, так что нарушение одного рецептора может вызвать компенсаторную активацию другого рецептора [39].
Полученные результаты подтверждают наше предположение об участии 5-HT5A рецепторов наряду с 5-НТ1 рецепторами в модуляции моторного выхода спинальных мотонейронов лягушки. Однако, учитывая сложные взаимодействия 5-HT5A рецепторов с 5-НТ1 и, возможно, с другими типами серотониновых рецепторов, необходимы дополнительные исследования.
Список литературы
Nakamura K, Wong-Lin K (2014) Functions and computational principles of serotonergic and related systems at multiple scales. Front Integr Neurosci 8: 1–2. https://doi.org/10.3389/fnint.2014.00023
Ciranna L (2006) Serotonin as a modulator of glutamate and GABA-mediated neurotransmission: implications in physiological functions and in pathology. Current Neuropharmacol 4: 101–114. https://doi.org/10.2174/157015906776359540
Rekling JC, Funk GD, Bayliss DA, Dong X-W, Feldman JL (2000) Synaptic control of motoneuronal excitability. Physiol Rev 80 (2): 767–852. https://doi.org/10.1152/physrev.2000.80.2.767
Jacobs BL, Azmitia EC (1992) Structure and function of the brain serotonin system. Physiol Rev 72: 165–229. https://doi.org/10.1152/physrev.1992.72.1.165
Schmidt BJ, Jordan LM (2000) The role of serotonin in reflex modulation and locomotor rhythm production in the mammalian spinal cord. Brain Res Bull 53: 689–710. https://doi.org/10.1016/S0361-9230(00)00402-0
Zhang M (2016) Normal distribution and plasticity of serotonin receptors after spinal cord injury and their impacts on motor outputs. In: Recovery of motor function following spinal cord injury, Heidi Fuller and Monte Gates, IntechOpen. https://doi.org/10.5772/63759
Alvarez FJ, Pearson JC, Harrington D, Dewey D, Torbeck L, Fyffe REW (1998) Distribution of 5-hydroxytryptamine-immunoreactive boutons on α-motoneurons in the lumbar spinal cord of adult cats. J Comp Neurol 393: 69–83. https://doi.org/10.1002/(SICI)1096-9861(19980330)393:1<69::AID-CNE7>3.0.CO;2-O
Fink KB, Gőthert M (2007) 5-HT receptor regulation of neurotransmitter release. Pharmacol Rev 59(4): 360–417. https://doi.org/10.1124/pr.59.07103
Hoyer D, Hannon JP, Martin GR (2002) Molecular, pharmacological and functional diversity of 5-HT receptors. Pharmacol Biochem Behav 71: 533–554. https://doi.org/10.1016/S0091-3057(01)00746-8
Hannon J, Hoyer D (2008) Molecular biology of 5-HT receptors. Behav Brain Res 195: 198–213. https://doi.org/10.1016/j.bbr.2008.03.020
Doly S, Fischer J, Brisorgueil MJ, Vergé D, Conrath M (2004) 5HT5A receptor localization in the rat spinal cord suggests a role in nociception and control of pelvic floor musculature. J Comp Neurol 476: 316–329. https://doi.org/10.1002/cne.20214
Perrier J-F, Rasmussen HB, Christensen RK, Petersen AV(2013) Modulation of the intrinsic properties of motoneurons by serotonin. Current Pharmaceutical Design 19: 4371–4384.https://doi.org/10.2174/13816128113199990341
Perrier J-F, Cotel F (2015) Serotonergic modulation of spinal motor control. Current Opinion Neurobiol 33: 1–7. https://doi.org/10.1016/j.conb.2014.12.008
Kalinina N, Kurchavyi G, Zaitsev A, Veselkin N (2016) Presynaptic serotonergic modulation ofspontaneous and miniature synaptic activity in frog lumbar motoneurons. J Evol Biochem Phys 52:359–368. https://doi.org/10.1134/S0022093016050045
Kalinina NI, Zaitsev AV, Vesselkin NP (2018) Presynaptic serotonin 5-HT1B/D receptor mediated inhibition of glycinergic transmission to the frog spinal motoneurons. J Comp Physiol A. 204 (3): 329–337. https://doi.org/10.1007/s00359-017-1244-y
Kalinina NI, Zaitsev AV, Vesselkin NP (2019) Different Effects of 5-HT1 and 5-HT2 Receptor Agonists on Excitability Modulation of Motoneurons in Frog Spinal Cord. J Evol Biochem Phys 55(4): 284–292. https://doi.org/10.1134/S0022093019040045
Thomas DR, Soffin EM, Roberts C, Kew JN, de la Flor RM, Dawson LA, Fry VA, Coggon SA, Faedo S, Hayes PD, Corbett DF, Davies CH, Hagan JJ, Thomas DR (2006) SB-699551-A (3-cyclopentyl-N-[2-(dimethylamino)ethyl]-N-[(4'-{[(2-phenylethyl)amino]methyl}-4-biphenylyl)methyl]propanamide dihydrochloride), a novel 5-ht5A receptor-selective antagonist, enhances 5-HT neuronal function: Evidence for an autoreceptor role for the 5-ht5A receptor in guinea pig brain. Neuropharmacology 51(3): 566–577. https://doi.org/10.1016/j.neuropharm.2006.04.019
Thomas DR (2006) 5-ht5A Receptors as a Therapeutic Target. Pharmacol Ther 111(3): 707–714. https://doi.org/10.1016/j.pharmthera.2005.12.006
Corbett DF, Heightman TD, Moss SF, Bromidge SM, Coggon SA, Longley MJ, Roa AM, Williams JA, Thomas DR (2005) Discovery of a potent and selective 5-ht5A receptor antagonist by high-throughput chemistry. Bioorg Med Chem Lett 15: 4014–4018. https://doi.org/10.1016/j.bmcl.2005.06.024
Goodfellow NM, Bailey CDC, Lambe EK (2012) The Native Serotonin 5-HT5A Receptor: Electrophysiological Characterization in Rodent Cortex and 5-HT1A-Mediated Compensatory Plasticity in the Knock-Out Mouse. J Neurosci 32(17): 5804–5809. https://doi.org/10.1523/JNEUROSCI.4849-11.2012
Francken BJB, Jurzak M, Vanhauwe JFM, Luyten WHML, Leysen JE (1998) The human 5-ht5A receptor couples to Gi/Go proteins and inhibits adenylate cyclase in HEK-293 cells. Eur J Pharmacol 361: 299–309. https://doi.org/10.1016/S0014-2999(98)00744-4
Francken BJB, Josson K, Lijnen P, Jurzak M, Luyten WHML, Leysen JE (2000) Human 5-hydroxytryptamine 5A receptors activate coexpressed Gi and Go proteins in Spodoptera frugiperda-9 cells. Mol Pharmacol 57: 1034–1044.
Thomas DR, Larminieb CG, Lyonsc HR, Fosberryc A, Hill MJ, Hayesb PD (2004) Cloning and pharmacological characterisation of the guinea pig 5-ht5A receptor. Eur J Pharmacol 494 (2–3): 91–99. https://doi.org/10.1016/j.ejphar.2004.04.027
Noda M, Yasuda S, Okada M, Higashida H, Shimada A, Iwata N, Ozaki N, Nihikawa K, Shirasawa S, Uchida M, Aoki S, Wada K (2003) Recombinant human serotonin 5A receptors stably expressed in C6 glioma cells couple to multiple signal transduction pathways. J Neurochem 84: 222–232. https://doi.org/10.1046/j.1471-4159.2003.01518.x
Grailhe R, Grabtree GW, Hen R (2001) Human 5-HT(5) receptors: the 5-HT(5A) receptor is functional but the 5-HT(5B) receptor was lost during mammalian evolution. Eur J Pharmacol 418: 157–167. https://doi.org/10.1016/S0014-2999(01)00933-5
Pasqualetti M, Ori M, Marazziti D, Castagna M, Nardi I (1998) Distribution of 5-HT2c and 5-ht5a receptor mRNA in human brain. Ann NY Acad Sci 861: 245. https://doi.org/10.1111/j.1749-6632.1998.tb10202.x
Rees S, Daas I, Foord S, Goodson S, Bull D, Kilpatrick G, Lee M (1994) Cloning and characterisation of the human 5-HT5A serotonin receptor. FEBS Letters 355: 242–246. https://doi.org/10.1016/0014-5793(94)01209-1
Oliver KR, Kinsey AM, Wainwright A, Sirinathsinghji DJ (2000) Localization of 5-HT(5A) receptor-like immunoreactivity in the rat brain. Brain Res 867: 131–142. https://doi.org/10.1016/S0006-8993(00)02273-3
Kinsey AM, Wainwright A, Heavens R, Sirinathsinghji DJ, Oliver KR (2001) Distribution of 5-ht(5A), 5-ht(5B), 5-ht(6) and 5-HT(7) receptor mRNAs in the rat brain. Brain Res Mol Brain Res 88: 194–198. https://doi.org/10.1016/S0169-328X(01)00034-1
Garcia-Alcocer G, Rodriguez A, Moreno-Layseca P, Berumen LC, Escobar J, Miledi R (2010) Serotonin receptor 5-HT5A in rat hippocampus decrease by leptin treatment. Neurosci Lett 486: 171–173. https://doi.org/10.1016/j.neulet.2010.09.045
Xu C, Giuliano F, Sun X.Q, Brisorgueil M-J, Leclerc P, Verge D, Conrath M (2007) Serotonin 5-HT2A and 5-HT5A receptors are expressed by different motoneuron populations in rat Onuf’s nucleus. J Comp Neurol 502: 620–634. https://doi.org/10.1002/cne.21344
Muñoz-Islas E, Vidal-Cantú GC, Bravo-Hernández M, Cervantes-Durán C, Quiñonez-Bastidas GN, Pineda-Farias JB, Barragán-Iglesias P, Granados-Soto V (2014) Spinal 5-HT5A receptors mediate 5-HT-induced antinociception in several pain models in rats. Pharmacol Biochem Behav 120: 25–32. https://doi.org/10.1016/j.pbb.2014.02.001
Avila-Rojas SH, Velázquez-Lagunas I, Salinas-Abarca AB, Barragán-Iglesias P, Pineda-Farias JB, Granados-Soton V (2015) Role of spinal 5-HT5A and 5-HT1A/1B/1D receptors in neuropathic pain induced by spinal nerve ligation in rats. Brain Res 1622: 377–385. https://doi.org/10.1016/j.brainres.2015.06.043
Vidal-Cantú GC, Jiménez-Hernández M, Rocha-González HI, Villalón CM, Granados-Soto V, Muñoz-Islas E (2016) Role of 5-HT5A and 5-HT1B/1D receptors in the antinociception produced by ergotamine and valerenic acid in the rat formalin test. Eur J Pharmacol 781: 109–116. https://doi.org/10.1016/j.ejphar.2016.04.009
Ditjatev AE, Chmykhova NM, Dityateva GV, Babalian AL, Kleinle J, Clamann HP (2001) Structural and Physiological Properties of Connections Between Individual Reticulospinal Axons and Lumbar Motoneurons of the Frog. J Comp Neurol 430: 433–447. https://doi.org/10.1002/1096-9861(20010219) 430:4<433::AID-CNE1041>3.0.CO;2-Z
Kalinina NI, Zaitsev AV, Vesselkin NP (2019) Serotonin Modulates Differently the Functional Properties of Damaged and Intact Motoneurons in the Frog Spinal Cord. Dokl Biol Sci 484: 5–9.https://doi.org/10.1134/S0012496619010046
Barber RP, Vaughn JE, Roberts E (1982) The cytoarchitecture of GABAergic neurons in rat spinal cord. Brain Res 238: 305–328. https://doi.org/10.1016/0006-8993(82)90107-X
Noda M, Higashida H, Aoki S, Wada K (2004) Multiple signal transduction pathways mediated by 5-HT receptors. Mol Neurobiol 29: 31. https://doi.org/10.1385/MN:29:1:31
Gingrich JA, Hen R (2000) The broken mouse: the role of development, plasticity and environment in the interpretation of phenotypic changes in knockout mice. Curr Opin Neurobiol 10: 146–152. https://doi.org/10.1016/S0959-4388(99)00061-6
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова